Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une approche rapide à l'imagerie de fluorescence à haute résolution dans les tranches de cerveau semi-épais
Dans cet article
Résumé
Nous décrivons ici une méthode rapide et simple à l'image des cellules marquées par fluorescence dans les tranches de cerveau semi-épais. En fixant, le tranchage, et optiquement compensation du tissu cérébral, nous décrivons comment la norme d'imagerie à épifluorescence ou confocale peut être utilisé pour visualiser les cellules individuelles et des réseaux neuronaux dans les tissus nerveux intact.
Résumé
Un objectif fondamental à la fois fondamentales et cliniques en neurosciences est de mieux comprendre les identités, composition moléculaire, et des modèles de connectivité qui sont caractéristiques de neurones dans le cerveau normal et pathologique. Vers ce faire, un grand effort a été mis sur le renforcement cartes à haute résolution neuroanatomiques 1-3. Avec l'expansion de la génétique moléculaire et les avancées en microscopie optique est venu la possibilité d'interroger non seulement les morphologies neuronales, mais aussi la composition moléculaire et cellulaire des neurones individuels et leurs réseaux associés 4. Des avancées majeures dans la capacité de marquer et de manipuler des neurones et des gènes transgéniques par le biais des technologies de ciblage dans le rongeur désormais permettre aux enquêteurs de sous-ensembles neuronaux «programme» à volonté, 5-6. Sans doute, l'une des contributions les plus influents au contemporain neurosciences a été la découverte et le clonage de gènes codant pour des protéines fluorescentes (PC) chez les invertébrés marins 7-8, aux côtés de leurs ingénieurs ultérieure pour obtenir une boîte à outils sans cesse croissant de journalistes vitale 9. Exploiter une activité de promoteur spécifique du type cellulaire pour conduire l'expression ciblée de PF dans discrètes populations neuronales offre désormais enquête neuroanatomiques avec précision génétique.
Ingénierie FP expression dans les neurones a considérablement amélioré notre compréhension de la structure et la fonction cérébrales. Cependant, les neurones individuels d'imagerie et de leurs réseaux associés dans les tissus du cerveau profond, ou en trois dimensions, est restée un défi. Grâce à forte teneur en lipides, le tissu nerveux est assez opaque et autofluorescence expositions. Ces propriétés inhérentes biophysiques font qu'il est difficile de visualiser et d'image neurones marqués par fluorescence à haute résolution en utilisant la microscopie à épifluorescence standards ou confocale delà des profondeurs de plusieurs dizaines de microns. Pour contourner cette difficulté ont souvent recours à des enquêteurs de série à section mince d'imagerie et de 10 méthodes de reconstruction, ou la microscopie laser à 2 photons de numérisation 11. Inconvénients actuels de ces approches sont la préparation des tissus associés de main-d'œuvre, ou coût prohibitif d'instrumentation, respectivement.
Ici, nous présentons une méthode relativement simple et rapide de visualiser les cellules marquées par fluorescence dans les fixes semi-épais tranches de cerveau de souris en compensation optique et d'imagerie. Dans le protocole ci-joint, nous décrivons les méthodes de: 1) le tissu cérébral de fixation in situ par perfusion intracardiaque, 2) la dissection et l'enlèvement de cerveau entier, 3) intégrer le cerveau stationnaire dans l'agarose, 4) préparation de tranches de précision semi-épais à l'aide de nouveaux instruments vibratome tissus, 5) du cerveau de compensation à travers un gradient de glycérol, et 6) de fixation sur lames de verre pour la microscopie optique et z-stack de reconstruction (figure 1).
Pour la préparation de tranches de cerveau nous avons mis un morceau relativement nouveau de l'instrumentation appelé «Compresstome 'VF-200 (http://www.precisionary.com/products_vf200.html). Cet instrument est un microtome semi-automatique équipé d'une avance motorisé et le système de vibration des aubes avec des fonctions similaires en fonction de vibratomes autres. Contrairement à d'autres vibratomes, le tissu à découper en tranches est montée dans un bouchon d'agarose dans un cylindre en acier inoxydable. Le tissu est extrudé à des épaisseurs souhaitée dans le cylindre, et coupé par la lame vers l'avant avancer vibrante. La fiche d'agarose / système de vérin permet de tissus reproductibles de montage, l'alignement et une coupe de précision. Dans nos mains, le «Compresstome« rendements élevés des tranches de tissu de qualité pour l'électrophysiologie, l'immunohistochimie et directe fixe les tissus de montage et d'imagerie. Combiné avec la compensation optique, ici nous montrent la préparation de semi-épais tranches de cerveau fixes à haute résolution pour l'imagerie de fluorescence.
Protocole
1. Dans la fixation du cerveau in situ
* Préparer une seringue de 10 ml (aiguille de calibre 28) rempli de tampon phosphate salin (PBS).
* Préparer une seringue de 10 ml (aiguille de calibre 28) rempli avec du paraformaldéhyde 4% (PFA) dans le PBS. Réservez un ml supplémentaires 5-10 de PFA / PBS pour la fixation de poste.
- Injecter par voie intrapéritonéale expérimental chez la souris avec une dose létale de Avertin ou Nembutal.
- Une fois que la souris est sous sédatif, mouillée avec de l'éthanol de l'abdomen et sécuriser la souris vers le bas d'un plateau de couches avec du liège, la cire, ou en élastomère de silicone utilisant des broches de dissection. Avec l'abdomen vers le haut, sécuriser les quatre pattes à la surface - les répandre aussi largement que possible.
- Prenez la peau avec une pince au niveau du sternum, et coupée transversalement pour exposer le foie. Couper latéralement et ensuite à travers les côtes et le diaphragme. Retirez le lambeau thoracique et continuer à réduire jusqu'à ce que le coeur est accessible.
- Pierce ou snip l'oreillette droite pour drainer le sang circuler.
- Rincer le sang résiduel du système circulatoire par une perfusion de PBS grâce ventricule gauche.
- Accéder au trou de la même aiguille, fixer la souris tout en perfusion subséquente de PBS / PFA travers ventricule gauche.
2. Dissection et l'extraction du cerveau
- Retirez la peau de la tête, du cou et du crâne en coupant autour du conduit auditif et les orbites des yeux, puis en tirant la peau vers l'avant pour exposer le crâne.
* Voir Figure 2 pour une illustration des étapes 2,2) à 2,5) - En utilisant une paire de ciseaux os, coupées transversalement de l'oeil de la prise à travers les os du cornet nasal. Faites cela pour chaque côté. La coupe transversale devrait être antérieure pour les yeux et le bulbe olfactif.
- Couper la longueur de chaque canal de l'oreille à la cavité de l'œil.
- En utilisant une paire de ciseaux de dissection petits, couper la plaque recouvrant l'os occipital le cervelet d'un canal de l'oreille à l'autre.
- Avec les ciseaux de dissection même, coupé le long de la ligne médiane antérieure au niveau des bulbes olfactifs.
- En utilisant une pince, retirez chaque lame osseuse du cerveau, en prenant soin d'enlever tout le tissu conjonctif de sorte que le cerveau reste intact lors du levage de l'os.
- Les nerfs optiques et Snip crânienne, couper les vertèbres cervicales dessus, et enlever le cerveau en fixateur.
- Post-correctif pour 1-2 heures à 4 ° C. Laver 3 fois 15 min chacun dans du PBS.
3. Intégration Agarose
- Faire fondre 2% à haute résistance et à faible point de gel d'agarose de type IB (numéro de catalogue Sigma: A0576) dans du PBS salée avec four à micro-ondes.
- Transfert agarose fondu dans un tube à essai. Tube à essai Placer dans un bain chaud incubateur ou de l'eau (40 ° -41 ° C) jusqu'à ce que l'équilibrage de température.
- Collez le tissu cérébral fixé sur le piston de la seringue éprouvette avec de la colle cyanoacrylate (figure 3A). Appliquer une fine couche de gras saturés saccharose PBS solution sur la surface du tissu cérébral pour faciliter la libération ultérieure de l'anneau d'agarose des tranches de cerveau.
- Prélèvement sur le piston avec le tissu cérébral dans le boîtier du piston (figure 3B).
- Pipette ou verser chaude d'agarose dans le boîtier du piston, couvrant le tissu cérébral. Eviter d'emprisonner des bulles d'air dans l'agarose. Bulles d'air dans l'agarose compromettra la qualité tranche.
- Clamp la seringue avec un spécimen de froid (0 ° à -25 ° C) de bloc de refroidissement pendant 1 minute pour mettre l'agarose (figure 3C).
4. Sectionnement tranche de cerveau avec le Compresstome
- Assemblez la seringue échantillon contenant les tissus du cerveau dans la Compresstome (figure 3D).
- Alignez le bord de la lame de rasoir en étroite collaboration avec la sortie de la seringue éprouvette (figure 3F).
- Remplir le réservoir tampon avec une solution PBS.
- Tournez l'épaisseur de coupe micrométrique une à l'avant d'extruder le bloc de tissu du cerveau d'agarose de la seringue spécimen.
- Appuyez sur le bouton "start" sur l'unité de contrôle de la Compresstome d'engager le processus de sectionnement.
- Répétez les étapes 4.4) à 4.5) jusqu'à ce que les tranches souhaités sont obtenus à déterminer l'épaisseur.
- Récolte des tranches de cerveau avec une brosse ou pipette pour flacons ou des puits remplis coloration avec du PBS (figure 3F).
5. Compensation optique
- Préparer un 75% vol: vol solution de glycérol: PBS.
- Versez (ou pipette) à pied la moitié du volume de PBS de lavage des tranches de cerveau prélevés.
- Rajouter le volume enlevé avec glycérol / PBS.
- Laisser s'équilibrer en mélangeant doucement à 4 ° C jusqu'à l'évier tranches.
- Répétez les étapes 6,2) à 6,4) jusqu'à une concentration de glycérol final atteint 75%.
- Remplacer la solution de glycérol à 90% dans le PBS et laisser s'équilibrer.
* Remarque: Prenez soin de ne pas introduire de bulles d'air tout en ajoutant des solutions de glycérol. Verser lentement solutions et mélanger délicatement, car les bulles d'air vont interférer avec l'uniforme Equilibration et seront reportés à montage des diapositives.
6. Trancher le montage pour l'imagerie
- Couper joint adhésif double-face (SA-S-1L, Grace Bio-Labs) dans un rectangle ouvert à s'adapter à la zone visible d'une lame micro (Superfrost Plus, 25 x 75 x 1 mm, cat. # 48311-703, VWR ) avec les côtés 2-3 mm de large.
- Placer les tranches de cerveau à l'intérieur du centre du rectangle de ruban adhésif en utilisant une pipette ou un pinceau. Retirer l'excès de glycérol avec l'aspiration douce.
- Disposer les tranches de cerveau sur la diapositive dans l'ordre désiré avec un pinceau.
- Couvercle en verre délicatement inférieure (24 X 60 mm, cat. # 48383-139, VWR) sur le ruban adhésif, en prenant soin de ne pas introduire de bulles d'air. Appuyez doucement sur le verre couvercle pour assurer le contact avec du ruban adhésif.
- Aspirer le glycérol excès de bords entre lame et lamelle.
- Seal et glisser la lamelle à l'aide de vernis à ongles clair.
- Laisser sécher avant d'imagerie, ou de stocker à long terme dans des boîtes de diapositives à 4 ° C.
7. Les résultats représentatifs:
Traitement, l'imagerie et l'analyse des tissus du cerveau marqué par fluorescence sont devenus indispensables à l'étude de la neurobiologie. Beaucoup de ces enquêtes exigent des manipulations génétiques sophistiquées pour obtenir l'expression journaliste en sous-ensembles neuronaux ciblés, suivis par les deux analyses d'images à basse et haute résolution. Souvent les limites expérimentales et techniques font qu'il est impossible d'obtenir ces types de données provenant du même animal, ou d'une manière rapide. Préparation des opto-effacé, des coupes de cerveau semi-épais pour l'imagerie fluorescente aides dans ce défi. Un exemple d'une épaisse tranche de cerveau intact marqué par un virus génétiquement modifié pour exprimer la rage EGFP et imagée en utilisant la microscopie à épifluorescence et confocale est montré dans la figure 4 et figure 5, respectivement. Pour l'imagerie à épifluorescence nous avons utilisé un Leica M205 FA, et pour l'acquisition d'image confocale, nous avons utilisé une LSM Zeiss 510. En raison de la relative simplicité du protocole joint, cette méthode est capable de produire des données utiles à partir d'images tissu exprimant journalistes fluorescente avec un délai de moins d'une journée, et est compatible avec la microscopie optique à la fois faible et haute résolution.
Si l'enquêteur choisit d'incorporer à d'autres méthodes de marquage autopsie, la coloration immunohistochimique, ou de faire des sections plus minces, le protocole allonge en conséquence. Cependant, la méthode décrite ci-dessus représente une méthode simple et relativement haut débit pour les modèles de dépistage de l'expression journaliste vital dans le cerveau intact.
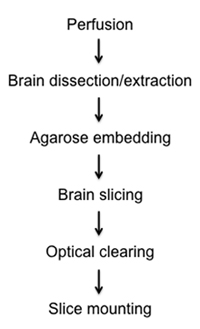
Figure 1. Organigramme de diagrammes de la fixation, la dissection, le tranchage, de compensation, et la procédure de montage de tranches de cerveau semi-épais.
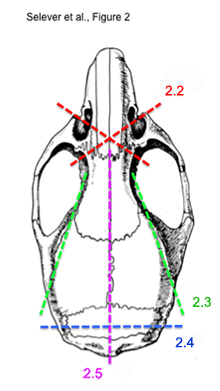
Figure 2. Schéma de la coupe séquentielle étapes pour extraire le cerveau de souris intactes.

Figure 3. Étapes de monter et couper le tissu cérébral à l'aide de la Compresstome. A) Placement de tissu cérébral sur piston de coupe en utilisant la superglue. B) Dessin bas du tissu cérébral monté dans le piston pour l'intégration d'agarose. C) Consolider une fiche cerveau agarose en utilisant un bloc de compression refroidie. D) Insertion de plug cerveau agarose et le piston dans la chambre de coupe Compresstome. E) L'alignement de rasoir à l'appareil piston. F) La coupe et la collecte des tranches de cerveau dans la chambre tampon Compresstome.
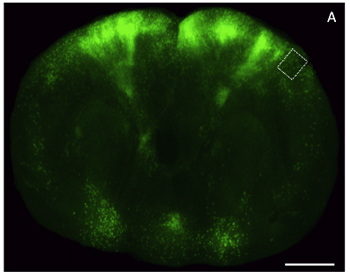
Figure 4. Images au microscope optique d'une épaisse tranche à partir du glycérol-effacé les tissus du cerveau dans le cortex frontal amélioré exprimer la protéine fluorescente verte (EGFP). Une tranche) coronales par un cerveau de souris (200 um d'épaisseur) marqué par un vecteur viral exprimant l'EGFP et imagé à basse résolution en utilisant un stéréoscope épifluorescence. La barre d'échelle, de 2 mm.

Figure 5. L'image à fort grossissement de la couche marqué par fluorescence 5 / 6 neurones corticaux dans une épaisse tranche de cerveau effacés. Une image) Haute résolution confocale d'une projection maximale Z-stack (150 um d'épaisseur) à travers la région en surbrillance dans (figure 4). La barre d'échelle, 25 um.
Discussion
Compte tenu de l'application généralisée de l'utilisation de protéines fluorescentes de cibler des sous-ensembles neuronaux pour enquête par l'intermédiaire microscopie optique, la nécessité de dépister rapidement, l'image, et d'analyser les réseaux de neurones dans le tissu cérébral intact est devenu une valeur inestimable.
Les progrès techniques dans le développement de convivialité vecteurs viraux, en techniques d'électroporation in viv...
Déclarations de divulgation
Jian-Kong Qiang est un employé de Precisionary Instruments, Inc, qui fabrique un produit utilisé dans cet article.
Remerciements
Ce travail a été financé par un soutien à travers la Fondation McNair, NARSAD, et NINDS octroi R00NS064171-03.
matériels
| Name | Company | Catalog Number | Comments |
| Nom de l'élément | Commentaires (optionnel) | ||
|---|---|---|---|
| Ciseaux d'os | TSF | 16044-10 | -Ou équivalent |
| TSF | 14084-08 | -Ou équivalent | |
| De type IB agarose | Sigma | A0576 | |
| Compresstome | Instruments Precisionary | VF-200 | -Autres vibratomes sont compatibles |
| Adhésif double face | Grace Bio-Labs | SA-S-1L | |
| Superfrost Plus diapositives | VWR | 48311-703 | |
| VWR | 48383-139 | ||
| Glycérol | EMD Chemicals Inc | GX0185-6 | -Ou équivalent |
Références
- Pfister, H., Lichtman, J., Reid, C. . The Connectome Project. , (2009).
- Briggman, K. L., Denk, W. Towards neural circuit reconstruction with volume electron microscopy techniques. Curr Opin Neurobiol. 16, 562-570 (2006).
- Micheva, K. D., Smith, S. J. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55, 25-36 (2007).
- Arenkiel, B. R., Ehlers, . Molecular genetic and imaging technologies for circuit based neuroanatomy. Nature. 461, 900-907 (2009).
- Capecchi, M. R. Altering the genome by homologous recombination. Science. 244, 1288-1292 (1989).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57, 634-660 (2008).
- Shimomura, O., Johnson, F., Saiga, Y. Extraction, purification, and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J. Cell Comp Physiol. 59, 223-239 (1962).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W., Prasher, D. Gene fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Giepmans, B. N., Adams, S. R., Ellisman, M. H., Tsien, R. Y. The fluorescent toolbox for assessing protein location and function. Science. 312, 217-224 (2006).
- Micheva, K. D., Smith, S. J. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55, 25-36 (2007).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon