È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Rilevamento di ossido nitrico e anione superossido radicale da spettroscopia di risonanza paramagnetica elettronica da cellule con Spin Traps
In questo articolo
Riepilogo
La risonanza paramagnetica elettronica (EPR) spettroscopia è stato impiegato per rilevare ossido nitrico da cellule endoteliali aortiche bovine e radicale superossido da neutrofili umani utilizzando ferro (II)-N-metil-D-glucammina ditiocarbammato, Fe (MGD) 2 E 5,5-dimetil-1-pyroroline-N-ossido, DMPO, rispettivamente.
Abstract
Azoto reattivo / specie di ossigeno (ROS / RNS) a basse concentrazioni gioca un ruolo importante nella regolazione della funzione delle cellule, di segnalazione, e la risposta immunitaria, ma in concentrazioni non regolamentati sono dannose per la vitalità cellulare 1, 2. Mentre i sistemi viventi si sono evoluti con meccanismi antiossidanti di difesa endogeni e dietetici per regolare ROS generazione, ROS vengono prodotti continuamente come naturali sottoprodotti del normale metabolismo di ossigeno e può causare danni ossidativi alle biomolecole con conseguente perdita di funzione della proteina, taglio del DNA, o lipidi perossidazione 3, e, infine, allo stress ossidativo che porta a lesioni o morte delle cellule 4.
Radicale superossido (O 2 • -) è il principale precursore di alcune delle specie più altamente ossidanti noti presenti in sistemi biologici, come perossinitrito e radicale idrossile. La generazione di O 2 • - segnala il primo segnale di burst ossidativo, e pertanto, its rilevamento e / o il sequestro nei sistemi biologici è importante. In questa dimostrazione, O 2 • - è stato generato da neutrofili polimorfonucleati (PMN). Attraverso la stimolazione chemiotattica con forbol-12-miristato-13-acetato (PMA), PMN genera O 2 • - attraverso l'attivazione di nicotinammide adenin dinucleotide fosfato (NADPH) ossidasi 5.
Ossido nitrico (NO) sintasi che viene in tre isoforme, come inducibile-,-neuronale e endoteliale-NOS, o iNOS, eNOS nNOS o, rispettivamente, catalizza la conversione di L-arginina a L-citrullina, usando NADPH per produrre NO 6 . Qui, abbiamo generato NO da cellule endoteliali. In condizioni di stress ossidativo, eNOS ad esempio possibile passare dalla produzione di NO a O 2 • - in un processo chiamato disaccoppiamento, che è ritenuto essere causato da ossidazione di eme 7 o la co-fattore, tetraidrobiopterina (BH 4) 8.
Ci sono solo pochemetodi affidabili per la rilevazione di radicali liberi in sistemi biologici, ma sono limitati dalla specificità e sensibilità. Trapping Spin è comunemente utilizzato per l'identificazione di radicali liberi e comporta la reazione di addizione di un radicale di una trappola di spin formando un addotto persistente centrifuga che può essere rilevato dal risonanza paramagnetica elettronica (EPR) spettroscopia. Gli addotti vari radicali presentano spettro distintivo che può essere utilizzato per identificare i radicali che vengono generati e può fornire una grande quantità di informazioni sulla natura e la cinetica della produzione di radicali 9.
Le nitroni ciclici, 5,5-dimetil-pirrolina-N-ossido, DMPO 10, il fosforil-sostituito DEPMPO 11, e l'estere-sostituito, Empo BMPO 12 e 13, sono stati ampiamente impiegati come trappole di spin - spin quest'ultimo trappole esibendo emivita più lunga per O 2 • - addotto. Ferro (II)-N-metil-D-glucammina ditiocarbammato, Fe (MGD) 2 </> Sub è comunemente utilizzato per intercettare NO dovuto alla elevata di formazione di addotti e l'elevata stabilità dell'addotto rotazione 14.
Protocollo
1. Coltura di cellule endoteliali dell'aorta bovina (BAEC)
- Corrette tecniche asettiche sono stati seguiti.
- In un bagno di acqua, terreno senza antibiotici calda a 37 ° C.
Nota: Il mezzo è costituito da fenolo libero terreno Dulbecco modificato Eagle (DMEM) con 4,5 g / L D-glucosio, 4 mM L-glutammina, 1% di amminoacidi non essenziali, integrato con 10% siero bovino fetale (FBS) e 2,5 mg / L fattore di crescita endoteliale.
- Rimuovere le cellule T75 pallone contenente dall'incubatore e pulire la superficie del pallone con il 70% di etanolo prima di inserirlo all'interno della cappa.
- Rimuovere il mezzo vecchio usando un aspiratore e lavare due volte con 5 ml di Dulbecco tampone fosfato salino (DPBS).
- Aggiungere 2 ml di tripsina e attendere per 4-5 min per le cellule di staccare periodicamente, mentre l'ispezione sotto il microscopio.
- Aggiungere 3 ml del mezzo e ripetutamente miscelare con una pipetta a separato tegli cellule e creare una sospensione omogenea.
- Trasferire 5 ml del mezzo con tripsina in un tubo da 15 ml e centrifugare a 121 g per 5 min.
- Rimuovere il surnatante mediante un aspiratore. Aggiungere 5 ml di DPBS e mescolare accuratamente. Centrifugare a 121g per 5 min.
- Aspirare il supernatante e risospendere il pellet aggiungendo 6 ml del mezzo.
- Su una piastra da 6 pozzetti, aggiungere 1 ml della sospensione cellulare a ciascun pozzetto si aggiunge 1 ml di mezzo. Mescolare la sospensione con una pipetta.
- Etichettare la piastra e incubare durante la notte a 37 ° C e 5% CO 2.
2A. Rilevamento di NO con Cell BAEC
- Corrette tecniche asettiche sono stati seguiti.
- Rimuovere la piastra da 6 pozzetti dall'incubatore e aspirare il mezzo dal primo pozzetto. Lavare le cellule due volte con 1 ml di DPBS.
- Aggiungere 210 ul di 1,9 mM ferro (II) solfato eptaidrato (FeSO 4 .7 H 2 O, preparare fresco sciogliendo 0,8 mg in1 ml con DPBS CaCl 2 e MgCl 2) e 210 pl di ammonio N-metil-D-glucammina ditiocarbammato (MGD, preparare fresco sciogliendo 2,7 mg in 500 pl con DPBS CaCl 2 e MgCl 2) usando un rapporto di 01:07 . (Nota:. Questo rapporto dove viene utilizzato MGD eccesso è stato convenzionalmente impiegati per la preparazione di Fe 2 +-MGD complessa a causa del fatto che la resa di Fe 3 +-MGD è massimizzata in presenza di eccesso MGD L'aggiunta di ascorbato in soluzione per stabilizzare il Fe 2 +-MGD non è necessaria poiché il NO-Fe 3 +-MGD formatosi viene endogenamente ridotto al rilevabile EPR NO-Fe 2 +-MGD da ascorbato, idrochinone, o cisteina con un'efficienza di conversione fino al 99,9% .. Il basso stato di spin diamagnetico di Fe 2 + consente il rilevamento di NO con celle piane o tubo capillare senza la necessità di un dispositivo a bassa temperatura) 15.
- Agitare la sospensione risultante bene e aggiungere 4,6 μl di calcio ionoforo (CAI) (preparato da una soluzione stock di 1,9 mM sciogliendo 1 mg in 1 ml di DMSO).
- Agitare la soluzione nuovamente e incubare a 37 ° C per 36 min per permettere un'ulteriore riduzione di NO-Fe 3 +-MGD al rilevabile EPR NO-Fe 2 +-MGD.
- Raccogliere il supernatante (425 pl) in un tubo Eppendorf e il trasferimento di una cella EPR piatta (o ad un tubo capillare 50 pl).
- Parametri di acquisizione EPR sono: frequenza delle microonde: 9,8 GHz; centro del campo: 3427 G; modulazione di ampiezza: 6,0 G, larghezza di scansione: 100 G; guadagno del ricevitore: 1 x 10 5, potenza microonde: 10 mW, il numero totale di scansioni: 121; tempo di scansione: 10 s, e la costante di tempo: 20 ms (Nota: poiché i parametri possono variare da uno strumento e le condizioni sperimentali per un altro, quindi, solo il campo centrale, la frequenza e modulazione di ampiezza sono i parametri più importanti da considerare.).
- Registrare il spettri a temperatura ambiente e il 2-D spettri sono stati integritànominale per ridurre il rumore di fondo e di base corretta con Bruker WinEPR software di elaborazione dati o di altri software di elaborazione. Per la quantificazione della formazione di addotti, trame standard di concentrazione in funzione del intensità del segnale (o area) può essere costruito usando un donatore di NO SNAP.
2B. eNOS Uncoupling Experiment
- Rimuovere la piastra da 6 pozzetti dall'incubatore e aspirare il terreno dal secondo pozzo e lavare due volte con 1 ml DPBS.
- Un donatore perossinitrito, 5-ammino-3-(4-morfolinil) -1,2,3-oxadiazolium cloruro (SIN-1) è stato usato per disaccoppiare eNOS 16. Aggiungere 100 pl di 0,5 mM SIN-1 (M r 206,6 g / mol, da 10 mM soluzione fotografia preparata sciogliendo 1 mg SIN-1 in 500 pl di PBS senza Ca / Mg ioni) e diluire a 2 ml con DPBS e il 10% FBS.
- Incubare per 2 ore a 37 ° C e 5% CO 2.
- Rimuovere la piastra dalla camera umida e lavare due volte con DPBS.
- Aggiungere 210 pl di2,8 mM FeSO 4 .7 H 2 O e 210 microlitri di 19,6 mM MGD preparata secondo la procedura di cui sopra.
- Agitare la soluzione e aggiungere 4,6 microlitri di 1,9 mM CAI.
- Agitare la soluzione nuovamente e incubare a 37 ° C per 36 min.
- Raccogliere il supernatante (425 pl) in un tubo Eppendorf e il trasferimento di una cella EPR piatta.
- Parametri di acquisizione EPR sono: frequenza delle microonde: 9,8 GHz; centro del campo: 3427 G; modulazione di ampiezza: 6 G, larghezza di scansione: 100 G; guadagno del ricevitore: 1 x 10 5, potenza microonde: 10 mW, il numero totale di scansioni: 121; Tempo di scansione: 10 s, e la costante di tempo: 20 ms.
- Registrare il spettri e il 2-D spettri sono stati integrati per ridurre il rumore di fondo e basale corretta come menzionato sopra.
3. Rilevamento di O 2 • - da polimorfonucleati neutrofili (PMN)
- I neutrofili sono stati isolati dal campione di sangue umano come descritto in precedenza 17.
- Ottenere una soluzione stock di 1 M * DMPO in PBS contenente 0,1 mM dietilentriammina-pentaacetico acido (DTPA). DMPO ha un punto di fusione di 25-29 ° C ed è quindi più conveniente per pipettare liquidi DMPO (densità ~ 1,02 g / ml a 25 ° C) per una fiala di vetro (Nota: non usare i flaconi di plastica per la pesatura in quanto pura DMPO reagisce con plastica). DMPO congelato può essere sciolto da acqua corrente tiepida al flacone (Nota: non eseguire l'acqua calda come DMPO può decomporsi).
- È importante utilizzare DMPO elevata purezza (> 99%) poiché alcune delle trappole di spin disponibili in commercio contengono impurità paramagnetici, e pertanto, è indispensabile eseguire spettro EPR della sola soluzione DMPO sola (10 mM in questo caso). È fondamentale che non segnale di fondo è evidente (vedi Figura 3A).
- Preparare la soluzione madre (1 mg / ml) di forbol-12-miristato-13-acetato (PMA) in DMSO. Effettuare aliquote diluendo la soluzione a 10 ug / ml in PBS.
- In un 1.5 ml provetta Eppendorf, preparare una soluzione con un volume totale di 0,6 ml seguendo la sequenza di aggiunta: ~ 10 6 cellule per ml di PMN, D-glucosio (1 mg / ml) e albumina (1 mg / ml), 10 DMPO mM e 0,2 mg / ml di PMA. (Nota: PMA è il radicale attivatore e dovrebbe essere aggiunto per ultimo).
- Trasferire la soluzione in una cella EPR piatto.
- EPR parametri di acquisizione condizioni sono: frequenza delle microonde: 9,8 GHz; centro del campo: 3486 G; modulazione di ampiezza: 0,5 G, larghezza di scansione: 100 G; guadagno del ricevitore: 5 x 10 5, il numero totale di scansioni: 10; tempo di scansione: 30 s ; microonde potenza: 20 mW, e costante nel tempo: 81 ms. Per la quantificazione della formazione di addotti, trame standard di concentrazione in funzione del intensità del segnale (o area) può essere costruito utilizzando i nitrossidi stabili come TEMPO o 3-carbossilico-PROXYL.
* Attenzione sull'uso di DMPO: Utilizzando una cella piatta, si può aumentare la densità cellulare e aumentando il segnaleintensità dell'addotto rotazione ma l'emivita di O 2 • - addotto di DMPO è breve (t 1/2 ~ 1 min) che si decompone a DMPO-OH. DMPO può essere sostituito con le stesse concentrazioni di Empo, BMPO o DEPMPO che sono disponibili commercialmente per una maggiore stabilità addotto con t 1/2 ~ 8 e 14 minuti, rispettivamente.
4. Risultati rappresentativi
Spin intrappolamento di NO radicale è stata effettuata utilizzando Fe 2 +-MGD. Figure 2A e 2B mostrano alcun segnale EPR da Fe 2 +-MGD o miscela di Fe 2 +-MGD con CAI, indicando che non NO segnale di fondo proviene da questi reagenti. BAEC dopo stimolazione con CAI rilascia NO che reagisce con Fe 2 +-MGD per formare l'addotto di spin, NO-Fe 2 +-MGD, e mostra un segnale di caratteristica tripletto con divisione iperfine costante (hfsc) valore di N = 12,66 G e g-fattore g = 2,040. (Figura 2C). Il hfsc valore è stato determinato utilizzando il programma di simulazione WINSIM che può essere scaricato dal sito NIEHS Database Software EPR. Il hfsc sperimentale è coerente con il valore di una letteratura N = 12,70 e G = 2,041 g per 18 NO-Fe 2 +-MGD addotto. Analogamente, l'effetto di SIN-1 sul BAEC abbassa la produzione di NO per eNOS disaccoppiamento come mostrato nella Figura 2D.
DMPO spin trap è stato utilizzato per O 2 • - rilevamento. DMPO sola non ha dato un segnale, come mostrato nella Figura 3A confermano che la trappola rotazione è esente da impurità paramagnetiche. Figura 3B è lo spettro di DMPO e PMN solo, e analogamente, non c'è segnale rilevabile suggerendo che il DMPO non provoca attivazione del ossidasi NADPH enzima. figura 3C mostra il segnale osservato EPR alla stimolazione di PMN da PMA. I valori hfsc per questo segnale sono stati determinati per essere un N = 14,71 G, a β-H = 11,40 G e γ-H = 1,25 G, e sono coerenti con i valori di letteratura di un N = 14,3 G, una β-H = 11,7 G e γ-H = 1,3 G 19 per DMPO-O 2 H addotto.

Figura 1. Diagramma di flusso per la rilevazione di radicali da neutrofili e BAEC utilizzando trapping EPR rotazione. (A) sono stati mescolati con PMN DMPO e PMA, e la miscela risultante trasferita in una cella EPR piatta per l'acquisizione dei dati. (B) BAEC sono state fatte crescere su una piastra, e lavata con DPBS. Lo spin trap Fe (MGD) 2 è stato aggiunto insieme con il CAI. La soluzione è stata accuratamente miscelati e incubati. La miscela è stata trasferita ad una cella EPR appartamento EPR acquisizione dati.
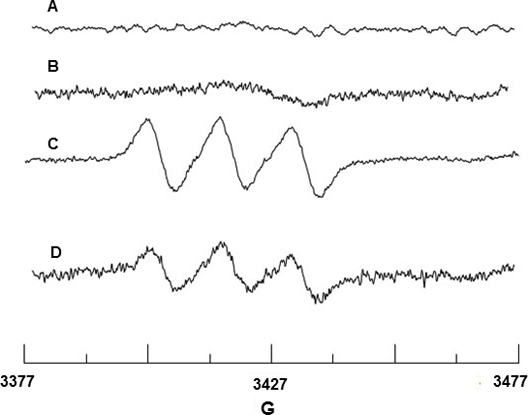
Figura 2. Rilevazione EPR di NO da BAEC. (A) Spettro di Fe 2 +-MGD solo (B) Spettro di Fe 2 +-MGD + CAI solo. (C) Triplet spettro derivante da NO trapping da Fe 2 +-MGD con CAI-cellule stimolate. (D) Spettro che mostra diminuzione della produzione di NO per 0,5 mM SIN-1 trattamento di cellule.
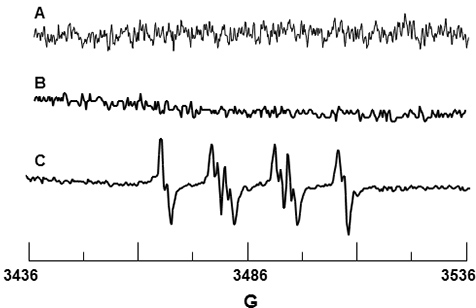
Figura 3. Rilevazione EPR di DMPO-O 2 H dai neutrofili attivati. (A) Spettro di 10 DMPO soli mm. (B) Spettro di PMN solo in presenza di 10 mM DMPO. (C) Spettro di PMN attivato dal PMA in presenza di 10 mM DMPO.
Discussione
Trapping centrifuga EPR è stato impiegato in una vasta gamma di applicazioni biomediche per quantificare e identificare i radicali liberi. Trapping Spin è altamente sensibile, in grado di rilevare radicali a concentrazioni comprese tra nM a pM rendendo così adatto per applicazioni in sistemi biologici. La formazione dell'addotto paramagnetico, NO-Fe 2 +-MGD, è la base di NO rilevamento via EPR. Fe 2 +-MGD reagisce rapidamente con NO 18 ad una velocità di ~ 10 6
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Questo lavoro è stato finanziato dal National NIH Heart, Lung, and Blood Institute concessione RO1 HL81248.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Commenti (opzionale) |
| Fenolo DMEM libero Alta glucosio 1X | GIBCO | 31053 | |
| 0,25% tripsina-EDTA | GIBCO | 25200 | |
| L-Glutammina | Fisher Scientific | BP379-100 | |
| MEM non amminoacidi essenziali | GIBCO | 11140 | |
| Siero bovino fetale | Atlanta Biologicals | S11550 | |
| Fattore di crescita endoteliale | Millipore | 02-102 | |
| CAI | Enzo Life Sciences | A-23187 | Sciogliere in DMSO |
| SIN-1 | Enzo Life Sciences | BML-CN245-0020 | |
| DMPO | Dojindo Laboratories | D048-10 | |
| FeSO 4 .7 H 2 O | Sigma Aldrich | 215422-250G | Sciogliere in PBS con Ca e Mg |
| MGD | Enzo Life Sciences | ALX-400-014-M050 | Sciogliere in PBS con Ca 2 + e Mg 2 + |
| Cellule BAEC | Sistemi di celle | 2B2-C75 | |
| DMSO | Fisher Scientific | BP231-100 | |
| DPBS | Sigma Aldrich | D8537 | |
| DPBS con CaCl 2 e MgCl 2 | A Sigmaldrich | D8662 | |
| Forbol-miristato acetato (PMA) | Sigma Aldrich | 79346-1MG |
Riferimenti
- Winterbourn, C. C. Reconciling the chemistry and biology of reactive oxygen species. Nat. Chem. Biol. 4, 278-286 (2008).
- Winterbourn, C. C., Hampton, M. B. Thiol chemistry and specificity in redox signaling. Free Radic. Biol. Med. 45, 549-561 (2008).
- Clerch, L. B., Massaro, D. J. . Oxygen, Gene Expression, and Cellular Function. , (1997).
- Gutteridge, J. M. C., Halliwell, B. Antioxidants: Molecules, medicines, and myths. Biochem. Biophys. Res. Commun. 393, 561-564 (2010).
- Sumimoto, H. Structure, regulation and evolution of Nox-family NADPH oxidases that produce reactive oxygen species. FEBS J. 275, 3249-3277 (2008).
- Ignarro, L. J. . Editor Nitric Oxide: Biology and Pathobiology. , (2009).
- Moreau, M. Differential effects of alkyl- and arylguanidines on the stability and reactivity of inducible NOS heme-dioxygen complexes. Biochemistry. 45, 3988-3999 (2006).
- Vasquez-Vivar, J. Superoxide generation by endothelial nitric oxide synthase: the influence of cofactors. Proc. Natl. Acad. Sci. U. S. A. 95, 9220-9225 (1998).
- Villamena, F. A., Zweier, J. L. Detection of reactive oxygen and nitrogen species by EPR spin trapping. Antioxid. Redox Signal. 6, 619-629 (2004).
- Finkelstein, E., Rosen, G. M., Rauckman, E. J. Spin trapping of superoxide and hydroxyl radical: practical aspects. Arch. Biochem. Biophys. 200, 1-16 (1980).
- Frejaville, C. 5-Diethoxyphosphoryl-5-methyl-1-pyrroline N-oxide (DEPMPO): a new phosphorylated nitrone for the efficient in vitro and in vivo spin trapping of oxygen-centered radicals. J. Chem. Soc., Chem. Commun. , 1793-1794 (1994).
- Olive, G., Mercier, A., Le Moigne, F., Rockenbauer, A., Tordo, P. 2-Ethoxycarbonyl-2-methyl-3,4-dihydro-2H-pyrrole-1-oxide: Evaluation of the spin trapping properties. Free Radical. Biol. Med. 28, 403-408 (2000).
- Villamena, F. A., Zweier, J. L. Superoxide radical trapping and spin adduct decay of 5-tert-butoxycarbonyl-5-methyl-1-pyrroline N-oxide (BocMPO): kinetics and theoretical analysis. J. Chem. Soc., Perkin Trans. 2, 1340-1344 (2002).
- Tsuchiya, K. Nitric oxide-forming reactions of the water-soluble nitric oxide spin-trapping agent, MGD. Free Radical Biol. Med. 27, 347-355 (1999).
- Vanin, A. F., Poltorakov, A. P., Mikoyan, V. D., Kubrina, L. N., van Faassen, E. Why iron-dithiocarbamates ensure detection of nitric oxide in cells and tissues. Nitric Oxide. 15, 295-311 (2006).
- RojasWahl, R. U. Decomposition mechanism of 3-N-morpholinosydnonimine (SIN-1): A density functional study on intrinsic structures and reactivities. J. Mol. Model. 10, 121-129 (2004).
- Klempner, M. S., Gallin, J. I. Separation and functional characterization of human neutrophil subpopulations. Blood. 51, 659-669 (1978).
- Pou, S. Spin trapping of nitric oxide by ferro-chelates: kinetic and in vivo pharmacokinetic studies. Biochim. Biophys. Acta. 1427, 216-226 (1999).
- Finkelstein, E., Rosen, G. M., Rauckman, E. J. Spin trapping. Kinetics of the reaction of superoxide and hydroxyl radicals with nitrones. J. Am. Chem. Soc. 102, 4994-4999 (1980).
- Britigan, B. E., Rosen, G. M. Spin-trapping and human neutrophils. Limits of detection of hydroxyl radical. J. Biol. Chem. 264, 12299-12302 (1989).
- Frejaville, C. 5-(Diethoxyphosphoryl)-5-methyl-1-pyrroline N-oxide: A new efficient phosphorylated nitrone for the in vitro and in vivo spin trapping of oxygen-centered radicals. J. Med. Chem. 38, 258-265 (1995).
- Snyrychova, I. Improvement of the sensitivity of EPR spin trapping in biological systems by cyclodextrins: A model study with thylakoids and photosystem II particles. Free Radical Biol. Med. 48, 264-274 (2010).
- Han, Y. Lipophilic beta-cyclodextrin cyclic-nitrone conjugate: Synthesis and spin trapping studies. J. Org. Chem. 74, 5369-5380 (2009).
- Han, Y., Tuccio, B., Lauricella, R., Villamena, F. A. Improved spin trapping properties by beta-cyclodextrin-cyclic nitrone conjugate. J. Org. Chem. 73, 7108-7117 (2008).
- Hardy, M. Detection, characterization, and decay kinetics of ROS and thiyl adducts of mito-DEPMPO spin trap. Chem. Res. Toxicol. 20, 1053-1060 (2007).
- Kim, S. -. U. Fast reactivity of a cyclic nitrone-calix[4]pyrrole conjugate with superoxide radical anion: Theoretical and experimental studies. J. Am. Chem. Soc. 132, 17157-17173 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon