Method Article
Difusión lateral y exocitosis de proteínas de membrana en neuronas cultivadas evaluó a través de la recuperación de fluorescencia y la pérdida de fluorescencia photobleaching
En este artículo
Resumen
Este informe describe el uso de imágenes de células vivas y técnicas fotoblanquear para determinar la expresión en la superficie, las vías de transporte y la cinética de la trata de exógena expresó, sensible al pH las buenas prácticas agrarias de etiquetado proteínas en la membrana plasmática de las neuronas.
Resumen
Protocolo
1. Cultivo celular, la transducción viral, y expresión de proteínas
- Neuronas del hipocampo Cultura de alta densidad de crías de rata embrionarias día 18 (E18) sobre cubreobjetos de vidrio poli-l-lisina para 14-25 días in vitro (DIV).
- 6-24 horas antes de los experimentos en vivo, las células transducen con virus atenuado Sindbis que contienen la proteína de la membrana de interés, marcada con el pHluorin súper eclíptica (SEP).
- Añadir el medio pseudovirión que contiene directamente al cubreobjetos que contiene 1 ml de medio condicionado y devuelto a la incubadora cultivo. El título y el tiempo de expresión de la proteína después de la transducción viral variará dependiendo del lote de virus y debe determinarse para cada lote antes de comenzar los experimentos de células vivas.
2. FRAP, FLIP imágenes de células vivas
- Equipo de puesta a punto
- Transferir el portaobjetos a la cámara de imágenes de un microscopio Zeiss Axiovert META confocal LSM 510.Para minimizar las fluctuaciones de potencia durante la exploración, asegurar el microscopio se ha encendido, con salida de láser 100%, por lo menos 20 minutos antes de la imagen.
- Inmediatamente, sustituir el medio de cultivo con pre-calentado (37 ° C) solución de grabación extracelular que contiene 140 mM de NaCl, 5 mM de KCl, 15 mM de glucosa, 1,5 mM de CaCl 2, 1,5 mM de MgCl 2, 20-25 mM HEPES (pH ajustado a 7,4 con NaOH) y colocar la cámara en la etapa de pre-calentado (37 ° C) de la Zeiss Axiovert.
Asegurarse de la osmolaridad de la solución de grabación extracelular se ajusta dentro de 10 mOsM de su medio de cultivo. Siempre que no hay evaporación significativa se produce durante el curso de tiempo de la experiencia, la solución independiente de CO 2 es adecuado para experimentos cortos (<10 horas). La suplementación con 1.2 mM de bicarbonato de sodio es recomendable.
- Definición de los parámetros de captura de imágenes
- En primer lugar, identificar una neurona que expresa la pro recombinanteproteína de interés y ponerla en el foco.
- Con un aceite de 63X se opuso, adquirir una imagen de toda la célula de excitación 488 nm utilizando la luz láser en el láser de baja potencia. Para reducir al mínimo photobleaching, utilice una velocidad nominal rápida (7-9) y píxeles de resolución baja (512-512) el mantenimiento de la velocidad de escaneo total de <1 segundo.
- Seleccione una parte de la dendrita de la imagen y el zoom para capturar un marco que contiene el retorno de la inversión (~ 1.5-2.5 x zoom óptico). Donde sea posible, asegurar el campo de visión contiene varios procesos de manera que las mediciones de dendritas de referencia se puede obtener, para determinar si no específica photobleaching debido a la adquisición se está produciendo.
- Ajuste de los filtros, estenopeica, velocidad de análisis y ganancia del detector de fluorescencia para permitir máxima de excitación láser mínima, pero con la saturación limitada. El diámetro del agujero de alfiler grande, se recomienda, para maximizar la recolección de fotones (2μm es adecuado para las espinas y las dendritas ternarios). La ganancia del detector debe ser lo suficientemente fuerte como para detectar pequeños incrementos de fluorescencia,de tal manera que las imágenes muy en primer lugar, antes de la fotoblanqueo no superar el 10% de pixeles saturados.
- Guarde esta configuración que se utilizará para la pre-/ post-cloro y fases de recuperación del experimento.
- A continuación, defina las regiones fotoblanquear; la selección de un retorno de la inversión para la fotoblanquear inicial y regiones de acompañamiento para la fase de photobleaching repetitivo posterior. Asegúrese de que las regiones que flanquean son lo suficientemente amplia como para impedir la recuperación por la difusión entre las exploraciones (típicamente de 5 m, ver fig. 2).
- Ajustar los parámetros de blanqueador para ROI fotoblanquear ambos. El fotoblanquear inicial debe ser rápida (0,1 a 0,5 seg) que requiere entre 1-5 iteraciones, dependiendo del zoom óptico y el volumen de la RDI. Para las regiones flanqueantes, la excitación láser debe ser ajustado para asegurar fotoblanqueo continua de las regiones de flanqueo, pero sin daño fototóxico.
- Como guía, se utiliza el 100% de excitación láser para el fotoblanquear inicial, y el 10% para el ph repetitivo photobleachingASE.
- Adquisición de imágenes
- Una vez que todos los parámetros se han establecido, realizar el experimento FRAP-FLIP como una secuencia variable de la imagen de lapso de tiempo, se indica en los 4 bloques siguientes:
BLOQUE 1: 3-10 de pre-blanqueo imágenes de referencia, en el láser de baja potencia, sin tiempo de retardo
BLOQUE 2: fotoblanquear el ROI central a plena potencia del láser, 1-5 iteraciones
BLOQUE 3: 3-10 lejía después de la recuperación de imágenes
BLOQUE 4: fotoblanquear repetitiva de las regiones flanqueantes en la potencia del láser con medio de captura de imágenes en un intervalo de tiempo típico de 1 - 5 segundos, dependiendo de la tasa de recuperación de la proteína bajo investigación. - Finalmente, reemplazar la solución de grabación extracelular con una solución tamponada a pH 6 de grabación que contiene 140 mM de NaCl, 5 mM de KCl, 15 mM de glucosa, 1,5 mM de CaCl 2, 1,5 mM de MgCl 2, 20-25 mM MES (para saciar fluorescencia) o complementado con 50 mM NH4Cl que contiene 90 mM de NaCl, 5 mM de KCl, 15 mM de glucosa, 1,8 mM de CaCl 2, 0,8 mMMgCl 2, 20-25 mM HEPES, pH 7,4 (para revelar las proteínas en las tiendas de pH intracelular bajo), (ver fig. 2).
- Recoger al menos 10 a 20 conjuntos de datos para cada proteína recombinante, para permitir el análisis estadístico. Para evitar sesgar los resultados, garantizar las condiciones de formación de imágenes se mantienen consistentes entre repeticiones. Deseche cualquier conjuntos de datos incompletos en el blanqueado, la desviación significativa del plano focal o daño de las células fototóxica se observan.
- Una vez que todos los parámetros se han establecido, realizar el experimento FRAP-FLIP como una secuencia variable de la imagen de lapso de tiempo, se indica en los 4 bloques siguientes:
3. Análisis de Datos
- Abra las imágenes con el software ImageJ.
- Alinear las pilas para dar cuenta de las pequeñas fluctuaciones en el plano xy que se hayan producido a lo largo de la serie de tiempo usando el plugin de Stackreg (plugins → → stackreg transformación: cuerpo rígido → ).
- Para las imágenes tomadas en Zeiss confocal, utilice el complemento Herramientas LSM para informar de los valores de tiempo como un archivo de texto (plugins → Herramientas → LSM Mostrar LSM Herramientas → → ),e importar estos valores en una hoja de análisis.
- Para medir las fluctuaciones de fluorescencia durante el experimento FRAP-FLIP, dividir el segmento photobleached en las regiones de píxeles individuales (aproximadamente 20pixels) y medir la fluorescencia media de estas regiones de interés en cada momento (F). Para obtener rápidamente estos valores, seleccionar varias regiones de interés utilizando la herramienta de ImageJ "retorno de la inversión del Administrador de análisis (Analizar → Herramientas → Administrador de retorno de la inversión) e informar de la media de fluorescencia por píxel a través del" Argumento del eje Z el perfil de comando (Imagen → → Pilas Parcela Z ejes perfil).
- Repetir este paso para medir la intensidad de fluorescencia de un fondo, en la región no fluorescente.
- Normalizar la intensidad de fluorescencia en cada punto de tiempo restando los valores de fondo para eliminar el ruido experimental, y dividir todos los valores de la medida basal media antes de la blanqueada.
- Medir la intensidad de la fluorescencia de las adyacentes no photobleached dendritas para evaluar el nivel de no-específicaphotobleaching durante la adquisición. Corrección de la no específica photobleaching se recomienda para la interpretación de 'FRAP-FLIP "los datos y se debe evitar siempre que sea posible.
- Para calcular si la recuperación significativa ha tenido lugar en un retorno de la inversión, se resta la media de las últimas medidas de 5-10 de la secuencia de la media de las primeras medidas de 5-10 (Df) y determinar la significación estadística. Clasificar el rendimiento de la inversión y no la recuperación de la recuperación-para evaluar el patrón de la exocitosis (es decir, puntos de acceso o de recuperación de la columna vertebral exocitosis vs eje).
4. Los resultados representativos
El resultado de típico FRAP-FLIP experimento se muestra en la fig. 2. Aquí, una neurona que expresa la subunidad del receptor de AMPA GluA2 de glutamato de tipo, etiquetados con la SEP ha sido selectivamente photobleached lo largo de una región de la dendrita. Fig. 2.A ilustra la región de dendrita que se ha fotografiado e indica la ROIs que han sido seleccionados para photobleaching (regiones de caja blanca). The gran área de caja blanca se blanqueó una vez, seguido por repetitivo blanqueo de las regiones de acompañamiento en caja, con la destacada dobles encabezados flechas azules. La flecha roja indica el retorno de la inversión medido, que se muestra en el gran aumento en los paneles inferiores.
Fig. 2.B, muestra la intensidad de fluorescencia en el retorno de la inversión medido durante el curso del tiempo del experimento. En este ejemplo, un período de recuperación un minuto se registró después de la fotoblanquear inicial para permitir que los receptores de crudos para entrar en el retorno de la inversión por difusión lateral. Cuando las regiones flanqueantes se photobleached, la señal de fluorescencia a partir de esta fracción muy móviles de los receptores está ocluida de la región central, y los de la región se diluyen a cabo. El aumento de la fluorescencia (Df) observada durante el "FLIP" secuencia por lo tanto se puede atribuir a la inserción de septiembre-GluA2 en el eje dendrítica. El lavado de bajo pH y el pH 7,4 + adición de NH4Cl respectivamente confirmar que la fluorescencia medida se deriva de la superficieproteínas y revelar la proporción de proteínas intracelulares, secuestrados en el ROI medido.
En contraste con FRAP, esta metodología aísla recuperación debido a exocitosis, resultando en un nivel muy reducido de recuperación de fluorescencia en la región photobleached. Hasta la fecha ningún modelo matemático fiable ha sido desarrollado para encajar y analizar la recuperación trazas grabado utilizando esta técnica selectiva de blanqueo. Sin embargo, es posible ajustar la traza de la recuperación con una recuperación mono exponencial:
F (t) = A s - A e 0 (-t / τ)
Donde f (t) es la fluorescencia en el tiempo t, s es un valor de estado estacionario, A 0 es el desplazamiento en el tiempo 0, τ es la constante de tiempo. El crecimiento de recuperación se fija con una tasa dada de llegar a un equilibrio, correspondiente a un estado estacionario entre la inserción y difusión. Es importante destacar que la constante de tiempo extraída de este unNÁLISIS no refleja la constante de tiempo de exocitosis y sólo se puede utilizar para tratamientos comparativos para una proteína individual.
Además, el patrón esperado de recuperación de fluorescencia es probable que se observa en sub-dominios a lo largo de la región photobleached. El análisis de retorno de la inversión pequeña dentro de un segmento photobleached puede ser esencial para revelar exocitosis "puntos calientes", y es conveniente analizar las regiones de longitudes comparables a los de la variabilidad de la densidad de estos puntos entre la dendrita afectará a la tasa calculada.
La figura 3 muestra una extensión de este protocolo, la aplicación de la fotoblanquear al retorno de la inversión la sección grande con múltiples dendritas en el campo de visión, seguido por repetitiva selectiva de blanqueo de una sola dendrita. Este enfoque permite a los tradicionales "FRAP" y "FRAP-FLIP" los datos que se deben adquirir en paralelo. En este ejemplo, las neuronas del hipocampo se han infectado con una subunidad del receptor glutamato de la clase de kainato, septiembre de etiquetado GluK2. Príor para formación de imágenes, estas neuronas de fueron tratados con cylcohexamide (2 horas a 200μg/ml), para bloquear la síntesis de proteínas. Como tal recuperación, la fluorescencia en el rendimiento de la inversión respectivo medida (figura 3.B) revela que la proporción de recuperación debido a la difusión lateral y el reciclaje en la dendrita FRAP estándar versus el reciclaje solo en la dendrita sometido a la 'FRAP-FLIP-protocolo. Al comparar los valores Df a partir de curvas de la FRAP frente a la recuperación "FRAP-FLIP-, las contribuciones relativas de reciclaje (Df rec = 11,05%) frente a la difusión laterales (Df diff = 9,35%) se puede deducir. A diferencia de la Figura 2, la recuperación no mantiene un nivel de estado estacionario, sino más bien, debido a la inhibición de la síntesis de proteínas, muestra un aumento transitorio y posterior bajada de la señal, correspondiente a la depleción de la piscina del receptor disponible (aproximadamente 20% disminución observada durante el período de grabación).
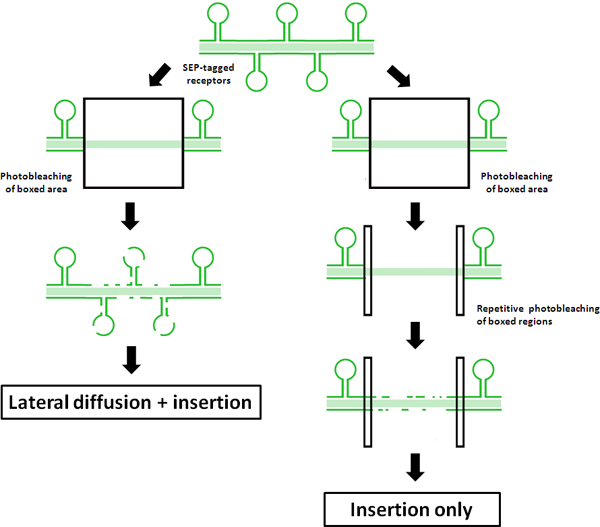
Figura 1. Esquema de los principios de la FRAP FRAP, FLIP vs protocolos Este esquema ilustra los resultados de un FRAP regular versus un protocolo 'FRAP-FLIP ", utilizando Sep-etiquetados receptores. La recuperación de la fluorescencia en el FRAP tradicional se muestra en el lado izquierdo. La recuperación de medición de fluorescencia en el centro de retorno de la inversión se atribuye a una combinación de laterales de difusión f no photobleached receptores de septiembre de etiquetado de fuera de la ROI photobleached y la inserción de los receptores a través del reciclaje y / o de la exocitosis novo en el eje dendríticas. Por el contrario, la photobleached repetitivo de la ROIs flanqueante se ilustra en el lado derecho, se muestra cómo 'FRAP-FLIP' esta modificación silencios protocolo debido a la difusión lateral de recuperación. Como tal, cualquier recuperación fluorescencia medida se puede atribuir a la inserción directa en el retorno de la inversión.
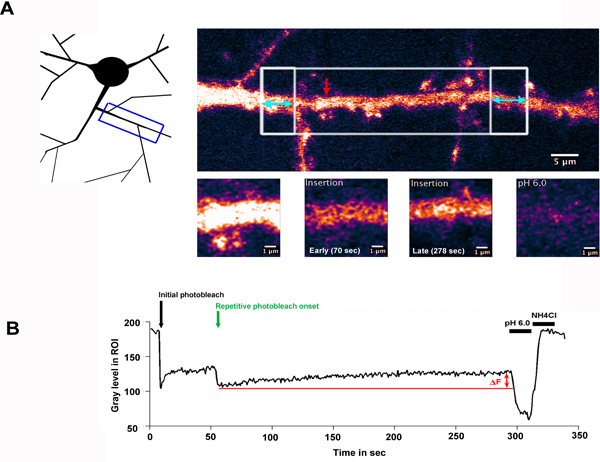
Figura 2.La inserción de septiembre-GluA2 en la membrana plasmática en el eje dendrítica
A) Una neurona del hipocampo expresan SEP-GluA2, selectivamente photobleached lo largo de una región de la dendrita. El esquema ilustra la región de dendrita que se ha fotografiado, mientras que el panel superior izquierda destaca la ROIs que han sido seleccionados para photobleaching. La gran área de caja blanca se blanqueó una vez, seguido por repetitivo blanqueo de las regiones de acompañamiento en caja, con la destacada dobles encabezados flechas azules. Este panel muestra la dendrita antes de photobleaching. La flecha roja indica el retorno de la inversión medido, que se muestra en el gran aumento en los paneles inferiores. B) muestra la intensidad de fluorescencia en el retorno de la inversión medido durante el curso del tiempo del experimento, trazada como nivel de gris en el ROI (no normalizado). La flecha negro resaltar el punto de tiempo de la fotoblanquear inicial y flecha verde indica el inicio de la photobleaching repetitivo. Df indica ªe incremento en la fluorescencia observada durante el período de recuperación, debido a la inserción de septiembre-GluA2 en el eje dendrítica. Tras pH bajo y un pH de 7,4 + NH 4 lavados Cl confirmar que la fluorescencia recuperado se refiere a la superficie receptores expresados.
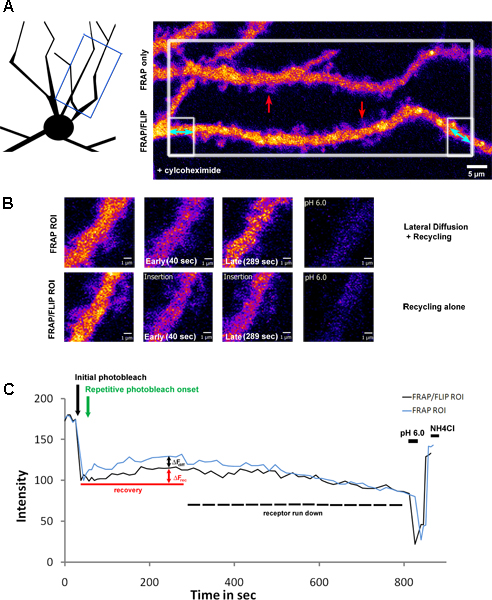
Figura 3. Reciclaje y reciclaje de lateral frente a la difusión de la SEP-GluK2 en el eje dendríticas después del tratamiento con cicloheximida
A) Una neurona del hipocampo expresan SEP-GluK2, de forma selectiva con el FRAP photobleached paralelo y 'Flip-FRAP "protocolos de recuperación realizados a lo largo de regiones de interés dendríticas por separado. Esta neurona fue sujeto a un tratamiento previo con ciclohexamida, para bloquear la síntesis de proteínas (2 horas a 200 g / ml). El esquema ilustra la región de dendrita que se ha fotografiado, mientras que el panel de la izquierda destacando la ROIs que han sido seleccionados para photobleaching. The gran área de caja blanca se blanqueó una vez, seguido por repetitivo blanqueo de las regiones de acompañamiento en caja, de la dendrita inferior solamente, con la destacada dobles encabezados flechas azules. Este panel muestra las dendritas antes de photobleaching. Las flechas rojas resaltar el rendimiento de la inversión se muestra en una gran ampliación en B) que ilustra la recuperación de la fluorescencia en el FRAP tradicional versus el protocolo del 'FRAP-FLIP. Las comparaciones de los niveles de intensidad de fluorescencia en la última etapa de recuperación (paneles de terceros) muestran la contribución de la difusión lateral y el reciclaje en comparación con el reciclaje solo. C) muestra la intensidad de fluorescencia en el rendimiento de la inversión medido en el transcurso del experimento, trazados como intensidad normalizada valores. La flecha negro resaltar el punto de tiempo de la fotoblanquear inicial y flecha verde indica el inicio de la photobleaching repetitivo. Df rec indica que la recuperación transitoria debido al reciclaje del receptor, determina a partir de la dendrita FRAP / FLIP, mientras que Dfesta mide la contribución de la difusión lateral de septiembre-GluK2 en el eje dendríticas en el 'FRAP sólo "retorno de la inversión. El aumento transitorio es seguido por disminución gradual de la señal, correspondiente a la carrera hacia abajo de los receptores disponibles como resultado de un tratamiento ciclohexamida. El pH posterior baja y pH 7,4 + NH 4 lavados Cl confirmar que la fluorescencia recuperado se refiere a la superficie receptores expresados.
Discusión
Se describe una estrategia innovadora para visualizar los componentes de la trata de plasma proteína de la membrana. El enfoque combinatorio de photobleaching técnicas con la proteína de septiembre de etiquetado permite selectivamente la membrana de plasma los eventos de inserción que deben evaluarse. Gracias a la continua photobleaching las proteínas de la membrana en las regiones flanqueantes durante la recuperación, el método de "FRAP-FLIP 'evalúa la contribución del tráfico vesicular a la recuperación de la fluorescencia. Este enfoque novedoso permite la grabación directa de inserción proteína de la membrana, lo que permite tanto el número de sub-compartimientos donde se observa la recuperación y la amplitud de la recuperación (Df) en el estado estacionario que se determine. Además, la comparación de FRAP con y sin FLIP permite la proporción de recuperación atribuible a la difusión lateral para ser calculado.
Además, en el mismo experimento, las regiones de no-photobleached dendrita adyacente a las regiones que flanquean photobleached puede serevaluación cualitativa durante la recuperación, la pérdida de fluorescencia observado en estas regiones se debe a la difusión lateral de los receptores de photobleached en estos segmentos no photobleached de la dendrita.
Este protocolo selectivo photobleaching puede ser utilizado para investigar una variedad de procesos celulares tales como el tráfico que caracteriza excocytosis en la membrana plasmática en subáreas definidas (por ejemplo, las dendritas o espinas) FRAP o evaluar la contribución de la inserción lateral de frente de difusión mediante la realización de FRAP paralelo y los -FLIP 'protocolos a lo largo de dendritas adyacentes (Fig. 3).
Es evidente que, mientras que las directrices específicas se han presentado, cada laboratorio deberá optimizar los parámetros de imagen de acuerdo a las muestras y equipos específicos. Es importante destacar que todos los receptores de la superficie en el ROI necesitan ser photobleached, independiente del plano focal del eje z, pero sin daño significativo fototóxico o fotoblanqueo no específica. Nosotrosres deben tener precaución cuando se trata de este protocolo en el soma celular, como el alto porcentaje de los compartimentos intracelulares de pH relativamente bajos por lo general resulta en la fluorescencia de fondo de alta en estas regiones. Además, aunque se ha demostrado que esta técnica se puede aplicar de varias formas, antes de comenzar los experimentos selectivos photobleaching en un nuevo septiembre de etiquetado construir, se aconseja que una caracterización inicial de los receptores marcados se llevó a cabo primero, como se ha descrito por Ashby et al 2.
En general, este método es una adaptación potente y versátil del protocolo estándar de FRAP, lo que permite los eventos de inserción en la membrana plasmática que se evalúan en tiempo casi real.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Estamos muy agradecidos con el Wellcome Trust y el Coordinador de apoyo financiero. IMGG es un compañero de EMBO. KLH es un estudiante de doctorado BBSRC financiado. Damos las gracias a Philip Rubin y Tidball Patrick para el apoyo técnico y la cultura de células, y el Dr. Andrew Doherty para el mantenimiento y la asistencia con los microscopios.
Materiales
Nombre del reactivo Empresa Número de catálogo Comentarios (opcional)
| Name | Company | Catalog Number | Comments |
| Cubreobjetos de vidrio de 24 mm | VWR International | 631-0161 | |
| Poli-l-lisina | Sigma | P2636 | 1mg/ml en tampón de borato a cubreobjetos capa |
| Medio Neurobasal | Invitrogen | 21103 | |
| B27 | Invitrogen | 17504-044 | 2% en el enchapado neuronal y la alimentación de medio |
| La penicilina estreptomicina | Sigma | P0781 | 1% en medio de placas neuronal y la alimentación |
| L-glutamina | Invitrogen | 25030 | 2 mM / 0,8 mM en el platinado / alimentación del medio |
| El suero de caballo | Biosera | DH-291H | 10% en los medios de galvanoplastia neuronales sólo |
| PSIN ReP5 vector de clonación | Invitrogen | K75001 | Para la producción de virus de Sindbis |
| LSM510 META confocal sistema de | Zeiss | ||
| Imagen de J Software | NIH | Software de libre acceso. Todos los plugins que se describen en este documento están disponibles en Http://rsbweb.nih.gov/ij/plugins/ |
Referencias
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The use of pHluorins for optical measurements of presynaptic activity. Biophys. J. 79, 2199-2208 (2000).
- Ashby, M. C., Ibaraki, K., Henley, J. M. It's green outside: tracking cell surface proteins with pH-sensitive GFP. Trends Neurosci. 27, 257-261 (2004).
- Swaminathan, R., Hoang, C. P., Verkman, A. S. Photobleaching recovery and anisotropy decay of green fluorescent protein GFP-S65T in solution and cells: cytoplasmic viscosity probed by green fluorescent protein translational and rotational diffusion. Biophys. J. 72, 1900-1907 (1997).
- Patterson, G. H., Knobel, S. M., Sharif, W. D., Kain, S. R., Piston, D. W. Use of the green fluorescent protein and its mutants in quantitative fluorescence microscopy. Biophys. J. 73, 2782-2790 (1997).
- Wiedenmann, J., Oswald, F., Nienhaus, G. U. Fluorescent proteins for live cell imaging: opportunities, limitations, and challenges. IUBMB Life. 61, 1029-1042 (2009).
- Ashby, M. C. Removal of AMPA receptors (AMPARs) from synapses is preceded by transient endocytosis of extrasynaptic AMPARs. J. Neurosci. 24, 5172-5176 (2004).
- Bouschet, T., Martin, S., Henley, J. M. Receptor-activity-modifying proteins are required for forward trafficking of the calcium-sensing receptor to the plasma membrane. J. Cell. Sci. 118, 4709-4720 (2005).
- Ashby, M. C., Maier, S. R., Nishimune, A., Henley, J. M. Lateral diffusion drives constitutive exchange of AMPA receptors at dendritic spines and is regulated by spine morphology. J. Neurosci. 26, 7046-7055 (2006).
- Martin, S., Bouschet, T., Jenkins, E. L., Nishimune, A., Henley, J. M. Bidirectional regulation of kainate receptor surface expression in hippocampal neurons. J. Biol. Chem. 283, 36435-36440 (2008).
- Jaskolski, F., Mayo-Martin, B., Jane, D., Henley, J. M. Dynamin-dependent membrane drift recruits AMPA receptors to dendritic spines. J. Biol. Chem. 284, 12491-12503 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados