Method Article
Identificazione e caratterizzazione di glicosilazione delle proteine con specifiche endo-e exoglycosidases
In questo articolo
Riepilogo
Utilizzando glicosidasi specifico per rimuovere gli zuccheri da glicoproteine seguita da SDS-PAGE è un metodo valido per individuare modifiche glycan su campioni di proteine ed è una buona scelta per gli studi Glycobiology iniziale. Seguenti modifiche deglycosylation possono essere rilevati come spostamenti della mobilità gel o con la colorazione glycan reagenti sensibili.
Abstract
Glicosilazione, l'aggiunta di zuccheri legati covalentemente, è un importante modificazione post-traslazionale di proteine che possono influenzare significativamente i processi, come l'adesione delle cellule, il traffico molecolare, di liquidazione, e la trasduzione del segnale 1-4. Negli eucarioti, le modifiche glicosilazione più comuni nella via secretoria sono aggiunte a residui di asparagina consenso (N-linked), oppure a residui di serina o treonina (O-linked) (Figura 1). Avvio di N-glicano sintesi è altamente conservato negli eucarioti, mentre il prodotto finale può variare notevolmente tra specie diverse, tessuti, o proteine. Alcuni glicani non vengono modificati ("alto mannosio N-glicani") o vengono ulteriormente elaborati nel Golgi ("complesso di N-glicani"). Diversità maggiore è trovato per O-glicani, che inizia con un comune N-acetilgalattosamina (GalNAc) residui nelle cellule animali, ma si differenziano per organismi inferiori 1. ENT "> L 'analisi dettagliata della glicosilazione delle proteine è un settore a sé e richiede ampie risorse e competenze per eseguire correttamente. tuttavia una serie di enzimi disponibili che gli zuccheri rimuovere (glicosidasi) rende possibile avere una idea generale dello stato di glicosilazione . una proteina in un ambiente di laboratorio standard Qui illustrare l'uso di glicosidasi per l'analisi di una glicoproteina modello. ricombinante gonadotropina corionica umana beta (hCGβ), che trasporta due N-glicani e quattro O-glicani 5 La tecnica richiede solo semplice strumentazione e materiale di consumo tipico, e può essere facilmente adattato alle analisi dei campioni glicoproteina multipli.
Numerosi enzimi possono essere utilizzati in parallelo per studiare una glicoproteina. PNGase F è in grado di rimuovere quasi tutti i tipi di N-glicani legate 6,7. Per O-glicani, non c'è enzima disponibile che può fendere un oligosaccaride intatto dal secoloe proteine spina dorsale. Invece, O-glicani sono rifilati da exoglycosidases a breve un nucleo, che viene facilmente rimosso da O-glicosidasi. Il Mix Deglycosylation Protein contiene PNGase F, O-glicosidasi, neuraminidasi (sialidasi), β1-4 galattosidasi e β-N-acetilglucosaminidasi. E 'utilizzato per rimuovere simultaneamente N-glicani e qualche O-glicani 8. Infine, il Mix Deglycosylation è stata integrata con una miscela di exoglycosidases altri (α-N-Acetylgalactosaminidase, α1-2 Fucosidase, α1, 3, 6 galattosidasi, e β1-3 galattosidasi), che aiutano a rimuovere monosaccaridi altrimenti resistenti che potrebbero essere presenti in alcune O-glicani.
SDS-PAGE/Coomasie blu è usato per visualizzare le differenze in migrazione proteine prima e dopo il trattamento glicosidasi. In aggiunta, uno zucchero metodo specifico colorazione, ProQ Smeraldo-300, mostra come il segnale diminuisce glicani sono successively rimosso. Questo protocollo è progettato per l'analisi di piccole quantità di glicoproteina (da 0,5 a 2 mg), anche se deglycosylation enzimatica può essere scalata fino a ospitare grandi quantità di proteine, se necessario.
Protocollo
1. Deglycosylation enzimatica
- Utilizzare provette PCR per ridurre al minimo la perdita d'acqua a causa dell'evaporazione. Etichettare una serie di tubi 1 a 7.
- Scongelare il buffer 10X G7, il buffer glicoproteina 10X denaturazione e il 10% NP-40 e picchiettare delicatamente i tubi per mescolare il contenuto. Conservare a temperatura ambiente.
- Posizionare l'enzima contenente fiale sul ghiaccio. Cercare di minimizzare disgelo / cicli di congelamento.
- Sciogliere il contenuto della fiala hCGβ (150 mg) in 600 ml di dH 2 O e tenere sul ghiaccio.
- Preparare 1 ml di tampone 1X G7 diluendo lo stock 10X in dH 2 O.
- Diluire 0,5 ml di PNGase F in 25 microlitri di buffer 1X G7 e mantenere sul ghiaccio.
- Preparare l'impasto exoglycosidase (mix EG) combinando due microlitri ognuna delle α-N-Acetylgalactosaminidase, α1-2 Fucosidase, β1-3 galattosidasi, e α1-3, 6 galattosidasi.
- Istituito provette PCR come indicato:
| Tubo / campione # | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| hCGβ (0.25mg/ml) | 9μl | 9μl | 9μl | 9μl | - | - | - |
| Glicoproteina 10X denaturazione Buffer | 1ml | 1ml | 1ml | 1ml | 1ml | 1ml | 1ml |
| dH 2 O | - | - | - | - | 9μl | 9μl | 9μl |
- Cap i tubi, mescolare delicatamente e mettere intermociclatore, chiudere il coperchio e denaturare le proteine incubando 10 minuti a 94 ° C, seguito da un 4 ° premuto C (utilizzando tubi di PCR in un termociclatore impedisce notevolmente l'evaporazione in campioni di piccolo volume).
- Rimuovere i tubi dal termociclatore e centrifugare per rimuovere l'eventuale condensa visibile.
- Aggiungere i seguenti reagenti come indicato:
| Esempio # | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 10% NP-40 | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl |
| 10X Buffer G7 | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5 & mu; L | 2.5μl |
| PNGase F 1:50 dil. | - | 2μl | - | - | 2μl | - | - |
| Deglycosylation Mix | - | - | 2μl | 2μl | - | 2μl | 2μl |
| Mix EG | - | - | - | 2μl | - | - | 2μl |
| dH 2 O | 10μl | 8μl | 8μl | 6μl | 8μl | 8μl | 6μl |
| Reazione vol totale. | 25 μ l | 25 μ l | 25 μ l | 25 μ l | 25 μ l | 25 μ l | 25 μ l |
- Chiudere i tubi PCR utilizzando tappi nuovi (scartare quelli usati dal momento che non si inseriscono correttamente dopo un ciclo di incubazione).
- Mescolare i tubi picchiettando delicatamente 4 volte e poi girare i contenuti verso il basso.
- Mettere le provette nel termociclatore e incubare a 37 ° C per 4 ore poi il raffreddamento dei campioni a 4 ° C.
2. SDS-PAGE di campioni deglicosilata
- Preparare 130 microlitri fresca 3X riducendo tampone di caricamento SDS con l'aggiunta di 4 ml di DTT 1.25m.
- Aggiungere 12,5 ml di preparato 3X riducendo il tampone di caricamento SDS per ogni campione.
- Chiudere i tubi con tappi nuovi e picchiettare delicatamente i tubi per mescolare.
- Incubare le provette in un termociclatore a 94 ° C per 5 minuti e poi raffreddare a 4 ° C.
- Carico 30 ml di ogni campione e 10 ml di marker di proteine su un 10-20% Tris-Glicina gel. Salva il resto del campione per la parte 3.1. Carico 10μl di Protein Marker ColorPlus Prestained.
- Elettroforesi il gel a 130 volt a temperatura ambiente fino a quando il fronte del colorante è vicino alla parte inferiore del gel.
- Quando il gel ha terminato l'esecuzione, rimuovere il gel dal cast e metterlo in una piccola scatola di plastica con sufficiente Coomasie macchia blu per coprire il gel.
- Macchiare il gel per 1 ora e scuotendo con cautela.
- Lavare il gel tre volte per 30 minuti in 50 ml di soluzione Decolorare.
- Registrare le immagini utilizzando un transilluminatore a luce bianca o scanner. In alternativa, il gel può essere asciugati tra fogli di cellophane in una cornice.
3. Pro-Q Smeralda 300 per il rilevamento delle proteine glicosilate in SDS-PAGE gel
- In parallelo con il gel in 2.1), caricare il resto dei campioni su un 10-20% Tris-Glicina gel. Carico 10 e mu; L di proteine marker ColorPlus Prestained.
- Mentre il gel è in esecuzione sciogliere il Pro-Q reagente Smeraldo con DMF e preparare la correzione magazzino, lavaggio e ossidanti soluzioni per la Pro-Q Emerald 300 macchia seguendo il manuale del prodotto fornito con il kit.
- Quando l'elettroforesi, rimuovere il gel da cast e metterlo in una scatola di plastica.
- Fissare il gel con l'aggiunta di 100 ml di soluzione Fix e lasciandola notte a temperatura ambiente e scuotendo con cautela.
- Lavare il gel con 100 ml di soluzione di lavaggio per 10 a 20 minuti a temperatura ambiente con agitazione gentile. Ripetere il lavaggio con soluzione di lavaggio fresca.
- Ossidare i carboidrati tramite l'incubazione del gel con leggera agitazione per 30 minuti in 25 ml di soluzione ossidante.
- Lavare il gel come descritto al punto 3.5.
- Mentre il gel è fresco lavaggio preparare Pro-Q Emerald 300 macchia aggiungendo 500 microlitri della Pro-Q Emerald 300 disciolti in soluzione reagente punto 3.2 a 25 ml dicolorazione buffer fornito nel kit.
- Macchiare il gel con l'aggiunta di 25 ml della macchia preparato al passo 3.8 e incubazione al buio scuotendo con cautela per 90 a 120 minuti.
- Ripetere le due fasi di lavaggio descritto al punto 3.5.
- Registra le immagini con un transilluminatore UV a 300nm. Utilizzare il marcatore 80 kDa, che viene etichettato con Pro-Q verde smeraldo, di sovrapporre l'immagine ai raggi UV per una fotografia luce bianca del gel che mostra la scala prestained.
- Confrontare le immagini del gel colorato Coomasie al passo 2,10 con la Pro-Q gel colorato Smeraldo a partire dal punto 3.11.
4. Rappresentante risultati
I cambiamenti nella migrazione proteina enzimatica dopo deglycosylation sono illustrati nella Figura 2. Confrontare il campione di controllo (pannello A, corsia 1) con il trattamento F PNGase (rimozione di N-glicani, corsia 2), e Mix Deglycosylation (PNGase F; più endo-e exoglycosidases per rimuovere l'O-glicani, corsia 3). Nessun ulteriore riduzionedelle dimensioni è visto dopo la digestione con glicosidasi aggiuntivi (corsia 4). Oltre ad un cambiamento di massa, bande diventano più nitide come glicani vengono rimossi. Una banda di esecuzione con l'indicatore 17 kDa (asterisco) rappresenta completamente deglicosilata hCGβ polipeptidiche (MW: 16 kDa). Altre band potrebbero derivare da deglycosylation incompleti o dalle proteine più non identificati presenti nel campione hCGβ (vedi corsia 1). Corsie 5 a 7 (controlli) mostrano la banda della glicosidasi.
La colorazione glicoproteina dal verde smeraldo è mostrato nel pannello B. Questo reagente ossida e macchie di tutti i glicani presenti in una molecola proteica. Quindi l'intensità del segnale diminuisce hCGβ è enzimaticamente deglicosilata (corsia 1 a corsia 4). Il segnale residuo a corsie 3 e 4 indicano la presenza di motivi glicani, che sono resistenti agli enzimi utilizzati. Le glicosidasi aggiuntivi utilizzati in corsia 4 rimuovere residui di qualche zucchero in più: la migrazione delle proteine è lo stesso, mauna leggera riduzione di intensità della colorazione può essere vista. Frazioni di zucchero resistenti non erano presenti in tutte le specie delle proteine: alcune band non sono stati rilevati dal verde smeraldo (assente nell'immagine UV, tra parentesi), indicando che sono stati ampiamente deglicosilata. Ulteriori dati supportano la conclusione che hCGβ è eterogeneo glicosilata. La banda inferiore sulla corsia 2 (freccia) è debole l'immagine verde smeraldo, mentre la banda superiore di corsia 2 è luminoso, che indica che molti gruppi glicani sono ancora presenti. Questi dati supportano la conclusione che hCGβ ricombinante espresso in cellule di topo contiene glicoforme più 9. Queste glicoforme diverse sono dovute alla eterogeneità intrinseca della glicosilazione dove alcuni polipeptidi non ricevono una glicani in ogni luogo del consenso e / o alcuni glicani sono estesi, mentre altri anche sulla stessa proteina non lo sono.
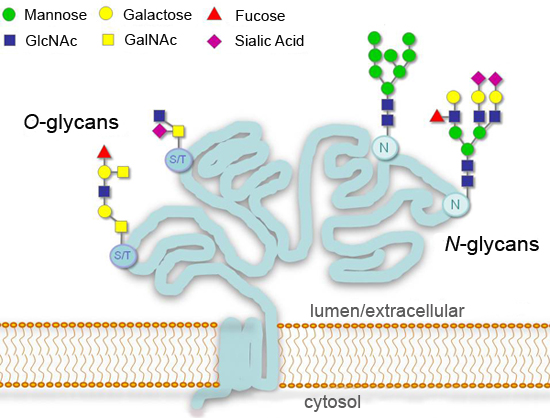
Figura 1.Modelli di glicosilazione tipico per secreta o superficie cellulare glicoproteine.
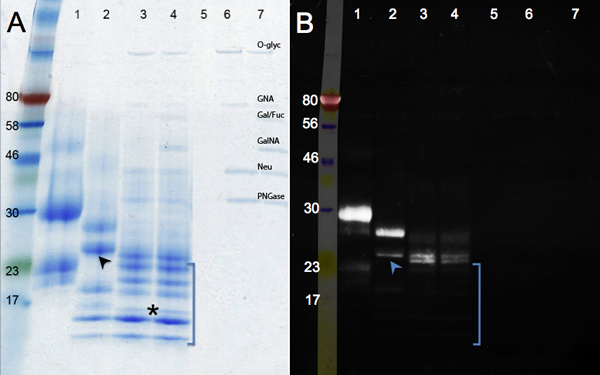
Figura 2. SDS-PAGE gel che mostra deglycosylation enzimatica di hCGβ. Pannello A mostra una colorazione blu, mentre Coomasie Panel B mostra i risultati di Pro-Q Smeralda 300 per la visualizzazione delle proteine glicosilate. Numero del campione: 1, il controllo hCGβ, 2, PNGase F digestione, 3, Mix digestione Deglycosylation, 4, Mix Deglycosylation più digestione exoglycosidases, campioni 5 a 7 sono i controlli reattivi (O-Glyc, O-glicosidasi, GNA, β-N -acetilglucosaminidasi; Fucosidase Gal / Fuc, β1-3 galattosidasi, α1-3, 6 galattosidasi, e α1-2; GalNA, α-N-Acetylglalactosaminidase, Neu, neuraminidasi; PNGase, F PNGase)
Discussione
Il metodo descritto qui utilizzando deglycosylation enzimatica e SDS-PAGE in grado di fornire preziose informazioni sullo stato glicosilazione di una proteina di interesse, mentre glycan reagenti specifici per agevolare l'interpretazione dei dati. Questo protocollo è stato progettato per gli studi iniziali di glicosilazione delle proteine ed è particolarmente adatto per secretoria e glicoproteine di membrana di cellule di mammifero: gli enzimi scelto in questo caso specifico rimuovere tutti gli N-glicani, e o N-glicani plus e gli zuccheri più comuni estendere e costituiscono il nucleo di O-glicani. Glicosidasi hanno il vantaggio aggiuntivo di essere mite, rispetto ai metodi chimici deglycosylation, preservare l'integrità di zuccheri e di spina dorsale delle proteine.
Per chiarire il tasso di occupazione (che gli aminoacidi sono glicosilata), l'estensione della glicosilazione, o per determinare la struttura fine di glicani, tecniche più sofisticate come la mspettrometria di culo, la cromatografia liquida o NMR sono obbligatori.
A causa della sua semplicità, diversi passi in questo protocollo può essere regolata, sostituiti e / o combinati per soddisfare varie esigenze sperimentali. Tuttavia, al fine di ottenere risultati che possono essere chiaramente interpretato, è importante capire i punti di forza e limiti. In primo luogo, la specificità e la purezza delle glicosidasi sono cruciali: solo gli enzimi ben caratterizzati testati per evitare di proteasi e altre attività inquinanti dovrebbero essere usati. Purtroppo, non c'è uno standard per la definizione di unità di enzimi glicosidasi, l'utilizzatore dovrebbe determinare la sostituzione appropriata in base alle specifiche del costruttore. In secondo luogo, una scelta accurata di rilevazione è necessario: a) i reagenti colorazione delle proteine sono utili solo se i risultati deglycosylation in un cambiamento significativo nella massa molecolare. Tale risultato chiaro come mostrato qui non è sempre ottenuta. In altri casi, abbiamo visto mi anormaleintegrazione dopo deglycosylation (lontano dal peso molecolare previsto, o la migrazione ancora più lento). Questo fenomeno non è ben compreso, ma si può dire che ogni cambiamento nella migrazione è la prova che la proteina è stata deglicosilata. B) individuazione di zucchero con anticorpi rappresenta una sfida unica limitando la loro applicabilità. E 'stato molto difficile per generare generale anticorpi anti-glicani, che solitamente sono sollevate contro un obiettivo complesso glicani, che limita il loro uso. Inoltre, diverse monoclonali anti-glicani anticorpi schermo indesiderato reattività incrociata 10. C) Le lectine (proteine con zucchero affinità intrinseca) sono adatti per il rilevamento di zucchero, più danno visione sulla struttura glicani. Tuttavia, non tutti hanno una specificità stretto, e molti sono solo parzialmente caratterizzato (nel senso che avrebbero potuto affinità sconosciuto). Come un segnale positivo colorazione lectina conseguenza, non fornisce indicazioni, la prova, la presenza di un given zucchero. d) kit di etichettatura chimica (sulla base di periodato ossidazione degli zuccheri) sono il metodo di scelta per colorare tutti gli glicoproteine, e quindi ben si adatta a seguire deglycosylation.
Quando si elabora un campione sconosciuto, è una buona pratica includere controlli glicoproteina. Fetuina è un N prontamente disponibili - e O-glicoproteina, gonadotropina corionica (entrambe le subunità) è anche una buona scelta. Sieroalbumina bovina (BSA) può essere utilizzato come controllo negativo. Tuttavia, va notato che alcuni non glicosilata proteine reagiscono un po 'con la Pro-Q Smeralda 300, in particolare quando utilizzati ad alte concentrazioni. Non glicosilata standard di peso molecolare, come il marcatore proteina prestained utilizzati in questo protocollo, hanno il vantaggio di visualizzare le bande taglienti. Solo per caso è una di queste proteine (80 kDa) reattiva a Pro-Q Smeralda 300. Pertanto, l'utente potrebbe desiderare di eseguire una scala standard glicoproteina invece, come la Candy-Cane da Invitrogen.
Infine, semplice-gel rilevazione delle glicoproteine nucleocytosolic (che sono modificati con un singolo O-GlcNAc) è possibile con l'utilizzo di un anticorpo monoclonale, insieme β-N-acetilglucosaminidasi per il controllo della specificità 11. La descrizione di questa tecnica è al di là del scopo di questo articolo, ma dovrebbe essere menzionato come glicosidasi sono strumenti utili per lo studio di molte altre glicoproteine e glicoconiugati presenti nelle cellule. Un trattamento completo di tutte le forme conosciute di glicosilazione può essere trovato nella seconda edizione di "Fondamenti di Glycobiology", disponibile gratuitamente on-line al scaffale NCBI (ID scaffale: NBK1908; PMID: 20301239) 12.
Divulgazioni
Gli autori sono impiegati da New England Biolabs, che produce molti dei reagenti utilizzati in questo articolo.
Riconoscimenti
Don Pettine
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti |
| Β gonadotropina corionica umana | Sigma Aldrich | C6572 | |
| PCR Tubes | VWR | 20170-004 | |
| PCR Termociclatore | Applied Biosystems | 4359659 | |
| PNGase F | New England Biolabs | P0704 | Fornito con tamponi |
| Proteine Deglycosylation Mix | New England Biolabs | P6039 | Fornito con tamponi |
| α-N-Acetylglalactosaminidase | New England Biolabs | P0734 | Fornito con tampone |
| α1-2 Fucosidase | New England Biolabs | P0724 | Fornito con tampone |
| α1-3, 6 galattosidasi | New England Biolabs | P0731 | Fornito con tampone |
| β1-3 galattosidasi | New England Biolabs | P0726 | Fornito con tampone |
| Buffer 10X G7 (500 mM fosfato di sodio) | New England Biolabs | --- | Fornito con PNGaseF o degl Mix |
| Glicoproteina Buffer 10X denaturazione (5% SDS, 400 mM DTT) | New England Biolabs | --- | Fornito con o degl PNGaseF Mix |
| 10% NP-40 | New England Biolabs | --- | Fornito con PNGaseF o degl Mix |
| 3X SDS tampone di caricamento (187,5 mM Tris-HCl pH 6.8, 6% SDS, 30% glicerolo, 0,03% Bromophenol blu) | New England Biolabs | B7703 | Fornito con 1,25 m DTT |
| ColorPlus Prestained Proteine Marker | New England Biolabs | P7709 | |
| 10-20% Tris-Glicina Multigel | Cosmo Bio Co. | DCB-414893 | |
| Cassette Elettroforesi Unità | Cosmo Bio Co. | DCB-303111 | |
| Elettroforesi di alimentazione EPS di alimentazione 301 | GE Healthcare | 18-1130-01 | |
| Pro-Q Emerald 300 Kit Glicoproteina Stain | Invitrogen | P-21857 | |
| Brilliant Blue R | Sigma Aldrich | B0149 | |
| AlphaImager HP System | Cellula Biosciences | 92-13823-00 |
Riferimenti
- Spiro, R. G. Protein glycosylation: nature, distribution, enzymatic formation, and disease implications of glycopeptide bonds. Glycobiology. 12 (4), 43-56 (2002).
- Ohtsubo, K., Marth, J. D. Glycosylation in Cellular Mechanisms of Health and Disease. Cell. 126, 855-867 (2006).
- Arnold, J. N., Wormald, M. R., Sim, R. B., Rudd, P. M., Dwek, R. A. The impact of glycosylation on the biological function and structure of human immunoglobulins. Annual Review of Immunology. 25, 21-50 (2007).
- Mitra, N., Sinha, S., Ramya, T. N. C., Surolia, A. N-linked oligosaccharides as outfitters for glycoprotein folding, form and function. Trends in Biochemical Sciences. 31, 156-163 (2006).
- Carlsen, R. B., Bahl, O. P., Swaminathan, N. Human chorionic gonadotropin. Linear amino acid sequence of the beta subunit. Journal of Biological Chemistry. 248 (19), 6810-6812 (1973).
- Tarentino, A. L., Plummer, T. H. Deglycosylation of Asparagine-linked Glycans by PNGaseF. Trends in Glycoscience and Glycotechnology. 5 (23), 163-170 (1993).
- Tretter, V., Altmann, F., Marz, L. Peptide-N4-(N-acetyl-β-glucosaminyl)asparagine amidase F cannot release glycans with fucose attached α1-3 to the asparagine-linked N-acetylglucosamine residue. European Journal of Biochemistry. 199, 647-652 (1991).
- Koutsioulis, D., Landry, D., Guthrie, E. P. Novel endo-α-N-acetylgalactosaminidases with broader substrate specificity. Glycobiology. 18 (10), 799-805 (2008).
- Thakur, D. Profiling the glycoforms of the intact alpha subunit of recombinant human chorionic gonadotropin by high-resolution capillary electrophoresis-mass spectrometry. Analytical Chemistry. 81 (2), 8900-8907 (2009).
- Park, S., Lee, M. R., Shin, I. Carbohydrate microarrays as powerful tools in studies of carbohydrate-mediated biological processes. Chemical Communications. 37, 4389-4399 (2008).
- Zachara, N. E., Vosseller, K., Hart, G. W. Detection and analysis of proteins modified by O-linked N-acetylglucosamine. Current Protocols in Molecular Biology. 95, 17-17 (2011).
- Varki, A. . Essentials of Glycobiology. , (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon