Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Presión constante controlada por extrusión Método para la preparación de vesículas de lípidos de tamaño nano-
En este artículo
Resumen
Este protocolo describe un método de extrusión para preparar vesículas lipídicas de tamaños sub-micra con un alto grado de homogeneidad. Este método utiliza un sistema de presión controlada con tasas controladas de nitrógeno de flujo para la preparación de liposomas. La preparación de lípidos 1,2, Extrusión de los liposomas, y caracterización tamaño se presenta en este documento.
Resumen
Los liposomas son vesículas preparadas artificialmente que consisten en fosfolípidos naturales y sintéticas que se utilizan ampliamente como una membrana celular imitando plataforma para estudiar proteína-proteína y lípidos interacciones proteína-3, la entrega del monitor fármaco 4,5, y la encapsulación 4. Los fosfolípidos naturalmente crear bicapas lipídicas curvadas, distinguiéndose de una micela. 6 Los liposomas son tradicionalmente clasificados por tamaño y número de bicapas, es decir, vesículas unilaminares grandes (LUVs), las pequeñas vesículas unilaminares (SUVs) y vesículas multilamelares (MLV) 7. En particular, la preparación de liposomas homogéneos de diversos tamaños es importante para el estudio de curvatura membrana que juega un papel vital en la señalización celular, endo y exocitosis, la fusión de membranas, y el tráfico de proteínas 8. Varios grupos de analizar cómo las proteínas se utilizan para modular los procesos que involucran a la curvatura de la membrana y por lo tanto preparar liposomas de diámetro <100 - 400nm a estudiar su comportamiento en 3 funciones celulares. Otros se centran en la encapsulación en liposomas de drogas, el estudio de los liposomas como vehículos para llevar y entregar un fármaco de interés 9. Encapsulación de fármacos se puede lograr como se informó durante la formación del liposoma 9. Nuestra etapa de extrusión no debe afectar el fármaco encapsulado por dos razones, es decir, (1) encapsulación del fármaco debe lograrse antes de esta etapa y (2) liposomas deben conservar su estabilidad biofísico natural, de forma segura la realización del fármaco en el núcleo acuoso. Estos objetivos de la investigación sugieren además la necesidad de un método optimizado para el diseño estables de sub-micrones vesículas lipídicas.
Sin embargo, las tecnologías actuales de preparación de liposomas (10 sonicación, congelación-descongelación y la 10, la sedimentación) no permiten la preparación de los liposomas con una superficie muy curvada (es decir, un diámetro <100 nm) con una alta consistencia y eficiencia 10,5, lo que limita la biofísica estudios de un EMERGIcampo ng de detección de curvatura de la membrana. Aquí, presentamos un método de preparación sólida para una variedad de liposomas biológicamente relevantes.
Extrusión manual utilizando Jeringas de gas y las membranas de policarbonato 10,5 es una práctica común pero heterogeneidad se observa a menudo cuando se utiliza tamaños de poro menores de 100 nm debido a debido a la variabilidad de la presión manual aplicada. Se empleó una constante presión controlada aparato de extrusión para preparar liposomas sintéticos cuyos diámetros varían entre 30 y 400 nm. Dispersión de luz dinámica (DLS) 10, 11 y microscopía electrónica de análisis de nanopartículas de seguimiento (NTA) 12 fueron utilizados para cuantificar los tamaños de liposomas como se ha descrito en el protocolo, con poliestireno comercial (PS) las perlas se utilizan como un estándar de calibración. Se observó una correlación lineal cerca se observó entre los tamaños de poro y los trabajadores liposomas determinados experimentalmente, lo que indica una alta fidelidad de nuestra presión controlada preparación de liposomas se reunióHod. Además, hemos demostrado que este método de preparación de vesículas de lípidos es aplicable en general, independiente de los diversos tamaños de liposomas. Por último, también hemos demostrado en un estudio de evolución en el tiempo que estos liposomas preparados fueron estables durante hasta 16 horas. Un representante de tamaño nanométrico protocolo de preparación de liposomas se demuestra a continuación.
Protocolo
1. Preparación de liposomas
- Recuperar un vial de 20 ml de vidrio con una tapa de teflon.
- Limpiar todo el material de vidrio y jeringas con cloroformo antes de su uso para evitar la contaminación.
- Transferir 100 l de cloroformo grado reactivo en el vial de vidrio utilizando un 250 l hermético jeringa de vidrio.
- Añadir 30 l de metanol de grado reactivo en el vial de vidrio utilizando un mismo 100 l hermético jeringa de vidrio.
- Para preparar un 2 mM 7:1.5:1.5 fosfatidilcolina (POPC): fosfatidiletanolamina (PAPA): solución de lípidos colesterol, transferir 216 l de 10 mg / ml POPC, 42 l de 10 l mg / ml PAPA y 20 de 11 mg / ml Las soluciones de colesterol en CHCl 3 al vial de vidrio de 20 ml.
- Se evaporan los disolventes orgánicos utilizando flujo lento de argón o gas nitrógeno hasta una fina película de lípidos se observa en la parte inferior del vial.
- Coloque el vial de vidrio sin capuchón en un desecador de vacío durante al menos 30 minutos para eliminar el disolvente residual.
- Transfer 2 ml de tampón, previamente pasados por un filtro de 0,2 micras, a la ampolla de cristal para hidratar los lípidos.
- Incubar la mezcla a 4 ° C durante la noche y utilizar dentro de las 48 horas.
2. Congelación-descongelación y: en los tamaños de liposomas de 30 - 100 nm Sólo
- Congelar suspensión de liposomas en nitrógeno líquido durante 15 segundos.
- Descongele suspensión de liposomas utilizando un bloque de calentamiento a 42 ° C de temperatura durante aproximadamente 3 minutos.
- Repetir los pasos 2.1 y 2,2 para un total de 5 ciclos.
3. Extrusión
Siga las instrucciones para ensamblar Avestin correctamente la Liposofast LF-50 extrusora, utilizando el esquema de instrumentos en su libro guía.
- Colocar la pantalla agujero apoyo grande (con agujeros circulares) en la base de soporte del filtro, seguido por el plato circular sinterizado (sin agujeros), un disco de drenaje (25 mm de diámetro), y una membrana de policarbonato (25 mm de diámetro).
- Coloque el negro pequeño,Junta tórica en la parte superior de la membrana para fijarla a la base de soporte del filtro.
- Coloque la extrusora filtro superior apretando los 4 tornillos en los 4 agujeros correspondientes.
- Montar la unidad de filtro a la extrusora debajo del tambor del extrusor grande. Añadir la solución de liposomas a la camisa del cilindro. Coloque el siguiente en la parte superior del cilindro de extrusión en orden: circular grande junta tórica, la tapa estrecho, circular grande junta tórica, la tapa circular.
- Conecte el regulador de gas en la parte superior barril de la extrusora y cerrar todas las válvulas para evitar fugas de aire, incluyendo la válvula de alivio de presión. Colocar un vial de vidrio de 20 ml o 50 ml Erlenmeyer debajo de la unidad extrusora filtro. Una válvula de seguridad está conectado al regulador y liberará si la presión excede 600 psi. Encienda el gas nitrógeno y abrir la válvula de gas conectado a la extrusora.
- Aumentar la presión de nitrógeno a 25 psi para 400 nm liposomas, 125 psi de 100 nm, liposomas y 400-500 psi de 30 nm liposomas.
- Vea el liposoma suspna pensión como se expulsa en el recipiente mientras siendo empujado por el nitrógeno. Mantener la corriente de nitrógeno hasta que ya no observar cualquier líquido que pasa a través del filtro extrusora en el vial de vidrio.
4. La dispersión de luz dinámica (DLS) Análisis
- Preparar 50 l de una solución 20 mM de liposomas.
- Encienda la fuente de alimentación y la fuente de la lámpara.
- Abra el software DynaPro.
- Configure el software para el modelo de algoritmo de MS / X para detectar los liposomas de 30 nm y 100 nm y MS800 modelo algoritmo para detectar> 100 nm liposomas.
- Conectar con el hardware.
- Pipetear 14 ml de muestra de liposomas en la cubeta de cuarzo y de inserción en el soporte de la célula.
- Presione comenzar.
- Pulse para después de ~ 20 - 30 adquisiciones.
- Analizar los picos promedio de liposomas de diámetro grabados en el histograma.
5. Nanopartículas de análisis de seguimiento (NTA)
- Preparar una l 500, 0,1 mM de liposomassolución.
- Lavar el compartimento de la muestra con agua y etanol.
- Seque el compartimiento de la muestra con una toalla de papel sin pelusa.
- Encienda la fuente de potencia del láser y la computadora.
- Entregar 300 L de solución 0,1 mM de liposomas para el compartimiento de la muestra.
- Abra el control de la temperatura y el software de seguimiento de las nanopartículas de análisis.
- Pulse Capturar para activar el láser.
- Utilice los ajustes horizontales y verticales para mover el escenario y ajustar el enfoque del microscopio.
- Ajuste la temperatura deseada (20 ° C) y tiempo de grabación (por lo menos 30 segundos).
- Pulse el botón de grabación para tomar múltiples marcos de foto de las partículas de liposomas para una cantidad especificada de tiempo. Analizar los picos correspondientes a los tamaños de diámetro de los liposomas en el histograma como se rastrea el movimiento de cada partícula.
6. Los resultados representativos
Un esquema de esbozar el método de extrusión es presentido en la Figura 1. Para obtener resultados óptimos, la preparación de liposomas con diámetros de 30 nm requiere una alta presión de ~ 500 psi y diámetros de 100 nm requiere una presión de 125 psi para lograr una tasa de filtro rápido. Para diámetros de 400 nm, una baja presión de ~ 25 psi se recomienda para lograr una velocidad más lenta de filtro, que permite que las vesículas para alargar y formar grandes, liposomas homogéneos. Hemos llevado a cabo una serie de experimentos para determinar la presión óptima para la producción consistentes tamaños sub-micrón vesícula. Se varió la presión, así como el número de extrusión pasa a través de filtros de policarbonato con poros de tamaños de 30, 100 y 400 nm y descubrió presión adecuada para cada tamaño deseado. Durante 30 nm poros, la presión por debajo de 500 psi se reducirá la velocidad de flujo, provocando alargamiento y por lo tanto los tamaños más grandes vesículas. Por los poros de 100 nm, un flujo constante se alcanzó a 125 psi. Por 400 nm poros, de baja presión (25 psi) permite las vesículas para alargar s en la vesícula más grandeiza. Un lento goteo de filtración de flujo es el óptimo para crear mayor sub-micrón vesículas 13.
Se realizó DLS para determinar los tamaños de liposomas extruídos a través de tres tamaños diferentes diámetros, es decir, 30, 100 y 400 nm. DLS es un método establecido que recoge la luz dispersada para determinar el diámetro de las partículas. Nosotros, los liposomas extruidos hidratadas de 2 mM a través de una membrana de policarbonato 30 nm a 500 psi con 5 pasadas a través del poro del filtro; un 100 nm membrana de policarbonato a 125 psi con 5 pasadas a través del poro del filtro y una membrana de policarbonato de 400 nm a 25 psi con 2 pasa a través del poro del filtro. Los diámetros de los liposomas y medidos por DLS para 30, 100 y 400 nm tamaños de poro fueron de 66 ± 28, 138 ± 18 y 360 ± 25 nm (Figura 2). Una suspensión de 50 perlas de poliestireno nm fue utilizado como un estándar de calibración como se muestra en la Figura 2, donde se registró un diámetro de 47 ± 16 nm. El polydispe cientoUnive muestra que no hay superposición dentro de los tamaños de los liposomas. Es típico observar diámetros superiores a 30 nm mediante el análisis de DLS, debido a la tendencia conocida de este instrumento tiene en relación con las partículas más grandes 12. Intensidades de luz de dispersión de partículas grandes y pequeñas se recogen de forma simultánea desde un método de detección y por lo tanto más difíciles de resolver liposomas en suspensión 12. A pesar de esta limitación instrumental, la curva de calibración se describe una correlación lineal cerca.
NTA es una nueva tecnología que mide el tamaño de cada partícula de la observación directa de la difusión en un medio líquido, independiente del índice de refracción de partículas o densidad. Esta técnica de alta resolución se puede utilizar como complemento a la medición de liposomas con DLS. La NTA registraron diámetros de 95 ± 48 y 356 nm ± 51 nm, dos 100 y 400 nm soluciones de poliestireno se utiliza para la calibración. Las soluciones de lípidos de 30 nm y 100 nm se observa que tienen un borrador más diámetro de cultivo en relación con el DLS como se muestra en la Figura 3, produciendo tamaños promedio de 29 ± 14, 95 ± 17 y 359 ± 73 nm. La NTA puede ser una técnica de caracterización más general para cuantificar las partículas microscópicas desde su sensibilidad le permite medir las partículas de 50 a 1000 nm. La curva de calibración muestra una correlación lineal entre los poros de la membrana de policarbonato frente a la registrada diámetro de NTA.
| Tamaños de liposomas | Umbral de detección | Mínima esperada Tamaño de partícula (nm) |
| 30 nm | 11 | 30 |
| 100 nm | 11 | 100 |
| 400 nm | 21 | 400 |
Tabla 1. Parámetros NanoSight.
ad/4151/4151fig1.jpg "/>
Figura 1. Diagrama de flujo del método de extrusión, que describe cómo la presión y el flujo de nitrógeno controla la homogeneidad de diferentes diámetros de liposomas. Después de la hidratación de liposomas, vesículas unilaminares de diferentes tamaños son extruidos a través de diferentes policarbonato poros del filtro de membrana a diferentes presiones.
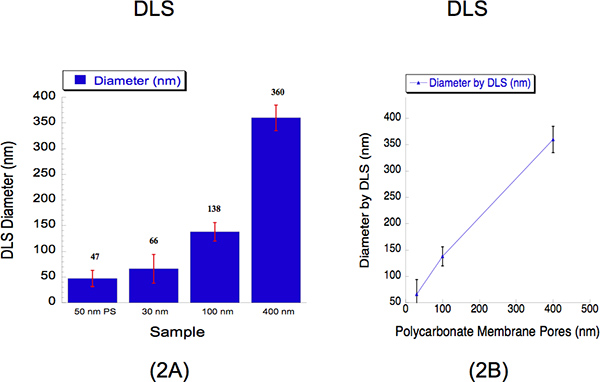
Figura 2. Dinámica de dispersión de luz (DLS) los datos que describen las dimensiones cuantitativas de liposomas después de la extrusión. (A) Los gráficos de barras se muestran para describir los diámetros de las tres muestras de liposomas. Un patrón de calibración de 50 nm de poliestireno (PS) las perlas se utilizó como una referencia. Los diámetros medios de liposomas se indican por encima de la barra para cada muestra. El eje X se describen los tamaños de poro de que las soluciones se extruye a través. El eje y describe el diámetro grabada por DLS. Aunque los 30 nm y 100 nm de registro tamañosed valores superiores a sus tamaños de poros, mientras que el mayor tamaño de 400 nm registró un tamaño ligeramente menor, la curva de calibración (b) muestra una correlación casi lineal, donde el eje x expresa los tamaños de poro de membrana de policarbonato, y el eje y describe el registró diámetro de los liposomas a través de DLS.

Figura 3. Nanopartículas Análisis de seguimiento (NTA) los datos que describen el tamaño de los liposomas después de la extrusión. (A) Los gráficos de barras que representa el diámetro de cada muestra de liposomas. El eje X se describen los tamaños de poro de que las soluciones se extruye a través. El eje y describe el diámetro de tamaño registrada por la NTA. Los diámetros medios de liposomas son etiquetados por encima de cada muestra. (B) La curva de calibración NTA muestra una correlación más lineal de la curva de calibración DLS entre los tamaños de poro del filtro de membrana versus el diámetro grabado. El eje X se describen los tamaños de poro de membrana de policarbonato. El eje y describe el diámetro grabada liposoma por NTA.
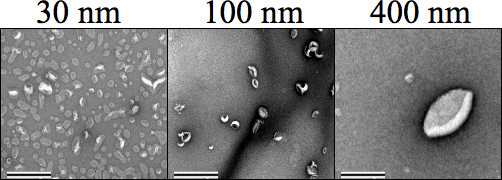
Figura 4. Tinción negativa de transmisión de microscopía electrónica (TEM) imágenes que muestran cada tamaño de liposomas (500 mM), seguido por extrusión. Carbono Formvar rejillas de malla se descargaron negativamente antes de la tinción de la muestra, donde 1% de acetato de uranilo en agua se utiliza para teñir las muestras antes del secado y de imagen con un aumento de x 34.000. Tamaños 30, 100 y 400 nm son claramente distintos entre sí. El aumento se estableció a 25.000 aumentos. La barra de escala representa 0,5 micras.
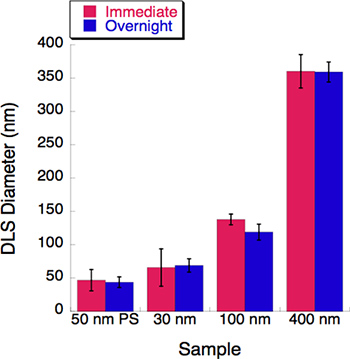
Figura 5. Un experimento tiempo-curso se llevó a cabo con tres tamaños de liposomas. Dispersión de luz dinámica (DLS) se midió para cada solución de liposomas siguiendo inmediatamente la extrusión. Todas las soluciones de liposomas se almacenaron en 4 °C durante la noche. Sus diámetros fueron registrados por el DLS después de una incubación durante la noche. Poco o ningún cambio se observó después de un período de incubación de 16 horas.
Discusión
Usando el Avestin Liposofast LF-50 Extrusora, hemos demostrado cómo de pequeño tamaño, los liposomas sintéticos se preparan a través de un sistema controlado por presión. Es importante señalar que las vesículas multilamelares se forman espontáneamente después de la hidratación de liposomas, que puede conducir a la producción de pequeñas nanopartículas. Estas vesículas multilamelares pequeñas inevitablemente fluirá a través del mayor tamaño de poro de membrana de policarbonato, causando la heterogeneid...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por el Instituto Médico Howard Hughes (HHMI), Premio de la Innovación Colaborativa. LAM fue apoyada por la Señalización Celular y el Reglamento del Instituto Nacional de Salud la formación de subvención (T32 GM008759) y el NIH Ruth L. Kirschstein Pre-Doctoral Fellow (CA165349-01). Nos gustaría dar las gracias al profesor Michael Stowell (CU Boulder), Rees Prof. Douglas y el Prof. Rob Phillips (Caltech) por sus valiosos comentarios.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Cloroformo | Sigma-Aldrich | 02432-25ML | Estabilizadores 95% |
| El metanol de alto grado | Sigma-Aldrich | 179337-4L | |
| Liposofast LF-50 Extrusora | Avestin, Inc. | ||
| Los fosfolípidos | Avanti Polar Lipids | ||
| Los poros de policarbonato | Avestin, Inc. | 25 mm de diámetro | |
| Escurrir los discos PE | Avestin, Inc. | 230600 | 25 mm de diámetro |
Referencias
- Connor, J., Bucana, C., Fidler, I. J., Schroit, A. J. Differentiation-dependent expression of phosphatidylserine in mammalian plasma membranes: quantitative assessment of outer-leaflet lipid by prothrombinase complex formation. Proc. Natl. Acad. Sci. U.S.A. 86, 3184-3188 (1989).
- Smith, S. A., Morrissey, J. H. Rapid and efficient incorporation of tissue factor into liposomes. J. Thromb. Haemost. 2, 1155-1162 (2004).
- Hui, E., Johnson, C. P., Yao, J., Dunning, F. M., Chapman, E. R. Synaptotagmin-mediated bending of the target membrane is a critical step in Ca(2+)-regulated fusion. Cell. 138, 709-721 (2009).
- Loughrey, H. C., Choi, L. S., Cullis, P. R., Bally, M. B. Optimized procedures for the coupling of proteins to liposomes. J. Immunol. Methods. 132, 25-35 (1990).
- Mui, B., Chow, L., Hope, M. J. Extrusion technique to generate liposomes of defined size. Methods Enzymol. 367, 3-14 (2003).
- Gruner, S. M., Cullis, P. R., Hope, M. J., Tilcock, C. P. Lipid polymorphism: the molecular basis of nonbilayer phases. Annu. Rev. Biophys. Biophys. Chem. 14, 211-238 (1985).
- Guven, A., Ortiz, M., Constanti, M., O'Sullivan, C. K. Rapid and efficient method for the size separation of homogeneous fluorescein-encapsulating liposomes. J. Liposome. Res. 19, 148-154 (2009).
- Zimmerberg, J., Kozlov, M. How proteins produce cellular membrane curvature. Nature Reviews Molecular Cell Biology. 7, 9-19 (2006).
- Chonn, A., Cullis, P. R. Recent advances in liposomal drug-delivery systems. Curr. Opin. Biotechnol. 6, 698-708 (1995).
- Mayer, L. D., Hope, M. J., Cullis, P. R. Vesicles of variable sizes produced by a rapid extrusion procedure. Biochim. Biophys. Acta. 858, 161-168 (1986).
- Matsuoka, K., Schekman, R. The use of liposomes to study COPII- and COPI-coated vesicle formation and membrane protein sorting. Methods. 20, 417-428 (2001).
- Dragovic, R. A., Gardiner, C., Brooks, A. S., Tannetta, D. S., Ferguson, D., Hole, P., Carr, B., Redman, C., Harris, A. L., Dobson, P. J., Harrison, P., Sargent, I. L. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine. , (2011).
- Hunter, D. G., Frisken, B. J. Effect of extrusion pressure and lipid properties on the size and polydispersity of lipid vesicles. Biophys J. 74, 2996-3002 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados