このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
プリザーブド解剖組織と無傷マウスの鼻腔組織を準備するための効果的なマニュアル脱骨方法
要約
要約
哺乳類の鼻は複雑な内部構造を持つ多機能な器官である。鼻腔は、解剖学的部位、形態や機能に著しく異なる、嗅覚呼吸、および扁平上皮などの様々な上皮が並んでいます。成体マウスにおいて、鼻、特に内部構造、主嗅上皮(MOE)として後方などの形態と実験的なアクセスを制限する、種々の頭蓋骨で覆われている。ここでは、保存され、解剖学的組織とほぼ全体とそのまま鼻組織を得るための効果的な方法を説明する。解剖顕微鏡下手術のツールを使用して、我々は順番に鼻の周囲の組織の頭蓋骨の骨を取り除く。この手順は、両方のパラホルムアルデヒド固定し、新たに解剖し、肌のマウスの頭を行うことができる。全体の脱骨手順は、従来の化学ベースドに必要な実験時間よりも大幅に短くなって20〜30分程度をとり、石灰化。また、鼻の組織標本から無傷薄い水平または冠状または矢状セクションを取得するために重要である甲、間に閉じ込められた気泡を除去する簡単な方法を提示する。我々の方法を用いて調製した鼻腔組織は、特に地域特有の検査との比較に関心がある研究では、全体のマウント全体上皮の観察だけでなく、形態学、免疫細胞化学、RNAのようなin situハイブリダイゼーション 、および生理学的研究のために使用することができる。
概要
哺乳類の鼻腔は、異なる機能を果たす組織や臓器の様々なタイプが含まれています。鼻腔、肺の中に空の旅を可能にし、外に上気道の入り口部分を構成している。吸入空気は、それが同様に清掃や刺激や有害物質や感染性微生物2を除去するためにフィルタリングなどの温度と湿度の調節1を経鼻腔を通過する。両方の治療は腺や血管を含め、鼻上皮および上皮下組織によって実施され、下気道や肺を保護するために不可欠です。呼吸および上皮防衛におけるその役割に加えて、鼻の組織はまた、通過する空気中の化学物質の広い範囲を検出嗅覚と三叉神経システムの末梢感覚装置が含まれています。活性化されたシステムに応じて、鼻の中の化学物質の官能検出のいずれかを誘発することができ嗅覚、刺激、または痛み3,4。
末梢嗅覚系は複雑であり、鼻腔内のいくつかの解剖学的に分離された嗅覚の感覚器官で構成されている。このうち、主嗅上皮(MOE)はげっ歯5の鼻の上皮の約45から52パーセントを占めると後方領域に配置され、最大である。前腹領域では、鼻中隔の各辺に沿って座る鼻器官06として知られている管状構造のペアがある。 Masera 7,8とGruneberg神経節9の中隔臓器として知られている嗅覚ニューロンの二つの追加の小さなグループが、それぞれ、腹側中隔と鼻腔の背エントリ領域に沿って存在します。これらの末梢器官は、独特の形態の特徴、細胞マーカー発現、および生理機能と神経上皮が含まれています。彼らは一緒に臭いの何千ものを検出絶妙な感度10-12持つ分子。
嗅覚の感覚器官に加えて、鼻腔はまた、他の感覚系を収容する。これは、ペプチド性三叉神経繊維は、特に気道上皮13,14鼻上皮に存在することが知られている。これらの繊維の中には、刺激性や有毒化学物質を検出し、そのような4,15の咳やくしゃみなどの保護反射を開始する責任があります。刺激性の臭気と苦味化合物は、また、三叉神経線維16-19によって支配されているその多くは孤独な化学感覚細胞(SCCの)の最近発見された人口によって検出することができる。これらのSCCは、それらがまた、保護機能16-18を果たす可能性があることを示唆、鼻腔と鋤鼻エントリーダクトの入口領域における高密度に配置されています。従って、鼻上皮は、その機能に応じて、形態学、および細胞組成物が実質的に異なる可能性が解剖学的部位。
でも、シングルと専門上皮内、地域差があります。 MOEは、その一例である。構造を複雑にし、カールしているMOEライン様々な甲、。したがって、それらのために、異なるMOE体験異なる空気流量の領域、および、異なる拡散と空中匂い分子20のクリアランス速度。また、それは所与の匂い受容体を発現する嗅細胞(OSNs)はMOE 21,22の4迂回ゾーンのいずれかに位置していることが知られている。この場所の差がどのように影響するか匂いにOSNの応答は、主に知られていない。さらに、いくつかのOSN集団は、地域嗜好を示す。グアニル酸シクラーゼ-D(GC-D)発現OSNsはectoturbinates 23,24の袋小路領域を支持する帯状の分布を有する。さらに最近では、我々は(TR一過性受容体電位チャネルM5を表現正規OSNsの亜集団を発見PM5)とは、優先的に横と腹側領域に25に位置しています。これらの結果は、MOEが均一でないことを示している。しかし、これらの地域差は、嗅覚のコーディングにどのように影響するかを理解されていません。これは一部にはあるためMOEと鼻の徹底的な生理調査が現在の方法を使用して保存され、解剖学的組織とそのまま鼻上皮を得ることの難しさによって限定されているされています。
鼻の上皮は、主に鼻、上顎、口蓋、頬骨、および篩骨骨を含む頭蓋前方骨に囲まれています。成体マウスや他の齧歯類モデルでは、これらの骨は特に密接に関連した鼻腔組織、繊細な甲を損傷することなく削除するのは難しいとは困難である。多くの場合、化学ベースの脱灰は、免疫組織化学、形態学、およびin situハイブリダイゼーションの研究で用鼻組織の凍結切片許可するように骨を柔らかくするために使用されていますが、依鼎は、動物の年齢に、脱灰プロセスは一晩まで7日間24,26-28続くことができます。それは組織が固定·保存される必要があるため、この治療法も限られている。さらに、化学的な脱灰が厳しいことと、いくつかの敏感な抗体29,30の免疫標識に影響を与えることができる。生理学的研究のために、生きている組織が 必要とされているので、これらの実験は、しばしば、その頭蓋骨の骨薄いと17,31,32柔らかい新生児から得孤立OSNsまたはMOEスライスに行われている。他の分野に生理の記録を制限する、生理学的研究はまた、分割して頭25,33,34のホールマウント標本を利用することができますが、通常は鼻の唯一の内側表面は簡単にアクセスできます。
ここでは、保存され、元の解剖学的組織と形態をそのまま鼻組織を準備するために効果的な、手動の除骨方法について説明します。私たちは、順番に前方の主要な骨を取り除くマウスは非常に古く、凍結切片が必要とされない限り、薄い甲の骨をそのまま維持しながら、ほぼ完全に無傷鼻上皮を公開する解剖顕微鏡下で頭蓋骨。また、このようにして末梢および中枢両方の回路の同時検査を容易にする、鼻腔組織及び嗅球の間の接続、ならびに脳の残りの部分を保持する方法が延びている。我々の手法は、パラホルムアルデヒド固定だけでなく、新鮮な、ライブ鼻腔組織調製するために用いることができる。したがって、我々の方法は、呼吸、嗅覚、そして鼻の損傷や病気の、形態学的免疫組織化学的および生理学的研究を促進することが期待される。
プロトコル
1。マウス鼻の準備
我々はこの研究で、成人C57BL / 6背景のマウスを使用していました。すべての動物のケアと手順はメリーランド大学、ボルティモア郡の動物のケアと使用委員会(IACUC)によって承認されています。
1.1 paraformaldahyde固定マウスから鼻を取得
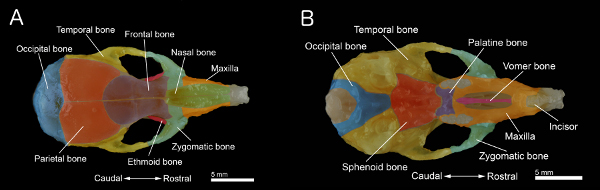
図1。マウスの頭蓋骨の骨:頭蓋骨の背面図B:。削除下顎骨と頭蓋骨の腹ビュー。頭蓋骨は、40日齢のマウスから調製した。個々の骨は、より良い視覚化のために色分けされています。 より大きい数字を表示するには、ここをクリックしてください 。
- 番目以下の個々のマウスを固定するtranscardially灌流林の電子プロトコルら 、(2008)16。 、固定含む3%パラホルムアルデヒドをバッファリングされた19 mMのL-リジンを簡単に説明すると、マウスは、トリブロモエタノール(アベルチン250μgの/ gの体重)で深く麻酔した0.1Mリン酸緩衝液(PB 30〜50 ml)で経心的に灌流、リンが続く塩酸塩、および0.23パーセントナトリウムのm-ヨウ素(約35〜50ミリリットル)。一つは、また、動物灌流35 Joveの資料の手順に従うことができます。
- 下顎骨を切断(または下顎)と頭の皮膚を除去するためにハサミを使用してください。
- 身体の残りの部分から頭部全体を分離。
- 口蓋を外します。また、 図1Aおよび1Bに示す標本を得るために、頭蓋骨の表面に残っている結合組織と筋肉をきれいに取り除く。
- 解剖顕微鏡下では、脳と嗅覚の球根をカバー頭蓋骨を削除します。過剰な組織と骨を切り落とす。ノーTEは、脳と鼻を接続したままにする拡張組織調製のために、唯一の頭蓋骨は削除されます。免疫組織化学的実験のために、組織は、1.5時間後に固定し、0.1Mリン酸に移し一晩、25%ショ糖緩衝生理食塩水(PBS)。鼻腔組織を緩衝スクロース溶液に数回浸漬して切開を通して加湿保たれるべきである。
1.2新たに安楽死させたマウスから鼻を取得
- 個々のマウスを清浄ケージに移し、最後の息後に頚椎脱臼5分間続いたCO 2ガスに曝露した。鼻ティッシュで血を軽減するために、胸を開いて、血が排水できるようにするために心をカットするはさみのペアを使用しています。
- 25%ショ糖と、ポスト固定と凍結保護を除いて、1.1.5のステップ1.1.2を繰り返します。標本は加湿保管し、タイロードの生理食塩水を含む(単位:mm)で維持されるべきである:140ナClで、5のKCl、1のMgCl 2、1のCaCl 2、10のNaピルビン酸、10 D-グルコース、および10 N-2-ヒドロキシエチルピペラジン-N'-2-エタンスルホン酸緩衝液(HEPES、pHを7.4に調整)。あるいは、キムワイプの部分を折る解剖しながらタイロード溶液及び標本の下に場所でそれを浸し、時折タイロード液に検体を浸したり、細胞や組織の生存を維持するために、それが加湿保つために組織の上、いくつかの解決策をドロップ。
2。切歯、前歯鋤骨と上顎骨の取り外し
- 腹側の観点から開始します。鋤骨の骨を見つけて、骨の腹側大部分を破壊する歯を骨鉗子やピンセットを用いて、その長さに沿って鋤骨骨を壊す。
- 鋸歯状の鉗子を使用して、そっと離れて鋤鼻器官(VNO)から骨片を撚ることで鋤骨骨の壊れたセグメントを削除。古いヶ月未満のマウスのために注意してください、またはMOEは、これらの2つのステレオに興味を持っている場合のみピコはスキップすることができる。
- 鉗子でしっかりと頭をホールド。前歯二門歯と鋤骨の骨との間の前歯上顎の接合部位の両方の前部を破るために骨鉗子を使用してください。
- まで背頬骨プレートのレベルに頬骨弓にだけ前方の領域に右上顎の腹部分を破る。
- 背側の視点のために鼻の裏返し。背頬骨プレートの右上顎の前歯を破るために骨鉗子を使用してください。頬骨プレート全体の右上顎の前歯が緩んでなければなりません。そっと上顎の基礎となる任意の鼻の組織を分離するために細かい鉗子を使用してから、静かに骨片を持ち上げ。
- 左の門歯と左前上顎を緩め、鼻骨が削除された後にそれらを削除するには、手順2.4と2.5を繰り返します。
3。鼻骨と頬骨弓背板の取り外し
- 再鋸歯鉗子または骨鉗子を使用してください鼻の骨に単に尾前頭骨の残りの部分を移動します。骨のこの部分を削除した後、鼻の骨の尾の部分はピンセットを用いて把持することができる。
- 頬骨プレートに接続されている頬骨弓の前方部分を壊すために骨鉗子を使用してください。
- 頬骨プレートの背終わりの側縁に細かい鉗子を取ると、そっと骨を反転し、それを削除してください。骨が緩んでいない場合には、除去のためにそれを緩めるために軽くクランプする骨鉗子を使用しています。
- 左右の鼻の骨の間内側縫合糸を緩め微鉗子やカミソリの刃を使用してください。
- 右の鼻の骨の尾の端を把持する鋸歯状の鉗子を使用してください。そっとティッシュを根底からそれを分離するために左右に骨を移動します。それは側に骨の側を移動するための鼻の骨の尾三に沿って鉗子を移動するのに便利です。鼻の骨が分離したように、ゆっくりと尾側端から骨を持ち上げる。
- 一方、T彼鼻骨を少し持ち上げて、細い気道上皮組織で裏打ちされた骨の横outcroppingを明らかにするために横方向に骨を傾ける。そっと鼻の骨からこの組織を解放するために細かい鉗子を使用してください。鼻骨を持ち上げるために続けています。骨が完全に下にある組織から分離されている場合は、吻側端で鼻骨を切断するはさみを使用しています。
- 左の鼻の骨の除去のための手順3.1、3.5および3.6を繰り返します。
- ステップ鼻の左側に3.2と3.3を繰り返します。
4。横頬骨弓プレートの取り外し
- 同時に頬骨プレート片側を外します。どちら頬骨板が最初に削除することができます。
- ブレークは頬骨弓に達するまで腹観点から、頬骨弓に劣る上顎を破る。
- 背側の観点から、優しく頬骨弓をつかむと、前方と横持ち上げる。頬骨プレートはまだ任意の組織に接続されている場合、罰金を取る鉗子と優しく組織と骨の間の接続を断つ。
- 鼻の反対側の頬骨プレートについて、この手順を繰り返します。
5。軌道の骨の取り外し
- 腹側の観点から、鼻の臼歯間palantine骨を壊す。
- 鼻の両側に3大臼歯と上顎を壊すために骨鉗子を使用してください。
- 鼻の両側に甲に腹と後骨の残りの厚い部分を破壊し、削除します。
6。篩骨の取り外し
- 甲に尾突出篩骨のいずれかの部分を破る。これは、甲を覆う篩骨の薄い部分を除去する際に介組織の損失を回避する必要がある。
- 鼻の右側には、篩骨の前縁に細かい鉗子を置き、静かにそれを削除します。骨の部分が残っている場合は、すべてになるまでこの手順を繰り返し甲を覆っている薄い骨は削除されました。甲の骨が準備のほとんどで削除する必要はありません。老齢マウスでは、篩板が脆くなる。鼻腔組織の凍結切片が必要な場合は、骨に起因する潜在的な被害を減らすために細かい鉗子でプレートの小片を取り除く。
- 鼻の左側のためにステップ6.2)を繰り返します。
- 前の切片に残った骨片を取り外します。注意:動物でよりセプタム骨の歳、posterodorsal領域よりもやや厚いと難しいです。一つは、細かい鉗子を使用して、この部分を削除することができます。セプタム骨とライニング上皮組織の背の部分を分離するために骨の両側に鉗子の先端を挿入します。骨をつかむと、標本を保持するために鉗子の一組を使用します。中隔の下部軟骨部分から上部の骨の部分を壊し、ゆっくりそれを削除するには鉗子の別のペアを使用してください。
7。凍結切片のための鼻の準備
- アスピレーター真空ポンプを設定します。
- 埋め込み型で鼻を置きます。 10月のメディアで水没鼻を。
- ノーズ組織内に閉じ込められた気泡を除去するために真空を使用します。このプロセスは、5分を要します。
- 気泡を除去した後、所望の向きで組織を設定する。
- 10月とドライアイスを使用して金型内の組織を凍結。埋め込まれた組織は、その後直ちに凍結切片又は-80℃で将来使用するために保存することができる。
結果
この方法を使用して、我々は確実にほぼ完全に無傷の鼻腔組織を得ることができます。 図2Aは、パラホルムアルデヒド固定頭部から成人鼻標本の画像を示している。この標本では、MOE、隔臓器、Gruneberg神経節、およびVNOを含むすべての4つのサブ嗅覚感覚器官は、無傷である。また、気道上皮や腺などや船舶などの上皮下組織は、保持されます。我々は、我々が正常形態、分?...
ディスカッション
ここでは、下記の組織を温存しながら順次周囲の骨を除去することにより、マウスの鼻から無傷の嗅覚および呼吸組織を分離するためのステップごとの手順を示した。我々は慎重に、骨の除去は、その全体をも、最も繊細な組織を維持することができることを示している。我々はまた、我々は神経接続を維持するために一緒に両方の脳と鼻の組織を分離しているこの技術の可能な修正、洞察?...
開示事項
著者は、彼らが競合する経済的利益を持っていないことを宣言します。
謝辞
この作品はWeihong林への研究助成金(NIH / NIDCD 009269、012831及びARRA行政サプリメントNIHの助成)によってサポートされていました。我々は、特にビデオテープに録画して処理するの彼の技術支援のためにUMBCで氏ティムフォードに感謝します。また、ビデオ撮影での機器の援助のためにオリンパスアメリカ社から博士ダフネブラムバーグ、UMBCで氏シェアーペティ氏とニコラス·マッカラムに感謝したい。
資料
| Name | Company | Catalog Number | Comments |
| Dissection | |||
| Rongeur, 1.0 mm Jaw width | World Precision Instruments (WPI) | 501333 | |
| Fine forceps, Dumont 3 | WPI | 503235 | |
| Fine forceps, Dumont 55 | WPI | 14099 | |
| Fine forceps, Dumont AA | Fine Science Tools (FST) | 11210-20 | |
| Specimen forceps, Serrated | VWR | 82027-440 | |
| Operating scissors | WPI | 501753 | |
| Iris scissors, Straight | Miltex | V95-304 | |
| Dissection microscope | Olympus | SZ40 | |
| [header] | |||
| Tissue embedding | |||
| Optimum cutting temperature (OCT) compound | Sakura Finetek | 4583 | |
| Plastic embedding mold | VWR | 15160-215 | |
| Aspirator vacuum pump | Fisher Scientific | 09-960-2 | |
| [header] | |||
| Section staining | |||
| Neutral red | ACROS Organic | CAS 553-24-2 | Nuclei staining |
参考文献
- Naclerio, R. M., Pinto, J., Assanasen, P., Baroody, F. M. Observations on the ability of the nose to warm and humidify inspired air. Rhinology. 45, 102-111 (2007).
- Bjermer, L. The nose as an air conditioner for the lower airways. Allergy. 54, 26-30 (1999).
- Firestein, S. How the olfactory system makes sense of scents. Nature. 413, 211-218 (2001).
- Bryant, B., Silver, W. L. . Chemisthesis: The common chemical sense. , (2000).
- Gross, E. A., Swenberg, J. A., Fields, S., Popp, J. A. Comparative morphometry of the nasal cavity in rats and mice. J. Anat. 135, 83-88 (1982).
- Halpern, M. The organization and function of the vomeronasal system. Annu. Rev. Neurosci. 10, 325-362 (1987).
- Rodolfo-Masera, T. Su l'esquoestizenza di un particulare organo olfacttivo nel setto nasale della cavia e di altri roditori. Arch. Ital. Anat. Embryol. 48, 157-212 (1943).
- Levai, O., Strotmann, J. Projection pattern of nerve fibers from the septal organ: DiI-tracing studies with transgenic OMP mice. Histochemistry and Cell biology. 120, 483-492 (2003).
- Storan, M. J., Key, B. Septal organ of Gruneberg is part of the olfactory system. J. Comp. Neurol. 494, 834-844 (2006).
- Restrepo, D., Arellano, J., Oliva, A. M., Schaefer, M. L., Lin, W. Emerging views on the distinct but related roles of the main and accessory olfactory systems in responsiveness to chemosensory signals in mice. Horm. Behav. 46, 247-256 (2004).
- Breer, H., Fleischer, J., Strotmann, J. The sense of smell: multiple olfactory subsystems. Cell Mol. Life Sci. 63, 1465-1475 (2006).
- Munger, S. D., Leinders-Zufall, T., Zufall, F. Subsystem organization of the mammalian sense of smell. Annu. Rev. Physiol. 71, 115-140 (2009).
- Finger, T. E., St Jeor, V. L., Kinnamon, J. C., Silver, W. L. Ultrastructure of substance P- and CGRP-immunoreactive nerve fibers in the nasal epithelium of rodents. J. Comp. Neurol. 294, 293-305 (1990).
- Papka, R. E., Matulionis, D. H. Association of substance-P-immunoreactive nerves with the murine olfactory mucosa. Cell Tissue Res. 230, 517-525 (1983).
- Baraniuk, J. N., Kim, D. Nasonasal reflexes, the nasal cycle, and sneeze. Curr. Allergy Asthma Rep. 7, 105-111 (2007).
- Lin, W., Ogura, T., Margolskee, R. F., Finger, T. E., Restrepo, D. TRPM5-expressing solitary chemosensory cells respond to odorous irritants. J. Neurophysiol. 99, 1451-1460 (2008).
- Ogura, T., et al. Cholinergic microvillous cells in the mouse main olfactory epithelium and effect of acetylcholine on olfactory sensory neurons and supporting cells. J. Neurophysiol. 106, 1274-1287 (2011).
- Finger, T. E., et al. Solitary chemoreceptor cells in the nasal cavity serve as sentinels of respiration. Proceedings of the National Academy of Sciences of the United States of America. 100, 8981-8986 (2003).
- Gulbransen, B. D., Clapp, T. R., Finger, T. E., Kinnamon, S. C. Nasal solitary chemoreceptor cell responses to bitter and trigeminal stimulants in vitro. J. Neurophysiol. 99, 2929-2937 (2008).
- Zhao, K., Dalton, P., Yang, G. C., Scherer, P. W. Numerical modeling of turbulent and laminar airflow and odorant transport during sniffing in the human and rat nose. Chemical Senses. 31, 107-118 (2006).
- Ressler, K. J., Sullivan, S. L., Buck, L. B. A zonal organization of odorant receptor gene expression in the olfactory epithelium. Cell. 73, 597-609 (1993).
- Vassar, R., Ngai, J., Axel, R. Spatial segregation of odorant receptor expression in the mammalian olfactory epithelium. Cell. 74, 309-318 (1993).
- Fulle, H. J., et al. A receptor guanylyl cyclase expressed specifically in olfactory sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 92, 3571-3575 (1995).
- Juilfs, D. M., et al. A subset of olfactory neurons that selectively express cGMP-stimulated phosphodiesterase (PDE2) and guanylyl cyclase-D define a unique olfactory signal transduction pathway. Proceedings of the National Academy of Sciences of the United States of America. 94, 3388-3395 (1997).
- Lin, W., Arellano, J., Slotnick, B., Restrepo, D. Odors detected by mice deficient in cyclic nucleotide-gated channel subunit A2 stimulate the main olfactory system. The Journal of Neuroscience: The Official journal of the Society for Neuroscience. 24, 3703-3710 (2004).
- Ishii, T., Omura, M., Mombaerts, P. Protocols for two- and three-color fluorescent RNA in situ hybridization of the main and accessory olfactory epithelia in mouse. J. Neurocyt. 33, 657-669 (2004).
- Lee, A. C., Tian, H., Grosmaitre, X., Ma, M. Expression patterns of odorant receptors and response properties of olfactory sensory neurons in aged mice. Chemical Senses. 34, 695-703 (2009).
- Packard, A., Schnittke, N., Romano, R. A., Sinha, S., Schwob, J. E. DeltaNp63 regulates stem cell dynamics in the mammalian olfactory epithelium. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 31, 8748-8759 (2011).
- Matthews, J. B., Mason, G. I. Influence of decalcifying agents on immunoreactivity of formalin-fixed, paraffin-embedded tissue. Histochem J. 16, 771-787 (1984).
- Athanasou, N. A., Quinn, J., Heryet, A., Woods, C. G., McGee, J. O. Effect of decalcification agents on immunoreactivity of cellular antigens. J. Clin. Pathol. 40, 874-878 (1987).
- Hegg, C. C., Irwin, M., Lucero, M. T. Calcium store-mediated signaling in sustentacular cells of the mouse olfactory epithelium. Glia. 57, 634-644 (2009).
- Spehr, M., et al. Essential role of the main olfactory system in social recognition of major histocompatibility complex peptide ligands. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 26, 1961-1970 (2006).
- Ma, M., Chen, W. R., Shepherd, G. M. Electrophysiological characterization of rat and mouse olfactory receptor neurons from an intact epithelial preparation. J. Neurosci. Methods. 92, 31-40 (1999).
- Cygnar, K. D., Stephan, A. B., Zhao, H. Analyzing responses of mouse olfactory sensory neurons using the air-phase electroolfactogram recording. J. Vis. Exp. (37), e1850 (2010).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J. Vis. Exp. (65), e3564 (2012).
- Lin, W., Margolskee, R., Donnert, G., Hell, S. W., Restrepo, D. Olfactory neurons expressing transient receptor potential channel M5 (TRPM5) are involved in sensing semiochemicals. Proceedings of the National Academy of Sciences of the United States of America. 104, 2471-2476 (2007).
- Lin, W., Ezekwe, E. A., Zhao, Z., Liman, E. R., Restrepo, D. TRPM5-expressing microvillous cells in the main olfactory epithelium. BMC Neurosci. 9, 114 (2008).
- Ogura, T., Krosnowski, K., Zhang, L., Bekkerman, M., Lin, W. Chemoreception regulates chemical access to mouse vomeronasal organ: role of solitary chemosensory cells. PLoS One. 5, e11924 (2010).
- Sathyanesan, A., Feijoo, A. A., Mehta, S. T., Nimarko, A. F., Lin, W. Expression profile of G-protein βγ subunit gene transcripts in the mouse olfactory sensory epithelia. Frontiers in Cellular Neuroscience. 7, 84 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved