Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un désossage méthode manuelle en vigueur pour préparer Intact souris tissu nasal avec l'organisation anatomique préservée
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Résumé
Le nez des mammifères est un organe multifonctionnel avec des structures internes complexes. La cavité nasale est bordée de divers épithéliums comme l'épithélium olfactif, respiratoires et squameuses qui se distinguent nettement dans des endroits anatomiques, la morphologie et les fonctions. Chez la souris adulte, le nez est couvert de différents os du crâne, ce qui limite l'accès expérimental aux structures internes, en particulier ceux dans le postérieur comme l'épithélium olfactif principal (MOE). Nous décrivons ici une méthode efficace pour obtenir la quasi-totalité et intact tissus nasaux avec l'organisation anatomique préservée. L'utilisation d'outils chirurgicaux sous un microscope à dissection, nous enlevons successivement les os du crâne autour du tissu nasal. Cette procédure peut être effectuée sur les deux, têtes de souris peau paraformaldéhyde fixes et fraîchement disséqué. La procédure de désossage complet prend environ 20-30 min, ce qui est nettement plus courte que la durée de l'essai requis pour conventionnel à base chimique decalcification. En outre, nous présentons une méthode facile pour éliminer les bulles d'air piégées entre cornets, ce qui est critique pour obtenir des coupes horizontales ou coronale ou sagittale minces intactes de la préparation de tissu nasal. Tissu nasal préparés en utilisant notre méthode peut être utilisée pour toute observation de montage de l'ensemble de l'épithélium, ainsi que morphologique, immunocytochimique, l'ARN par hybridation in situ et des études physiologiques, en particulier dans les études où spécifique à la région examen et la comparaison d'intérêt.
Introduction
La cavité nasale mammifères contient différents types de tissus et d'organes qui remplissent des fonctions distinctes. La cavité nasale constitue la partie d'entrée de l'appareil respiratoire supérieur, ce qui permet des déplacements de l'air dans et hors des poumons. L'air inhalé passe à travers la cavité nasale où il subit une température et une humidité conditionnement 1, ainsi que de nettoyage ou de filtration pour éliminer les substances et les micro-organismes infectieux 2 irritantes et toxiques. Les deux traitements sont effectués par l'épithélium nasal et les tissus sous-épithéliaux, y compris les glandes et les vaisseaux et sont essentiels pour protéger les voies respiratoires inférieures et des poumons. En plus de son rôle dans la respiration et de la défense épithélial, le tissu nasal contient également des appareils sensoriels périphériques des systèmes olfactifs et trijumeau, qui détectent un large éventail de substances chimiques dans l'air qui passe. Selon le système est activé, la détection sensorielle de produits chimiques dans le nez peut provoquer soitun sens de l'odorat, de l'irritation ou de la douleur 3,4.
Le système olfactif périphérique est complexe et composée de plusieurs organes sensoriels olfactifs anatomiquement séparés dans la cavité nasale. Parmi eux, l'épithélium olfactif principal (MOE) est le plus grand, ce qui représente environ 45-52% de l'épithélium nasal chez les rongeurs 5 et est situé dans la région postérieure. Dans la région antéroventrale, il ya une paire de structures tubulaires connues sous le nom organe voméronasal 6, qui siègent le long de chaque côté de la cloison nasale. Deux petits groupes supplémentaires de neurones sensoriels olfactifs, connu comme l'organe septal de Masera 7,8 et le ganglion Gruneberg 9, résident le long de la cloison ventrale et la zone d'entrée dorsale de la cavité nasale, respectivement. Ces organes périphériques contiennent neuro-épithélium avec des caractéristiques distinctives de la morphologie, de l'expression des marqueurs des cellules et la fonction physiologique. Ensemble, ils détectent des milliers d'odeursmolécules avec une exquise sensibilité 10-12.
En plus des organes sensoriels olfactifs, la cavité nasale abrite également d'autres systèmes sensoriels. Il est connu que les fibres de nerf trijumeau peptidergiques sont présents dans l'épithélium nasal, en particulier l'épithélium respiratoire 13,14. Certaines de ces fibres détection des produits chimiques irritants et toxiques et sont responsables d'initier réflexes protecteurs tels que la toux et les éternuements 4,15. Composés odorants et amer irritants peuvent également être détectés par une population récemment découvert des cellules chimiosensoriels solitaires (SCC), dont beaucoup sont innervés par des fibres de nerf trijumeau 16-19. Ces CSC sont situés à une densité plus élevée dans la région d'entrée de la cavité nasale et des voies d'entrée voméronasal, laissant entendre qu'ils pourraient également avoir une fonction protectrice 16-18. Ainsi, l'épithélium nasal peut varier considérablement en fonction, la morphologie et la composition de la cellule en fonction de leuremplacements anatomiques.
Même au sein d'une seule et spécialisée épithélium, il existe des différences régionales. Le ministère de l'Environnement en est un exemple. Les lignes MEO différents de cornets, qui sont complexes et structures recourbé. Grâce à eux, les différentes régions de l'expérience différents débits d'air Moe, et donc différente de diffusion et de taux d'élimination des molécules odorantes air 20. En outre, on sait que les neurones sensoriels olfactifs (ARS) exprimant un récepteur d'odeur donnée sont situés dans l'une des quatre zones contournées de la MOE 21,22. Comment cette différence de situation affecte la réponse de l'OSN à odorants est largement inconnue. En outre, certaines populations présentent OSN préférence régionale. ARS Guanylyl cyclase-D (GC-D) exprimant des répartitions zonales favorisant les régions cul-de-sac de l'ectoturbinates 23,24. Plus récemment, nous avons constaté une sous-population des ARS canoniques qui exprime transitoire récepteur potentiel canal M5 (trpM5) et est de préférence situé dans les régions latérales et ventrale 25. Ces résultats indiquent que le MEO n'est pas uniforme. Cependant, comment ces différences régionales affectent codage olfactif n'est pas compris. C'est en partie à cause physiologique enquête approfondie de la MOE et le nez a été limitée par la difficulté d'obtenir intact nasal épithélium avec l'organisation anatomique conservés par des méthodes actuelles.
L'épithélium nasal sont principalement entouré par les os du crâne antérieures, y compris le nasal, maxillaire, palatin, zygomatique, et les os ethmoïde. Chez les souris adultes et d'autres modèles de rongeurs, ces os sont durs et difficiles à enlever sans endommager le tissu nasal étroitement associé, notamment les cornets délicates. Souvent, détartrage à base chimique est utilisé pour adoucir les os pour permettre cryosectioning des tissus nasaux pour morphologique, immunohistochimique, et dans les études d'hybridation in situ, mais dépendanceding sur l'âge de l'animal, le processus de décalcification peut durer une nuit jusqu'à 7 jours 24,26-28. Ce traitement est également limitée car elle nécessite tissu soit fixateur préservé. En outre, la décalcification chimique peut être dur et affecter l'immuno-marquage de certains anticorps sensibles à 29,30. Pour les études physiologiques, les tissus vivants est nécessaire, et donc, ces expériences sont souvent effectués sur ARS isolés ou en tranches ME obtenues à partir de nouveau-nés dont les os crâne sont minces et souples 17,31,32. Des études physiologiques peuvent également utiliser des préparations de montage entières en divisant la tête 25,33,34, mais en général seulement la surface interne du nez est facilement accessible, ce qui limite les enregistrements physiologiques sur d'autres domaines.
Ici, nous décrivons une méthode de désossage efficace, manuel pour préparer les tissus nasaux intactes avec l'organisation anatomique d'origine préservé et la morphologie. Nous enlevons successivement les principaux os de la partie antérieurecrâne sous un microscope de dissection pour exposer un épithélium nasal presque entièrement intact tout en gardant les os minces cornets intact à moins que les souris sont très vieux et cryosectioning est nécessaire. On étend également la méthode pour préserver la connexion entre les tissus des voies nasales et des bulbes olfactifs, ainsi que le reste du cerveau, ce qui facilite l'examen simultané des deux circuits périphériques et centraux. Notre méthode peut être utilisée pour préparer paraformaldéhyde-fixe, ainsi que les frais, tissu nasal direct. Ainsi, on s'attend à notre méthode pour faciliter les études morphologiques, immuno et physiologique de la respiration, olfaction, et nasale dommages et la maladie.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Souris Nez Préparation
Nous avons utilisé des souris C57BL / 6 de fond adultes dans cette étude. Tous les soins et les procédures animaux sont approuvés par le soin des animaux et les Comités d'utilisation (IACUC) de l'Université du Maryland, Baltimore County.
1.1 L'acquisition du nez de souris paraformaldahyde-fixes
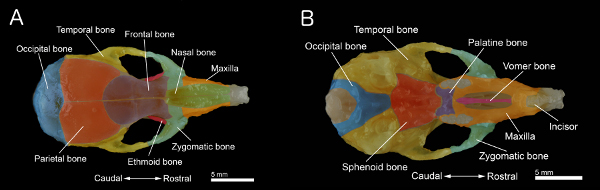
Figure 1. Os d'un crâne de souris. A: vue dorsale du crâne B: vue ventrale. Du crâne avec la mandibule retiré. Le crâne a été préparé à partir d'une vieille souris de 40 jours. Os individuels sont colorés pour une meilleure visualisation. Cliquez ici pour agrandir la figure .
- Perfuser transcardiaque de fixer souris individuelles suite èmee protocole de Lin, et al., (2008) 16. Brièvement, les souris ont été profondément anesthésiés avec tribromoéthanol (Avertin 250 pg / g de poids corporel), perfusé transcardiaque avec tampon phosphate 0,1 M (PB, 30-50 ml), suivi par un tampon phosphate fixateur contenant du paraformaldéhyde 3%, 19 mM de L-lysine monohydrochloride, et 0,23% de sodium m-periodate (environ 35-50 ml). On peut également suivre les étapes dans l'article JoVE pour perfusion animale 35.
- Utilisez une paire de ciseaux pour couper la mandibule (ou la mâchoire inférieure) et enlever la peau sur la tête.
- Séparer la totalité de la tête du reste du corps.
- Retirez le palais. Aussi, nettoyer et enlever le tissu conjonctif et les muscles restant sur la surface du crâne pour obtenir l'échantillon représenté dans les figures 1A et 1B.
- Sous un microscope de dissection, retirer l'os du crâne recouvrant le cerveau et le bulbe olfactif. Coupez le tissu et d'os en excès. Nonte, pour la préparation de tissu étendue dans laquelle le cerveau et les nez restent connectés, seuls les os du crâne sont enlevés. Pour les expériences d'immunohistochimie, le tissu a été post-fixé pendant 1,5 heure et transféré à 0,1 M tampon phosphate salin (PBS) avec 25% de saccharose pendant la nuit. Tissu nasal doit être maintenue tout au long de la dissection humidifié en le plongeant dans la solution de saccharose tamponné à plusieurs reprises.
1.2 L'acquisition du nez de souris fraîchement euthanasiés
- Souris individuelles ont été transférés dans une cage propre et exposés à des gaz CO 2, qui a été suivie par dislocation cervicale 5 min après le dernier souffle. Pour réduire le sang dans les tissus du nez, utiliser une paire de ciseaux pour ouvrir le coffre et coupez le cœur pour permettre au sang de s'écouler.
- Répéter les étapes 1.1.2 à 1.1.5, à l'exception de la post-fixation et cryoprotection avec 25% de saccharose. Le spécimen devrait être maintenu humidifié et maintenue avec une solution saline contenant de Tyrode (en mm): 140 NaCl, KCl 5, MgCl2 1, CaCl2 1, 10 pyruvate de Na, le 10 D-glucose, et de 10 N-2-hydroxyéthylpipérazine-N'-2-éthanesulfonique acide tampon (HEPES, ajusté à pH 7,4). Sinon, pliez un morceau de Kimwipes, tremper avec la solution, et le lieu de Tyrode sous le spécimen tout disséquer et parfois plonger l'échantillon dans une solution de Tyrode ou déposez une solution sur le tissu pour le maintenir humidifiée pour maintenir la viabilité des cellules et des tissus .
2. Incisive, antérieure Vomer et renvoi os maxillaire
- Partir d'un point de vue ventrale. Localisez le vomer et de briser l'os vomer sur toute sa longueur à l'aide d'une gouge ou une pince à dents pour briser la majeure partie ventrale de l'os.
- En utilisant des pinces dentelées, retirez les segments brisés de l'os vomer par sillonnent doucement les fragments d'os loin de l'organe voméronasal (VNO). Remarque, pour les souris moins d'un mois, ou si seulement intéressés par la MOE, ces deux steps peut être ignorée.
- Tenez fermement la tête avec une pince. Utilisez le rongeur de briser la partie avant des deux incisives et de la région d'articulation du maxillaire antérieur entre les deux incisives et le vomer.
- Casser la partie ventrale de la droite maxillaire à la région juste en avant de l'arcade zygomatique jusqu'au niveau de la plaque dorsale zygomatique.
- Retournez sur le nez d'un point de vue dorsale. Utilisez le rongeur de briser le maxillaire droit antérieur de la plaque dorsale zygomatique. L'ensemble du maxillaire droit antérieur de la plaque zygomatique doit être lâche. Utilisez les pinces fines pour séparer doucement tout tissu nasal qui sous-tend le maxillaire supérieur, puis soulevez doucement le fragment d'os.
- Répétez les étapes 2.4 et 2.5 pour desserrer l'incisive gauche et maxillaire antérieur gauche et les supprimer après l'os nasal a été supprimé.
3. Os nasal et retrait de la plaque dorsale zygomatique
- Utilisez la pince ou dentelée, le rongeur à nouveaupasser le reste de l'os frontal juste caudal des os du nez. Après avoir enlevé ce morceau d'os, la partie caudale de l'os nasal peut être saisie avec une pince.
- Utilisation de la pince-gouge pour rompre la portion antérieure de l'arcade zygomatique, qui est reliée à la plaque zygomatique.
- Prenez les pince fine au bord latéral de l'extrémité postérieure de la plaque zygomatique et retournez délicatement l'os et le retirer. Si l'os n'est pas lâche, utilisez le rongeur pour serrer doucement pour le desserrer pour l'enlèvement.
- Utilisez les pince fine ou d'une lame de rasoir pour desserrer la suture médiane entre les os du nez droit et gauche.
- Utilisez la pince crantée pour saisir l'extrémité caudale de l'os nasal droit. Déplacez doucement l'os d'un côté à l'autre de la séparer de tissus sous-jacents. Il est utile pour déplacer la pince le long du troisième caudale de l'os nasal destiné à déplacer le côté de l'os à l'autre. Comme l'os nasal sépare, soulever lentement l'os à partir de l'extrémité caudale.
- Alors til os nasal est légèrement levé, inclinez l'os latéralement pour révéler un affleurement latérales de l'os qui est bordée mince tissu épithélial respiratoire. Utilisez une pince fine pour libérer doucement ce tissu de l'os nasal. Continuer à soulever l'os nasal. Lorsque l'os est complètement séparé du tissu sous-jacent, utiliser des ciseaux pour couper l'os nasal à la fin rostral.
- Répétez les étapes 3.1, 3.5 et 3.6 pour le retrait de l'os nasal gauche.
- Répétez les étapes 3.2 et 3.3 pour le côté gauche du nez.
4. Retrait de la plaque latérale zygomatique
- Retirer la plaque zygomatique d'un côté à la fois. Soit plaque zygomatique peut être retiré en premier.
- D'un point de vue ventrale, briser la mâchoire inférieure à l'arcade zygomatique jusqu'au break atteint l'arcade zygomatique.
- D'un point de vue dorsale, prenez doucement l'arcade zygomatique et soulever l'avant et latérale. Si la plaque zygomatique est encore attaché à n'importe quel tissu, prendre l'amendepinces et couper délicatement les connexions entre le tissu et l'os.
- Répéter la plaque zygomatique de l'autre côté du nez.
5. Retrait des os de l'orbite
- D'un point de vue ventrale, briser l'os palantine entre les molaires du nez.
- Utilisation de la pince-gouge pour briser les trois molaires du maxillaire supérieur et de chaque côté du nez.
- Casser et enlever les gros morceaux restants de la moelle ventrale et postérieure aux cornets de chaque côté du nez.
6. Enlèvement d'os ethmoïde
- Casser une partie de l'os ethmoïde saillie caudale pour les cornets. Cela est nécessaire pour éviter la perte de tissu cornet lors de la suppression de minces morceaux de l'os ethmoïde couvrant les cornets.
- Pour le côté droit du nez, de placer les pince fine sur le bord antérieur de l'os ethmoïde et retirez-le délicatement. Si une partie de l'os reste, répétez cette procédure jusqu'à ce que tousl'os mince recouvrant les cornets a été éliminée. Les cornets n'ont pas besoin d'être enlevé dans la plupart des préparations. Chez les souris âgées, la lame criblée devient cassant. Si cryosectioning du tissu nasal est nécessaire, retirer des petits morceaux de la plaque avec des pinces fines pour réduire les dommages potentiels causés par l'os.
- Répéter l'étape 6.2) pour le côté gauche du nez.
- Retirez tous les fragments d'os restants avant la coupe. Note: les animaux de plus de un ans, la région postérodorsale de l'os de la cloison est un peu épais et dur. On peut supprimer cette partie à l'aide de pinces fines. Insérer la pointe de la pince dans les deux côtés de l'os pour séparer la partie dorsale de la cloison os et le tissu épithélial de revêtement. Utilisez une paire de pinces pour attraper l'os et maintenez le spécimen. Utilisez une autre paire de pinces pour briser la partie supérieure osseuse de la partie cartilagineuse inférieure du septum et retirez-le délicatement.
7. Nez Préparation pour cryosectioning
- Mettre en place la pompe à vide de la trompe.
- Placer le nez dans un moule d'enrobage. Plonger le nez dans les médias octobre
- Utilisez un aspirateur pour éliminer les bulles d'air emprisonnées dans les tissus du nez. Ce processus peut prendre jusqu'à 5 min.
- Après avoir enlevé les bulles d'air, régler le tissu dans l'orientation désirée.
- Geler les PTOM et les tissus dans le moule avec de la glace sèche. Le tissu peut ensuite être intégré cryosectioned immédiatement ou stocké à -80 ° C pour une utilisation future.
Access restricted. Please log in or start a trial to view this content.
Résultats
En utilisant cette méthode, nous pouvons obtenir de manière fiable tissu nasal presque entièrement intact. Figure 2A montre une image du spécimen nasal adulte à partir d'une tête paraformaldéhyde fixe. Dans ce modèle, tous les organes sensoriels olfactifs sous-quatre, y compris le ministère de l'Environnement, organe septal, le ganglion Gruneberg et VNO, sont intacts. En outre, l'épithélium respiratoire et des tissus sous-épithéliaux, tels que les glandes et les vaisseaux, sont ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Ici, nous avons démontré une procédure étape par étape pour isoler le tissu olfactif et respiratoire intact du nez de la souris en enlevant successivement les os environnants tout en épargnant les tissus ci-dessous. Nous montrons que la suppression de l'os attentif peut conserver même les tissus les plus délicats dans leur intégralité. Nous partageons également un aperçu des modifications possibles de cette technique, dans lequel on isole à la fois le cerveau et les tissus du nez ensemble pour préserve...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont aucun intérêt financier concurrents.
Remerciements
Ce travail a été financé par des subventions de recherche (NIH / NIDCD 009269, 012831 et ARRA administratives supplément subventions des NIH) à Weihong Lin. Nous remercions tout particulièrement M. Tim Ford à UMBC pour son assistance technique dans l'enregistrement vidéo et le traitement. Nous tenons également à remercier le Dr Daphne Blumberg, Mme Chere Petty à UMBC et M. Nicholas McCollum d'Olympus America Inc. pour leur soutien matériel à l'enregistrement vidéo.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Dissection | |||
| Rongeur, 1.0 mm Jaw width | World Precision Instruments (WPI) | 501333 | |
| Fine forceps, Dumont 3 | WPI | 503235 | |
| Fine forceps, Dumont 55 | WPI | 14099 | |
| Fine forceps, Dumont AA | Fine Science Tools (FST) | 11210-20 | |
| Specimen forceps, Serrated | VWR | 82027-440 | |
| Operating scissors | WPI | 501753 | |
| Iris scissors, Straight | Miltex | V95-304 | |
| Dissection microscope | Olympus | SZ40 | |
| [header] | |||
| Tissue embedding | |||
| Optimum cutting temperature (OCT) compound | Sakura Finetek | 4583 | |
| Plastic embedding mold | VWR | 15160-215 | |
| Aspirator vacuum pump | Fisher Scientific | 09-960-2 | |
| [header] | |||
| Section staining | |||
| Neutral red | ACROS Organic | CAS 553-24-2 | Nuclei staining |
Références
- Naclerio, R. M., Pinto, J., Assanasen, P., Baroody, F. M. Observations on the ability of the nose to warm and humidify inspired air. Rhinology. 45, 102-111 (2007).
- Bjermer, L. The nose as an air conditioner for the lower airways. Allergy. 54, Suppl 57. 26-30 (1999).
- Firestein, S. How the olfactory system makes sense of scents. Nature. 413, 211-218 (2001).
- Bryant, B., Silver, W. L. Chemisthesis: The common chemical sense. , 2nd, Wiley-Liss. (2000).
- Gross, E. A., Swenberg, J. A., Fields, S., Popp, J. A. Comparative morphometry of the nasal cavity in rats and mice. J. Anat. 135, 83-88 (1982).
- Halpern, M. The organization and function of the vomeronasal system. Annu. Rev. Neurosci. 10, 325-362 (1987).
- Rodolfo-Masera, T. Su l'esquoestizenza di un particulare organo olfacttivo nel setto nasale della cavia e di altri roditori. Arch. Ital. Anat. Embryol. 48, 157-212 (1943).
- Levai, O., Strotmann, J. Projection pattern of nerve fibers from the septal organ: DiI-tracing studies with transgenic OMP mice. Histochemistry and Cell biology. 120, 483-492 (2003).
- Storan, M. J., Key, B. Septal organ of Gruneberg is part of the olfactory system. J. Comp. Neurol. 494, 834-844 (2006).
- Restrepo, D., Arellano, J., Oliva, A. M., Schaefer, M. L., Lin, W. Emerging views on the distinct but related roles of the main and accessory olfactory systems in responsiveness to chemosensory signals in mice. Horm. Behav. 46, 247-256 (2004).
- Breer, H., Fleischer, J., Strotmann, J. The sense of smell: multiple olfactory subsystems. Cell Mol. Life Sci. 63, 1465-1475 (2006).
- Munger, S. D., Leinders-Zufall, T., Zufall, F. Subsystem organization of the mammalian sense of smell. Annu. Rev. Physiol. 71, 115-140 (2009).
- Finger, T. E., St Jeor, V. L., Kinnamon, J. C., Silver, W. L. Ultrastructure of substance P- and CGRP-immunoreactive nerve fibers in the nasal epithelium of rodents. J. Comp. Neurol. 294, 293-305 (1990).
- Papka, R. E., Matulionis, D. H. Association of substance-P-immunoreactive nerves with the murine olfactory mucosa. Cell Tissue Res. 230, 517-525 (1983).
- Baraniuk, J. N., Kim, D. Nasonasal reflexes, the nasal cycle, and sneeze. Curr. Allergy Asthma Rep. 7, 105-111 (2007).
- Lin, W., Ogura, T., Margolskee, R. F., Finger, T. E., Restrepo, D. TRPM5-expressing solitary chemosensory cells respond to odorous irritants. J. Neurophysiol. 99, 1451-1460 (2008).
- Ogura, T., et al. Cholinergic microvillous cells in the mouse main olfactory epithelium and effect of acetylcholine on olfactory sensory neurons and supporting cells. J. Neurophysiol. 106, 1274-1287 (2011).
- Finger, T. E., et al. Solitary chemoreceptor cells in the nasal cavity serve as sentinels of respiration. Proceedings of the National Academy of Sciences of the United States of America. 100, 8981-8986 (2003).
- Gulbransen, B. D., Clapp, T. R., Finger, T. E., Kinnamon, S. C. Nasal solitary chemoreceptor cell responses to bitter and trigeminal stimulants in vitro. J. Neurophysiol. 99, 2929-2937 (2008).
- Zhao, K., Dalton, P., Yang, G. C., Scherer, P. W. Numerical modeling of turbulent and laminar airflow and odorant transport during sniffing in the human and rat nose. Chemical Senses. 31, 107-118 (2006).
- Ressler, K. J., Sullivan, S. L., Buck, L. B. A zonal organization of odorant receptor gene expression in the olfactory epithelium. Cell. 73, 597-609 (1993).
- Vassar, R., Ngai, J., Axel, R. Spatial segregation of odorant receptor expression in the mammalian olfactory epithelium. Cell. 74, 309-318 (1993).
- Fulle, H. J., et al. A receptor guanylyl cyclase expressed specifically in olfactory sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 92, 3571-3575 (1995).
- Juilfs, D. M., et al. A subset of olfactory neurons that selectively express cGMP-stimulated phosphodiesterase (PDE2) and guanylyl cyclase-D define a unique olfactory signal transduction pathway. Proceedings of the National Academy of Sciences of the United States of America. 94, 3388-3395 (1997).
- Lin, W., Arellano, J., Slotnick, B., Restrepo, D. Odors detected by mice deficient in cyclic nucleotide-gated channel subunit A2 stimulate the main olfactory system. The Journal of Neuroscience: The Official journal of the Society for Neuroscience. 24, 3703-3710 (2004).
- Ishii, T., Omura, M., Mombaerts, P. Protocols for two- and three-color fluorescent RNA in situ hybridization of the main and accessory olfactory epithelia in mouse. J. Neurocyt. 33, 657-669 (2004).
- Lee, A. C., Tian, H., Grosmaitre, X., Ma, M. Expression patterns of odorant receptors and response properties of olfactory sensory neurons in aged mice. Chemical Senses. 34, 695-703 (2009).
- Packard, A., Schnittke, N., Romano, R. A., Sinha, S., Schwob, J. E. DeltaNp63 regulates stem cell dynamics in the mammalian olfactory epithelium. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 31, 8748-8759 (2011).
- Matthews, J. B., Mason, G. I. Influence of decalcifying agents on immunoreactivity of formalin-fixed, paraffin-embedded tissue. Histochem J. 16, 771-787 (1984).
- Athanasou, N. A., Quinn, J., Heryet, A., Woods, C. G., McGee, J. O. Effect of decalcification agents on immunoreactivity of cellular antigens. J. Clin. Pathol. 40, 874-878 (1987).
- Hegg, C. C., Irwin, M., Lucero, M. T. Calcium store-mediated signaling in sustentacular cells of the mouse olfactory epithelium. Glia. 57, 634-644 (2009).
- Spehr, M., et al. Essential role of the main olfactory system in social recognition of major histocompatibility complex peptide ligands. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 26, 1961-1970 (2006).
- Ma, M., Chen, W. R., Shepherd, G. M. Electrophysiological characterization of rat and mouse olfactory receptor neurons from an intact epithelial preparation. J. Neurosci. Methods. 92, 31-40 (1999).
- Cygnar, K. D., Stephan, A. B., Zhao, H. Analyzing responses of mouse olfactory sensory neurons using the air-phase electroolfactogram recording. J. Vis. Exp. (37), e1850(2010).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J. Vis. Exp. (65), e3564(2012).
- Lin, W., Margolskee, R., Donnert, G., Hell, S. W., Restrepo, D. Olfactory neurons expressing transient receptor potential channel M5 (TRPM5) are involved in sensing semiochemicals. Proceedings of the National Academy of Sciences of the United States of America. 104, 2471-2476 (2007).
- Lin, W., Ezekwe, E. A., Zhao, Z., Liman, E. R., Restrepo, D. TRPM5-expressing microvillous cells in the main olfactory epithelium. BMC Neurosci. 9, 114(2008).
- Ogura, T., Krosnowski, K., Zhang, L., Bekkerman, M., Lin, W. Chemoreception regulates chemical access to mouse vomeronasal organ: role of solitary chemosensory cells. PLoS One. 5, e11924(2010).
- Sathyanesan, A., Feijoo, A. A., Mehta, S. T., Nimarko, A. F., Lin, W. Expression profile of G-protein βγ subunit gene transcripts in the mouse olfactory sensory epithelia. Frontiers in Cellular Neuroscience. 7, 84(2013).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon