È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un efficace manuale disosso metodo per preparare intatto il mouse tessuto nasale con organizzazione anatomica Conservato
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Abstract
Il naso dei mammiferi è un organo multi-funzionale con le strutture interne complesse. La cavità nasale è rivestita con vari epiteli, come epiteli olfattivi, respiratori, e squamose che differiscono notevolmente in sedi anatomiche, morfologia e funzioni. In topi adulti, il naso è coperto con varie ossa del cranio, limitando l'accesso sperimentale alle strutture interne, in particolare quelli del posteriore, come il principale epitelio olfattivo (MOE). Qui si descrive un metodo efficace per ottenere quasi tutto intatto e tessuti nasali con organizzazione anatomica conservata. L'utilizzo di strumenti chirurgici sotto un microscopio da dissezione, abbiamo sequenziale rimuoviamo le ossa del cranio che circondano il tessuto nasale. Questa procedura può essere eseguita su entrambe le teste del mouse, dalla pelle paraformaldeide-fissi e appena sezionato. L'intera procedura disossamento richiede circa 20-30 min, che è significativamente più breve del tempo richiesto per sperimentale convenzionale a base chimica decalcificazione. Inoltre, vi presentiamo un metodo semplice per rimuovere le bolle d'aria intrappolate tra i turbinati, che è fondamentale per l'ottenimento di sezioni orizzontali o coronale o sagittale sottili intatte dalla preparazione dei tessuti nasali. Tessuto nasale preparati usando il nostro metodo può essere utilizzato per tutta osservazione monte dell'intero epiteli, nonché morfologica, immunocitochimica, RNA ibridazione in situ, e studi fisiologici, specialmente negli studi in cui regione specifica esame e confronto sono di interesse.
Introduzione
La cavità nasale mammiferi contiene vari tipi di tessuti ed organi che servono funzioni distinte. La cavità nasale costituisce la porzione di imbocco del tratto respiratorio superiore, che permette di viaggiare aria dentro e fuori i polmoni. Aria inalata passa attraverso la cavità nasale dove subisce temperatura e umidità condizionata 1 così come la pulizia o filtrazione per rimuovere sostanze irritanti e tossiche e microrganismi infettivi 2. Entrambi i trattamenti sono effettuati da nasale epiteli e tessuti subepiteliali, tra cui le ghiandole e vasi e sono fondamentali per la protezione delle vie respiratorie inferiori e dei polmoni. Oltre al suo ruolo nella respirazione e difesa epiteliale, il tessuto nasale contiene anche apparati sensoriali periferici dei sistemi olfattivi e trigemino, che rilevano una vasta gamma di sostanze chimiche in aria che passa. A seconda del sistema è attivato, il rilevamento sensoriale di sostanze chimiche nel naso può suscitare siaun senso di odore, irritazione o dolore 3,4.
Il sistema olfattivo periferico è complesso e costituito da diversi organi sensoriali olfattivi anatomicamente separate all'interno della cavità nasale. Tra questi, il principale epitelio olfattivo (MOE) è la più grande, che costituisce circa il 45-52% degli epiteli nasali nei roditori 5 e si trova nella regione posteriore. Nella regione anteroventrale, vi è una coppia di strutture tubolari noti come vomeronasal organo 6, che siedono lungo ogni lato del setto nasale. Altri due piccoli gruppi di neuroni sensoriali olfattivi, noto come l'organo del setto di Masera 7,8 e il ganglio Gruneberg 9, risiedono lungo il setto ventrale e la regione dorsale ingresso della cavità nasale, rispettivamente. Questi organi periferici contengono neuro-epiteli con caratteristiche di spicco nella morfologia, espressione marcatore della cella, e la funzione fisiologica. Insieme, essi rilevano migliaia di odorimolecole con squisita sensibilità 10-12.
Oltre agli organi sensoriali olfattivi, la cavità nasale ospita anche altri sistemi sensoriali. E 'noto che le fibre del nervo trigemino peptidergico sono presenti nell'epitelio nasale, specialmente l'epitelio respiratorio 13,14. Alcune di queste fibre di rilevare sostanze chimiche irritanti e tossici e sono responsabili per l'avvio di riflessi protettivi come tosse e starnuti 4,15. Composti odorosi e amaro irritanti possono essere rilevati anche da una popolazione di cellule recentemente scoperto chemosensoriali solitarie (SCC), molti dei quali sono innervate da fibre nervose del trigemino 16-19. Questi SCC si trovano a maggiore densità nella zona ingresso della cavità nasale e delle vie d'ingresso vomeronasali, suggerendo che esse possono servire anche una funzione protettiva 16-18. Così, epiteli nasali possono differire sostanzialmente in funzione, morfologia e composizione delle cellule a seconda della lorosedi anatomiche.
Anche all'interno di un unico e specializzato epitelio, ci sono differenze regionali. Il MOE è un esempio. Le linee MOE vari turbinati, che sono complicate e arricciati strutture. Grazie a loro, diverse regioni delle esperienze diverse portate d'aria MOE e, quindi, diversa diffusione e di clearance delle molecole di odore nell'aria 20. Inoltre, è noto che i neuroni sensoriali olfattivi (OSN) esprimenti un dato recettore odore sono situati in una delle quattro aggirato zone del MOE 21,22. Come questa differenza di posizione influenza la risposta di un OSN per odoranti non è ampiamente noto. Inoltre, alcune popolazioni OSN mostrano preferenza regionale. OSN guanylyl ciclasi-D (GC-D)-esprimenti hanno distribuzioni zonali favorendo le regioni cul-de-sac delle ectoturbinates 23,24. Più di recente, abbiamo trovato una sottopopolazione di OSN canoniche che esprime transitoria recettore potenziale canale M5 (trPM5) ed è preferenzialmente situati nelle regioni laterali e ventrali 25. Questi risultati indicano che MOE non è uniforme. Tuttavia, come queste differenze regionali influenzano codifica olfattivi non è compreso. Questo è in parte perché accurata indagine fisiologica del MOE e il naso è stato limitato dalla difficoltà di ottenere intatta nasale epiteli con organizzazione anatomica conservata con i metodi attuali.
La nasale epiteli sono prevalentemente circondato dalle ossa anteriori del cranio, compreso il naso, mascella, palatino, zigomatico, e le ossa etmoidali. In topi adulti e altri modelli di roditori, queste ossa sono dure e difficili da rimuovere senza danneggiare il tessuto nasale strettamente associata, in particolare dei turbinati delicati. Spesso, decalcificazione chimici a base viene usato per ammorbidire le ossa per consentire criosezionamento dei tessuti nasali per morfologica, immunoistochimica, e in studi di ibridazione in situ, tuttavia, dipending l'età dell'animale, il processo di decalcificazione può durare durante la notte fino a 7 giorni 24,26-28. Questo trattamento è limitata anche perché richiede tessuto fissativo essere conservato. Inoltre, decalcificazione chimica può essere dura e influenzare la immunomarcatura di alcuni anticorpi sensibili 29,30. Per gli studi fisiologici, è richiesta tessuto vivo, e, quindi, questi esperimenti sono spesso condotti su OSN isolate o fette MOE ottenuti da neonati le cui ossa del cranio sono sottili e morbidi 17,31,32. Studi fisiologici possono anche utilizzare i preparati montare tutto, dividendo la testa 25,33,34, ma di solito solo la superficie mediale del naso è facilmente accessibile, limitando le registrazioni fisiologiche su altre aree.
Qui, descriviamo un efficace metodo di disossamento manuale per preparare i tessuti nasali intatte con conservato organizzazione anatomica e morfologia. Noi sequenziale rimuoviamo le principali ossa del anterioreè necessaria cranio sotto un microscopio dissezione per esporre un epitelio nasale quasi totalmente intatto, mantenendo le sottili ossa turbinati intatto a meno che i topi sono molto vecchi e criosezionamento. Abbiamo anche estendere il metodo per conservare la connessione tra i tessuti nasali e bulbi olfattivi, così come il resto del cervello, facilitando così esame simultaneo di entrambi i circuiti periferici e centrali. Il nostro metodo può essere utilizzato per preparare paraformaldeide-fisso, nonché fresco, tessuto nasale vivo. Così, il nostro metodo è previsto per facilitare gli studi morfologici, immunoistochimici e fisiologici della respirazione, l'olfatto, e nasale danni e malattia.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Topo Preparazione Naso
Abbiamo usato adulto C57BL / 6 topi sfondo in questo studio. Tutte le cure e le procedure di animali sono approvati dalla cura degli animali e utilizzare i comitati (IACUC) della University of Maryland, Baltimore County.
1.1 Acquisire il naso da topi paraformaldahyde-fissi
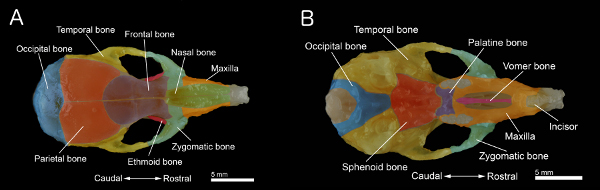
Figura 1. Le ossa di un cranio del mouse A:. Vista dorsale del cranio B:. Vista ventrale del cranio con la mandibola rimosso. Il cranio è stato preparato da un 40 giorni vecchio topo. Singole ossa sono colorati per una migliore visualizzazione. Clicca qui per ingrandire la figura .
- Profumato transcardially di fissare singoli topi a seguito di the protocollo di Lin, et al., (2008) 16. In breve, i topi sono stati anestetizzati profondamente con tribromoethanol (Avertin 250 mcg / g di peso corporeo), perfusi con transcardiaca 0.1M tampone fosfato (PB, 30-50 ml), seguito da un fosfato tamponata fissativo contenente 3% paraformaldeide, 19 mM di L-lisina monocloridrato, e 0,23% di sodio m-periodato (circa 35-50 ml). Si può anche seguire la procedura descritta in questo articolo JoVE per la perfusione degli animali 35.
- Utilizzare un paio di forbici per tagliare mandibola (o mascella inferiore) e rimuovere la pelle sulla testa.
- Separare l'intera testa dal resto del corpo.
- Rimuovere il palato. Inoltre pulire e rimuovere il tessuto connettivo e muscolare rimanente sulla superficie del cranio per ottenere il campione mostrato nelle figure 1A e 1B.
- Sotto un microscopio dissezione, togliere l'osso del cranio che copre il cervello e bulbi olfattivi. Tagliare il tessuto in eccesso e ossa. Note, per la preparazione dei tessuti prolungato in cui il cervello e il naso rimangono collegati, solo le ossa del cranio vengono rimossi. Per gli esperimenti di immunoistochimica, il tessuto era post-fissato per 1,5 ore e trasferito 0.1M tampone fosfato (PBS) con il 25% di saccarosio durante la notte. Nasale tessuto deve essere mantenuta per tutta la dissezione umidificato mediante immersione nella soluzione di saccarosio tamponata più volte.
1.2 Acquisire il naso da topi appena eutanasia
- Singoli topi sono stati trasferiti in una gabbia pulita ed esposti a gas CO 2, a cui è seguito dislocazione cervicale 5 minuti dopo l'ultimo respiro. Per ridurre il sangue nel tessuto naso, usare un paio di forbici per aprire la cassa e tagliare il cuore per permettere al sangue di defluire.
- Ripetere i passaggi da 1.1.2 a 1.1.5, tranne il post-fissazione e crioprotezione con il 25% di saccarosio. Il campione deve essere conservato e mantenuto umidificato con soluzione salina contenente Tyrode (in mm): 140 NaCl, 5 KCl, 1 MgCl2, 1 CaCl 2, 10 Na piruvato, 10 D-glucosio, 10 e N-2-Hydroxyethylpiperazine-N'-2-etano tampone acido (HEPES, regolato a pH 7,4). In alternativa, piegare un pezzo di Kimwipes, immergerlo con la soluzione di Tyrode, e posto sotto il provino durante la dissezione e, occasionalmente, immergere il campione in soluzione del Tyrode o far cadere qualche soluzione sul tessuto per tenerlo umidificata per mantenere la vitalità delle cellule e dei tessuti .
2. Incisivo, anteriore Vomer e Mascella rimozione ossea
- Inizia da un punto di vista ventrale. Individuare l'osso vomere e rompere l'osso vomere lungo la sua lunghezza con un rongeur o pinze con i denti per rompere il ventrale maggior parte dell'osso.
- Utilizzando seghettate pinze, rimuovere i segmenti spezzati dell'osso vomere per l'esercizio di un'attività delicatamente i frammenti ossei dal organo vomeronasale (VNO). Si noti, per i topi di meno di un mese, o anche solo interessati al MOE, questi due steps può essere saltato.
- Tenere la testa saldamente con una pinza. Utilizzare il rongeur per rompere la porzione anteriore di entrambe incisivi e la regione snodato di mascella anteriore tra i due incisivi e l'osso vomere.
- Rompere la parte ventrale del mascellare superiore destra alla regione appena anteriormente al zigomatica fino al livello della piastra dorsale zigomatico.
- Capovolgere il naso per un punto di vista dorsale. Utilizzare il rongeur per rompere il diritto mascellare anteriore della piastra zigomatico dorsale. Tutta la destra mascella anteriore del piatto zigomatico dovrebbe essere sciolto. Utilizzare i pinza sottile per separare delicatamente qualsiasi tessuto nasale alla base della mascella, quindi sollevare delicatamente via il frammento osseo.
- Ripetere i passi 2.4 e 2.5 per allentare l'incisivo sinistro e sinistro mascellare anteriore e togliere loro dopo l'osso nasale è stato rimosso.
3. Osso nasale e Dorsale rimozione Piastra zigomatico
- Usate il forcipe o dentata il rongeur di rispostare il resto delle ossa frontali appena caudalmente ossa nasali. Dopo la rimozione di questo pezzo di osso, la parte caudale dell'osso nasale può essere afferrato con pinze.
- Utilizzare il rongeur per rompere la porzione anteriore dell'arco zigomatico, che è collegato alla piastra zigomatico.
- Prendete le pinza sottile sul bordo laterale della fine dorsale della piastra zigomatico e capovolgere delicatamente l'osso e rimuoverlo. Se l'osso non è allentata, utilizzare il rongeur per premere delicatamente per allentare la rimozione.
- Utilizzare le pinze sottili o una lama di rasoio per allentare la sutura mediale tra destra e sinistra ossa nasali.
- Utilizzare il seghettato pinze per afferrare l'estremità caudale dell'osso nasale destra. Spostare delicatamente l'osso da un lato all'altro per separarlo dalla base del tessuto. È utile per spostare la pinza lungo il terzo caudale dell'osso nasale per spostare il lato dell'osso a lato. Come separa l'osso nasale, sollevare lentamente l'osso dall'estremità caudale.
- Mentre tegli osso nasale è leggermente sollevato, inclinare l'osso lateralmente per rivelare un affioramento laterali del midollo che è rivestito con sottile tessuto epiteliale respiratorio. Utilizzare una pinza sottile per rilasciare delicatamente il tessuto dall'osso nasale. Continuare a sollevare l'osso nasale. Quando l'osso è completamente separato dal tessuto sottostante, usare le forbici per tagliare l'osso nasale, alla fine rostrale.
- Ripetere i punti 3.1, 3.5 e 3.6 per la rimozione di osso nasale sinistra.
- Ripetere i punti 3.2 e 3.3 per il lato sinistro del naso.
4. Laterale rimozione Piastra zigomatico
- Rimuovere la piastra zigomatico un lato alla volta. O piastra zigomatico può essere rimosso per primo.
- Da un punto di vista ventrale, rompere la mascella inferiore al zigomatica fino pausa raggiunge il zigomatica.
- Da un punto di vista dorsale, afferrare delicatamente il zigomatica e sollevare in avanti e laterale. Se la piastra zigomatico è ancora attaccato a qualsiasi tessuto, prendere la multaforcipe e recidere delicatamente le connessioni tra il tessuto e l'osso.
- Ripetere per la piastra zigomatico sull'altro lato del naso.
5. Orbit rimozione ossea
- Da un punto di vista ventrale, rompere l'osso Palatina tra i molari del naso.
- Utilizzare il rongeur per rompere i 3 ei molari del mascellare su ciascun lato del naso.
- Rompere e rimuovere eventuali pezzi rimanenti spessore di osso ventrale e posteriore alle turbinati su ciascun lato del naso.
6. Etmoide rimozione ossea
- Rompere qualsiasi parte dell'osso etmoide sporgente caudale ai turbinati. Ciò è necessario per evitare la perdita di tessuto turbinate nel rimuovere pezzi sottili di osso etmoide coprono turbinati.
- Per il lato destro del naso, posizionare i pinza sottile sul bordo anteriore dell'osso etmoide e rimuoverla delicatamente. Se una porzione dell'osso rimane, ripetere questa procedura finché tuttil'osso sottile che copre i turbinati è stato rimosso. Le ossa turbinati non devono essere rimossi nella maggior parte delle preparazioni. In topi anziani, la lamina cribrosa diventa fragile. Se è necessaria criosezionamento del tessuto nasale, rimuovere piccoli pezzi della piastra con una pinza sottile per ridurre il potenziale danno causato dalla osso.
- Ripetere il punto 6.2) per il lato sinistro del naso.
- Rimuovere eventuali frammenti di ossa rimanenti prima del sezionamento. Nota: in animali più di un anni, la regione posterodorsal dell'osso setto è alquanto denso e duro. Si può rimuovere questa parte con una pinza sottile. Inserire la punta della pinza in entrambi lato dell'osso per separare la porzione dorsale del setto osseo e il tessuto di rivestimento epiteliale. Utilizzare un paio di pinze per afferrare l'osso e tenere il campione. Utilizzare un altro paio di pinze per rompere la parte ossea superiore della porzione cartilaginea inferiore del setto e rimuoverla delicatamente.
7. Preparazione del naso per criosezionamento
- Impostare la pompa del vuoto aspiratore.
- Mettere il naso in uno stampo embedding. Immergere il naso in OCT media.
- Utilizzare un aspirapolvere per rimuovere le bolle d'aria intrappolate all'interno del tessuto naso. Questo processo può richiedere fino a 5 min.
- Dopo la rimozione di bolle d'aria, il tessuto impostare l'orientamento desiderato.
- Congelare l'ottobre e il tessuto nello stampo usando ghiaccio secco. Il tessuto incorporato può quindi essere cryosectioned immediatamente o conservato a -80 ° C per un uso futuro.
Access restricted. Please log in or start a trial to view this content.
Risultati
Usando questo metodo, si può attendibilmente ottenere tessuto nasale quasi completamente intatte. Figura 2A mostra un'immagine esemplare adulto nasale da una testa paraformaldeide-fissa. In questo esemplare, tutti e quattro gli organi sensoriali sub-olfattive, tra cui il MOE, organo del setto, il ganglio Gruneberg e VNO, sono intatte. Inoltre, gli epiteli delle vie respiratorie e dei tessuti subepiteliali, come le ghiandole e vasi, sono conservati. Abbiamo utilizzato con successo questo metodo in u...
Access restricted. Please log in or start a trial to view this content.
Discussione
Qui, abbiamo dimostrato una procedura passo-passo per isolare il tessuto olfattivo e respiratorio intatta dal naso mouse sequenzialmente rimuovendo le ossa circostanti, risparmiando il tessuto sottostante. Abbiamo dimostrato che un'attenta rimozione ossea può conservare anche i tessuti più delicati nella loro interezza. Condividiamo anche spaccato eventuali modifiche di questa tecnica, in cui isolare sia il cervello e il tessuto naso insieme per preservare il collegamento nervo. Questo nuovo metodo fornisce un mez...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari in competizione.
Riconoscimenti
Questo lavoro è stato sostenuto da borse di ricerca (NIH / NIDCD 009.269, 012.831 e ARRA amministrative supplemento sovvenzioni NIH) a Weihong Lin. Noi in particolare ringraziamo il signor Tim Ford a UMBC per la sua assistenza tecnica in videoregistrazione e l'elaborazione. Desideriamo inoltre ringraziare il Dott. Daphne Blumberg, la signora Chere Petty a UMBC e il signor Nicola McCollum da Olympus America Inc. per la loro assistenza materiale in videoregistrazione.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Dissection | |||
| Rongeur, 1.0 mm Jaw width | World Precision Instruments (WPI) | 501333 | |
| Fine forceps, Dumont 3 | WPI | 503235 | |
| Fine forceps, Dumont 55 | WPI | 14099 | |
| Fine forceps, Dumont AA | Fine Science Tools (FST) | 11210-20 | |
| Specimen forceps, Serrated | VWR | 82027-440 | |
| Operating scissors | WPI | 501753 | |
| Iris scissors, Straight | Miltex | V95-304 | |
| Dissection microscope | Olympus | SZ40 | |
| [header] | |||
| Tissue embedding | |||
| Optimum cutting temperature (OCT) compound | Sakura Finetek | 4583 | |
| Plastic embedding mold | VWR | 15160-215 | |
| Aspirator vacuum pump | Fisher Scientific | 09-960-2 | |
| [header] | |||
| Section staining | |||
| Neutral red | ACROS Organic | CAS 553-24-2 | Nuclei staining |
Riferimenti
- Naclerio, R. M., Pinto, J., Assanasen, P., Baroody, F. M. Observations on the ability of the nose to warm and humidify inspired air. Rhinology. 45, 102-111 (2007).
- Bjermer, L. The nose as an air conditioner for the lower airways. Allergy. 54, Suppl 57. 26-30 (1999).
- Firestein, S. How the olfactory system makes sense of scents. Nature. 413, 211-218 (2001).
- Bryant, B., Silver, W. L. Chemisthesis: The common chemical sense. , 2nd, Wiley-Liss. (2000).
- Gross, E. A., Swenberg, J. A., Fields, S., Popp, J. A. Comparative morphometry of the nasal cavity in rats and mice. J. Anat. 135, 83-88 (1982).
- Halpern, M. The organization and function of the vomeronasal system. Annu. Rev. Neurosci. 10, 325-362 (1987).
- Rodolfo-Masera, T. Su l'esquoestizenza di un particulare organo olfacttivo nel setto nasale della cavia e di altri roditori. Arch. Ital. Anat. Embryol. 48, 157-212 (1943).
- Levai, O., Strotmann, J. Projection pattern of nerve fibers from the septal organ: DiI-tracing studies with transgenic OMP mice. Histochemistry and Cell biology. 120, 483-492 (2003).
- Storan, M. J., Key, B. Septal organ of Gruneberg is part of the olfactory system. J. Comp. Neurol. 494, 834-844 (2006).
- Restrepo, D., Arellano, J., Oliva, A. M., Schaefer, M. L., Lin, W. Emerging views on the distinct but related roles of the main and accessory olfactory systems in responsiveness to chemosensory signals in mice. Horm. Behav. 46, 247-256 (2004).
- Breer, H., Fleischer, J., Strotmann, J. The sense of smell: multiple olfactory subsystems. Cell Mol. Life Sci. 63, 1465-1475 (2006).
- Munger, S. D., Leinders-Zufall, T., Zufall, F. Subsystem organization of the mammalian sense of smell. Annu. Rev. Physiol. 71, 115-140 (2009).
- Finger, T. E., St Jeor, V. L., Kinnamon, J. C., Silver, W. L. Ultrastructure of substance P- and CGRP-immunoreactive nerve fibers in the nasal epithelium of rodents. J. Comp. Neurol. 294, 293-305 (1990).
- Papka, R. E., Matulionis, D. H. Association of substance-P-immunoreactive nerves with the murine olfactory mucosa. Cell Tissue Res. 230, 517-525 (1983).
- Baraniuk, J. N., Kim, D. Nasonasal reflexes, the nasal cycle, and sneeze. Curr. Allergy Asthma Rep. 7, 105-111 (2007).
- Lin, W., Ogura, T., Margolskee, R. F., Finger, T. E., Restrepo, D. TRPM5-expressing solitary chemosensory cells respond to odorous irritants. J. Neurophysiol. 99, 1451-1460 (2008).
- Ogura, T., et al. Cholinergic microvillous cells in the mouse main olfactory epithelium and effect of acetylcholine on olfactory sensory neurons and supporting cells. J. Neurophysiol. 106, 1274-1287 (2011).
- Finger, T. E., et al. Solitary chemoreceptor cells in the nasal cavity serve as sentinels of respiration. Proceedings of the National Academy of Sciences of the United States of America. 100, 8981-8986 (2003).
- Gulbransen, B. D., Clapp, T. R., Finger, T. E., Kinnamon, S. C. Nasal solitary chemoreceptor cell responses to bitter and trigeminal stimulants in vitro. J. Neurophysiol. 99, 2929-2937 (2008).
- Zhao, K., Dalton, P., Yang, G. C., Scherer, P. W. Numerical modeling of turbulent and laminar airflow and odorant transport during sniffing in the human and rat nose. Chemical Senses. 31, 107-118 (2006).
- Ressler, K. J., Sullivan, S. L., Buck, L. B. A zonal organization of odorant receptor gene expression in the olfactory epithelium. Cell. 73, 597-609 (1993).
- Vassar, R., Ngai, J., Axel, R. Spatial segregation of odorant receptor expression in the mammalian olfactory epithelium. Cell. 74, 309-318 (1993).
- Fulle, H. J., et al. A receptor guanylyl cyclase expressed specifically in olfactory sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 92, 3571-3575 (1995).
- Juilfs, D. M., et al. A subset of olfactory neurons that selectively express cGMP-stimulated phosphodiesterase (PDE2) and guanylyl cyclase-D define a unique olfactory signal transduction pathway. Proceedings of the National Academy of Sciences of the United States of America. 94, 3388-3395 (1997).
- Lin, W., Arellano, J., Slotnick, B., Restrepo, D. Odors detected by mice deficient in cyclic nucleotide-gated channel subunit A2 stimulate the main olfactory system. The Journal of Neuroscience: The Official journal of the Society for Neuroscience. 24, 3703-3710 (2004).
- Ishii, T., Omura, M., Mombaerts, P. Protocols for two- and three-color fluorescent RNA in situ hybridization of the main and accessory olfactory epithelia in mouse. J. Neurocyt. 33, 657-669 (2004).
- Lee, A. C., Tian, H., Grosmaitre, X., Ma, M. Expression patterns of odorant receptors and response properties of olfactory sensory neurons in aged mice. Chemical Senses. 34, 695-703 (2009).
- Packard, A., Schnittke, N., Romano, R. A., Sinha, S., Schwob, J. E. DeltaNp63 regulates stem cell dynamics in the mammalian olfactory epithelium. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 31, 8748-8759 (2011).
- Matthews, J. B., Mason, G. I. Influence of decalcifying agents on immunoreactivity of formalin-fixed, paraffin-embedded tissue. Histochem J. 16, 771-787 (1984).
- Athanasou, N. A., Quinn, J., Heryet, A., Woods, C. G., McGee, J. O. Effect of decalcification agents on immunoreactivity of cellular antigens. J. Clin. Pathol. 40, 874-878 (1987).
- Hegg, C. C., Irwin, M., Lucero, M. T. Calcium store-mediated signaling in sustentacular cells of the mouse olfactory epithelium. Glia. 57, 634-644 (2009).
- Spehr, M., et al. Essential role of the main olfactory system in social recognition of major histocompatibility complex peptide ligands. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 26, 1961-1970 (2006).
- Ma, M., Chen, W. R., Shepherd, G. M. Electrophysiological characterization of rat and mouse olfactory receptor neurons from an intact epithelial preparation. J. Neurosci. Methods. 92, 31-40 (1999).
- Cygnar, K. D., Stephan, A. B., Zhao, H. Analyzing responses of mouse olfactory sensory neurons using the air-phase electroolfactogram recording. J. Vis. Exp. (37), e1850(2010).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J. Vis. Exp. (65), e3564(2012).
- Lin, W., Margolskee, R., Donnert, G., Hell, S. W., Restrepo, D. Olfactory neurons expressing transient receptor potential channel M5 (TRPM5) are involved in sensing semiochemicals. Proceedings of the National Academy of Sciences of the United States of America. 104, 2471-2476 (2007).
- Lin, W., Ezekwe, E. A., Zhao, Z., Liman, E. R., Restrepo, D. TRPM5-expressing microvillous cells in the main olfactory epithelium. BMC Neurosci. 9, 114(2008).
- Ogura, T., Krosnowski, K., Zhang, L., Bekkerman, M., Lin, W. Chemoreception regulates chemical access to mouse vomeronasal organ: role of solitary chemosensory cells. PLoS One. 5, e11924(2010).
- Sathyanesan, A., Feijoo, A. A., Mehta, S. T., Nimarko, A. F., Lin, W. Expression profile of G-protein βγ subunit gene transcripts in the mouse olfactory sensory epithelia. Frontiers in Cellular Neuroscience. 7, 84(2013).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon