Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine effektive Methode, um Manuelle Zerlege Intact Maus Nasengewebe mit erhaltener Anatomische Organisation vorbereiten
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Zusammenfassung
Das Säugetier Nase ist ein multifunktionales Organ mit komplizierten inneren Strukturen. Die Nasenhöhle ist mit verschiedenen Epithelien wie Geruchs-, Atmungs-und Plattenepithel die sich deutlich in anatomischen Stellen, Morphologie und Funktionen ausgekleidet. Bei erwachsenen Mäusen wird die Nase mit verschiedenen Schädelknochen bedeckt, die Begrenzung experimentellen Zugang zu den internen Strukturen, vor allem diejenigen in der hinteren wie die wichtigsten olfaktorischen Epithel (MOE). Hier beschreiben wir eine effektive Methode zur Gewinnung fast die gesamte und intakte Nasalgewebe mit erhaltenen anatomischen Organisation. Mit chirurgische Instrumente unter einem Binokular, wir nacheinander entfernen Sie die Schädelknochen rund um die Nasen-Gewebe. Dieser Vorgang kann auf beiden Paraformaldehyd-fixierten und frisch seziert, gehäutet Maus Köpfe durchgeführt werden. Der gesamte Vorgang dauert Zerlegung etwa 20-30 min, die deutlich kürzer als die experimentelle Zeit für herkömmliche chemische-basierten de erforderlich istVerkalkung. Darüber hinaus präsentieren wir Ihnen eine einfache Methode, um Luftblasen zwischen Nasenmuscheln, die kritisch für den Erhalt intakter dünnen horizontalen oder koronalen oder Sagittalschnitten vom Nasengewebe Vorbereitung ist gefangen zu entfernen. Nasal Gewebe unter Verwendung unserer Methode kann für whole mount Beobachtung des gesamten Epithelien sowie morphologische, immunozytochemische, RNA in situ Hybridisierung und physiologische Studien verwendet werden, insbesondere in Studien, in denen regional spezifische Prüfung und Vergleich von Interesse sind.
Einleitung
Der Säuger Nasenhöhle umfasst verschiedene Arten von Geweben und Organen, die unterschiedliche Funktionen erfüllen. Die Nasenhöhle bildet den Eintrag des oberen Atemwege, der Luftfahrt kann in die und aus der Lunge. Inhalierten Luft durch die Nasenhöhle, wo es einer Temperatur-und Luftfeuchtigkeits-1 sowie die Reinigung oder Filterung reizende und toxische Stoffe und infektiöse Mikroorganismen 2 zu entfernen. Beide Behandlungen werden von nasalen Epithelien und subepithelialen Gewebe, einschließlich Drüsen und Gefäßen durchgeführt und sind entscheidend für den Schutz der unteren Atemwege und die Lunge. Zusätzlich zu seiner Rolle in der Atmung und epithelialen Abwehr, die nasale Gewebe enthält auch periphere sensorische Geräte der Geruchs-und Trigeminus-Systeme, die eine breite Palette von chemischen Substanzen zu erkennen in der durchströmenden Luft. Je nachdem, welches System aktiviert ist, können sensorische Erkennung von Chemikalien in der Nase zu entlocken entwederein Gefühl der Geruch, Reizung oder Schmerzen 3,4.
Die periphere olfaktorische System ist komplex und besteht aus mehreren anatomisch getrennt olfaktorischen Sinnesorgane innerhalb der Nasenhöhle gemacht. Unter ihnen ist die wichtigste olfaktorischen Epithel (MOE) die größte, die bis macht etwa 45-52% der nasalen Epithelien in Nagetieren 5 und wird in der hinteren Region. Im anteroventral Region, gibt es ein Paar von röhrenförmigen Strukturen Vomeronasalorgan 6, die entlang jeder Seite der Nasenscheidewand sitzen bekannt. Zwei weitere kleine Gruppierungen von Riechzellen, als Septalorgan von Masera 7,8 und dem Gruneberg Ganglion 9 bekannt, wohnen zusammen das ventrale Septum und die dorsale Eingangsbereich der Nasenhöhle, beziehungsweise. Diese peripheren Organen enthalten Neuro-Epithelien mit Besonderheiten in der Morphologie, Zell-Marker Expression und physiologische Funktion. Gemeinsam erkennen sie Tausende von GerüchenMoleküle mit exquisiten Empfindlichkeit 10-12.
Zusätzlich zu den olfaktorischen Organe, die Nasenhöhle beherbergt auch andere Sinnesorgane. Es ist bekannt, dass peptiderge Trigeminus Fasern in der Nasenschleimhaut, insbesondere das respiratorische Epithel 13,14 sind. Einige dieser Fasern erkennen reizende und giftige Chemikalien und sind verantwortlich für die Initiierung Schutzreflexe wie Husten und Niesen 4,15. Reizt Geruchs-und Bitterstoffe kann auch durch eine kürzlich entdeckte Population von einsamen chemosensory Zellen (SCC), von denen viele von Trigeminus Fasern 16-19 innerviert werden erkannt werden. Diese SCCs sind in höherer Dichte im Eingangsbereich der Nasenhöhle und vomeronasal Eintrag Leitungen befindet, deutete an, dass sie auch dazu dienen, eine Schutzfunktion 16-18. Somit kann Nasenepithelien wesentlichen unterscheiden sich in Funktion, Morphologie und Zell-Zusammensetzung in Abhängigkeit von ihreranatomischen Stellen.
Selbst innerhalb eines einzelnen und spezialisierten Epithel, gibt es regionale Unterschiede. Die MOE ist ein solches Beispiel. Die MOE-Linien verschiedene Nasenmuscheln, die kompliziert und sind gewellt Strukturen. Wegen ihnen verschiedenen Regionen der MOE Erfahrung unterschiedlichen Luftmengen und somit unterschiedliche Diffusion und Clearance-Raten in der Luft Geruchsmoleküle 20. Es ist auch bekannt, dass Riechneuronen (OSN) Expression eines bestimmten Geruchsstoff-Rezeptor in einer von vier Zonen umgangen der MOE 21,22 befinden. Wie dieser Unterschied wirkt Lage eines OSN Antwort auf Duftstoffe weitgehend nicht bekannt. Darüber hinaus zeigen einige OSN Populationen regionalen Vorlieben. Guanylylcyclase-D (GC-D)-exprimierenden OSNs haben zonale Ausschüttungen zugunsten der Cul-de-sac Regionen der ectoturbinates 23,24. In jüngerer Zeit fanden wir eine Subpopulation von kanonischen OSNs die transient receptor potential Kanal M5 drückt (trpM5) und wird vorzugsweise in der lateralen und ventralen Bereiche 25 befinden. Diese Ergebnisse zeigen, dass MOE ist nicht einheitlich. Allerdings ist, wie diese regionalen Unterschiede olfaktorischen Codierung beeinflussen nicht verstanden. Dies ist zum Teil, weil gründliche physiologische Untersuchung der MOE und die Nase ist durch die Schwierigkeiten bei der Beschaffung intakt Nasenepithelien mit erhaltenen anatomischen Organisation mit aktuellen Methoden beschränkt.
Die Nasenepithelien werden überwiegend von den vorderen Knochen des Schädels, einschließlich der nasalen, Oberkiefer, Palatin, Jochbein und ethmoid Knochen umgeben. Bei erwachsenen Mäusen und anderen Nagetieren Modelle, sind diese Knochen hart und schwierig, ohne eine Beschädigung der in enger Beziehung Nasengewebe, insbesondere die empfindliche Nasenmuscheln entfernen. Oft wird auf chemischer Basis zur Entkalkung Knochen erweichen, damit Kryoschneiden von Nasalgewebe für morphologische, immunhistochemische und in situ Hybridisierung Studien, jedoch Abhängigkeitding auf dem Alter des Tieres, kann die Entkalkung dauern über Nacht bis zu 7 Tage 24,26-28. Diese Behandlung ist auch begrenzt, da es erfordert Gewebes Fixiermittel erhalten. Darüber hinaus können chemische Entkalkung hart sein und Einfluss auf die Immunmarkierung von einigen empfindlichen Antikörper 29,30. Aus physiologischen Studien wird lebendes Gewebe erforderlich, und somit diese Versuche sind oft auf isolierte OSNs oder MOE Scheiben von Neugeborenen, deren Schädelknochen sind dünn und weich 17,31,32 erzielt worden. Physiologische Untersuchungen können auch nutzen whole mount Präparaten durch Spaltung des Kopfes 25,33,34, aber in der Regel nur die mediale Oberfläche der Nase ist leicht zugänglich, die Begrenzung physiologischen Aufnahmen auf anderen Gebieten.
Hier beschreiben wir eine wirksame, manuelle Methode zur Zerlegung intakt Nasalgewebe mit erhaltenen ursprünglichen anatomischen Organisation und Morphologie vorzubereiten. Wir nacheinander entfernen Sie die wichtigsten Knochen des vorderenSchädel unter einer Dissektionsmikroskop eine fast völlig intakt Nasenepithel aussetzen, während die dünnen Nasenmuscheln intakt, es sei denn die Mäuse sehr alt sind und Kryoschneiden benötigt wird. Wir verlängern auch die Methode, um die Verbindung zwischen den nasalen Gewebe und Riechkolben, sowie den Rest des Gehirns zu erhalten und ermöglicht so die gleichzeitige Prüfung von sowohl peripheren und zentralen Schaltungen. Unsere Methode kann verwendet werden, um vorzubereiten Paraformaldehyd-fixierte, sowie frische, Live Nasengewebe werden. So ist unsere Methode zu erwarten morphologische, immunhistochemische und physiologische Untersuchungen der Atmung, Geruchssinn und nasal Schaden und Krankheit zu erleichtern.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Maus Nose Vorbereitung
Wir verwendeten erwachsenen C57BL / 6 Hintergrund Mäuse in dieser Studie. Alle Tierpflege und Verfahren werden durch die Animal Care und Use Committees (IACUC) der University of Maryland, Baltimore Landkreis genehmigt.
1.1 Der Erwerb der Nase aus paraformaldahyde fixierten Mäusen
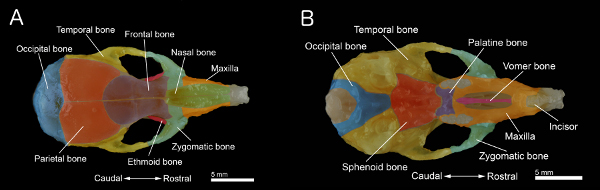
Abbildung 1. Bones Schädel einer Maus A:. Dorsale Ansicht des Schädels B:. Ventralansicht des Schädels mit dem Unterkiefer entfernt. Der Schädel wurde aus einer 40 Tage alten Maus hergestellt. Einzelne Knochen werden zur besseren Visualisierung gefärbt. Klicke hier, um eine größere Abbildung anzuzeigen .
- Perfundieren transkardial einzelnen Mäusen nach th behebene Protokoll von Lin et al., (2008) 16. Kurz gesagt, wurden die Mäuse tief narkotisierten mit Tribromethanol (Avertin 250 ug / g Körpergewicht), transkardial mit 0,1 M Phosphatpuffer (PB, 30-50 ml), gefolgt von einem Phosphat gepufferte Fixiermittel perfundiert mit 3% Paraformaldehyd, 19 mM L-Lysin monohydrochloride und 0,23% Natrium-m-Perjodat (ca. 35-50 ml). Man kann auch die Schritte in der JoVE Artikel für Tier Perfusion 35.
- Verwenden Sie eine Schere abzuschneiden Unterkiefer (oder der Unterkiefer) und entfernen Sie die Haut auf dem Kopf.
- Trennen der gesamte Kopf vom Rest des Körpers.
- Entfernen Sie den Gaumen. Außerdem reinigen und entfernen Sie die restlichen Bindegewebe und Muskulatur auf der Oberfläche des Schädels, um die Probe in den 1A und 1B gezeigt bekommen.
- Unter einem Dissektionsmikroskop, entfernen Sie die Schädelknochen, die das Gehirn und Riechkolben. Schneiden Sie überschüssiges Gewebe und Knochen. Keinete, für den erweiterten Gewebe Vorbereitung, in der das Gehirn und Nase verbunden bleiben, werden nur die Schädelknochen entfernt. Für immunhistochemische Untersuchungen wurde das Gewebe für 1,5 h nach befestigt und in 0,1 M phosphatgepufferter Kochsalzlösung (PBS) mit 25% Saccharose über Nacht. Nasal Gewebe sollte gehalten befeuchtet werden während der Präparation durch Eintauchen in das gepufferte Saccharose-Lösung mehrmals.
1.2 Der Erwerb der Nase frisch eingeschläfert Mäuse
- Einzelne Mäuse wurden auf eine saubere Käfig übertragen und belichtet, um CO 2-Gas, das durch Genickbruch 5 min nach dem letzten Atemzug folgte. Um das Blut in der Nase Gewebe zu reduzieren, verwenden Sie eine Schere, um die Truhe zu öffnen und schneiden das Herz, damit das Blut abfließen kann.
- Wiederholen Sie die Schritte 1.1.2 bis 1.1.5, mit Ausnahme der Post-Fixierung und Kryokonservierung mit 25% Saccharose. Die Probe sollte gehalten befeuchtet und gewartet werden mit Kochsalzlösung mit Tyrode (in mM): 140 NaCl, 5 KCl, 1 MgCl 2, 1 CaCl 2, 10 Na-Pyruvat, 10 D-Glucose und 10 N-2-Hydroxyethyl-N'-2-ethansulfonsäure-Puffer (HEPES, eingestellt auf pH 7.4). Alternativ faltet ein Stück Kimwipes, tränken sie mit Tyrode-Lösung und Ort unter der Probe während Sezieren und gelegentlich tauchen die Probe in der Tyrode-Lösung oder einige Tropfen Lösung auf das Gewebe zu halten befeuchtet, um die Lebensfähigkeit der Zellen und Gewebe zu erhalten .
2. Schneidezahn, Vordere Vomer und Oberkiefer Knochen Removal
- Starten Sie von einer ventralen Sicht. Suchen Sie die vomer Knochen und brechen die Knochen vomer entlang seiner Länge mit einer Zange oder Pinzette mit Zähnen, um die meisten ventralen Teil des Knochens zu brechen.
- Mit gezackten Zange, entfernen Sie die defekte Segmente des vomer Knochen sanft Aufdrängend die Knochenfragmente vom Vomeronasalorgan (VNO). Hinweis für Mäuse weniger als einen Monat alt, oder wenn nur Interesse an der MOE, diese beiden steps übersprungen werden.
- Halten Sie den Kopf fest mit einer Pinzette. Verwenden Sie die Zange, um den vorderen Teil der beiden Schneidezähne und der Region verbunden Frontzahnbereich des Oberkiefers zwischen den beiden Schneidezähnen und dem vomer Knochen brechen.
- Brechen Sie den ventralen Teil des rechten Oberkiefers in dem Bereich knapp vor der Jochbogen bis zur Höhe der Rückenflosse Jochbein Platte.
- Flip über die Nase für eine Rückenflosse Sicht. Verwenden Sie die Zange, um den vorderen rechten Oberkiefer des dorsalen Platte Jochbein zu brechen. Der gesamte vordere rechten Oberkiefer des Jochbein Platte sollte locker sein. Verwenden Sie die feinen Pinzette vorsichtig trennen jede Nasengewebe zugrunde liegenden Oberkiefer, und dann sanft abhebt das Knochenstück.
- Wiederholen Sie die Schritte 2.4 und 2.5 auf der linken Schneidezahn und linken vorderen Oberkiefer Lösen und entfernen Sie sie nach dem Nasenbein entfernt wurde.
3. Nasenbein und Jochbein Dorsal Plattenentnahme
- Verwenden Sie die gezackten Zange oder die Zange wiederBewegen Sie den Rest der Stirnbeine nur kaudal der nasalen Knochen. Nach dem Entfernen dieses Stück Knochen, kann der kaudalen Teil des Nasenbein mit einer Pinzette gegriffen werden.
- Verwenden Sie die Zange, um den vorderen Teil des Jochbogen, die dem Jochbein Platte angeschlossen ist zu brechen.
- Nehmen Sie die feinen Pinzette am seitlichen Rand der dorsalen Ende des Jochbein Platte und vorsichtig drehen die Knochen und entfernen Sie es. Wenn der Knochen nicht locker ist, verwenden Sie die Zange, um es vorsichtig spannen, um es für die Entfernung zu lockern.
- Verwenden Sie die feinen Pinzette oder einer Rasierklinge die mediale Naht zwischen der rechten und linken Nasenbein lockern.
- Verwenden Sie die Zange, um die gezackten kaudalen Ende der rechten Nasenbein greifen. Bewegen Sie die Knochen von einer Seite zur anderen, um sie vom darunter liegenden Gewebe zu trennen. Es ist sinnvoll, die Zange entlang der kaudalen Drittel des Nasenbein bewegen zum Bewegen der Knochen einer Seite zur anderen. Wie das Nasenbein trennt, langsam heben die Knochen aus dem kaudalen Ende.
- Während ter Nasenbein leicht angehoben wird, kippen die Knochen seitlich zu einer seitlichen outcropping des Knochens, die mit dünnen respiratorischen Epithel ausgekleidet ist zu offenbaren. Verwenden feinen Pinzette vorsichtig lösen dieses Gewebe aus dem Nasenbein. Fahren Sie mit dem Nasenbein heben. Wenn der Knochen vollständig vom darunter liegenden Gewebe getrennt, mit einer Schere abgeschnitten Nasenbein am rostralen Ende.
- Die Schritte 3.1, 3.5 und 3.6 für die Entfernung von links Nasenknochens.
- Die Schritte 3.2 und 3.3 für die linke Seite der Nase.
4. Lateral Jochbein Plattenentnahme
- Entfernen Sie das Jochbein Platte einen Seite zu einem Zeitpunkt. Entweder Jochbein Platte zuerst entfernt werden.
- Von einer ventralen Sicht brechen die Oberkiefer schlechter als die Jochbogen bis zum Bruch der Jochbogen erreicht.
- Von einer dorsalen Sicht vorsichtig greifen die Jochbogen und heben Sie Vorderkante und den seitlichen. Wenn das Jochbein Platte ist immer noch zu jedem Gewebe befestigt ist, nehmen Sie die feinenZange und sanft die Verbindungen trennen, zwischen dem Gewebe und dem Knochen.
- Wiederholen Sie für die Jochbein Platte auf der anderen Seite der Nase.
5. Orbit Knochen Removal
- Von einer ventralen Sicht brechen die Knochen palantine zwischen den Backenzähnen der Nase.
- Verwenden Sie die Zange, um die 3 Backenzähne und der Oberkiefer auf jeder Seite der Nase zu brechen.
- Brechen und entfernen Sie alle verbleibenden dicke Stücke von Knochen ventralen und posterioren den Nasenmuscheln auf jeder Seite der Nase.
6. Siebbeins Removal
- Brechen Sie einen beliebigen Teil der Siebbein vorstehende kaudal der Nasenmuscheln. Dies ist notwendig, um den Verlust der Nasenmuschel Gewebe zu vermeiden beim Abnehmen dünne Stücke des Siebbein Abdecken der Nasenmuscheln.
- Für die rechte Seite der Nase, legen Sie die feinen Pinzette an der vorderen Kante des Siebbein und sanft entfernen. Wenn ein Teil des Knochens bleibt, wiederholen Sie den Vorgang, bis alleder dünne Knochen bedeckt die Nasenmuscheln entfernt wurde. Die Nasenmuscheln nicht brauchen, um in den meisten Präparaten entfernt werden. In alten Mäusen, wird der Siebbeinplatte spröde. Wenn Kryoschneiden der nasalen Gewebe benötigt wird, entfernen Sie kleine Stücke von der Platte mit feinen Pinzette, um den möglichen Schaden durch die Knochen zu reduzieren.
- Wiederholen Schritt 6.2) für die linke Seite der Nase.
- Entfernen Sie alle restlichen Knochenfragmente vor dem Schneiden. Hinweis: bei Tieren mehr als ein Jahr alt, der posterodorsal Bereich des Septum Knochen ist etwas dick und hart. Man kann diesen Teil entfernen mit feinen Pinzette. Führen Sie die Spitze der Zange in beiden Seiten des Knochens an die dorsale Abschnitt des Septum Knochen und dem Futter Epithelgewebe trennen. Verwenden Sie eine Pinzette, um den Knochen zu greifen und halten Sie die Probe. Verwenden Sie eine andere Pinzette, um den oberen knöchernen Teil aus dem unteren Teil der knorpeligen Nasenscheidewand brechen und entfernen Sie sie.
7. Nose Vorbereitung Kryoschneiden
- Richten Sie den Sauger Vakuumpumpe.
- Legen Sie die Nase in einer Einbettform. Tauchen Sie die Nase in OCT Medien.
- Verwenden Sie einen Staubsauger, um Luftblasen in der Nase Gewebe gefangen zu entfernen. Dieser Vorgang dauert bis zu 5 min.
- Nach Entfernen von Luftblasen, stellen das Gewebe in der gewünschten Orientierung.
- Frieren Sie das OAT und Gewebe in der Form unter Verwendung von Trockeneis. Das eingebettete Gewebe kann dann sofort kryogeschnitten oder bei -80 ° C für eine spätere Verwendung.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Mit dieser Methode können wir zuverlässig erhalten fast vollständig intakt Nasengewebe. 2A zeigt ein Bild von erwachsenen nasal Probe aus einem Paraformaldehyd-fixierten Kopf. In dieser Probe sind alle vier Sub-olfaktorischen Sinnesorgane, einschließlich der MOE, Septalorgan, die Gruneberg Ganglion und VNO, intakt. Außerdem sind die Atemwege Epithelien und subepithelialen Gewebe, wie Drüsen und Gefäße erhalten. Wir haben erfolgreich diese Methode in einer Reihe von Studien, in denen wir untersuc...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Hier haben wir gezeigt, eine Schritt-für-Schritt-Verfahren zur Isolierung von intakten olfaktorischen und respiratorischen Gewebe aus der Maus Nase durch sequentielles Entfernen der umgebenden Knochen unter Schonung des Gewebes unterhalb. Wir zeigen, dass eine sorgfältige Entfernung von Knochen können sogar die zartesten Gewebe in ihrer Gesamtheit zu bewahren. Wir teilen auch Einblick in mögliche Modifikationen dieser Technik, in denen wir isolieren sowohl das Gehirn und Nase Gewebe zusammen, um die Nerven zu bewahr...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen haben.
Danksagungen
Diese Arbeit wurde durch Forschungsgelder (NIH / NIDCD 009269, 012831 und ARRA administrative Ergänzung NIH Zuschüsse) zu Weihong Lin unterstützt. Wir danken besonders Herrn Tim Ford bei UMBC für seine technische Unterstützung bei Videoaufnahmen und Bearbeitung. Wir möchten auch Dr. Daphne Blumberg, Ms. Chere Petty bei UMBC und Mr. Nicholas McCollum von Olympus America Inc. danken für ihre Unterstützung bei der Ausrüstung Videoaufnahmen.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Dissection | |||
| Rongeur, 1.0 mm Jaw width | World Precision Instruments (WPI) | 501333 | |
| Fine forceps, Dumont 3 | WPI | 503235 | |
| Fine forceps, Dumont 55 | WPI | 14099 | |
| Fine forceps, Dumont AA | Fine Science Tools (FST) | 11210-20 | |
| Specimen forceps, Serrated | VWR | 82027-440 | |
| Operating scissors | WPI | 501753 | |
| Iris scissors, Straight | Miltex | V95-304 | |
| Dissection microscope | Olympus | SZ40 | |
| [header] | |||
| Tissue embedding | |||
| Optimum cutting temperature (OCT) compound | Sakura Finetek | 4583 | |
| Plastic embedding mold | VWR | 15160-215 | |
| Aspirator vacuum pump | Fisher Scientific | 09-960-2 | |
| [header] | |||
| Section staining | |||
| Neutral red | ACROS Organic | CAS 553-24-2 | Nuclei staining |
Referenzen
- Naclerio, R. M., Pinto, J., Assanasen, P., Baroody, F. M. Observations on the ability of the nose to warm and humidify inspired air. Rhinology. 45, 102-111 (2007).
- Bjermer, L. The nose as an air conditioner for the lower airways. Allergy. 54, Suppl 57. 26-30 (1999).
- Firestein, S. How the olfactory system makes sense of scents. Nature. 413, 211-218 (2001).
- Bryant, B., Silver, W. L. Chemisthesis: The common chemical sense. , 2nd, Wiley-Liss. (2000).
- Gross, E. A., Swenberg, J. A., Fields, S., Popp, J. A. Comparative morphometry of the nasal cavity in rats and mice. J. Anat. 135, 83-88 (1982).
- Halpern, M. The organization and function of the vomeronasal system. Annu. Rev. Neurosci. 10, 325-362 (1987).
- Rodolfo-Masera, T. Su l'esquoestizenza di un particulare organo olfacttivo nel setto nasale della cavia e di altri roditori. Arch. Ital. Anat. Embryol. 48, 157-212 (1943).
- Levai, O., Strotmann, J. Projection pattern of nerve fibers from the septal organ: DiI-tracing studies with transgenic OMP mice. Histochemistry and Cell biology. 120, 483-492 (2003).
- Storan, M. J., Key, B. Septal organ of Gruneberg is part of the olfactory system. J. Comp. Neurol. 494, 834-844 (2006).
- Restrepo, D., Arellano, J., Oliva, A. M., Schaefer, M. L., Lin, W. Emerging views on the distinct but related roles of the main and accessory olfactory systems in responsiveness to chemosensory signals in mice. Horm. Behav. 46, 247-256 (2004).
- Breer, H., Fleischer, J., Strotmann, J. The sense of smell: multiple olfactory subsystems. Cell Mol. Life Sci. 63, 1465-1475 (2006).
- Munger, S. D., Leinders-Zufall, T., Zufall, F. Subsystem organization of the mammalian sense of smell. Annu. Rev. Physiol. 71, 115-140 (2009).
- Finger, T. E., St Jeor, V. L., Kinnamon, J. C., Silver, W. L. Ultrastructure of substance P- and CGRP-immunoreactive nerve fibers in the nasal epithelium of rodents. J. Comp. Neurol. 294, 293-305 (1990).
- Papka, R. E., Matulionis, D. H. Association of substance-P-immunoreactive nerves with the murine olfactory mucosa. Cell Tissue Res. 230, 517-525 (1983).
- Baraniuk, J. N., Kim, D. Nasonasal reflexes, the nasal cycle, and sneeze. Curr. Allergy Asthma Rep. 7, 105-111 (2007).
- Lin, W., Ogura, T., Margolskee, R. F., Finger, T. E., Restrepo, D. TRPM5-expressing solitary chemosensory cells respond to odorous irritants. J. Neurophysiol. 99, 1451-1460 (2008).
- Ogura, T., et al. Cholinergic microvillous cells in the mouse main olfactory epithelium and effect of acetylcholine on olfactory sensory neurons and supporting cells. J. Neurophysiol. 106, 1274-1287 (2011).
- Finger, T. E., et al. Solitary chemoreceptor cells in the nasal cavity serve as sentinels of respiration. Proceedings of the National Academy of Sciences of the United States of America. 100, 8981-8986 (2003).
- Gulbransen, B. D., Clapp, T. R., Finger, T. E., Kinnamon, S. C. Nasal solitary chemoreceptor cell responses to bitter and trigeminal stimulants in vitro. J. Neurophysiol. 99, 2929-2937 (2008).
- Zhao, K., Dalton, P., Yang, G. C., Scherer, P. W. Numerical modeling of turbulent and laminar airflow and odorant transport during sniffing in the human and rat nose. Chemical Senses. 31, 107-118 (2006).
- Ressler, K. J., Sullivan, S. L., Buck, L. B. A zonal organization of odorant receptor gene expression in the olfactory epithelium. Cell. 73, 597-609 (1993).
- Vassar, R., Ngai, J., Axel, R. Spatial segregation of odorant receptor expression in the mammalian olfactory epithelium. Cell. 74, 309-318 (1993).
- Fulle, H. J., et al. A receptor guanylyl cyclase expressed specifically in olfactory sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 92, 3571-3575 (1995).
- Juilfs, D. M., et al. A subset of olfactory neurons that selectively express cGMP-stimulated phosphodiesterase (PDE2) and guanylyl cyclase-D define a unique olfactory signal transduction pathway. Proceedings of the National Academy of Sciences of the United States of America. 94, 3388-3395 (1997).
- Lin, W., Arellano, J., Slotnick, B., Restrepo, D. Odors detected by mice deficient in cyclic nucleotide-gated channel subunit A2 stimulate the main olfactory system. The Journal of Neuroscience: The Official journal of the Society for Neuroscience. 24, 3703-3710 (2004).
- Ishii, T., Omura, M., Mombaerts, P. Protocols for two- and three-color fluorescent RNA in situ hybridization of the main and accessory olfactory epithelia in mouse. J. Neurocyt. 33, 657-669 (2004).
- Lee, A. C., Tian, H., Grosmaitre, X., Ma, M. Expression patterns of odorant receptors and response properties of olfactory sensory neurons in aged mice. Chemical Senses. 34, 695-703 (2009).
- Packard, A., Schnittke, N., Romano, R. A., Sinha, S., Schwob, J. E. DeltaNp63 regulates stem cell dynamics in the mammalian olfactory epithelium. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 31, 8748-8759 (2011).
- Matthews, J. B., Mason, G. I. Influence of decalcifying agents on immunoreactivity of formalin-fixed, paraffin-embedded tissue. Histochem J. 16, 771-787 (1984).
- Athanasou, N. A., Quinn, J., Heryet, A., Woods, C. G., McGee, J. O. Effect of decalcification agents on immunoreactivity of cellular antigens. J. Clin. Pathol. 40, 874-878 (1987).
- Hegg, C. C., Irwin, M., Lucero, M. T. Calcium store-mediated signaling in sustentacular cells of the mouse olfactory epithelium. Glia. 57, 634-644 (2009).
- Spehr, M., et al. Essential role of the main olfactory system in social recognition of major histocompatibility complex peptide ligands. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 26, 1961-1970 (2006).
- Ma, M., Chen, W. R., Shepherd, G. M. Electrophysiological characterization of rat and mouse olfactory receptor neurons from an intact epithelial preparation. J. Neurosci. Methods. 92, 31-40 (1999).
- Cygnar, K. D., Stephan, A. B., Zhao, H. Analyzing responses of mouse olfactory sensory neurons using the air-phase electroolfactogram recording. J. Vis. Exp. (37), e1850(2010).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J. Vis. Exp. (65), e3564(2012).
- Lin, W., Margolskee, R., Donnert, G., Hell, S. W., Restrepo, D. Olfactory neurons expressing transient receptor potential channel M5 (TRPM5) are involved in sensing semiochemicals. Proceedings of the National Academy of Sciences of the United States of America. 104, 2471-2476 (2007).
- Lin, W., Ezekwe, E. A., Zhao, Z., Liman, E. R., Restrepo, D. TRPM5-expressing microvillous cells in the main olfactory epithelium. BMC Neurosci. 9, 114(2008).
- Ogura, T., Krosnowski, K., Zhang, L., Bekkerman, M., Lin, W. Chemoreception regulates chemical access to mouse vomeronasal organ: role of solitary chemosensory cells. PLoS One. 5, e11924(2010).
- Sathyanesan, A., Feijoo, A. A., Mehta, S. T., Nimarko, A. F., Lin, W. Expression profile of G-protein βγ subunit gene transcripts in the mouse olfactory sensory epithelia. Frontiers in Cellular Neuroscience. 7, 84(2013).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten