É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um método eficaz para Desossa manual Prepare Intacto Rato tecido nasal com organização anatômica preservada
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Resumo
O nariz de mamífero é um órgão multi-funcional com estruturas internas intrincados. A cavidade nasal é revestida com vários epitélios, tais como epitélio olfatório, respiratória e escamosas que diferem acentuadamente em localizações anatômicas, morfologia e funções. Em ratinhos adultos, o nariz é coberto com vários ossos do crânio, limitando o acesso experimental para as estruturas internas, especialmente aquelas na região posterior, tais como o epitélio olfactivo principal (MOE). Aqui nós descrevemos um método eficaz para a obtenção de quase os tecidos nasais inteiros e intactos, com organização anatômica preservada. Usando ferramentas cirúrgicas sob um microscópio de dissecação, que sequencialmente remover os ossos do crânio em torno do tecido nasal. Este procedimento pode ser realizado em ambas as cabeças de pele de rato paraformaldeído fixos e recém-dissecados. O processo de desossamento inteiro leva cerca de 20-30 minutos, o que é significativamente mais curto do que o tempo necessário para experimental convencional de química baseadacalcificação. Além disso, apresentamos um método fácil para remover as bolhas de ar presas entre os cornetos, o que é fundamental para a obtenção de seções horizontais ou coronal e sagital finas intactas desde a preparação do tecido nasal. Tecido nasal preparado utilizando o nosso método pode ser utilizado para a observação de toda a montagem de todo o epitélio, bem como características morfológicas, imunocitoquímica, de hibridação de ARN in situ e os estudos fisiológicos, especialmente em estudos onde o exame específico de região e comparação de interesse.
Introdução
A cavidade nasal de mamíferos contém vários tipos de tecidos e órgãos que servem funções distintas. A cavidade nasal constitui a porção de entrada do tracto respiratório superior, o que permite viajar ar para dentro e para fora dos pulmões. Ar inalado passa através da cavidade nasal, onde é submetido a temperatura e humidade condicionado 1, bem como a limpeza ou a filtração para remover as substâncias tóxicos e irritantes e microrganismos infecciosos 2. Ambos os tratamentos são efectuados pelo epitélio nasal e subepiteliais tecidos, incluindo as glândulas e vasos e são críticos para proteger as vias aéreas inferiores e dos pulmões. Em adição ao seu papel na respiração e de defesa do epitélio, o tecido nasal também contém aparelhos sensoriais periféricos dos sistemas olfactivos e trigeminal, que detectam uma vasta gama de substâncias químicas na passagem de ar. Dependendo de qual o sistema é activado, a detecção sensorial dos produtos químicos no nariz pode provocar querum sentido de cheiro, irritação ou dor 3,4.
O sistema olfativo periférica é complexo e composto de vários órgãos sensoriais olfativos anatomicamente separados dentro da cavidade nasal. Entre eles, o epitélio olfactivo principal (MOE) é o maior, o que representa cerca de 45-52% do epitélio nasal em roedores 5 e está localizado na região posterior. Na região anteroventral, existe um par de estruturas tubulares conhecidos como o órgão vomeronasal 6, que sentar-se ao longo de cada lado do septo nasal. Dois pequenos agrupamentos adicionais de neurónios sensoriais olfactivos, conhecidos como o órgão de septo de Masera 7,8 e gânglio Grüneberg 9, reside ao longo do septo ventral e dorsal da região de entrada da cavidade nasal, respectivamente. Estes órgãos periféricos conter neuro-epitélio com características distintivas em morfologia, expressão marcador celular e função fisiológica. Juntos, eles detectar milhares de odormoléculas com requintada sensibilidade 10-12.
Além dos órgãos sensoriais olfactivos, na cavidade nasal também abriga outros sistemas sensoriais. Sabe-se que as fibras do nervo trigeminal peptidérgicas estão presentes no epitélio nasal, especialmente o epitélio respiratório 13,14. Algumas dessas fibras detectar produtos químicos tóxicos e irritantes e são responsáveis por iniciar reflexos protetores, tais como tosse e espirros 4,15. Compostos odoríferos e amargo Irritante também pode ser detectada por uma população de células recentemente descoberto quimio solitários (SCCs), muitos dos quais são inervados por fibras nervosas trigeminais 16-19. Estes CCEs estão localizados em maior densidade na região da entrada da cavidade nasal e os dutos de entrada vomeronasal, dando a entender que eles também podem ter uma função protetora 16-18. Assim, o epitélio nasal pode variar substancialmente em função, morfologia e composição celular em função da sualocalizações anatômicas.
Mesmo dentro de um epitélio único e especializado, existem diferenças regionais. O MOE é um exemplo. As linhas MOE vários cornetos, que são complicados e estruturas enrolado. Por causa deles, diferentes regiões da experiência de taxas de fluxo de ar diferentes Moe, e, portanto, diferente de difusão e taxas de depuração de moléculas de odor no ar 20. Além disso, sabe-se que os neurónios sensoriais olfactivos (ORS) que expressam um dado receptor de odor estão localizados numa das quatro zonas contornadas do MOE 21,22. Como esta diferença local afecta a resposta de um OSN a odorantes largamente não é conhecido. Além disso, algumas populações OSN exibem preferência regional. Guanilato ciclase-D (GC-D) expressando ORS têm distribuições zonais favorecendo as regiões cul-de-sac das ectoturbinates 23,24. Mais recentemente, verificou-se uma subpopulação de ORS canônicas que expressa transitória receptor potencial canal M5 (trPM5) e localiza-se preferencialmente nas regiões laterais e ventral 25. Estes resultados indicam que o MOE não é uniforme. No entanto, como estas diferenças regionais afectar codificação olfactivos não é compreendido. Isto é em parte porque a investigação aprofundada fisiológica do MOE e do nariz tem sido limitada pela dificuldade de obtenção de epitélio nasal intacto com organização anatómica preservados utilizando métodos correntes.
O epitélio nasal são predominantemente cercado pelos ossos anterior do crânio, incluindo o nasal, maxila, palatino, zigomático, e os ossos etmoidais. Em camundongos adultos e outros modelos de roedores, estes ossos são duros e difíceis de remover sem danificar o tecido nasal intimamente associada, especialmente dos cornetos delicados. Muitas vezes, descalcificação de base química é utilizada para amolecer ossos para permitir cryosectioning dos tecidos nasais para morfológica, imuno-histoquímica, e em estudos de hibridação in situ, no entanto, dependendo da idade do animal, do processo de descalcificação pode durar até durante a noite a 7 dias 24,26-28. Este tratamento também é limitada, porque requer tecido fixador ser preservada. Além disso, a descalcificação química pode ser dura e afetar a imunomarcação de alguns anticorpos sensíveis 29,30. Para os estudos fisiológicos, tecido vivo é necessário e, portanto, estas experiências são frequentemente executadas em ORS isoladas ou fatias de MOE obtidos a partir de recém-nascidos, cujos ossos do crânio são fina e macia 17,31,32. Estudos fisiológicos também podem utilizar os preparativos de montagem inteiros, dividindo a cabeça 25,33,34, mas geralmente apenas a superfície medial do nariz é facilmente acessível, limitando gravações fisiológicas em outras áreas.
Aqui, descrevemos, um método de desossa manual do efetivo para preparar tecidos nasais intactas com organização anatómica original preservada e morfologia. Nós sequencialmente remover os principais ossos do anteriorÉ necessário crânio sob um microscópio de dissecação para expor um epitélio nasal quase inteiramente intactas, mantendo os ossos finos cornetos intacta, a menos que os ratos são muito antigas e cryosectioning. Nós também estender o método para preservar a conexão entre os tecidos nasais e bolbos olfactivos, assim como o resto do cérebro, facilitando, assim, análise simultânea dos circuitos centrais e periféricos. O método pode ser utilizado para preparar o paraformaldeído fixo, bem como fresco, tecido nasal vivo. Assim, espera-se o nosso método para facilitar estudos morfológicos, imuno-histoquímica e fisiológico da respiração, olfato e nasal danos e doenças.
Protocolo
1. Rato Nariz Preparação
Usamos adultos camundongos C57BL / 6 fundo neste estudo. Todos os cuidados e procedimentos com animais são aprovados pelo Animal Care e Comitês de Uso (IACUC) da Universidade de Maryland, Baltimore County.
1.1 Adquirir o nariz de camundongos paraformaldahyde-fixados
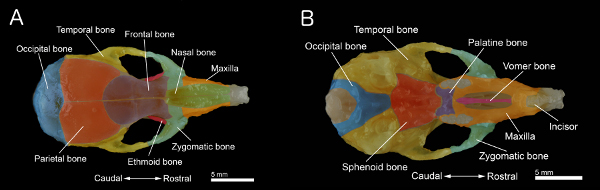
Figura 1. Ossos de um crânio de rato A:. Vista dorsal do crânio B:. Vista ventral do crânio com a mandíbula removida. O crânio foi preparado a partir de um ratinho de idade de 40 dias. Ossos individuais são coloridos para melhor visualização. Clique aqui para ver a figura maior .
- Perfundir transcardially para corrigir camundongos individuais seguindo ªe protocolo de Lin et ai., (2008) 16. Resumidamente, os ratos foram profundamente anestesiados com tribromoetanol (Avertin 250 ug / g de peso corporal), transcardially perfundidos com tampão fosfato 0,1 M (PB, 30-50 ml), seguido por um agente fixador de fosfato tamponada, contendo 3% de paraformaldeído, 19 mM de L-lisina monocloridrato, e 0,23% de m-periodato de sódio (cerca de 35-50 mL). Pode-se também seguir as etapas no artigo Jove para perfusão animais 35.
- Utilizar um par de tesouras para cortar mandíbula (ou a mandíbula inferior) e retirar a pele da cabeça.
- Separa-se toda a cabeça do resto do corpo.
- Retire o paladar. Também, limpar e remover o tecido muscular e conjuntivo remanescente na superfície do crânio para obter a amostra representada nas Figuras 1A e 1B.
- Sob um microscópio de dissecção, remover o osso do crânio que cobre o cérebro e os bulbos olfactivos. Apare o excesso de tecido e ossos. Nãote, para a preparação de tecido estendido em que o cérebro e nariz permanecer ligado, apenas os ossos são removidos do crânio. Para as experiências de imuno-histoquímica, o tecido foi pós-fixada, durante 1,5 horas e transferidas para solução salina tamponada com fosfato 0,1 M (PBS) com 25% de sacarose durante a noite. Tecido nasal deve ser mantida durante todo o humidif dissecção por imersão na solução de sacarose tamponada várias vezes.
1.2 Adquirir o nariz de camundongos recém-sacrificados
- Ratinhos individuais foram transferidas para uma gaiola limpa e exposto a gás de CO 2, o que foi seguido por deslocamento cervical 5 min após o sopro final. Para reduzir o sangue no tecido nariz utilize uma tesoura para abrir a caixa e cortar o coração para permitir que o sangue escorra.
- Repita os passos 1.1.2 a 1.1.5, exceto a pós-fixação e crioproteção com 25% de sacarose. A amostra deve ser mantido humidificada e mantida com solução salina de Tyrode contendo (em mM): 140 de NaCl, 5 KCl, MgCl2 1, CaCl2 1, 10 piruvato de Na, 10 em D-glucose, e 10 N-2-hidroxietilpiperazina-N'-2-etanossulfónico tampão de ácido (HEPES, com pH ajustado para 7,4). Alternativamente, dobrar uma peça de Kimwipes, embeba-lo com uma solução de Tyrode, e colocar sob o espécime dissecando e ocasionalmente mergulhar o espécimen em solução a de Tyrode ou cair algumas solução sobre o tecido para o manter húmida para manter a viabilidade das células e dos tecidos .
2. Incisivo, Anterior Vomer e maxila remoção óssea
- Iniciar a partir de um ponto de vista ventral. Localize o osso vômer e quebrar o osso vômer ao longo de seu comprimento usando uma rongeur ou pinças com dentes para quebrar a maior parte ventral do osso.
- Usando fórceps serrilhados, remover os segmentos quebradas do osso vômer dobrando suavemente os fragmentos do osso para fora do órgão vomeronasal (OVN). Note-se, para os ratos menos de um mês de idade, ou se apenas interessados no MOE, estes dois steps pode ser ignorada.
- Segure a cabeça firmemente com uma pinça. Utilizar a alveolótomo para quebrar a porção frontal dos incisivos e da região anterior da maxila articulada entre os dois incisivos e do osso vômer.
- Ruptura da porção ventral da maxila direita na região imediatamente anterior ao arco zigomática até ao nível da placa zigomática dorsal.
- Virar o nariz para um ponto de vista dorsal. Use o rongeur para quebrar o anterior maxilar direito da placa zigomática dorsal. Todo o anterior maxilar direito da placa zigomática deve ser solto. Use as pinça fina para separar delicadamente qualquer tecido nasal subjacente à maxila, e em seguida, levante suavemente o fragmento de osso.
- Repita os passos 2.4 e 2.5 para soltar o dente incisivo esquerdo e maxilar anterior esquerda e depois removê-los do osso nasal foi removido.
3. Osso nasal e Dorsal retirada da placa zigomático
- Usar o fórceps ou serrilhada o alveolótomo remover o restante dos ossos frontal apenas caudais para os ossos nasais. Depois de retirar esse pedaço de osso, a parte caudal do osso nasal pode ser tomado com a pinça.
- Utilizar a alveolótomo para quebrar a porção anterior da arcada zigomática, o qual está ligado à placa zigomática.
- Aqui as pinça fina na borda lateral da extremidade dorsal da placa zigomática e virar suavemente o osso e removê-lo. Se o osso não está solto, utilize o rongeur para apertá-lo suavemente para soltá-lo para remoção.
- Utilizar as pinças finas ou uma lâmina de barbear para soltar o fio de sutura medial entre os ossos nasais direita e esquerda.
- Use o serrilhada pinça para agarrar a extremidade caudal do osso nasal direita. Mova cuidadosamente o osso de um lado para outro para separá-lo do tecido subjacente. É útil para mover as pinças ao longo do terceiro caudal do osso nasal para mover o lado do osso para o outro. À medida que o separa do osso nasal, lentamente levantar o osso a partir da extremidade caudal.
- Enquanto tele osso nasal é ligeiramente levantada, incline lateralmente o osso para revelar um afloramento laterais do osso que é forrado com tecido epitelial respiratória fina. Use uma pinça fina para libertar suavemente este tecido do osso nasal. Continue a levantar o osso nasal. Quando o osso está completamente separado do tecido subjacente, use uma tesoura para cortar o osso nasal no final rostral.
- Repita os passos 3.1, 3.5 e 3.6 para a remoção de osso nasal esquerda.
- Repita os passos 3.2 e 3.3 para o lado esquerdo do nariz.
4. Lateral retirada da placa zigomático
- Remova a placa zigomática um lado de cada vez. Ou placa zigomática pode ser removido primeiro.
- Do ponto de vista ventral, quebrar o maxilar inferior do arco zigomático até a ruptura atinge o arco zigomático.
- Do ponto de vista dorsal, pegue suavemente o arco zigomático e levantar a frente e lateral. Se a placa zigomática ainda está ligado a qualquer tecido, tomar a multafórceps e separam cuidadosamente as ligações entre o tecido eo osso.
- Repetir para a placa zigomática no outro lado do nariz.
5. Orbit remoção óssea
- Do ponto de vista ventral, quebrar o osso palantine entre os molares do nariz.
- Utilizar a alveolótomo para quebrar as três molares e da maxila de cada lado do nariz.
- Quebrar e remover quaisquer pedaços grossos restantes do osso ventral e posterior aos cornetos em cada lado do nariz.
6. Remoção etmóide
- Quebrar qualquer parte do osso etmóide salientes caudal aos cornetos. Isso é necessário para evitar a perda de tecido concha ao remover partes finas do osso etmóide cobrindo os cornetos.
- Para o lado direito do nariz, coloque as pinça fina na borda anterior do osso etmóide e remova-o suavemente. Se uma parte do osso permanece, repita esse procedimento até que todos osfino que cobre o osso das conchas foi removido. Os cornetos não precisa de ser retirada a maior parte das preparações. Em ratos idosos, a placa cribriforme torna-se frágil. Se cryosectioning do tecido nasal é necessário, remover pequenos pedaços da placa com uma pinça fina para reduzir o dano potencial causado pelo osso.
- Repetir passo 6.2) para o lado esquerdo do nariz.
- Remova todos os fragmentos de ossos restantes antes do corte. Nota: em animais com mais de um ano de idade, a região póstero do osso septo é um pouco espessa e difícil. Pode-se remover esta parte usando uma pinça fina. Inserir a ponta do fórceps para ambos os lados do osso para separar a porção dorsal do osso do septo e o forro de tecido epitelial. Use uma pinça para pegar o osso e manter o espécime. Use um outro par de fórceps para quebrar a parte superior óssea da parte inferior do septo cartilaginoso e removê-lo suavemente.
7. Preparação nariz para cryosectioning
- Configure a bomba de vácuo aspirador.
- Coloque o nariz em um molde de incorporação. Submergir o nariz na mídia outubro
- Usar um vácuo para remover as bolhas de ar aprisionadas no interior do tecido do nariz. Este processo leva até 5 min.
- Depois de remover as bolhas de ar, definido o tecido na orientação desejada.
- Congelar a outubro e de tecido no molde usando gelo seco. O tecido pode, então, ser incorporado cryosectioned imediatamente ou armazenada a -80 ° C para uso futuro.
Resultados
Usando esse método, podemos obter de forma confiável tecido nasal quase inteiramente intactas. Figura 2A mostra uma imagem de amostra nasal adulto de uma cabeça paraformaldeído fixo. Neste modelo, todas as quatro sub-órgãos sensoriais olfactivos, incluindo a, órgão MOE do septo, o gânglio Grüneberg e VNO, estão intactas. Além disso, o epitélio respiratório e tecidos subepiteliais, tais como glândulas e vasos, são preservados. Nós utilizamos com sucesso este método de uma série de estu...
Discussão
Aqui, demonstramos um procedimento passo-a-passo para o isolamento de tecido olfactivo e respiratório intacto a partir do nariz do rato sequencialmente remoção dos ossos ao redor, enquanto poupando o tecido abaixo. Nós mostramos que a remoção cuidadosa de osso pode preservar até os tecidos mais delicados, na sua totalidade. Também compartilhar insights sobre possíveis modificações desta técnica, em que isolar tanto o cérebro eo tecido nariz juntos para preservar a conexão do nervo. Este novo método propor...
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi apoiado por bolsas de investigação (NIH / NIDCD 009269, 012831 e ARRA administrativos suplemento NIH) para Weihong Lin. Agradecemos especialmente Mr. Tim Ford em UMBC por sua assistência técnica na filmagem e processamento. Gostaríamos também de agradecer ao Dr. Daphne Blumberg, Ms. Chere Petty em UMBC eo Sr. Nicholas McCollum da Olympus America Inc. por sua assistência em equipamentos de filmagem.
Materiais
| Name | Company | Catalog Number | Comments |
| Dissection | |||
| Rongeur, 1.0 mm Jaw width | World Precision Instruments (WPI) | 501333 | |
| Fine forceps, Dumont 3 | WPI | 503235 | |
| Fine forceps, Dumont 55 | WPI | 14099 | |
| Fine forceps, Dumont AA | Fine Science Tools (FST) | 11210-20 | |
| Specimen forceps, Serrated | VWR | 82027-440 | |
| Operating scissors | WPI | 501753 | |
| Iris scissors, Straight | Miltex | V95-304 | |
| Dissection microscope | Olympus | SZ40 | |
| [header] | |||
| Tissue embedding | |||
| Optimum cutting temperature (OCT) compound | Sakura Finetek | 4583 | |
| Plastic embedding mold | VWR | 15160-215 | |
| Aspirator vacuum pump | Fisher Scientific | 09-960-2 | |
| [header] | |||
| Section staining | |||
| Neutral red | ACROS Organic | CAS 553-24-2 | Nuclei staining |
Referências
- Naclerio, R. M., Pinto, J., Assanasen, P., Baroody, F. M. Observations on the ability of the nose to warm and humidify inspired air. Rhinology. 45, 102-111 (2007).
- Bjermer, L. The nose as an air conditioner for the lower airways. Allergy. 54, 26-30 (1999).
- Firestein, S. How the olfactory system makes sense of scents. Nature. 413, 211-218 (2001).
- Bryant, B., Silver, W. L. . Chemisthesis: The common chemical sense. , (2000).
- Gross, E. A., Swenberg, J. A., Fields, S., Popp, J. A. Comparative morphometry of the nasal cavity in rats and mice. J. Anat. 135, 83-88 (1982).
- Halpern, M. The organization and function of the vomeronasal system. Annu. Rev. Neurosci. 10, 325-362 (1987).
- Rodolfo-Masera, T. Su l'esquoestizenza di un particulare organo olfacttivo nel setto nasale della cavia e di altri roditori. Arch. Ital. Anat. Embryol. 48, 157-212 (1943).
- Levai, O., Strotmann, J. Projection pattern of nerve fibers from the septal organ: DiI-tracing studies with transgenic OMP mice. Histochemistry and Cell biology. 120, 483-492 (2003).
- Storan, M. J., Key, B. Septal organ of Gruneberg is part of the olfactory system. J. Comp. Neurol. 494, 834-844 (2006).
- Restrepo, D., Arellano, J., Oliva, A. M., Schaefer, M. L., Lin, W. Emerging views on the distinct but related roles of the main and accessory olfactory systems in responsiveness to chemosensory signals in mice. Horm. Behav. 46, 247-256 (2004).
- Breer, H., Fleischer, J., Strotmann, J. The sense of smell: multiple olfactory subsystems. Cell Mol. Life Sci. 63, 1465-1475 (2006).
- Munger, S. D., Leinders-Zufall, T., Zufall, F. Subsystem organization of the mammalian sense of smell. Annu. Rev. Physiol. 71, 115-140 (2009).
- Finger, T. E., St Jeor, V. L., Kinnamon, J. C., Silver, W. L. Ultrastructure of substance P- and CGRP-immunoreactive nerve fibers in the nasal epithelium of rodents. J. Comp. Neurol. 294, 293-305 (1990).
- Papka, R. E., Matulionis, D. H. Association of substance-P-immunoreactive nerves with the murine olfactory mucosa. Cell Tissue Res. 230, 517-525 (1983).
- Baraniuk, J. N., Kim, D. Nasonasal reflexes, the nasal cycle, and sneeze. Curr. Allergy Asthma Rep. 7, 105-111 (2007).
- Lin, W., Ogura, T., Margolskee, R. F., Finger, T. E., Restrepo, D. TRPM5-expressing solitary chemosensory cells respond to odorous irritants. J. Neurophysiol. 99, 1451-1460 (2008).
- Ogura, T., et al. Cholinergic microvillous cells in the mouse main olfactory epithelium and effect of acetylcholine on olfactory sensory neurons and supporting cells. J. Neurophysiol. 106, 1274-1287 (2011).
- Finger, T. E., et al. Solitary chemoreceptor cells in the nasal cavity serve as sentinels of respiration. Proceedings of the National Academy of Sciences of the United States of America. 100, 8981-8986 (2003).
- Gulbransen, B. D., Clapp, T. R., Finger, T. E., Kinnamon, S. C. Nasal solitary chemoreceptor cell responses to bitter and trigeminal stimulants in vitro. J. Neurophysiol. 99, 2929-2937 (2008).
- Zhao, K., Dalton, P., Yang, G. C., Scherer, P. W. Numerical modeling of turbulent and laminar airflow and odorant transport during sniffing in the human and rat nose. Chemical Senses. 31, 107-118 (2006).
- Ressler, K. J., Sullivan, S. L., Buck, L. B. A zonal organization of odorant receptor gene expression in the olfactory epithelium. Cell. 73, 597-609 (1993).
- Vassar, R., Ngai, J., Axel, R. Spatial segregation of odorant receptor expression in the mammalian olfactory epithelium. Cell. 74, 309-318 (1993).
- Fulle, H. J., et al. A receptor guanylyl cyclase expressed specifically in olfactory sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 92, 3571-3575 (1995).
- Juilfs, D. M., et al. A subset of olfactory neurons that selectively express cGMP-stimulated phosphodiesterase (PDE2) and guanylyl cyclase-D define a unique olfactory signal transduction pathway. Proceedings of the National Academy of Sciences of the United States of America. 94, 3388-3395 (1997).
- Lin, W., Arellano, J., Slotnick, B., Restrepo, D. Odors detected by mice deficient in cyclic nucleotide-gated channel subunit A2 stimulate the main olfactory system. The Journal of Neuroscience: The Official journal of the Society for Neuroscience. 24, 3703-3710 (2004).
- Ishii, T., Omura, M., Mombaerts, P. Protocols for two- and three-color fluorescent RNA in situ hybridization of the main and accessory olfactory epithelia in mouse. J. Neurocyt. 33, 657-669 (2004).
- Lee, A. C., Tian, H., Grosmaitre, X., Ma, M. Expression patterns of odorant receptors and response properties of olfactory sensory neurons in aged mice. Chemical Senses. 34, 695-703 (2009).
- Packard, A., Schnittke, N., Romano, R. A., Sinha, S., Schwob, J. E. DeltaNp63 regulates stem cell dynamics in the mammalian olfactory epithelium. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 31, 8748-8759 (2011).
- Matthews, J. B., Mason, G. I. Influence of decalcifying agents on immunoreactivity of formalin-fixed, paraffin-embedded tissue. Histochem J. 16, 771-787 (1984).
- Athanasou, N. A., Quinn, J., Heryet, A., Woods, C. G., McGee, J. O. Effect of decalcification agents on immunoreactivity of cellular antigens. J. Clin. Pathol. 40, 874-878 (1987).
- Hegg, C. C., Irwin, M., Lucero, M. T. Calcium store-mediated signaling in sustentacular cells of the mouse olfactory epithelium. Glia. 57, 634-644 (2009).
- Spehr, M., et al. Essential role of the main olfactory system in social recognition of major histocompatibility complex peptide ligands. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 26, 1961-1970 (2006).
- Ma, M., Chen, W. R., Shepherd, G. M. Electrophysiological characterization of rat and mouse olfactory receptor neurons from an intact epithelial preparation. J. Neurosci. Methods. 92, 31-40 (1999).
- Cygnar, K. D., Stephan, A. B., Zhao, H. Analyzing responses of mouse olfactory sensory neurons using the air-phase electroolfactogram recording. J. Vis. Exp. (37), e1850 (2010).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J. Vis. Exp. (65), e3564 (2012).
- Lin, W., Margolskee, R., Donnert, G., Hell, S. W., Restrepo, D. Olfactory neurons expressing transient receptor potential channel M5 (TRPM5) are involved in sensing semiochemicals. Proceedings of the National Academy of Sciences of the United States of America. 104, 2471-2476 (2007).
- Lin, W., Ezekwe, E. A., Zhao, Z., Liman, E. R., Restrepo, D. TRPM5-expressing microvillous cells in the main olfactory epithelium. BMC Neurosci. 9, 114 (2008).
- Ogura, T., Krosnowski, K., Zhang, L., Bekkerman, M., Lin, W. Chemoreception regulates chemical access to mouse vomeronasal organ: role of solitary chemosensory cells. PLoS One. 5, e11924 (2010).
- Sathyanesan, A., Feijoo, A. A., Mehta, S. T., Nimarko, A. F., Lin, W. Expression profile of G-protein βγ subunit gene transcripts in the mouse olfactory sensory epithelia. Frontiers in Cellular Neuroscience. 7, 84 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados