Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un método eficaz para Deshuesado Manual Preparar Intact ratón tejido nasal con la organización anatómica Conservas
* Estos autores han contribuido por igual
En este artículo
Resumen
Resumen
La nariz de mamífero es un órgano de múltiples funciones con estructuras internas complejas. La cavidad nasal está llena de diversos epitelios, como el epitelio olfativo, respiratorias, y de células escamosas, que difieren notablemente en localizaciones anatómicas, morfología y funciones. En ratones adultos, la nariz está cubierto con varios huesos del cráneo, lo que limita el acceso experimental a las estructuras internas, especialmente las de la posterior tal como epitelio olfativo principal (MOE). Aquí se describe un método eficaz para la obtención de los tejidos nasales casi enteras intactas y con organización anatómica conservado. El uso de herramientas quirúrgicas bajo un microscopio de disección, que secuencialmente quitamos los huesos del cráneo que rodean el tejido nasal. Este procedimiento se puede realizar en ambos, cabezas de piel de ratón paraformaldehído-fijos y recién disecados. El procedimiento de deshuesado completo dura aproximadamente 20-30 min, que es significativamente más corto que el tiempo experimental requerido para convencional de química basadacalcificación. Además, se presenta un método fácil para eliminar las burbujas de aire atrapadas entre los cornetes, lo cual es crítico para la obtención de secciones horizontales o coronal o sagital delgadas intactas de la preparación del tejido nasal. Tejido nasal preparado usando nuestro método se puede utilizar para la observación de todo el montaje de todo el epitelio, así como morfológica, inmunocitoquímica, ARN la hibridación in situ, y los estudios fisiológicos, especialmente en estudios en los que la región específica de examen y la comparación son de interés.
Introducción
La cavidad nasal de mamíferos contiene varios tipos de tejidos y órganos que sirven para funciones distintas. La cavidad nasal constituye la parte de entrada de las vías respiratorias superiores, que permite el desplazamiento de aire dentro y fuera de los pulmones. El aire inhalado pasa a través de la cavidad nasal donde se somete a temperatura y humedad acondicionado 1, así como la limpieza o el filtrado para eliminar las sustancias irritantes y tóxicos y microorganismos infecciosos 2. Ambos tratamientos son realizados por epitelio nasal y los tejidos subepiteliales, incluyendo glándulas y vasos y son fundamentales para la protección de las vías respiratorias inferiores y los pulmones. Además de su papel en la respiración y la defensa epitelial, tejido de la nariz también contiene aparatos sensoriales periféricas de los sistemas olfativos y del trigémino, que detectan una amplia gama de sustancias químicas en el aire que pasa. Dependiendo de qué sistema se activa, la detección sensorial de productos químicos en la nariz puede obtener ya seaun sentido del olfato, irritación, o dolor 3,4.
El sistema olfativo periférico es complejo y compuesto de varios órganos sensoriales olfativas anatómicamente separados dentro de la cavidad nasal. Entre ellos, el epitelio olfativo principal (MOE) es la más grande, lo que constituye aproximadamente el 45-52% del epitelio nasal en roedores 5 y está ubicado en la región posterior. En la región anteroventral, hay un par de estructuras tubulares conocidos como el órgano vomeronasal 6, que se sientan a lo largo de cada lado del tabique nasal. Dos pequeñas agrupaciones adicionales de las neuronas sensoriales olfativas, conocidos como el órgano septal de Masera 7,8 y el ganglio Gruneberg 9, residen a lo largo del tabique ventral y dorsal de la región de entrada de la cavidad nasal, respectivamente. Estos órganos periféricos contienen neuro-epitelial con características distintivas en la morfología, la expresión de marcadores de células y la función fisiológica. Juntos detectar miles de oloresmoléculas con exquisita sensibilidad 10-12.
Además de los órganos sensoriales olfativas, la cavidad nasal también alberga otros sistemas sensoriales. Se sabe que las fibras del nervio trigémino peptidérgicas están presentes en el epitelio nasal, especialmente el epitelio respiratorio 13,14. Algunas de estas fibras detectar sustancias químicas irritantes y tóxicos, y son responsables de iniciar los reflejos protectores, tales como tos y los estornudos 4,15. Compuestos olorosos y amargo irritantes también pueden ser detectados por una población recientemente descubierta de células quimiosensoriales solitarios (SCC), muchos de los cuales están inervadas por fibras nerviosas del trigémino 16-19. Estos SCC se encuentran en mayor densidad en la zona de entrada de la cavidad nasal y de los conductos de entrada vomeronasal, dando a entender que ellos también pueden tener una función protectora 16-18. Por lo tanto, epitelio nasal puede diferir sustancialmente en función, la morfología y composición de las células en función de sulocalizaciones anatómicas.
Incluso dentro de una única y especializada epitelio, hay diferencias regionales. El Ministerio de Educación es un ejemplo de ello. Las líneas MOE varios cornetes, que son complicados y las estructuras curvadas. Debido a ellos, diferentes regiones de la experiencia de diferentes tasas de flujo de aire del Ministerio de Educación y, por tanto, diferente de difusión y tasas de eliminación de moléculas de olor en el aire 20. Además, se sabe que las neuronas sensoriales olfativas (OSN) que expresan un receptor de olor que se encuentran en una de las cuatro zonas de eludido el MOE 21,22. ¿Cómo afecta esta diferencia ubicación es en gran parte no se conoce la respuesta de una OSN a odorantes. Además, algunas poblaciones OSN exhiben preferencia regional. OSN guanililciclasa-D (GC-C) que expresan tienen distribuciones zonales a favor de las regiones cul-de-sac de las ectoturbinates 23,24. Más recientemente, encontramos una subpoblación de OSN canónicas que expresa transitoria receptor potencial canal M5 (trpM5) y se localiza preferentemente en las regiones laterales y ventral 25. Estos resultados indican que MOE no es uniforme. Sin embargo, ¿cómo estas diferencias regionales afectan codificación olfativas no se entiende. Esto es en parte porque la investigación fisiológica a fondo de la MOE y la nariz ha sido limitado por la dificultad de obtener intacta epitelio nasal con organización anatómica conservado con los métodos actuales.
El epitelio nasal son predominantemente rodeada por los huesos anteriores del cráneo, incluyendo el nasal, maxilar superior, palatino, cigomático, y los huesos etmoidales. En ratones adultos y otros modelos de roedores, estos huesos son duros y difíciles de eliminar sin dañar el tejido nasal estrechamente asociada, sobre todo los delicados cornetes. A menudo, la descalcificación de base química se utiliza para ablandar los huesos para permitir cryosectioning de los tejidos nasales para morfológica, inmunohistoquímica y estudios de hibridación in situ, sin embargo, depending de la edad del animal, el proceso de descalcificación puede durar durante la noche hasta 7 días 24,26-28. Este tratamiento también es limitada, ya que requiere el tejido sea fijador-preservada. Además, descalcificación química puede ser duro y afectar la inmunomarcación de algunos anticuerpos sensibles 29,30. Para los estudios fisiológicos, se requiere tejido vivo, y por lo tanto, estos experimentos se llevó a cabo a menudo en OSN aislados o rodajas MOE obtenidos a partir de los recién nacidos cuyos huesos del cráneo son delgados y blandos 17,31,32. Los estudios fisiológicos pueden también utilizar preparaciones todo el montaje por incisión de la cabeza 25,33,34, pero por lo general sólo la superficie medial de la nariz es de fácil acceso, lo que limita las grabaciones fisiológicas en otras áreas.
Aquí se describe un método eficaz deshuesado, manual para preparar los tejidos nasales intactos con preservada organización anatómica original y morfología. Nos quitamos secuencialmente los principales huesos de la anteriorSe necesita cráneo bajo un microscopio de disección para exponer un epitelio nasal casi en su totalidad intacta, manteniendo los huesos cornete delgadas intacta a menos que los ratones son muy antiguo y cryosectioning. También extendemos el método para preservar la conexión entre los tejidos nasales y los bulbos olfativos, así como el resto del cerebro, facilitando así el examen simultáneo de ambos circuitos periféricos y centrales. Nuestro método se puede utilizar para preparar paraformaldehído-fijo, así como fresco, tejido nasal vivo. Por lo tanto, se espera que nuestro método para facilitar los estudios morfológicos, inmunohistoquímicos y fisiológica de la respiración, el olfato, y nasales daños y enfermedades.
Protocolo
1. Ratón nariz Preparación
Se utilizó adultos C57BL / 6 ratones de fondo en este estudio. Todo el cuidado de los animales y los procedimientos son aprobados por el Cuidado de Animales y el Comité uso (IACUC) de la Universidad de Maryland, Condado de Baltimore.
1.1 La adquisición de la nariz de los ratones paraformaldahyde fijos
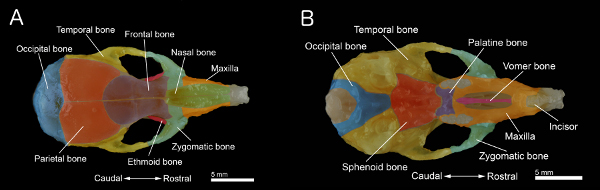
Figura 1. Los huesos de un cráneo de ratón A:. Vista dorsal del cráneo B:. Vista ventral del cráneo con la mandíbula eliminado. El cráneo fue preparado a partir de un ratón viejo de 40 días. Huesos individuales son de color para una mejor visualización. Haz clic aquí para ver más grande la figura .
- Perfusión transcardially fijar ratones individuales después de the protocolo de Lin, et al., (2008) 16. Brevemente, los ratones fueron profundamente anestesiados con tribromoetanol (Avertin 250 mg / g de peso corporal), perfundido transcardialmente con tampón fosfato 0,1 M (PB, 30-50 ml), seguido de un tampón fosfato fijador que contienen 3% de paraformaldehído, 19 mM de L-lisina monohidrocloruro, y 0.23% m-peryodato sódico (aproximadamente 35-50 ml). También se pueden seguir los pasos en el artículo Jove para la perfusión animales 35.
- Use un par de tijeras para cortar la mandíbula (o de la mandíbula inferior) y quitar la piel de la cabeza.
- Separar toda la cabeza del resto del cuerpo.
- Retire el paladar. También, limpiar y eliminar el tejido conjuntivo y el músculo restante sobre la superficie del cráneo para obtener la muestra se muestra en las Figuras 1A y 1B.
- Bajo un microscopio de disección, quitar el hueso del cráneo que cubre el cerebro y los bulbos olfatorios. Se quita el exceso de tejido y huesos. Note, para la preparación del tejido extendida en la que el cerebro y la nariz permanecen conectados, sólo se eliminan los huesos del cráneo. Para los experimentos de inmunohistoquímica, el tejido fue después de la fijada durante 1,5 horas y se transfirió a 0,1 M tampón fosfato salino (PBS) con 25% de sacarosa durante la noche. Tejido nasal se debe mantener humidificado a lo largo de la disección por inmersión en la solución de sacarosa tamponada varias veces.
1.2 La adquisición de la nariz de los ratones recién sacrificados
- Ratones individuales se transfirieron a una jaula limpia y se expusieron a 2 de gas CO, que fue seguido por dislocación cervical 5 min después de que el último aliento. Para reducir la sangre en el tejido de la nariz, usar un par de tijeras para abrir el pecho y cortar el corazón para permitir que la sangre fluya.
- Repita los pasos 1.1.2 al 1.1.5, excepto el post-fijación y crioprotección con un 25% de sacarosa. La muestra debe mantenerse humidificado y se mantiene con solución salina de Tyrode que contiene (en mM): 140 NaCl, 5 KCl, 1 MgCl 2, 1 de CaCl 2, piruvato de Na 10, 10 D-glucosa, y 10 N-2-hidroxietilpiperazina-N'-2-etanosulfónico tampón de ácido (HEPES, ajustado a pH 7,4). Alternativamente, doblar una pieza de Kimwipes, remojo con una solución de Tyrode, y el lugar por debajo de la muestra, mientras que la disección y, ocasionalmente, sumergir la muestra en la solución de Tyrode o soltar algo de solución sobre el tejido para mantenerlo humidificado para mantener la viabilidad de las células y tejidos .
2. Incisivo, anterior Vomer y hueso maxilar Removal
- Empezar desde un punto de vista ventral. Localice el hueso vómer y romper el hueso vómer largo de su longitud usando una gubia o fórceps de dientes para romper el ventral mayor parte del hueso.
- Con unas pinzas dentadas, retire los segmentos rotos del hueso vómer por navegan suavemente los fragmentos de hueso de distancia desde el órgano vomeronasal (VNO). Tenga en cuenta, para los ratones de menos de un mes de edad, o si sólo está interesado en el Ministerio de Educación, estos dos steps se puede omitir.
- Sostenga firmemente la cabeza con unas pinzas. Utilice la gubia para romper la parte delantera de ambos incisivos y la región articulado del maxilar anterior entre los dos incisivos y el hueso vómer.
- Romper la porción ventral del maxilar a la derecha en la región justo anterior al arco cigomático hasta el nivel de la placa dorsal cigomático.
- Dé la vuelta a la nariz de un punto de vista dorsal. Utilice la gubia para romper el anterior maxilar derecha de la placa cigomática dorsal. Todo el anterior maxilar superior derecho de la placa cigomática debe estar suelto. Utilice las pinzas finas para separar con cuidado el tejido nasal subyacente al maxilar, y luego levante suavemente el fragmento óseo.
- Repetir los pasos 2.4 y 2.5 para aflojar el incisivo izquierdo y el maxilar anterior izquierda y eliminarlos después de que el hueso nasal se ha eliminado.
3. Hueso Nasal y Dorsal Extracción de la placa cigomática
- Utilice el fórceps o dentada, las pinzas gubias para volvermover el resto de los huesos frontales justo caudal a los huesos nasales. Una vez retirada la pieza de hueso, la parte caudal del hueso nasal se puede agarrar con fórceps.
- Usa las pinzas gubias para romper la porción anterior del arco cigomático, que está conectado a la placa cigomático.
- Tome las pinzas finas en el borde lateral del extremo dorsal de la placa cigomático y estirar suavemente el hueso y retirarlo. Si el hueso no está suelta, la gubia para apretar suavemente para aflojar para su eliminación.
- Utilice las pinzas finas o una hoja de afeitar para aflojar la sutura medial entre los huesos nasales derecha e izquierda.
- Utilice el dentada fórceps para agarrar el extremo caudal del hueso nasal derecha. Suavemente mueva el hueso de lado a lado para separarlo de los tejidos subyacentes. Es útil para mover las pinzas a lo largo de la tercera caudal del hueso nasal para mover el lado del hueso a lado. Como se separa el hueso nasal, levante lentamente el hueso del extremo caudal.
- Mientras que tque hueso nasal está ligeramente levantada, incline lateralmente el hueso para revelar un saliente lateral del hueso que se alinearon con el tejido epitelial respiratoria delgada. Use unas pinzas finas para liberar este tejido suavemente desde el hueso nasal. Continúe levantando el hueso nasal. Cuando el hueso está completamente separado del tejido subyacente, utilizar unas tijeras para cortar el hueso nasal en el extremo rostral.
- Repita los pasos 3.1, 3.5 y 3.6 para la extracción del hueso nasal izquierdo.
- Repetir los pasos 3.2 y 3.3 para el lado izquierdo de la nariz.
4. Lateral Extracción de la placa cigomática
- Retire la placa cigomática un lado a la vez. De cualquier placa cigomático puede quitar primero.
- Desde un punto de vista ventral, romper el maxilar inferior hasta el arco cigomático hasta las vacaciones llega el arco cigomático.
- Desde un punto de vista dorsal, agarra suavemente el arco cigomático y levante hacia delante y lateral. Si la placa cigomático está aún en cualquier tejido, tome la multafórceps y cortar suavemente las conexiones entre el tejido y el hueso.
- Repita este procedimiento para la placa cigomático en el otro lado de la nariz.
5. Orbit Bone Removal
- Desde un punto de vista ventral, romper el hueso palantine entre los molares de la nariz.
- Utilice la gubia para romper las 3 molares y el maxilar en cada lado de la nariz.
- Romper y extraer todos los trozos gruesos restantes de hueso ventral y posterior a los cornetes en cada lado de la nariz.
6. Remoción del hueso etmoidal
- Romper cualquier porción del hueso etmoides que sobresale caudal a los cornetes. Esto es necesario para evitar la pérdida de tejido cornete cuando la eliminación de piezas finas de hueso etmoides que cubren los cornetes.
- En el lado derecho de la nariz, coloque las pinzas finas en el borde anterior del hueso etmoides y retírela. Si una parte de los restos óseos, repetir este procedimiento hasta que todosel hueso delgada que cubre los cornetes se ha eliminado. Los huesos cornete no necesitan ser eliminados en la mayoría de las preparaciones. En ratones de edad avanzada, la placa cribiforme vuelve quebradizo. Si se necesita cryosectioning del tejido nasal, extraer pequeños trozos de la placa con unas pinzas finas para reducir el daño potencial causado por el hueso.
- Repita el paso 6.2) para el lado izquierdo de la nariz.
- Retire los fragmentos de huesos que quedan antes de la corte. Nota: en los animales de más de un año de edad, la región posterodorsal del hueso del tabique es algo grueso y duro. Se puede quitar esta parte mediante unas pinzas finas. Insertar la punta de las pinzas, a ambos lados del hueso para separar la parte dorsal de la médula tabique y el tejido epitelial de revestimiento. Use un par de pinzas para agarrar el hueso y mantener la muestra. Utilice otro par de pinzas para romper la parte superior del hueso de la parte cartilaginosa inferior del tabique y retírela.
7. Preparación nariz por cryosectioning
- Configure la bomba de vacío aspirador.
- Coloque la nariz en un molde de inclusión. Sumerja la nariz en octubre los medios de comunicación.
- Utilice una aspiradora para eliminar las burbujas de aire atrapadas en el tejido de la nariz. Este proceso puede tardar hasta 5 min.
- Después de eliminar las burbujas de aire, ajustar el tejido en la orientación deseada.
- Congelar los PTU y el tejido en el molde utilizando hielo seco. El tejido incrustado a continuación, se puede cryosectioned inmediatamente o se almacenó a -80 ° C para su uso futuro.
Resultados
El uso de este método, podemos obtener de manera fiable los tejidos nasales casi totalmente intacta. Figura 2A muestra una imagen de la muestra nasal adulto de una cabeza de paraformaldehído-fijo. En esta muestra, los cuatro órganos sensoriales sub-olfativas, como el Ministerio de Educación, órgano septal, el ganglio Gruneberg y VNO, están intactos. Además, el epitelio respiratorio y tejidos subepiteliales, como las glándulas y vasos, se conservan. Hemos utilizado con éxito este método en un n...
Discusión
Aquí, hemos demostrado un procedimiento paso a paso para aislar el tejido olfativo y respiratoria intacta de la nariz del ratón mediante la eliminación secuencial de los huesos que rodean sin dañar el tejido de abajo. Se demuestra que la eliminación de hueso cuidadosa puede conservar incluso los tejidos más delicados en su totalidad. También compartimos la visión de las posibles modificaciones de esta técnica, en la que nos aislamos el cerebro y los tejidos nasales juntos para preservar la conexión nerviosa. E...
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Este trabajo fue apoyado por becas de investigación (NIH / NIDCD 009269, 012831 y ARRA administrativos suplemento subvenciones NIH) a Lin Weihong. Agradecemos especialmente al Sr. Tim Ford en UMBC por su asistencia técnica en la grabación en vídeo y procesamiento. También queremos dar las gracias al Dr. Blumberg Daphne, la Sra. Chere Petty en UMBC y el Sr. Nicholas McCollum de Olympus America Inc. por su asistencia equipos de videograbación.
Materiales
| Name | Company | Catalog Number | Comments |
| Dissection | |||
| Rongeur, 1.0 mm Jaw width | World Precision Instruments (WPI) | 501333 | |
| Fine forceps, Dumont 3 | WPI | 503235 | |
| Fine forceps, Dumont 55 | WPI | 14099 | |
| Fine forceps, Dumont AA | Fine Science Tools (FST) | 11210-20 | |
| Specimen forceps, Serrated | VWR | 82027-440 | |
| Operating scissors | WPI | 501753 | |
| Iris scissors, Straight | Miltex | V95-304 | |
| Dissection microscope | Olympus | SZ40 | |
| [header] | |||
| Tissue embedding | |||
| Optimum cutting temperature (OCT) compound | Sakura Finetek | 4583 | |
| Plastic embedding mold | VWR | 15160-215 | |
| Aspirator vacuum pump | Fisher Scientific | 09-960-2 | |
| [header] | |||
| Section staining | |||
| Neutral red | ACROS Organic | CAS 553-24-2 | Nuclei staining |
Referencias
- Naclerio, R. M., Pinto, J., Assanasen, P., Baroody, F. M. Observations on the ability of the nose to warm and humidify inspired air. Rhinology. 45, 102-111 (2007).
- Bjermer, L. The nose as an air conditioner for the lower airways. Allergy. 54, 26-30 (1999).
- Firestein, S. How the olfactory system makes sense of scents. Nature. 413, 211-218 (2001).
- Bryant, B., Silver, W. L. . Chemisthesis: The common chemical sense. , (2000).
- Gross, E. A., Swenberg, J. A., Fields, S., Popp, J. A. Comparative morphometry of the nasal cavity in rats and mice. J. Anat. 135, 83-88 (1982).
- Halpern, M. The organization and function of the vomeronasal system. Annu. Rev. Neurosci. 10, 325-362 (1987).
- Rodolfo-Masera, T. Su l'esquoestizenza di un particulare organo olfacttivo nel setto nasale della cavia e di altri roditori. Arch. Ital. Anat. Embryol. 48, 157-212 (1943).
- Levai, O., Strotmann, J. Projection pattern of nerve fibers from the septal organ: DiI-tracing studies with transgenic OMP mice. Histochemistry and Cell biology. 120, 483-492 (2003).
- Storan, M. J., Key, B. Septal organ of Gruneberg is part of the olfactory system. J. Comp. Neurol. 494, 834-844 (2006).
- Restrepo, D., Arellano, J., Oliva, A. M., Schaefer, M. L., Lin, W. Emerging views on the distinct but related roles of the main and accessory olfactory systems in responsiveness to chemosensory signals in mice. Horm. Behav. 46, 247-256 (2004).
- Breer, H., Fleischer, J., Strotmann, J. The sense of smell: multiple olfactory subsystems. Cell Mol. Life Sci. 63, 1465-1475 (2006).
- Munger, S. D., Leinders-Zufall, T., Zufall, F. Subsystem organization of the mammalian sense of smell. Annu. Rev. Physiol. 71, 115-140 (2009).
- Finger, T. E., St Jeor, V. L., Kinnamon, J. C., Silver, W. L. Ultrastructure of substance P- and CGRP-immunoreactive nerve fibers in the nasal epithelium of rodents. J. Comp. Neurol. 294, 293-305 (1990).
- Papka, R. E., Matulionis, D. H. Association of substance-P-immunoreactive nerves with the murine olfactory mucosa. Cell Tissue Res. 230, 517-525 (1983).
- Baraniuk, J. N., Kim, D. Nasonasal reflexes, the nasal cycle, and sneeze. Curr. Allergy Asthma Rep. 7, 105-111 (2007).
- Lin, W., Ogura, T., Margolskee, R. F., Finger, T. E., Restrepo, D. TRPM5-expressing solitary chemosensory cells respond to odorous irritants. J. Neurophysiol. 99, 1451-1460 (2008).
- Ogura, T., et al. Cholinergic microvillous cells in the mouse main olfactory epithelium and effect of acetylcholine on olfactory sensory neurons and supporting cells. J. Neurophysiol. 106, 1274-1287 (2011).
- Finger, T. E., et al. Solitary chemoreceptor cells in the nasal cavity serve as sentinels of respiration. Proceedings of the National Academy of Sciences of the United States of America. 100, 8981-8986 (2003).
- Gulbransen, B. D., Clapp, T. R., Finger, T. E., Kinnamon, S. C. Nasal solitary chemoreceptor cell responses to bitter and trigeminal stimulants in vitro. J. Neurophysiol. 99, 2929-2937 (2008).
- Zhao, K., Dalton, P., Yang, G. C., Scherer, P. W. Numerical modeling of turbulent and laminar airflow and odorant transport during sniffing in the human and rat nose. Chemical Senses. 31, 107-118 (2006).
- Ressler, K. J., Sullivan, S. L., Buck, L. B. A zonal organization of odorant receptor gene expression in the olfactory epithelium. Cell. 73, 597-609 (1993).
- Vassar, R., Ngai, J., Axel, R. Spatial segregation of odorant receptor expression in the mammalian olfactory epithelium. Cell. 74, 309-318 (1993).
- Fulle, H. J., et al. A receptor guanylyl cyclase expressed specifically in olfactory sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 92, 3571-3575 (1995).
- Juilfs, D. M., et al. A subset of olfactory neurons that selectively express cGMP-stimulated phosphodiesterase (PDE2) and guanylyl cyclase-D define a unique olfactory signal transduction pathway. Proceedings of the National Academy of Sciences of the United States of America. 94, 3388-3395 (1997).
- Lin, W., Arellano, J., Slotnick, B., Restrepo, D. Odors detected by mice deficient in cyclic nucleotide-gated channel subunit A2 stimulate the main olfactory system. The Journal of Neuroscience: The Official journal of the Society for Neuroscience. 24, 3703-3710 (2004).
- Ishii, T., Omura, M., Mombaerts, P. Protocols for two- and three-color fluorescent RNA in situ hybridization of the main and accessory olfactory epithelia in mouse. J. Neurocyt. 33, 657-669 (2004).
- Lee, A. C., Tian, H., Grosmaitre, X., Ma, M. Expression patterns of odorant receptors and response properties of olfactory sensory neurons in aged mice. Chemical Senses. 34, 695-703 (2009).
- Packard, A., Schnittke, N., Romano, R. A., Sinha, S., Schwob, J. E. DeltaNp63 regulates stem cell dynamics in the mammalian olfactory epithelium. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 31, 8748-8759 (2011).
- Matthews, J. B., Mason, G. I. Influence of decalcifying agents on immunoreactivity of formalin-fixed, paraffin-embedded tissue. Histochem J. 16, 771-787 (1984).
- Athanasou, N. A., Quinn, J., Heryet, A., Woods, C. G., McGee, J. O. Effect of decalcification agents on immunoreactivity of cellular antigens. J. Clin. Pathol. 40, 874-878 (1987).
- Hegg, C. C., Irwin, M., Lucero, M. T. Calcium store-mediated signaling in sustentacular cells of the mouse olfactory epithelium. Glia. 57, 634-644 (2009).
- Spehr, M., et al. Essential role of the main olfactory system in social recognition of major histocompatibility complex peptide ligands. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 26, 1961-1970 (2006).
- Ma, M., Chen, W. R., Shepherd, G. M. Electrophysiological characterization of rat and mouse olfactory receptor neurons from an intact epithelial preparation. J. Neurosci. Methods. 92, 31-40 (1999).
- Cygnar, K. D., Stephan, A. B., Zhao, H. Analyzing responses of mouse olfactory sensory neurons using the air-phase electroolfactogram recording. J. Vis. Exp. (37), e1850 (2010).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J. Vis. Exp. (65), e3564 (2012).
- Lin, W., Margolskee, R., Donnert, G., Hell, S. W., Restrepo, D. Olfactory neurons expressing transient receptor potential channel M5 (TRPM5) are involved in sensing semiochemicals. Proceedings of the National Academy of Sciences of the United States of America. 104, 2471-2476 (2007).
- Lin, W., Ezekwe, E. A., Zhao, Z., Liman, E. R., Restrepo, D. TRPM5-expressing microvillous cells in the main olfactory epithelium. BMC Neurosci. 9, 114 (2008).
- Ogura, T., Krosnowski, K., Zhang, L., Bekkerman, M., Lin, W. Chemoreception regulates chemical access to mouse vomeronasal organ: role of solitary chemosensory cells. PLoS One. 5, e11924 (2010).
- Sathyanesan, A., Feijoo, A. A., Mehta, S. T., Nimarko, A. F., Lin, W. Expression profile of G-protein βγ subunit gene transcripts in the mouse olfactory sensory epithelia. Frontiers in Cellular Neuroscience. 7, 84 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados