Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Эффективный метод обвалки Руководство Подготовиться Интактные Мышь носовой ткани с сохранением анатомической организации
* Эти авторы внесли равный вклад
В этой статье
Резюме
Аннотация
Млекопитающих нос многофункциональный орган со сложными внутренними структурами. Полость носа выстлана эпителием различные, такие как обонятельные, дыхательной и плоского эпителия которые существенно отличаются по анатомической локализации, морфологии и функции. У взрослых мышей, нос покрыты различными костей черепа, ограничивающий экспериментальных доступ к внутренней структуре, особенно в задней такие как основной обонятельный эпителий (МО). Здесь мы опишем эффективный метод получения почти весь и сохранности носовых тканей с сохранением анатомической организации. Использование хирургических инструментов при вскрытии микроскопом, мы последовательно удалить кости черепа окружающих тканей носа. Эта процедура может быть выполнена как на параформальдегиде фиксированной и недавно рассеченные, кожей руководители мыши. Вся процедура обвалки занимает приблизительно 20-30 мин, что значительно меньше, чем экспериментальный время, необходимое для обычной химической основе декальцификации. Кроме того, мы представляем простой способ для удаления пузырьков воздуха в ловушке между носовыми раковинами, которая имеет решающее значение для получения нетронутыми тонких горизонтальных или корональной или сагиттальных срезах из носовых подготовки ткани. Носовые ткани получают, используя наш метод может быть использован для наблюдения целого горе всей эпителия, а также морфологические, иммуноцитохимической, РНК в гибридизация и физиологических исследований, особенно в области исследований, в которых конкретные обследования и сравнения представляют интерес.
Введение
Млекопитающих носовую полость содержит различные типы тканей и органов, которые служат различные функции. Носовой полости находится в передней части верхних дыхательных путей, что позволяет воздушным транспортом в и из легких. Ингаляционный воздух проходит через носовую полость, где он подвергается температуры и влажности воздуха 1, а также очистки или фильтрации для удаления раздражающих и токсичных веществ и инфекционные микроорганизмы 2. Обе процедуры осуществляются в виде назального эпителия и субэпителиальные тканей, в том числе желез и сосудов и критически важно для защиты нижних дыхательных путей и легких. В дополнение к его роль в дыхании и эпителиальных защиты, носовой ткани также содержит периферических сенсорных аппаратов обонятельной и тройничного систем, которые обнаружить широкий диапазон химических веществ в прохождении воздуха. В зависимости от системы, которая активирована, сенсорных обнаружения химических веществ в носу может вызвать либоОбоняние, раздражение или боль 3,4.
Периферийные обонятельная система сложна и состоит из нескольких анатомически отделены обонятельной сенсорных органов в полости носа. Среди них, основной обонятельный эпителий (МО) является самым большим, что составляет примерно 45-52% от назальный эпителий у грызунов 5 и расположена в задней области. В антеровентральном область, имеется пара трубчатых структур, известных как вомероназальный орган 6, который сидит вдоль каждой стороны носовой перегородки. Два дополнительных небольшими группами обонятельные сенсорные нейроны, известные как перегородки орган Masera 7,8 и 9 ганглий Грюнберг, проживающие вдоль вентральной перегородки и области спины входа полости носа соответственно. Эти периферические органы содержат нейроэпителий с отличительными особенностями в морфологии, экспрессии в клетках маркера, и физиологические функции. Вместе они обнаруживают тысячи запаховМолекулы с изысканной чувствительностью 10-12.
В дополнение к обонятельные органы чувств, носовой полости также находится других сенсорных систем. Известно, что пептидергические тройничного нерва волокна присутствуют в назальный эпителий, особенно дыхательный эпителий 13,14. Некоторые из этих волокон обнаружить раздражающих и токсичных химических веществ и ответственны за введение защитных рефлексов, таких как кашель и чихание 4,15. Раздражает пахучих и горьких соединений может быть обнаружена и на недавно обнаруженной населения хемосенсорным одиночные клетки (СОС), многие из которых иннервируются нервными волокнами тройничного 16-19. Эти кластеры с единым хранилищем находятся в более высокой плотности в записи область носовой полости и каналы вомероназальной входа, намекая, что они могут также выполняют защитную функцию 16-18. Таким образом, назальный эпителий может существенно отличаться в зависимости, морфологии и клеточного состава в зависимости от иханатомических местах.
Даже в пределах одного и специализированного эпителия, существуют региональные различия. МЧС является одним из таких примеров. МЧС линий различных раковин, которые сложны и свернулся структур. Из-за них, в разных частях МЧС опыт различных скоростях потока воздуха, и, таким образом, различные диффузии и освобожденных в воздухе молекулами запаха 20. Кроме того, известно, что обонятельной сенсорных нейронов (OSNs) экспрессии данного запах рецептор находится в одном из четырех обход зоны МО 21,22. Как это место разница влияет на ответы OSN на пахучие вещества в значительной степени неизвестны. Кроме того, некоторые OSN населения проявляют региональные предпочтения. Гуанилилциклазы-D (GC-D)-экспрессирующих OSNs имеют зональное распределение в пользу куль-де-мешок регионах ectoturbinates 23,24. Совсем недавно мы нашли субпопуляции канонической OSNs который выражает переходный рецепторный потенциал канала M5 (TRБДМ-5) и преимущественно расположены в поперечной и вентральной области 25. Эти результаты показывают, что МЧС не является единообразной. Тем не менее, как эти региональные различия влияют на обонятельные кодирование не поняли. Это отчасти потому, что тщательное физиологическое исследование МЧС и носа была ограничена трудностью получения нетронутыми носового эпителия с сохранением анатомической организации с использованием современных методов.
Носового эпителия преимущественно окруженный передних костей черепа, в том числе носовой, верхней челюсти, небных, скуловых и решетчатой костей. У взрослых мышей и других грызунов моделей, эти кости твердые и трудно удалить, не повреждая тесно связаны носовые ткани, в частности тонких раковин. Часто, на основе химических декальцинации используется для смягчения костей, чтобы cryosectioning носовых тканей для морфологического, иммуногистохимического и полевых исследованиях гибридизации, однако, зависимостьмости от возраста животного, декальцинации процесс может длиться в течение ночи до 7 дней 24,26-28. Это лечение также ограничена, поскольку она требует быть фиксатора ткани сохранились. Кроме того, химические декальцинации могут быть резкими и влияют на иммунную некоторых чувствительных антител 29,30. Для физиологических исследований, живой ткани не требуется, и, таким образом, эти эксперименты часто проводятся на изолированных OSNs МЧС или ломтиками, полученные из новорожденных, кости черепа тонкие и мягкие 17,31,32. Физиологические исследования могут также использовать весь препараты горе, разделив голову 25,33,34, но обычно только медиальной поверхности носа легко доступна, ограничивая физиологических записей на других областях.
Здесь мы описываем эффективные, ручной метод обвалки подготовить нетронутыми носовых тканей с сохранением оригинальной анатомической организации и морфологии. Мы последовательно удалить основные кости переднейЧереп при вскрытии микроскоп, чтобы подвергать почти полностью нетронутым носовом эпителии, сохраняя при этом тонкие кости носовой раковины нетронутым, если мыши не очень старые и cryosectioning необходима. Мы также распространить метод сохранить соединение между носовой ткани и обонятельной луковицы, а также в остальной части мозга, способствуя тем самым одновременном рассмотрении и периферических и центральных схем. Наш метод может быть использован для получения параформальдегиде-фиксированных, а также свежие, живые тканей носа. Таким образом, наш метод, как ожидается, для облегчения морфологических, иммуногистохимических и физиологические исследования дыхания, обоняния и носового повреждения и болезни.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Подготовка Мышь Нос
Мы использовали взрослые фоне C57BL / 6 мышей в этом исследовании. Все по уходу за животными и процедуры утверждаются уходу и использованию животных комитета (IACUC) из Университета штата Мэриленд, округ Балтимор.
1.1 Приобретение нос от параформальдегида фиксированной мышей
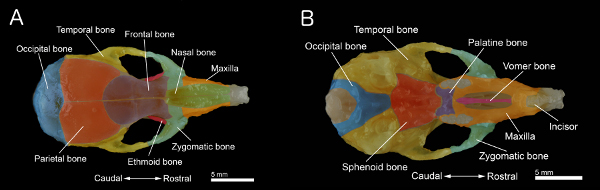
Рисунок 1. Кости черепа мыши:. Спинной части черепа B:. Вентральной части черепа с нижней челюсти удалены. Череп был изготовлен из 40-дневных мышей. Отдельных костей окрашены для лучшей визуализации. Нажмите здесь, чтобы увеличить рисунок .
- Заливать транскардиально исправить отдельных мышей после йэлектронной протокол Лин и др.., (2008) 16. Вкратце, мышей глубокой анестезии с трибромэтанола (Авертен 250 мкг / г массы тела), транскардиальной перфузии с помощью 0,1 М фосфатном буфере (PB, 30-50 мл), а затем фосфатным буфером фиксатора, содержащего 3% параформальдегида, 19 мМ L-лизина моногидрохлорида и 0,23%-ного т-периодат (примерно 35-50 мл). Можно также следуйте Юпитера статью для животных перфузии 35.
- Используйте ножницы, чтобы отрезать нижнюю челюсть (или нижней челюсти) и снимите кожу на голове.
- Отдельные всей головы от остальной части тела.
- Снимите неба. Кроме того, очистки и удаления оставшегося соединительной ткани и мышцы на поверхности черепа, чтобы получить образец показано на фиг.1А и 1В.
- Под микроскопом рассечение, удалить кости черепа охватывающих мозга и обонятельных луковиц. Обрежьте лишнюю ткань и кости. НетТе, для расширенной подготовки ткани, в которой мозга и нос остаются соединенными, только кости черепа удаляются. Для иммуногистохимического экспериментов, ткань была после фиксированной в течение 1,5 часа и передаются в 0,1 М фосфатно-солевом буфере (PBS) с 25%-ной сахарозы в течение ночи. Носовые ткани должна быть увлажненной в течение вскрытия путем погружения его в буферный раствор сахарозы несколько раз.
1.2 Приобретение носа из свежего эвтаназии мышей
- Индивидуальные мышей переносили в чистую клетку и подвергается газообразного СО 2, за которым последовало цервикальной дислокации через 5 мин после последнего дыхания. Чтобы уменьшить крови в ткани носа, используйте ножницы, чтобы открыть сундук и вырезать сердце, чтобы позволить крови стечь.
- Повторите шаги 1.1.2 1.1.5, за исключением после фиксации и криозащиты с 25% сахарозы. Образец должен быть увлажненным и поддерживается с физиологическим раствором, содержащим Тирода (в мМ): 140 NaCl, 5 KCl, 1 MgCl 2, 1 CaCl 2, 10 пирувата Na, 10 D-глюкозы и 10 N-2-гидроксиэтилпиперазин-N'-2-этансульфоновой кислоты буфера (HEPES, регулируется при рН 7,4). Кроме того, сложите кусок Kimwipes, смочите его с решением Тирода, и место под образцом в то время рассечения и иногда погружаюсь образца в растворе Тирода или отказаться от ряда раствор на ткань, чтобы сохранить его увлажненным для поддержания жизнеспособности клеток и тканей .
2. Резец, Передней Vomer и удаление верхней челюсти кость
- Начните с вентральной точки зрения. Местонахождение сошник кости и разорвать сошник кости вдоль ее длины использованием костные кусачки или щипцы с зубами разорвать вентральной большую часть кости.
- Использование зубчатые щипцы, удалить поврежденную сегментов уотег кости, осторожно курсирующих костных фрагментов от вомероназальный орган (ВНО). Обратите внимание, что для мышей меньше, чем месяц назад, или если только заинтересованные в МЧС, эти два StePS может быть пропущен.
- Держите голову твердо щипцами. Использование костные кусачки нарушить передней части обоих резцов и соединенные области передней верхней челюсти двух резцов и сошника кости.
- Перерыв брюшной части правой верхней челюсти в области расположенной кпереди от скуловой дуги до уровня скуловой спинной пластины.
- Переверните нос спинной точки зрения. Используйте костными кусачками сломать правую переднем отделе верхней челюсти дорсальной скуловой пластины. Вся правая переднем отделе верхней челюсти скуловой пластина должна быть свободной. Используйте тонкий пинцет, чтобы аккуратно отделить любой носовой ткани, лежащие на верхней челюсти, а затем слегка приподнимите от костного фрагмента.
- Повторите этапы 2.4 и 2.5, чтобы ослабить левый резца и левой передней верхней и удалить их после носовой кости был удален.
3. Носовая кость и спинного скуловой съемника
- Используйте зубчатыми щипцами или костными кусачками повторнопереместить остаток лобной кости только каудально к носовой кости. После удаления этой части кости, каудальной части носовой кости может быть захвачен с помощью щипцов.
- Использование костные кусачки разорвать передней части скуловой кости, который подключен к скуловой пластины.
- Возьмем тонких щипцов на боковой кромке спинной части скуловой пластины и осторожно перевернуть кости и удалить его. Если кость не теряет, используйте костными кусачками зажать ее аккуратно протирая его удалить.
- Использование тонких щипцов или лезвие, чтобы ослабить медиального шва между правой и левой носовых костей.
- Используйте зубчатые щипцы для захвата хвостового конца правой носовой кости. Аккуратно переместите кость из стороны в сторону, чтобы отделить его от основной ткани. Это полезно для перемещения щипцы вдоль хвостовой треть носовой кости для перемещения костей стороны в сторону. В носовой кости отделяет, медленно поднимите кости от хвостового конца.
- В то время как Tон носовой кости слегка поднял, наклоните кости сбоку, чтобы показать боковое обнажение кости, которая выстлана тонкой эпителиальной ткани дыхательных. Используйте тонкий пинцет, чтобы стравить этой ткани из носовой кости. Продолжайте поднимать носовую кость. Когда кость полностью отделена от основной ткани, используйте ножницы, чтобы отрезать носовой кости на ростральные конца.
- Повторите шаги 3.1, 3.5 и 3.6 для удаления левой носовой кости.
- Повторите этапы 3.2 и 3.3 на левой стороне носа.
4. Боковые скуловой съемника
- Снимите пластину скуловой одну сторону за один раз. Либо скуловой пластины могут быть удалены в первую очередь.
- С вентральной точки зрения, разорвать челюсти уступают скуловой дуге, пока снова не достигает скуловой дуги.
- От спинного точке зрения, мягко захватите скуловой дуги и поднимите вперед и боковые. Если скуловой пластина еще привязаны к любой ткани, взять штрафщипцов и аккуратно разъединить эти связи между тканью и костью.
- Повторите для скуловой пластины на другую сторону носа.
5. Удаление Orbit костей
- С вентральной точки зрения, разорвать Palantine кости между коренными зубами носа.
- Использование костные кусачки разорвать 3 коренные зубы и челюсти с каждой стороны носа.
- Перерыв и удаления любого оставшегося толстой части кости вентральной и задней с раковин на каждой стороне носа.
6. Решетчатая удаления костей
- Перерыв любую часть решетчатой кости выступающие каудальнее раковин. Это необходимо, чтобы избежать потери ткани носовых раковин при удалении тонких кусочков решетчатой кости охватывающих раковин.
- Для правой стороне носа, поместите тонкий пинцет на переднем краю решетчатой кости и аккуратно снимите ее. Если часть кости остается не повторить эту процедуру, пока всетонких костей покрытие раковин был удален. Носовой кости не должны быть удалены в большинстве препаратов. В старых мышей, решетчатой пластины становится хрупким. Если cryosectioning из тканей носа необходимо, удалить небольшие кусочки пластины с тонким пинцетом, чтобы уменьшить потенциальный ущерб от кости.
- Повторите шаг 6.2) для левой стороны носа.
- Удалите все оставшиеся фрагменты костей до секционирования. Примечание: у животных больше, чем летний, постеродорсальной области перегородки кости несколько толстые и твердые. Можно удалить эту часть с использованием тонких щипцов. Вставьте кончик пинцетом в обе стороны кость отделить спинной части кости перегородки и подкладка эпителиальной ткани. Используйте одну пару щипцов, чтобы захватить и удерживать кости образца. Используйте другой парой щипцов пробить верхнюю часть костных от нижней хрящевой части перегородки и аккуратно извлеките ее.
7. Нос Подготовка к Cryosectioning
- Установка насоса вакуум при помощи отсасывания.
- Поместите в нос вложение формы. Погрузите носом в ОСТ СМИ.
- С помощью пылесоса, чтобы удалить пузырьки воздуха в ловушке внутри носа ткани. Этот процесс занимает до 5 мин.
- После удаления пузырьков воздуха, установите ткани в требуемом направлении.
- Заморозить ОСТ и ткани в форме с использованием сухого льда. Встроенный ткани может быть затем cryosectioned непосредственно или хранили при -80 ° С для последующего использования.
Access restricted. Please log in or start a trial to view this content.
Результаты
Используя этот метод, мы можем гарантированно получить почти полностью нетронутым тканей носа. 2А показывает изображение взрослого носовые образца у параформальдегиде фиксированной голове. В этом образце, все четыре суб-обонятельные органы чувств, в том числе МЧС, перегородк...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Здесь мы показали, шаг за шагом способ выделения нетронутыми обонятельной и дыхательной ткани от мыши носа путем последовательного удаления окружающих костей при щадящем ткани ниже. Мы покажем, что тщательное удаление кости может сохранить даже самые деликатные ткани в полном объеме....
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана грантами исследований (NIH / NIDCD 009269, 012831 и ARRA административных дополнения NIH гранты) Weihong Лин. Мы особенно благодарны г-н Тим Форд на UMBC за техническую помощь в видеозаписи и обработки. Мы также хотели бы поблагодарить доктора Дафна Блумберг, г-жа Шер Петти в UMBC и г-н Николас McCollum с Олимпа Америка Инк для их оборудования помощь в видеозаписи.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Dissection | |||
| Rongeur, 1.0 mm Jaw width | World Precision Instruments (WPI) | 501333 | |
| Fine forceps, Dumont 3 | WPI | 503235 | |
| Fine forceps, Dumont 55 | WPI | 14099 | |
| Fine forceps, Dumont AA | Fine Science Tools (FST) | 11210-20 | |
| Specimen forceps, Serrated | VWR | 82027-440 | |
| Operating scissors | WPI | 501753 | |
| Iris scissors, Straight | Miltex | V95-304 | |
| Dissection microscope | Olympus | SZ40 | |
| [header] | |||
| Tissue embedding | |||
| Optimum cutting temperature (OCT) compound | Sakura Finetek | 4583 | |
| Plastic embedding mold | VWR | 15160-215 | |
| Aspirator vacuum pump | Fisher Scientific | 09-960-2 | |
| [header] | |||
| Section staining | |||
| Neutral red | ACROS Organic | CAS 553-24-2 | Nuclei staining |
Ссылки
- Naclerio, R. M., Pinto, J., Assanasen, P., Baroody, F. M. Observations on the ability of the nose to warm and humidify inspired air. Rhinology. 45, 102-111 (2007).
- Bjermer, L. The nose as an air conditioner for the lower airways. Allergy. 54, Suppl 57. 26-30 (1999).
- Firestein, S. How the olfactory system makes sense of scents. Nature. 413, 211-218 (2001).
- Bryant, B., Silver, W. L. Chemisthesis: The common chemical sense. , 2nd, Wiley-Liss. (2000).
- Gross, E. A., Swenberg, J. A., Fields, S., Popp, J. A. Comparative morphometry of the nasal cavity in rats and mice. J. Anat. 135, 83-88 (1982).
- Halpern, M. The organization and function of the vomeronasal system. Annu. Rev. Neurosci. 10, 325-362 (1987).
- Rodolfo-Masera, T. Su l'esquoestizenza di un particulare organo olfacttivo nel setto nasale della cavia e di altri roditori. Arch. Ital. Anat. Embryol. 48, 157-212 (1943).
- Levai, O., Strotmann, J. Projection pattern of nerve fibers from the septal organ: DiI-tracing studies with transgenic OMP mice. Histochemistry and Cell biology. 120, 483-492 (2003).
- Storan, M. J., Key, B. Septal organ of Gruneberg is part of the olfactory system. J. Comp. Neurol. 494, 834-844 (2006).
- Restrepo, D., Arellano, J., Oliva, A. M., Schaefer, M. L., Lin, W. Emerging views on the distinct but related roles of the main and accessory olfactory systems in responsiveness to chemosensory signals in mice. Horm. Behav. 46, 247-256 (2004).
- Breer, H., Fleischer, J., Strotmann, J. The sense of smell: multiple olfactory subsystems. Cell Mol. Life Sci. 63, 1465-1475 (2006).
- Munger, S. D., Leinders-Zufall, T., Zufall, F. Subsystem organization of the mammalian sense of smell. Annu. Rev. Physiol. 71, 115-140 (2009).
- Finger, T. E., St Jeor, V. L., Kinnamon, J. C., Silver, W. L. Ultrastructure of substance P- and CGRP-immunoreactive nerve fibers in the nasal epithelium of rodents. J. Comp. Neurol. 294, 293-305 (1990).
- Papka, R. E., Matulionis, D. H. Association of substance-P-immunoreactive nerves with the murine olfactory mucosa. Cell Tissue Res. 230, 517-525 (1983).
- Baraniuk, J. N., Kim, D. Nasonasal reflexes, the nasal cycle, and sneeze. Curr. Allergy Asthma Rep. 7, 105-111 (2007).
- Lin, W., Ogura, T., Margolskee, R. F., Finger, T. E., Restrepo, D. TRPM5-expressing solitary chemosensory cells respond to odorous irritants. J. Neurophysiol. 99, 1451-1460 (2008).
- Ogura, T., et al. Cholinergic microvillous cells in the mouse main olfactory epithelium and effect of acetylcholine on olfactory sensory neurons and supporting cells. J. Neurophysiol. 106, 1274-1287 (2011).
- Finger, T. E., et al. Solitary chemoreceptor cells in the nasal cavity serve as sentinels of respiration. Proceedings of the National Academy of Sciences of the United States of America. 100, 8981-8986 (2003).
- Gulbransen, B. D., Clapp, T. R., Finger, T. E., Kinnamon, S. C. Nasal solitary chemoreceptor cell responses to bitter and trigeminal stimulants in vitro. J. Neurophysiol. 99, 2929-2937 (2008).
- Zhao, K., Dalton, P., Yang, G. C., Scherer, P. W. Numerical modeling of turbulent and laminar airflow and odorant transport during sniffing in the human and rat nose. Chemical Senses. 31, 107-118 (2006).
- Ressler, K. J., Sullivan, S. L., Buck, L. B. A zonal organization of odorant receptor gene expression in the olfactory epithelium. Cell. 73, 597-609 (1993).
- Vassar, R., Ngai, J., Axel, R. Spatial segregation of odorant receptor expression in the mammalian olfactory epithelium. Cell. 74, 309-318 (1993).
- Fulle, H. J., et al. A receptor guanylyl cyclase expressed specifically in olfactory sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 92, 3571-3575 (1995).
- Juilfs, D. M., et al. A subset of olfactory neurons that selectively express cGMP-stimulated phosphodiesterase (PDE2) and guanylyl cyclase-D define a unique olfactory signal transduction pathway. Proceedings of the National Academy of Sciences of the United States of America. 94, 3388-3395 (1997).
- Lin, W., Arellano, J., Slotnick, B., Restrepo, D. Odors detected by mice deficient in cyclic nucleotide-gated channel subunit A2 stimulate the main olfactory system. The Journal of Neuroscience: The Official journal of the Society for Neuroscience. 24, 3703-3710 (2004).
- Ishii, T., Omura, M., Mombaerts, P. Protocols for two- and three-color fluorescent RNA in situ hybridization of the main and accessory olfactory epithelia in mouse. J. Neurocyt. 33, 657-669 (2004).
- Lee, A. C., Tian, H., Grosmaitre, X., Ma, M. Expression patterns of odorant receptors and response properties of olfactory sensory neurons in aged mice. Chemical Senses. 34, 695-703 (2009).
- Packard, A., Schnittke, N., Romano, R. A., Sinha, S., Schwob, J. E. DeltaNp63 regulates stem cell dynamics in the mammalian olfactory epithelium. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 31, 8748-8759 (2011).
- Matthews, J. B., Mason, G. I. Influence of decalcifying agents on immunoreactivity of formalin-fixed, paraffin-embedded tissue. Histochem J. 16, 771-787 (1984).
- Athanasou, N. A., Quinn, J., Heryet, A., Woods, C. G., McGee, J. O. Effect of decalcification agents on immunoreactivity of cellular antigens. J. Clin. Pathol. 40, 874-878 (1987).
- Hegg, C. C., Irwin, M., Lucero, M. T. Calcium store-mediated signaling in sustentacular cells of the mouse olfactory epithelium. Glia. 57, 634-644 (2009).
- Spehr, M., et al. Essential role of the main olfactory system in social recognition of major histocompatibility complex peptide ligands. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 26, 1961-1970 (2006).
- Ma, M., Chen, W. R., Shepherd, G. M. Electrophysiological characterization of rat and mouse olfactory receptor neurons from an intact epithelial preparation. J. Neurosci. Methods. 92, 31-40 (1999).
- Cygnar, K. D., Stephan, A. B., Zhao, H. Analyzing responses of mouse olfactory sensory neurons using the air-phase electroolfactogram recording. J. Vis. Exp. (37), e1850(2010).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J. Vis. Exp. (65), e3564(2012).
- Lin, W., Margolskee, R., Donnert, G., Hell, S. W., Restrepo, D. Olfactory neurons expressing transient receptor potential channel M5 (TRPM5) are involved in sensing semiochemicals. Proceedings of the National Academy of Sciences of the United States of America. 104, 2471-2476 (2007).
- Lin, W., Ezekwe, E. A., Zhao, Z., Liman, E. R., Restrepo, D. TRPM5-expressing microvillous cells in the main olfactory epithelium. BMC Neurosci. 9, 114(2008).
- Ogura, T., Krosnowski, K., Zhang, L., Bekkerman, M., Lin, W. Chemoreception regulates chemical access to mouse vomeronasal organ: role of solitary chemosensory cells. PLoS One. 5, e11924(2010).
- Sathyanesan, A., Feijoo, A. A., Mehta, S. T., Nimarko, A. F., Lin, W. Expression profile of G-protein βγ subunit gene transcripts in the mouse olfactory sensory epithelia. Frontiers in Cellular Neuroscience. 7, 84(2013).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены