Method Article
Cryo-Microscopía Electrónica de Preparación de Muestras por medio de un haz de iones focalizados
En este artículo
Resumen
Cryo microscopios electrónicos, ya sea de barrido (SEM) o transmisión (TEM), son ampliamente utilizados para la caracterización de las muestras biológicas o de otros materiales con un alto contenido de agua 1. Un SEM / haz de iones focalizados (FIB) se utiliza para identificar las características de interés en muestras y extraer una lámina delgada, transparente-de electrones para la transferencia a un crio-TEM.
Resumen
Aquí presentamos un protocolo que se utiliza para preparar las muestras de crio-TEM de esporas de Aspergillus niger, pero que se puede adaptar fácilmente para cualquier número de microorganismos o soluciones. Hacemos uso de una estación de transferencia de la crio-hecha a la medida y una cámara de preparación de la crio-SEM modificado 2. Las esporas se toman de una cultura, hundir-congelado en un granizado de nitrógeno líquido y se observa en la crio-SEM para seleccionar una región de interés. Una laminilla fina se extrae a continuación con el FIB, que se adjunta a una rejilla TEM y posteriormente diluido con electrones transparencia. La rejilla se transfiere a un soporte de crio-TEM y en un TEM para estudios de alta resolución. Gracias a la introducción de una punta nanomanipulador enfriado y una estación de crio-transferencia, este protocolo es una adaptación sencilla a temperatura criogénica de la preparación FIB utilizado rutinariamente de muestras TEM. Como tal, tiene la ventaja de que requiere una pequeña cantidad de modificaciones de instrumentos, configuraciones y procedimientos existentes; que is fácil de implementar; que tiene una amplia gama de aplicaciones, en principio, el mismo que para la preparación de muestras crio-TEM. Una limitación es que se requiere de un manejo hábil de las muestras en las etapas decisivas para evitar o reducir al mínimo la contaminación.
Introducción
En este protocolo una cryo-FIB/SEM se utiliza para producir muestras de TEM de una región específica de la muestra, previamente identificado con alta precisión por análisis SEM. La microscopía electrónica (de barrido o de transmisión) análisis de muestras biológicas es una técnica de rutina utilizada para la investigación y de diagnóstico. SEM es bastante rápido y fácil de emplear e interpretar, pero la información se obtiene sólo desde la superficie de la muestra y con una resolución en el rango de 1,5 nm. TEM tiene una resolución más alta, pero es más difícil de poner en práctica, el análisis de la imagen es menos directa y que la información se obtiene a granel, las muestras tienen que ser diluido con electrones transparencia (menos de aproximadamente 500 nm de espesor). Un problema adicional es que los requisitos de vacío de esos instrumentos son raramente tolerados por las muestras que contienen agua. En la mayoría de los casos, las muestras biológicas tienen que ser ya sea fija químicamente (sustituyendo agua con, por ejemplo, polímeros) o seca. En ambos casos, los cambios significativos en ella morfología y la estructura de la muestra es probable que ocurran. Preparación de Cryo TEM de las muestras hidratadas induce cambios químicos mínimos y produce muestras lo más cerca posible a su estado nativo, especialmente si se obtiene la vitrificación de hielo 1-6.
La FIB es ampliamente utilizado para preparar las muestras TEM por sus numerosas ventajas 7. Para nombrar algunos: el uso de iones de alta energía con incidencia casi normal minimiza el efecto de las tasas de molienda diferenciales relacionados con el material; la región se extrae de la muestra a granel se puede elegir con una precisión inferior a la micra; se extrae una cantidad muy pequeña de material. Algunos avances técnicos recientes han hecho posible el uso de la FIB también para la preparación de muestras TEM a temperaturas criogénicas 2,8-10. Hay varias ventajas sobre el método de preparación tradicional de crio-microtomía 11,12 utilizado principalmente para muestras de materia blanda, tales como la falta de deformación mecánica de la lámina en rodajas,la ausencia de marcas de cuchillo y la posibilidad de preparar muestras compuestas con interfaces o componentes duros / blandos.
Protocolo
Nota: Todos los parámetros que se indican en este protocolo son válidas para los instrumentos y modelos indicados aquí. Algunos de esos parámetros (marcadas con * en el texto) puede ser diferente si se utiliza otro fabricante o modelo.
1. Puesta en marcha de la FIB / SEM
- Monte el nanomanipulador fría hecha a la medida (NM) de punta sin asociar las trenzas de Cu a la anticontaminator (AC). En lugar asegurarse de que las trenzas están conectados al resto de la NM encima del punto de aislante para evitar la carga durante la etapa de afilado (1.2).
- Cierre la cámara de SEM, la bomba de alto vacío y la imagen de la punta NM.
- Si la punta es roma, doblados o contaminados por uso previo, afinarlo por medio del haz de iones: seleccionar patrones de fresado poligonales a lo largo de los lados de la punta, por lo que después de la molienda, la punta se estrechará hasta 1 mo menos.
- Una vez que los lados de la punta se han blanqueado de distancia, girar manualmente por 90 ° toda la varilla NMdesde fuera de la cámara de SEM.
- Ajuste las pautas de fresado poligonales para adaptarse a la punta girada y repetir la molienda desde un ángulo diferente.
- Una vez que la punta se ha agudizado a ser inferior a 1 micra, retraer el NM e inserte la aguja del Sistema de inyección de gas (GIS); cambiar la posición de la aguja para estar en alrededor de 1 mm por encima de la distancia de trabajo (en lugar de los habituales 175 micras).
- Si se utiliza un precursor Pt, cambiar su temperatura de funcionamiento de 24 a 26 ° C (en lugar de los habituales 40 º C). Estos pasos son necesarios para la crio-depósito 13 de la pinta.
- Abra la cámara de SEM y preparar la FIB / SEM para el modo crio montando el escenario muestra crio y el aire acondicionado.
- Cambie el NM a la posición insertada y conecte sus trenzas Cu a la AC. Asegúrese de no tocar accidentalmente la punta NM. El sistema se enfría con el NM insertado para asegurarse de que la pérdida de flexibilidad de la trenza de Cu a temperaturas criogénicas no obstaculizará el movimiento NMMent.
- Purgar los tubos para la refrigeración con gas nitrógeno seco durante unos minutos.
- Bombear la cámara de preparación de la crio y la cámara muestra principal a alto vacío.
- Añadir nitrógeno líquido para enfriar los Dewars ambas cámaras. Esperar hasta que se alcanza la temperatura deseada.
2. La congelación de la muestra
- Montar dos rejillas TEM para muestras FIB en el soporte de transferencia de SEM. Asegúrelos apretando los tornillos correspondientes con un destornillador.
- Montar una muestra de código auxiliar apropiado para la muestra y añadir una porción de la muestra. Dependiendo del tipo de sangre, las muestras pueden ser fijados con pegamento criogénico o con una abrazadera. Use cantidades tan pequeñas como sea posible para asegurar la congelación óptima.
- Monte el soporte de transferencia de SEM en el dispositivo de transferencia de vacío (ETV).
- Añadir nitrógeno líquido en la estación de antióxido y bombee hasta obtener aguanieve nitrógeno.
- Abra la slestación ushing y de inmersión congelar el titular de la transferencia SEM. Bomba de nuevo hasta que hierva se completa y se obtiene aguanieve nuevo. Cabe señalar que un etano o propano aguanieve o de congelación de alta presión son las técnicas más adecuadas para obtener la vitrificación de la muestra.
- Repliegue el titular de la transferencia SEM en la cámara de vacío de la ETV y sellarlo.
- Ventile la estación slushing y la esclusa de aire cámara de preparación de crio.
- Coincidir con el sello de ETV con la esclusa de aire de la cámara de preparación crio y la bomba.
- Cuando se alcanza un buen nivel de vacío, enganche el pasador de bolsa de aire para abrir el sello de la ETV y la esclusa de aire exterior; inserte el soporte de transferencia de SEM. Hay marcas en los cursores en las cámaras de preparación que indican la posición de la muestra para la farfulla y la fracturación.
- Si es necesario, la muestra puede ser: fracturó con el cuchillo frío; sublimado mediante el establecimiento de una temperatura más alta (por lo general -1006; C); recubiertos con Au / Pd o Pt por medio de la tartamudo frío (300 V, 10 mA, 60 seg para un 2-3 nm tapa de Au / Pd) *. Sublimación no debe utilizarse para las muestras vitrificados para evitar su recristalización.
- Utilice el cuchillo frío para abrir las tapas protectoras de las ranuras de rejilla TEM.
- Traiga la etapa de frío en el compartimento de medición a la altura de recepción (16 mm *).
- Apague el HT en el FIB / SEM y abra la esclusa de aire interior.
- Utilice la ETV para transferir el soporte de SEM en la cámara de muestra. Cómo atenuar la iluminación de la habitación puede ayudar en este paso.
- Una vez que el titular de la SEM se encuentra en la etapa de frío, desenganchar el VTD empujando y girando.
- Retirar la varilla de ETV hasta el final en la cámara de vacío VTD y cerrar la esclusa de aire interior, la esclusa de aire exterior y el sello de la ETV. La esclusa de aire exterior ahora se puede ventilar para retirar el sello ETV. No se requiere este último paso, pero se recomienda que la varilla ETV puede ser fácilmente desplazado por accidente, lo que puede causar dañosa la ETV o la esclusa.
3. Ion de fresado
- Encienda la alta tensión en ambas columnas y establecer los parámetros de imagen apropiadas (tensión de aceleración: 10 kV para el haz de electrones, 30 kV para el haz de iones; tamaño de punto: 3; distancia de trabajo: 5 mm, corriente de haz de iones: 10-100 pA para imágenes, 1-3 nA para fresado) *.
- Utilice el haz de electrones para encontrar una característica de interés y para adquirir imágenes para documentar el estado de la muestra antes de la extracción de la lámina.
- Una vez que una región de interés (ROI) para la extracción ha sido identificado, marcarlo por el patrón de haz de iones, a menos que la topografía de la muestra en sí permite una fácil identificación de la ROI, incluso después de la deposición de Pt. Para una mayor precisión, utilizar el método descrito por Pettersson et al. 14 Las marcas deben ser profunda, amplia y lo suficientemente lejos para ser todavía visibles después de ser cubierto por el depósito crio-Pt (que es no-SELectantes y cubrirá varios mm 2 de la superficie de la muestra).
- Calentar el gas precursor a 24-26 ° C e inserte la aguja GIS a una altura de aproximadamente 1 mm por encima de la superficie de la muestra (véase también el paso 1.3).
- Mientras que las imágenes con el haz de electrones, abrir la válvula de gas durante unos pocos segundos. La tasa de crio-Pt deposición es 100-500 nm / seg o más, dependiendo de la distancia de la aguja SIG, la rugosidad de la muestra y el sistema del usuario. Es recomendable ejecutar algunas declaraciones de prueba para determinar los parámetros óptimos.
- La prima deposición crio-Pt es muy áspero y no homogénea. Curar el depósito sobre el retorno de la inversión mediante el uso de un haz de iones 1000 pA a bajo aumento (por ejemplo 2000 X). A diferencia de la deposición crio, este sitio de curado es selectiva y se debe realizar en sólo el retorno de la inversión. El propósito de esta primera crio-deposición es para proteger la superficie de la muestra del daño haz de iones y para reducir curtaining durante adelgazamiento de iones 13.
- Incline la muestra a52 ° de manera que la superficie es perpendicular al haz de iones. Molino de distancia dos trincheras en terrazas en ambos lados de la ROI. Las dimensiones típicas de las trincheras son 20-30 micras en la dirección (X) paralela a la lamela a extraer, 10-15 micras en la dirección perpendicular (Y) y con una variable, pendiente de profundidad (Z), con el punto más profundo cerca de la ROI. La pendiente debe ser de 45-55 °. En algunos instrumentos, trincheras terrazas sólo se pueden moler con el punto más profundo en la parte superior. En tal caso, el molino de uno bajo el retorno de la inversión, a continuación, girar la imagen 180 º y molino de la segunda en el otro lado. La profundidad de fresado se puede seleccionar si se conoce la tasa de pulverización catódica del material. Para la mayoría de la muestra-hidratado congelado, la tasa de pulverización catódica de hielo se puede utilizar 7.
- Incline la muestra de nuevo a 0 ° y utilizar el haz de iones para cortar los lados y la parte inferior de la lámina, asegurándose de que las marcas de corte pasan por toda la lámina (deben dejar marcas de molienda en el molino de laderas en terrazased en el paso anterior). Deja sólo dos pequeños puentes que conectan la lámina para el resto de la muestra.
- Inserte la aguja GIS (esto puede variar ligeramente de la muestra). Maniobra el NM hasta que su punta está en contacto físico con la lámina, preferiblemente en el lado. Asegúrese de que el NM no obstruya la vista de haz de iones de los dos pequeños puentes que conectan.
- Abrir la válvula de SIG durante unos segundos y controlar la deposición de crio por imágenes continua con el haz de electrones.
- Cuando una capa de 1-2 micras adicional de Pt ha sido crio-depositado, cerrar la válvula.
- Curar el Pt (véase el paso 2.6) sólo en la pocas micras alrededor del punto donde el NM está en contacto con la lámina.
- Use una corriente de haz de iones de alta para cortar la lámina libre. Los dos puentes de conexión deben ser molidos de distancia, así como cualquier exceso de Pt que pueda haberse formado nuevos puntos de contacto entre la lámina y el resto de la muestra. No retraiga la aguja SIG todavía.
- Maniobrar con cuidado el NM para extraer la lámina de las trincheras y moverlo lo menos 500 m por encima de la superficie de la muestra. Sólo después de este paso, retraer la aguja SIG.
- Baje la etapa de la muestra de unos pocos milímetros y muévalo hasta que una de las rejillas TEM está a la vista. Mueva el área de fijación en la parrilla en la posición de trabajo e introduzca la aguja SIG.
- Maniobrar con cuidado el NM para llevar la lámina adjunta en contacto físico con la zona de fijación en la rejilla TEM. No debe haber presión o tensión entre las láminas, la rejilla TEM y el NM.
- Abra la válvula de gas durante unos segundos y la crio-depósito de una capa de 1-2 micras adicional de Pt.
- Curar el Pt (véase el paso 2.6), sólo en pocas micras alrededor del punto de contacto entre la lámina y la rejilla TEM.
- Use una corriente de haz de iones de alta para cortar la lámina libre del NM. Esto se puede lograr mediante la molienda de distancia ya sea la punta NM o el lado de la muestra. En tél primer caso, la punta tendrá que ser afilada de nuevo antes del siguiente uso, como se describe en el paso 1.2.
- OPCIONAL: en esta etapa, es posible utilizar la ETV para tomar el soporte de transferencia de SEM y almacenarlo O / N en un Dewar lleno de nitrógeno líquido. Esta transferencia y el almacenamiento de O / N es probable que cause la formación de hielo en la superficie de la lámina si los cristales de hielo ya están presentes y / o si el nitrógeno líquido se expone al aire húmedo; pero este tipo de contaminación se eliminará por el siguiente paso en un tiempo relativamente corto. A medida que los pasos anteriores pueden haber tomado varias horas para completar, podría ser apropiado para hacerlo, ya que tras el paso siguiente no se recomienda dicho almacenamiento O / N, ya que no habría ninguna manera de eliminar la contaminación del hielo excepto por sublimación (que no se puede realizar si la vitrificación de la muestra debe ser mantenida).
- Incline la muestra a 52 ° y utilizar el haz de iones para diluir a la transparencia de electrones 7. Se recomienda comenzar con una mayor, rougsus corrientes de haz para eliminar la mayor y proceder al pulido fino de la superficie con corrientes de haz bajas, eventualmente también la reducción de la tensión de aceleración. El espesor final de la lámina debe ser de 100-200 nm o menos para el análisis en una ultraestructura TEM 100-200 kV o hasta 500 nm para la tomografía en un TEM 300 kV, dependiendo de la composición de la muestra. Durante el adelgazamiento, las tensiones internas de la muestra pueden provocar la lámina se enrolle o doblarse. En tal caso, la región adelgazada debe ser restringido. Esto sucedió por ejemplo en las Figuras 11 y 12.
4. Cryo Traslado al TEM
- Enjuague la estación de crio-transferencia con gas nitrógeno seco por un par de minutos.
- Añadir nitrógeno líquido para el Dewar de la TEM de CA y de la estación de crio-transferencia.
- Inserte el soporte de la crio-TEM de transferencia en la ranura correspondiente de la estación de la crio-transferencia y llenar su Dewar también. Espere hasta que cada borradoronent ha alcanzado la temperatura deseada (aproximadamente 15 min). Si es posible, el controlador del soporte de crio-TEM de transferencia debe ser conectado para controlar la temperatura durante la transferencia. Es importante darse cuenta de que la punta del soporte de TEM (donde se encuentra el sensor de temperatura) estará en contacto con la estación de transferencia de la crio-y por lo tanto se enfriará más rápidamente que el resto del soporte de TEM. Por ello se recomienda que el tiempo necesario para el conjunto del soporte TEM crio-transferencia para enfriarse se mide de antemano, y que se permite que el sistema para thermalize por lo menos esa cantidad de tiempo.
- Llene una taza criogénica con nitrógeno líquido y se sumerja en ella: la herramienta de TEM de la muestra de sujeción, un destornillador y unas pinzas, con el fin de enfriar sus consejos a la temperatura deseada. Todas las herramientas deben estar correctamente aislados en el otro extremo, para no causar quemaduras por frío a la mano del operador.
- Coincidir con el VTD a la esclusa de aire exterior. Traiga el ciervo fríocorreo a la altura de transferencia (16 mm *). Apague la alta tensión.
- Abra el sello ETV, la esclusa de aire exterior y la cámara de aire interior.
- Utilice la barra de ETV para bloquear en el soporte de transferencia SEM presionando y girando en sentido horario.
- Repliegue el titular de la transferencia SEM en la cámara de preparación crio.
- Utilice el cuchillo frío para cerrar las tapas de protección de las rejillas TEM. Esto es necesario para reducir la posible contaminación de hielo durante la transferencia.
- Utilice la varilla ETV para mover la muestra en la cámara de vacío de la ETV.
- Cierre las compuertas y el sello.
- Ventile la esclusa de aire exterior y retire la ETV. Coincidir con el VTD al puerto de SEM de la estación de la crio-transferencia. Mientras barrido con nitrógeno seco, use el pasador en la estación para abrir el sello de la ETV y deslice el soporte de transferencia de SEM en el Dewar de la estación de la crio-transferencia.
- Añadir suficiente nitrógeno líquido, de modo que el nivel en la estación de crio-transferencia es lo suficientemente altosimplemente sumergir la muestra.
- Utilice el destornillador previamente enfriada para abrir una de las tapas y aflojar el tornillo correspondiente que se mantiene la rejilla TEM en su lugar.
- Utilice las pinzas enfriada previamente a recoger la rejilla TEM y colocarlo en el soporte TEM.
- Utilice la hexring enfriado para sujetar la rejilla TEM en el soporte TEM.
- Cierre el obturador del soporte del crio-TEM transferencia. El paso de transferencia de la muestra es crucial y puede verse obstaculizado por gas nitrógeno reducir la visibilidad de la muestra pequeña de TEM.
- Desconectar la estación de crio-transferencia desde el sistema de bombeo y transportarlo cerca de la TEM, junto con el controlador de calentador del soporte de crio-TEM de transferencia.
- Arranque la bomba turbomolecular del TEM para bombear la línea de respaldo a la esclusa de aire TEM.
- Prepare el escenario muestra TEM a una inclinación de -70 ° *.
- Ajuste el tiempo de bombeo más corto para la esclusa de aire (30-60 seg), con sólo un ciclo de purga con gas nitrógeno seco.
- Asegúrese de que el obturador de protección en el soporte de la crio-TEM traspasos está cerrado. Retire el soporte de TEM de la estación de la crio-transferencia y la inserta en el goniómetro inclinada (nitrógeno líquido se derrame fuera de la Dewar titular TEM). El ciclo de bombeo se iniciará. Una vez que se completa el ciclo, establecer el goniómetro para inclinar de nuevo a 0 ° y, al mismo tiempo, mantenga el soporte de TEM de modo que no gira con el goniómetro. Inserte completamente el interior del TEM. Durante este paso, el soporte de crio-TEM de transferencia debe estar conectado a su controlador de calentador para controlar la temperatura. El procedimiento para insertar el soporte de la muestra en el TEM puede variar entre diferentes TEM. Por ello se recomienda ponerse en contacto con el fabricante del TEM para obtener el procedimiento adecuado.
- Vuelva a llenar el titular de la crio-TEM transferencia Dewar. Espere a que el vacío en el TEM para llegar a un nivel aceptable.
Resultados
En este trabajo se hizo uso de: a doble haz FIB / SEM equipado con un nanomanipulador y una cámara criogénica preparación; un TEM con un soporte de crio-transferencia; una estación de transferencia de la crio-prototipo. El anticontaminator (AC) palas de la cámara de la crio-preparación y la punta de la nanomanipulador (NM) fueron modificados por Gatan. Con respecto a una cámara criogénica preparación estándar, las clavijas de CA son más grandes para proporcionar un mayor disipador de calor para la punta NM. Por otra parte, el aire acondicionado está equipado con abrazaderas para la conexión de las trenzas de Cu para el intercambio de calor con la punta NM. Los neumáticos de la FIB / SEM fueron modificados para permitir que el NM para ser y estar dentro, incluso cuando se ventiló la cámara de muestras. Cabe señalar que los parámetros utilizados en este trabajo son los más adecuados para los equipos mencionados anteriormente; esos parámetros pueden necesaria para ajustar la hora de trabajar con otros tipos de equipos. Para trabajar con este protocolo, las precauciones normales para el manejo de la criogenia, sistemas de nitrógeno y vacío líquido debeseguir.
El método ha sido probado en diferentes tipos de muestras con buenos resultados, que van desde soluciones o matrices poliméricas que contienen nanopartículas, al organismo unicelular a los nematodos. Ejemplos de los diferentes pasos del procedimiento se ilustran en las figuras 1-12 en A. niger tiñeron con tetróxido de osmio y permanganato de potasio. Las esporas se primera reflejados por SEM (Figura 1) para identificar el sitio para la extracción. En este caso, una sección transversal de cualquier espora era suficiente, pero es posible posicionar el retorno de la inversión para la extracción con sub-micrómetro de precisión de, por ejemplo, cortar una celda específica a una distancia específica de la membrana celular. Una vez que la característica de interés se ha identificado, el primer paso de la deposición de la crio-Pt se implementa (Figura 2), para proteger la muestra de daños del haz de la molienda de iones. La muestra está inclinado a 52 ° para proceder con los primeros pasos of la molienda (Figura 3): el bombardeo iónico de dos trincheras en ambos lados de la lámina. La muestra se inclina hacia atrás y aún muele hasta dejar sólo dos pequeños puentes que conectan a la masa (Figura 4). El nanomanipulador enfriada se pone en contacto con la lámina (Figura 5) y otro crio-deposición de Pt ellos soldaduras juntos (Figura 6). Los pequeños puentes de conexión se muelen a continuación de distancia y el NM mueve la lámina cerca de la zona de fijación de la rejilla TEM (Figura 7), donde se suelda con un crio-deposición final del Pt (Figura 8). El NM se separa entonces de la lámina (Figura 9), que se adelgaza hacia abajo para la transparencia de electrones con el haz de iones (Figura 10 y 11). La lámina se transfiere finalmente a la TEM (Figura 12) donde las imágenes de alta resolución, espectroscopia, la tomografía y otras técnicas de can ser empleados.

Figura 1. Imagen Cryo-SEM de esporas de A. niger, antes de Pt deposición.

Figura 2. La misma zona en la Figura 1 después de la deposición de Pt pero antes del curado.

Figura 3. Imagen Cryo-SEM de la misma área en la figura 2, inclinado 52 º, después de la deposición de Pt y el curado, con el fresado zanja en curso(Véase el paso 3.7).

Figura 4. La lámina, listo para la elevación-out.

Figura 5. La punta nanomanipulador frío hace contacto con la lámina.

Figura 6. Un segundo crio-deposición de Pt se utiliza para soldar juntos el nanomanipulador y la lámina.

Figura 7. El nanomanipulador frío se utiliza para transferir la lámina a la zona de fijación de la rejilla de TEM.

Figura 8. Cryo-deposición se utiliza una vez más para fijar la lámina a la rejilla TEM.

Figura 9. La lámina se corta libre de la nanomanipulador y ahora está listo para su almacenamiento o adelgazamiento de electrones transparencia.

Figura 10. Un paso intermedio del adelgazamiento, con unas pocas esporas visibles en sección transversal.

Figura 11 imagen Cryo-SEM de la muestra después de adelgazamiento final.; la mayoría de las otras esporas tenían a moler lejos porque la lámina había empezado a curvarse.
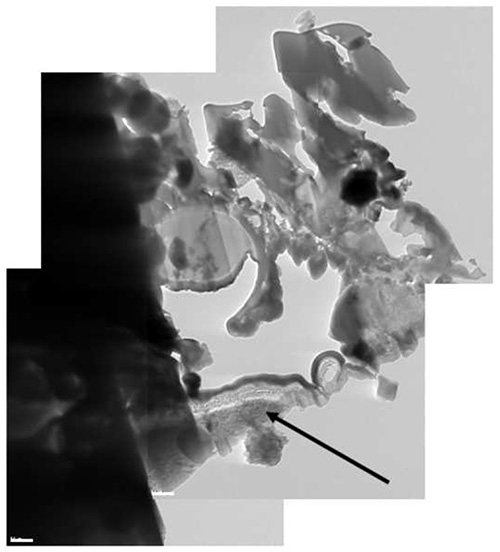
Figura 12. Una imagen Cryo-TEM de material compuesto de la lámina. Parte de la Al talón se ha incluidoen la lamela (flecha negro).
Discusión
Este protocolo es una adaptación bastante directa a temperaturas criogénicas de la preparación de la muestra FIB / TEM estándar utilizado en ciencias de los materiales a temperatura ambiente. El método produce muestras TEM libres de la deformación mecánica y marcas de cuchillo (El mayor inconveniente de microtomía), aunque curtaining puede ocurrir si la superficie de la muestra es homogénea. Esto se puede reducir por crio-deposición de una capa de cobertura (en este trabajo se utilizó Pt), curado hasta que es lisa y sin rasgos 13. Las muestras con componentes de muy diferente dureza se pueden preparar como bien sin el riesgo de que se rompa bajo tensión durante la preparación. Las tensiones internas todavía pueden causar la lámina delgada se doble o rizo, en cuyo caso el tamaño de la sección tiene que ser reducida. Un inconveniente en comparación con otro método es la posibilidad de alterar la estructura biológica debido a la exposición al haz de iones y la posible implantación de los iones en la muestra. Estos inconvenientes también se producen a temperatura ambiente durante la muestra prepaación en la ciencia de materiales 15. Se pueden reducir al completar el adelgazamiento con un paso final de pulido en el voltaje de aceleración más bajo para los iones (500-1.000 V). Esta etapa de pulido muy suave eliminará la capa dañada de la lámina.
Debido a la naturaleza de la crio-deposición (pasos 3.5, 3.10 y 3.13), gran parte de la muestra serán cubiertos, obstruyendo así el punto de vista de la superficie original. Esto puede hacer que sea difícil hacer un seguimiento de la ROI, a menos que se utilizan varias marcas como se sugiere en el paso 3.3.
Durante los pasos 4.5 y 4.7 los riesgos de láminas delgadas que entran en contacto con el aire. Esta tiene que ser evitada, ya que podría causar la humedad en el aire para formar cristales de hielo en la superficie de la muestra, posiblemente hasta el punto de oscurecer características importantes. Estos pasos deben realizarse lo más rápidamente posible, pero al mismo tiempo es probable que resulte en la pérdida de la muestra de un mal manejo durante la transferencia seyo. Se recomienda que el usuario practique estos pasos mediante el uso de rejillas TEM vacías antes de un intento en una muestra real se hace.
En ciencia de los materiales, el instrumento FIB se ha convertido en el principal método de preparación de muestras TEM en una década de su comercialización. Puesto que se puede utilizar en prácticamente cualquier espécimen, que elimina la necesidad de adaptar la técnica de preparación para el tipo de muestra. Estamos firmemente convencidos de que lo mismo podría ocurrir a temperaturas criogénicas, gracias al procedimiento que se detalla aquí. Su aplicación a las muestras más grandes aún está sujeta a la capacidad de la crio-conservación en un estado vitrificado, pero técnicas como inmersión de embargo preventivo o de alta presión de congelación de 3,5 puede llegar a ser la solución óptima para este problema.
Divulgaciones
Los autores tienen nada que revelar.
Agradecimientos
Esta investigación recibió apoyo del proyecto QNano http://www.qnano-ri.eu que es financiado por las infraestructuras de investigación de la Comunidad Europea dentro del Programa Capacidades del 7PM (Grant No. INFRA-2010 hasta 262.163).
Agradecemos también al consejo de investigación Formas de apoyo financiero.
Materiales
| Name | Company | Catalog Number | Comments |
| Strata DB 235 | FEI | FIB/SEM | |
| Omniprobe 100 | Oxford Instruments | nanomanipulator | |
| Alto 2500 | Gatan | cryo preparation chamber | |
| cryo-holder model 626 | Gatan | cryo transfer TEM holder | |
| Tecnai F30 | FEI | TEM | |
Referencias
- Echlin, P. . Low Temperature Microscopy and Analysis. , (1992).
- Rubino, S., et al. A site-specific focused-ion-beam lift-out method for cryo Transmission Electron Microscopy. J. Struct. Biol. 180, 572 (2012).
- Studer, D., et al. A new approach for cryofixation by high-pressure freezing. J. Microsc. 203, 285 (2001).
- Umrath, W. Cooling bath for rapid freezing in electron microscopy. J. Microsc. 101, 103 (1974).
- Walther, P. Recent progress in freeze-fracturing of high-pressure frozen samples. J. Microsc. 212, 34 (2003).
- Elder, H. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. Cryo fixation. Techniques in Immunocytochemistry. , (1989).
- Giannuzzi, L. A., Stevie, F. A. . Introduction to Focused Ion Beams. , (2005).
- Marko, M., et al. Focused-ion-beam thinning of frozen-hydrated biological specimens for cryoelectron microscopy. Nat. Methods. 4, 215 (2007).
- Hayles, M. F., et al. The making of frozen-hydrated, vitreous lamellas from cells for cryo-electron microscopy. J. Struct. Biol. 172, 180 (2010).
- Rigort, A. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. J. Struct. Biol. 109, 4449-44 (2012).
- Hsieh, C., et al. Towards high-resolution three-dimensional imaging of native mammalian tissue: electron tomography of frozen-hydrated rat liver sections. J. Struct. Biol. 153, 1 (2006).
- McDowall, A. W., et al. Electron microscopy of frozen hydrated sections of vitreous ice and vitrified biological samples. J. Microsc. 131, 1 (1983).
- Hayles, M. F., et al. A technique for improved focused ion beam milling of cryo-prepared life science specimens. J. Microsc. 226, 263 (2007).
- Pettersson, H., et al. A method for producing site-specific TEM specimens from low contrast materials with nanometer precision. Microsc. Microanal. 19 (1), 73 (2013).
- Wätjen, J. T., et al. Cu out-diffusion in kesterites—A transmission electron microscopy specimen preparation artifact. Appl. Phys. Lett. Appl. Phys. Lett, 051902 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados