このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
水 - パルス振幅変調(WATER-PAM)蛍光測定を用いて細菌/植物プランクトンの共培養を評価するために小音量バイオアッセイ
要約
The goal of this procedure is to demonstrate the reproducibility and adaptability of using a microtiter plate format for microalgal screening. This rapid screen combines WATER-Pulse-Amplitude-Modulated (WATER-PAM) fluorometry to measure photosynthetic yield as an indicator of Photosystem II (PSII) health with small volume bacterial-algal co-cultures.
要約
培養物は、実験1-7を通してサブサンプリングすることができるように、微細藻類の実験操作のための従来の方法は、培養物の大量の(5 L 20 ml)を使用している。 1)それは、全体積の変化および表面積を引き起こす:大量のサブサンプリングは、いくつかの理由で問題となることが実験中の培養物の体積比; 2)疑似レプリケーション( すなわち、同じ治療フラスコ8からサ ンプルを複製する)は、多くの場合、むしろ真の複製(複製処理からのすなわち、サンプリング)も採用されている。 3)実験の期間は、総容量によって制限されます。汚染は、一般的にサブサンプリング中に起こるような、4)純粋培養または通常の細菌叢は、長期間の実験の間に維持することが困難である。
マイクロタイタープレートの使用は、内、最大48の別々の治療法を用いて1ml培養毎に使用するボリュームの複製を可能に12.65 X 8.5×2.2センチプレート、それによって実験的なボリュームを減少させ、任意の治療をサブサンプリングすることなく、大規模な複製を可能にする。 9-11をスクリーニングする細菌藻類共培養物、藻類生理学テスト、および毒素:さらに、この技術は、実験を含む種々の型式に適合するように修正することができる。水 - パルス振幅変調(WATER-PAM)蛍光法、顕微鏡検査、細菌のコロニー形成単位(CFU):藻類、細菌および/または共培養は、数々の実験手順のためにサンプリングしたが、これに限定されないことができますと、個々のウェルカウントおよびフローサイトメトリー。マイクロタイタープレート形式とWATER-PAMの蛍光測定の組み合わせは、光化学収率および試料間の低い変動性を有する他の光化学的パラメータの複数の迅速な測定を可能にし、高い再現性実験の過程でカーボイまたは三角フラスコをサブサンプリングの多くの落とし穴を回避する。
概要
植物プランクトンの生理機能は、伝統的に三角フラスコ中で20ミリリットルからカーボイ1-7 で5 Lの範囲のメソスケールの実験で研究されている。各時点で複製試料を犠牲にすることは手に負えない実験装置を作成し、この実験的なスケールは、実験的な監視のためのサブサンプリングが必要です。
藻類の生理学実験のための実験容積を小型化することによって、同じ日周インキュベータ·スペースを使用しながら独立した実験の数を増加させる能力は、大量のサンプリング擬似複製の制限を軽減または排除する。マイクロタイタープレート形式は、実験変数の条件で藻類を操作するための1ml培養体積を使用して、藻類のバイオアッセイのために開発された。この実験小容積が増加する反復の数を可能に起因複製試料との間の減少した変動性、実験の再現性を増加させる実験、および140日間( 図2)12のための実験対照( すなわち、純粋藻類培養液)を維持しながら、真の複製を可能にする。
このマイクロタイタープレート形式で容易のような実験的な質問、各種のために適合される:細菌は、その藻類ホストと、共生中性または病原性の相互作用がありますか?藻類への化合物の刺激の追加や毒性はありますか?これらおよび他の問題は、この新しい形式9-11を用いた迅速なハイスループットの方法で対処することができる。
48ウェルマイクロタイター培養プレートに1mlずつウェル単一の時点でサンプリングされる独立した実験設定にすることができる。各種パラメータを含め、この1ミリリットルボリュームからサ ンプリングしたが、これらに限定されないことができます:水-パルス振幅変調(WATER-PAM)蛍光法( 材料および機器の表を参照)1を用いたクロロフィル蛍光及び光化学パラメータ3。WATER-PAMの蛍光測定は、藻類13で行われた実験を監視するために使用することができる迅速かつ非侵襲的な技術である。 14,15(WATER-PAMのために4mlの容量- - 2培地で希釈した培養液300μl150)それは小さな培養液量から光合成効率とPSII健康の測定を可能にする。 WATER-PAMの蛍光測定に加えて、この設定を含む他の様々なパラメータを測定するために用いることができるが、これらに限定されない:藻類細胞および藻類細胞形態の変化に付着した細菌を可視化する顕微鏡。単位(CFU)のカウントを形成する細菌のコロニー。と藻類の細胞数と識別する亜集団のためにフローサイトメトリー。
プロトコル
実験のセットアップの1の計算
- 藻類および/または式(1)を用いて全実験に必要とされる制御に必要な細菌培養物の体積を計算する。
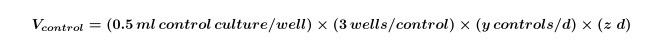
yは日ごとに必要なコントロールの数に等しく、zは日数に等しい。 - 式2を使用して、実験の共培養のために必要とされる藻類および/または細菌培養物の体積を計算する。
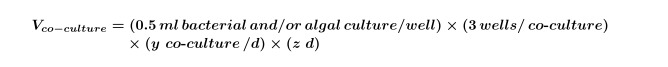
注:これは、任意の化合物画面で「共培養」実験を置換することが可能である。ただ実験計画に合わせて、最終的な化合物、溶媒及び藻類の濃度を調整します。 - 早期指数藻類培養物の最終体積を計算するために式1および式2を使用して(一般的に5日〜10 4細胞/ mlで、これはperformiによって決定されるべきである(このボリュームは、式3を用いて、ステップ2.3)に必要とされる実験に必要ngの藻類の成長曲線)

- 式4を使用して(このボリュームはステップ4.2に必要とされる)は、実験に必要な10 4 cfu / mlで細菌培養物(または所望の接種濃度)の最終体積を計算する式1および2を使用します。

注:0 D上のエラーと実行され、任意の試験( 例えば、水-PAM、フローサイトメトリー、顕微鏡など ) をペッティングを考慮するためのステップ1.3と1.4で追加の10ミリリットルを使用してください。実験計画に合わせて、必要に応じてこのボリュームを大きくします。
注:8日間の実験の計算例では、セクション10を参照してくださいメディアのレシピのための補助的な表を参照してください。
実験のセットアップ2.成長する藻
- 隔離または入手積極的に純粋藻類培養物を増殖させる。
- 無菌的に滅菌した藻類の培地への藻類培養の最終容量の移転10%( 例えば、L1または類似の海藻媒体は、材料および装置の表を参照)、1の確保:新鮮な培地で藻類培養の9希釈。 (:8時間の明:暗サイクルが一般的に使用されている16 例、18℃)、その歪みのために先に決定成長条件を使用して、日中のインキュベーター中で希釈された藻を育てる。
- 藻類の最終体積であることが9希釈:文化が初期指数期、再培養に到達したとき、同じ無菌藻類の培地中の藻類( 例えば、L1または類似の海洋藻類の培地)を、最終濃度が1であることを確認V A計算し(ステップ1.3)に等しい。
注:これらの培養物は無菌であることを確認することが重要です。すべての藻類メディアや汚染の藻類の株式ボトルは、一般的な海洋細菌培地( 例えば、海洋上に20μlのアリコートをメッキすることにより、テスト培養液2216を1.5%寒天または同様のもの)を補充した。 - 初期指数期(〜10 4細胞/ ml)に藻類培養を成長させる。
注:すべての藻類株は、培養条件に応じてユニークな成長曲線を有する。初期対数期(約10 4細胞/ ml)(フローサイトメトリーまたは顕微鏡メトリを用いて、すなわち)細胞密度に基づいて、藻類の成長曲線を実行することによって決定することができる。
3.接種のために細菌細胞を準備する
- (選択された細菌の培地および増殖条件で増殖曲線を実行して、定常期の細菌の細菌濃度(cfu / mlで)および光学密度(OD)を予め決定し、例えば、25℃、160 rpmで2216マリンブロス、 )または同様。細胞(ステップ3.3)を成長させるために、この情報を使用して、後のステップ3.7で正しく細胞を希釈する。
- 無菌的にしなやかな、1.5%寒天プレート( 例えば、マリンブロス2216から分離し、新たに増殖させた細菌コロニーを転送( 例えば、マリンブロス2216または類似の海洋細菌培地)細菌の液体培地5mlに)は、1.5%寒天または類似の海洋細菌の固形培地でmented。
- ( - 細菌に応じて、36時間〜12)ローリングドラムやシェーカー上固定相への細菌を育てる。藻細胞が初期対数期(約10 4細胞/ ml)に達していると同時に- (10 9 cfu / mlで約10 8)細菌が定常期に達するように実験を計画する。
- ピペットを用いて、培地中に試験管に添付されたバイオフィルムをダウン洗う。無菌の1.5ミリリットルマイクロチューブにピペットでよく混合細菌培養の1ミリリットル。 14000×gで1分間遠心。
- (細菌細胞)を取り外し、ペレットを中断することなく、上清(細菌メディア)を処分する。 (ペレットとの)マイクロチューブに無菌の藻類の媒体( 例えば、L1または類似の)の1ミリリットルを追加します。藻類のメディアでペレットを再懸濁するための渦マイクロチューブ。
- 二回目の洗浄:ステップ3.5を繰り返します。
注:これはの栄養組成を変えることができるようにそれは完全に前に彼らと藻類を接種した細胞からの細菌メディア、細胞残骸、排泄タンパク質および小分子のすべてを除去するために、藻類のメディアと細菌の細胞を洗浄することが重要です藻類メディアまたは画面に生物活性分子を導入。 - 直列に所望の最終細菌濃度(cfu / mlで)よりも100倍以上濃縮され、最終濃度を、藻類の培地中で洗浄し、細菌細胞を希釈する。ステップ4.2のための藻類の培地で洗浄し、希釈された細胞を含むマイクロチューブを保存します。
注:0 D上の細菌に藻の1:1の比率を有することに基づいて実験を計画します。ステップ3.7において、初期セルを直列に10 6 cfuの/ mlに希釈すべきであるので、これを行うために、実験のための所望の初期細菌濃度は、10 4のcfu / mlである。
実験4.準備細菌アルのセットアップ
- 4無菌のオートクレーブ処理ガラス三角フラスコを用意し、それらをレーベル:A) '藻類の制御フラスコ'、B ')希釈した細菌株のフラスコ'、C ')細菌の対照フラスコ」と、d)「共培養フラスコを」。
- から細菌懸濁液を希釈 最終容量= V B(ステップ1.4)に無菌の藻類のメディアと3.7 1:99ステップ。フラスコラベル希釈した細菌株(ステップ4.1)で希釈してください。
注:前の例(ステップ4.2)では、この1:99希釈は10 4のcfu / mlの最終濃度を与える。スワールフラスコの細胞を混合する。 - 希釈した細菌株からピペットV 制御 (ステップ1.1)と細菌の対照フラスコに入れて。
- 細菌のコントロールフラスコに無菌の藻類媒体のピペットV コントロール (これは1:1で希釈)。スワールフラスコは、細胞をミックスし、ステップ7.3のために確保されている。
- 希釈した細菌株からピペットV 共培養ステップ6.1用に確保フラスコを設定し、共培養フラスコにフラスコ。
注:一度に同じ藻類で複数の共培養を行う場合には、個別に各菌株のためのV 共培養を再計算し、ステップを繰り返す必要がある( すなわち、2つの異なる細菌の共培養は、一つの制御と分離株)個別にそれぞれの共培養のために4.5。これは、式5に示される両方の共培養物を含むように、ステップ1.3で算出したV Aを増加させることも必要である。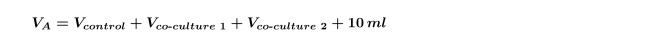
実験のセットアップのための藻類の準備5.
- 細胞が十分に混合表示されるまで、静かに広口ピペットチップで(ステップ2.4から)早期指数関数藻類文化をミックス。
- 藻類の対照フラスコに藻類株式ボトルからピペットV コントロール 。穏やかを10mlピペットを用いてピペット。その後、日周インキュベーター内藻類株式ボトルを返す。
- ピペットV CONT藻類の対照フラスコに滅菌藻類媒体のROL(これは1:1で希釈)。ステップ7.4に必要とされるまで、昼行性インキュベーターにフラスコと場所を混合する渦巻。
6.準備実験の共培養
- ステップ4.5からの細菌の共培養フラスコに藻類の株式フラスコから静かにピペットV 共培養 。ステップ7.5のために必要となるまで昼行インキュベーターに共培養フラスコを返します。
注:細菌のコントロール中の細菌の濃度は、実験的な共培養中の細菌濃度を同じにする必要があります。同様に、藻類の制御における藻類の濃度は、実験的な共培養で藻類の濃度を同じにする必要があります。同じ初期の細菌と藻類の濃度を有することで、人口密度は、実験を通して比較することができる。
7.マイクロタイタープレートのセットアップ
- 図1に従って、滅菌48ウェルマイクロタイタープレートを分割する。滅菌希釈剤または非光合成サンプルのいずれかを含む外側のウェルの上にラベルを付けます。
注意:プレートのウェルのランダム化は同じ日に採取された試料に対して行うことができる。例えば、第1象限の実験で1からdでサンプリングされる。 4及びC2 - - 図1に示すように滅菌溶液で満たされたプレートの外周を残す4.ランダム化されるべきであるウェルがB2である。
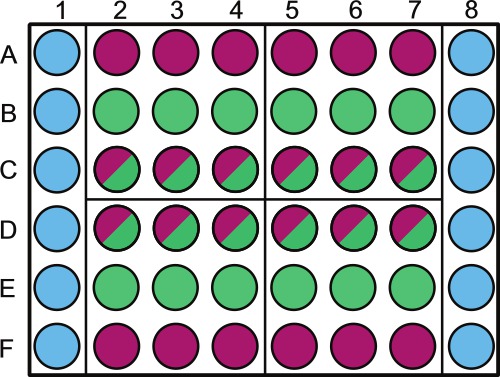
以下のように48ウェルマイクロタイタープレートのウェル中の試料の配置図1略図が満たされるべきである:カラム1及び図6に示すように、A〜Fのウェル(  )を1mlの1×PBS(または他の滅菌溶液/媒体)で充填される。列AとF、井戸2から8(
)を1mlの1×PBS(または他の滅菌溶液/媒体)で充填される。列AとF、井戸2から8(  )を1mlの細菌の制御が充填されている。 ROWS BとE、ウェル2から8(
)を1mlの細菌の制御が充填されている。 ROWS BとE、ウェル2から8(  )を1mlの藻類の制御が充填されている。行CとD、ウェル2から8(
)を1mlの藻類の制御が充填されている。行CとD、ウェル2から8(  )を1mlの共培養で満たされる。図4に示すように、これは、プレート全体に無作為化し、それに応じてラベル付けされるべき - プレートを4象限(A2、A5、D2およびD5)、これらの象限1は、各特定のサンプリング日数である分割されている。毎日の中で、我々は(藻類の制御をランダムに助言
)を1mlの共培養で満たされる。図4に示すように、これは、プレート全体に無作為化し、それに応じてラベル付けされるべき - プレートを4象限(A2、A5、D2およびD5)、これらの象限1は、各特定のサンプリング日数である分割されている。毎日の中で、我々は(藻類の制御をランダムに助言 )と共培養(
)と共培養(  乱数発生器を使用して)をウェル。藻類培養液のシェーディングを防止するために、1×PBSおよび/または細菌の対照ウェルの上に蓋にラベルを付けます。
乱数発生器を使用して)をウェル。藻類培養液のシェーディングを防止するために、1×PBSおよび/または細菌の対照ウェルの上に蓋にラベルを付けます。
- ピペット1ミリリットル1×リン酸緩衝溶液(PBS、pH7.4)で、または図1に示されるように、適切なウェル内の他の滅菌溶液をゆっくりと慎重にこれを実行する。 PBS意志ちゃんGE藻類および/または共培養培地のイオン強度は、他のウェルはとても慎重に扱うに跳ねている場合。
- ピペットでウェルに細菌の対照培養の1ミリリットル( 図1)は、細菌コントロールのラベル。細菌の沈降を避けるために、各プレートをピペット前に、細菌のフラスコを旋回。
- ピペットウェルに藻類コントロール培養物1mlを広口ピペットチップ( 図1)を用いて藻類の制御を標識。として定期的に細菌のフラスコなどの藻類のフラスコを旋回。藻は、シンクまたはフロートする傾向があれば、視覚的に均一な文化を維持するために必要とされると定期的に渦巻く。
- 広口ピペットチップ、ピペット適切なウェルにおける共培養物1ml( 図1)を使用して。として定期的に藻類フラスコのような共培養フラスコを旋回。
- 所望の温度と日周光周期で日中のインキュベーター中でパラフィルムと場所との各プレートをシール(:8時間の明:16と18℃の暗サイクルが一般的に使用されている)。去る取る準備ができて、PAMの測定値(セクション8)まで、昼行性インキュベーターでプレート。確実にすべてのプレートは、一貫した露光を可能にするために同じ方向に配向されている。
- PBS、藻類メディア、藻類ストックと藻類のコントロールから20μlのアリコートを取り、適切な非選択培地上にプレートをドロップ( 例えば、1.5%寒天を補足したマリンブロス2216)と18でプレートをインキュベート- 72、25℃汚染をテストするための時間。成長が細菌を含むべきではないソリューションのいずれかに表示されている場合は、これらのデータは使用すべきではありません。
- 読んで実験的な0のDのPAM蛍光測定(ステップ8.1を参照)藻類の制御と共培養フラスコから残りのサンプルを使用してPAM蛍光光度測定値を取る。他0 dの測定も、残りの藻類の制御、細菌の制御および共培養サンプルを用いて実施されるべきである。
株価のサンプルからPAM蛍光測定読み取りを行う8.
- ゼロWATER-PAM測定値8をとる前に、きれいなキュベット中の滅菌藻類のメディアと。
- 実験に使用したのと同じ藻類培地の2.7ミリリットルを含むクリーンなキュベットに藻類の制御または共培養フラスコからピペット300μL。広口ピペットチップで穏やかにサンプルおよび希釈剤を混ぜる。
- 拭き取り組織とキュベットの外側からすべての指紋をWATER-PAMにキュベットを配置する前に。
- WATER-PAMにキュベットを置きます。キャップでサンプルをカバーし、3分間暗適応させるためにそれを許可。暗順応時間は、藻類の種に依存して変化し、実験に使用される特定の藻類のために決定されなければならない。藻類の日周インキュベータ16,17の暗サイクルの途中で水-PAMの読みを取ることによって長い暗順応時間(> 20分)は避けてください。
- 暗い適応した後、F 0ボタンを押してください。藻類培地中に1:蛍光測定値が3900を超えている場合は、サンプル1を希釈。さらに3分であり、徳のためにダーク適応させるEA新しい読書。 F 0とF m個の測定値が3,900未満になるまで、藻類の培地中で1:F 0またはF Mの測定値が3,900を超える残っている場合は、サンプル1を希釈するために続ける。
注:最終蛍光を記録するときにこれらの希釈を考慮してください:藻類のサンプルが1に希釈されている場合、インスタンスのために:ウェルから希釈用チューブへの初期転送中に9を、その後500の藻類の蛍光読み取り、逆を掛けする必要があります(この場合は10)に希釈係数を、チューブの実際の蛍光はその後5000である。 - F 0を設定した後、F mの測定値を取るためにSATボタンを押すことで、すべての90秒を読んで飽和パルス(SAT-パルス)を取る。読みの間の時間間隔は、藻類株に応じて調整することができる。サンプルを捨てる。
- 残りのサンプル8.6 - を繰り返して、8.1を繰り返します。
マイクロタイタープレートからPAM蛍光測定読み取りを行う9.
- ラベル藻類コントロールウェルC2のための4 - -井戸B2のために> 3ミリリットルの体積の6無菌のサンプル管細菌の共培養のために4( 図1のプレートレイアウトを参照)。
- 小分けした各チューブに無菌の藻類培地の2.7ミリリットル。
- 場所管昼間インキュベーターで、それらを藻類を30分間成長させた温度に順応することを可能にする。
- インキュベーターからマイクロタイタープレートを取り外す前に暗い順応させたウェル内への光の侵入がアルミ箔(または類似の)でプレートを覆うことによって制限されて積極的に希釈管に井戸から文化を転送しながら、唯一の箔を削除することを確認してください(9.5ステップ - 9.7)。
- 無菌的にゆっくりとピペッティングして広口ピペットチップとよく最初のマイクロタイタープレート(ウェルB2)を混ぜる。
- (広口ピペットチップで、それに対応するサンプルチューブに300μlのよくB2( 図1)からのインキュベーターと無菌的に転送から希釈管を入手藻類培地中のサンプル)の9倍希釈これは1です。
- 残りのウェル9.6(B3,4とC2 - - 4)を繰り返して、9.5を繰り返します。
- アルミホイルでサンプルチューブをカバーし、水-PAMの準備ができるまで、昼行性インキュベーターに戻す。
- 8.7 - 手順8.1で説明したようにWATER-PAMの読み取りを実行します。インキュベーターに戻す前に、パラフィルムでマイクロタイタープレートをシール。
- 実験期間中に予定された時間間隔で測定値を繰り返します。サンプリングの頻度および長さは、実験開始時に計画されるべきである。
10.サンプル実験
サンプル実験は、細菌(Phaeobacterのgallaeciensisの BS107)の10日間共培養し、微細藻類(Emiliania石藻株 (CCMP3266))である。それは藻類の制御、細菌の制御、および細菌藻類実験的な共培養が含まれています。
- 1ステップ(必要な細菌や藻類の株のボリュームを計算します。1から1.4)

- 36ミリリットル培地で藻類4mlを接種することによって、藻類の株、40ミリリットルのV Aを調製し、初期の指数増殖が約10 4細胞/ ml(2.1ステップ- 2.4)の細胞密度に達するまで、インキュベートした。
- (細菌の最終濃度は10 4 cfu / mlでなります)藻類のメディアとの40ミリリットルのV Bに3章で得られた10 6 CFU / mlの細菌400μlの希釈することにより、細菌の株式フラスコを準備します。
- 細菌のコントロールフラスコに細菌の株式の半分(20ミリリットル)を転送し、細菌制御を行うために、藻類のメディアの20ミリリットルを追加します。藻類の制御フラスコに半分(20ミリリットル)藻類の株式を移し、藻類制御(第5節)を補うために藻類のメディアの20ミリリットルを追加します。共培養を確立するために、共培養フラスコに細菌の株式の残りの20ミリリットルを移し、藻類株式の残りの20ミリリットルと混合(セクション6)。
- 2つの事前標識したマイクロタイタープレート( 図1)は 、ウェルあたり1mlの1×PBS(pH7.4)で、コントロール、および共培養をピペット。 0 D測定(CFUカウント、WATER-PAM(8節)、藻類の細胞形態の顕微鏡観察、フローサイトメトリーのための藻類の細胞固定)を作るために、残りのコントロールと共培養の3ミリリットルを使用してください。
- 10日間一日一回藻類の制御と共培養のための水-PAMの読みを取り、常に0のD測定が行われたのと同じ時間(セクション8)で。
関心のある11。その他のパラメータ
- 細菌のCFU濃度を決定します。無菌1X PBS(または類似の)中の細菌コントロールと共培養の段階希釈を行い、その後、1.5%寒天(または類似の)を補充したマリンブロス2216上でプレートをドロップし、成長のcfuの数を観察する各ウェル18のための細菌のcfu / mlに決定する。
- 藻類の細胞濃度を評価するには、次の藻類の制御と協調を修正グルタルアルデヒドの0.15%の最終濃度の文化。暗い、その後フラッシュ液体窒素で凍結し、-80℃で保存し、10分間インキュベートする。プロセスフローサイトメーター(FACSキャリバーまたは類似の)上のすべてのサンプルは、藻類の細胞をカウントする。
- 藻類培養および顕微鏡( すなわち、光学顕微鏡、エピ蛍光、または類似した)を用いて細菌·藻類共培養:藻類細胞の形態を観察します。
結果
WATER-PAMの蛍光定量法の測定値。
水 - パルス振幅変調(PAM)蛍光光度法、蛍光(クロロフィル含量のプロキシ)と藻類の文化の光合成収率(PSII健康)を決定するための迅速かつ効率的な方法である。 PAM WinControlソフトウェアは、(以下では暗順応藻類のサンプルのための基本的なパラメータである)のための生データ値のスプレッドシートを生成します。
ディスカッション
小型化された形式での藻類の成長。
マイクロタイタープレート中の1ml培養体積に藻類培養物の微細化が増加する実験内での複製を可能にする。それは藻が実験を通して、健康であることを確認することが重要です。藻類の栄養要件が満たされていることを確認するために、様々な藻類メディアを評価するために、マイクロタイタープレートフォーマットを用いて、増殖曲?...
開示事項
The authors have nothing to disclose.
謝辞
This work was supported by Natural Sciences and Engineering Research Council of Canada (grant 402105), Canadian Foundation for Innovation (grant 129087) and Alberta Education and Training (grant AAETRCP-12-026-SEG) to RJC.
資料
| Name | Company | Catalog Number | Comments |
| 10 cu. ft. Diurnal incubator (6012-1) | Caron Corporate | 112310-6012-1-11 | www.caronproducts.com |
| Nunc EasYFlask 25 cm2, Vent/Close Cap, 7 ml working volume, 200/cs | Thermo Fisher Scientific | N156340 | www.fishersci.ca |
| Multiwell TC Plates – 48-well | BD Biosciences Discovery Labware | 353078 | www.bdbiosciences.com |
| P1000 Gilson The Pipetting Standard—Gilson's Pipetman | Mandel Scientific Company Inc. | GF-F123602 | www.mandel.ca |
| P10mL Gilson The Pipetting Standard—Gilson's Pipetman | Mandel Scientific Company Inc. | GF-F161201 | www.mandel.ca |
| Wide Orifice Tips nonsterile [100–1,250 µl] | VWR International | 89079-468 | www.ca.vwr.com |
| Ultrafine Tips nonsterile [100–1,250 µl] | VWR International | 89079-470 | www.ca.vwr.com |
| Finntip 10 ml [Vol: 1 - 10 ml] | Thermo Fisher Scientific | 9402151 | www.fishersci.ca |
| WATER-Pulse Amplitude Modulation (Water-ED) | Heinz Walz GmbH, Effeltrich, Germany | EDEE0232 | www.walz.com |
| 15 mm diameter quartz glass cuvette (WATER-K) | Caron Corporate | www.caronproducts.com | |
| Sodium chloride (crystalline/certified ACS), Fisher Chemical | Thermo Fisher Scientific | Thermo Fisher Scientific | www.fishersci.ca |
| BD Difco Marine Broth 2216 | BD Biosciences Discovery Labware | BD Biosciences Discovery Labware | www.bdbiosciences.com |
| BD Bacto Agar | BD Biosciences Discovery Labware | BD Biosciences Discovery Labware | www.bdbiosciences.com |
| L1 Medium Kit, 50 L | NCMA [National Center for Marine Algae and Microbiota | NCMA [National Center for Marine Algae and Microbiota | www.ncma.bigelow.org |
参考文献
- Scarratt, M. G., Marchetti, A. Assessing microbial responses to iron enrichment in the Subarctic Northeast Pacific: Do microcosms reproduce the in situ condition?. Deep Sea Res Part II Top. Stud. Oceanogr. 53 (20-22), 2182-2200 (2006).
- Bidle, K. D., Haramaty, L., Barcelos E Ramos, J., Falkowski, P. Viral activation and recruitment of metacaspases in the unicellular coccolithophore, Emiliania huxleyi. Proc. Natl. Acad. Sci. U. S. A. 104 (14), 6049-6054 (2007).
- Moore, L. R., Goericke, R., Chisholm, S. W. Comparative physiology of Synechococcus and Prochlorococcus: influence of light and temperature on growth, pigments, fluorescence and absorptive. Mar. Ecol. Prog. Ser. 116, (1995).
- Iglesias-Rodriguez, M. D., Halloran, P. R. Phytoplankton calcification in a high-CO2 world. Science. 320 (5874), 336-340 (2008).
- Chen, M., Tang, H., Ma, H., Holland, T. C., Ng, K. Y. S., Salley, S. O. Effect of nutrients on growth and lipid accumulation in the green algae Dunaliella tertiolecta. Bioresour. Technol. 102 (2), 1649-1655 (2011).
- Lv, J. -. M., Cheng, L. -. H., Xu, X. -. H., Zhang, L., Chen, H. -. L. Enhanced lipid production of Chlorella vulgaris by adjustment of cultivation conditions. Bioresour. Technol. 101 (17), 6797-6804 (2010).
- Geider, R., Graziano, L., McKay, R. M. Responses of the photosynthetic apparatus of Dunaliella tertiolecta (Chlorophyceae) to nitrogen and phosphorus limitation. Eur. J. Phycol. 33 (4), 315-332 (1998).
- MacIntyre, H. L., Cullen, J. J. Using Cultures to Investigate the Physiological Ecology of Microalgae. Algal Cult. Tech. , 287-326 (2005).
- Blaise, C., Vasseur, P. Algal microplate toxicity test. Small-scale Freshw. Toxic. Investig. Vol. 1 Toxic. Test Methods. , 137-179 (2005).
- Skjelbred, B., Edvardsen, B., Andersen, T. A high-throughput method for measuring growth and loss rates in microalgal cultures. J. Appl. Phycol. 24, 1589-1599 (2012).
- Nagai, T., Taya, K., Annoh, H., Ishihara, S. Application of a fluorometric microplate algal toxicity assay for riverine periphytic algal species. Ecotoxicol. Environ. Saf. 94, 37-44 (2013).
- Seyedsayamdost, M. R., Case, R. J., Kolter, R., Clardy, J. The Jekyll-and-Hyde chemistry of Phaeobacter gallaeciensis. Nat. Chem. 3 (4), 331-335 (2011).
- Schreiber, U., Schliwa, U., Bilger, W. Continuous recording of photochemical and non-photochemical chlorophyll fluorescence quenching with a new type of modulation fluorometer. Photosynth. Res. 10 (1-2), 51-62 (1986).
- Jones, R. J., Ward, S., Amri, A. Y., Hoegh-Guldber, O. Changes in quantum efficiency of photosystem II of symbiotic dinoflagellates of corals after heat stress, and of bleached corals sampled after the 1998 Great Barrier Reef mass bleaching event. Mar. Freshw. Res. 51 (345), 659-668 (1998).
- Beer, S., Larsson, C., Poryan, O., Axelsson, L. Photosynthetic rates of Ulva (Chlorophyta) measured by pulse amplitude modulated fluorometry. Eur. J. Phycol. 35 (1), 69-74 (2000).
- . . WATER-PAM Chlorophyll Fluorometer. Instrument Description and Information for Users. , (2013).
- Maxwell, K., Johnson, G. M., Heers, J. Chlorophyll fluorescence--a practical guide. J. Exp. Bot. 51 (345), 659-668 (2000).
- Herigstad, B., Hamilton, M., Heersink, J. How to optimize the drop plate method for enumerating bacteria. J. Microbiol. Methods. 44 (2), 121-129 (2001).
- Kooten, O., Snel, J. The use of chlorophyll fluorescence nomenclature in plant stress physiology. Photosynth. Res. 25 (3), 147-150 (1990).
- Maxwell, K., Johnson, G. N. Chlorophyll fluorescence--a practical guide. J. Exp. Bot. 51 (345), 659-668 (2000).
- Schreiber, U. Pulse-Amplitude-Modulation (PAM) Fluorometry and Saturation Pulse Method: An Overview. Chlorophyll a Fluoresc. A Signat. Photosynth. , 279-319 (2004).
- Roháček, K., Barták, M. Technique of the modulated chlorophyll fluorescence: basic concepts, useful parameters, and some applications. Photosynthetica. 37 (3), 339-363 (1999).
- Da Silva, J. M., da Silva, A. B., Pádua, M. Modulated chlorophyll a fluorescence: a tool for teaching photosynthesis. J. Biol. Educ. 41 (4), 178-183 (2007).
- Vieira, S., Ribeiro, L., Jesus, B., Cartaxana, P., da Silva, J. M. Photosynthesis assessment in microphytobenthos using conventional and imaging pulse amplitude modulation fluorometry. Photochem. Photobiol. 89 (1), 97-102 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved