Method Article
Имплантация Miniosmotic Насосы и доставка урочище TRACERS по изучению мозга реорганизации в патофизиологических условиях
В этой статье
Резюме
In order to study brain reorganization under pathological conditions we used miniosmotic pumps for direct protein delivery into the brain circumventing the blood brain barrier. Tract tracers are then injected to study alterations in brain connectivity under the influence of the protein.
Аннотация
Pharmacological treatment in animal models of cerebral disease imposes the problem of repeated injection protocols that may induce stress in animals and result in impermanent tissue levels of the drug. Additionally, drug delivery to the brain is delicate due to the blood brain barrier (BBB), thus significantly reducing intracerebral concentrations of selective drugs after systemic administration. Therefore, a system that allows both constant drug delivery without peak levels and circumvention of the BBB is in order to achieve sufficiently high intracerebral concentrations of drugs that are impermeable to the BBB. In this context, miniosmotic pumps represent an ideal system for constant drug delivery at a fixed known rate that eludes the problem of daily injection stress in animals and that may also be used for direct brain delivery of drugs. Here, we describe a method for miniosmotic pump implantation and post operatory care that should be given to animals in order to successfully apply this technique. We embed the aforementioned experimental paradigm in standard procedures that are used for studying neuroplasticity within the brain of C57BL6 mice. Thus, we exposed animals to 30 min brain infarct and implanted with miniosmotic pumps connected to the skull via a cannula in order to deliver a pro-plasticity drug. Behavioral testing was done during 30 days of treatment. After removal the animals received injections of anterograde tract tracers to analyze neuronal plasticity in the chronic phase of recovery. Results indicated that neuroprotection by the delivered drug was accompanied with increase in motor fibers crossing the midline of the brain at target structures. The results affirm the value of these techniques for drug administration and brain plasticity studies in modern neuroscience.
Введение
The delivery of proteins and pharmacological compounds into the brain are important strategies for studying mechanisms underlying brain diseases and evaluating candidate molecules for new treatments 1,2. In experimental neurosciences, the delivery of vectors such as plasmids or adenoviruses has become an important tool for studying long-term actions of proteins in the brain 3,4. Single injections of vectors present the advantage of a system which by itself will maintain highly stable levels of the therapeutic agent in the brain 4. However, for long term experiments with purified drugs systemic administration by intraperitoneal injection induces stress in mice or rats, and is not the best choice when a targeted brain response is needed, requiring also large doses of drug5. Miniosmotic pumps represent an ideal system for prolonged direct drug delivery into the brain by circumventing both low accessibility to the brain and also peaks of drug concentration, as the delivery of the drug happens directly into a targeted place in the brain and at a fixed flow rate determined by the pump model that is chosen2,6,7. Indeed, this system has allowed us to successfully study brain recovery after stroke by delivery of several drugs such as recombinant human erythropoietin (rhEpo) and vascular endothelial growth factor 6,7.
Brain plasticity is essential for the rewiring of connections in response to brain injuries. Plasticity is a broad concept that ranges from the formation or elimination of synaptic contacts, growth of dendritic spines and also elongation or retraction of long distance connections8,9. The brain was previously believed to not be capable of reconstructing connections after a lesion. However many approaches have shown that if properly stimulated it can reestablish connectivity 6,7,10. One technique that is particularly useful to study this is the use of tract tracers. Anterograde tract tracers are compounds that can enter neurons at the soma and then distribute all along the axons until these reach their target structures. Two examples are cascade blue (CB) and biotinylated dextran amine (BDA). Conversely, retrograde tract tracers, such as cholera toxin B (CTB) or fluorogold (FG) enter the neuron through the axon terminal and then distribute back to the soma thus revealing the site of origin of neurons targeting the injection site.
Here, we present the methods that we use for implantation of miniosmotic pumps for direct delivery of proteins or drugs that have potential effects on neural plasticity as well as the injection of BDA and FG to unveil input and output connections to the motor cortex. BDA will also be used as an example of a tract tracer used to demonstrate increased plasticity of axons emerging from the co after stroke under rhEpo treatment.
протокол
Эксперименты на животных проводились с одобрения правительства (G1361 / 13, G1362 и AZ84-02.04.2013.A192 / 13, AZ84-02.04.2013.A194; Bezirksregierung Дюссельдорф) на основе NIH Руководства по уходу и использованию лабораторных животных.
1. Подготовка Miniosmotic Насосы
- В стерильных условиях (т.е.., Мобильный капот культура), получить насос, катетер, модератор, мозг инфузионной канюли и распорок диски, которые будут использоваться (рисунок 1) течь.
- Для доставки лекарств непосредственно в желудочки использовать одну распорную диск таким образом, что только кончик канюли иглы в находится в контакте с желудочка. Держите канюли с ног на голову щипцами. Добавьте две капли клея цианакрилатного (Калифорния) и ввести один Дистанционная шайба.
- Оставьте канюлю на плоской поверхности, обращенной вверх, так что клей между распорной диска и канюли высохнет.
- Вырезать катетер в разделах около 2,5 см.
- Для еач насоса, подготовить минимальный 300-350 мкл раствора интереса, как это будет необходимо, чтобы полностью заполнить насос таким образом, весь воздух экструзии внутри него, чтобы предотвратить образование пузырьков внутри катетера. Пузыри будут препятствовать потоку Раствор в мозг.
- Осторожно соединить катетер модератором потока.
- Использование 2 мл шприц, соединенный с иглой, предоставленной инфузии комплекта мозга, заполнить насос, пока небольшое количество раствора не избегает насос, таким образом предотвращая пузырьки воздуха внутри него.
- Тщательно заполните модератора потока и катетер обращая внимание, чтобы предотвратить любые пузырьки, оставшиеся внутри катетера.
- Представьте модератора потока внутри насоса.
- После заполнения тщательно соединить канюлю к концу катетера. Если обнаружено, что пузырь формируется удалить канюлю и тщательно заправить катетер с транспортного средства или лекарственного раствора, а затем вновь канюлю.
- Поместите ПУт.пл. в контейнере с стерильным физиологическим раствором и оставить его на 37 ° CO / N.
- Перед имплантацией перепроверить для образования пузырьков. При необходимости (т.е.., Наблюдаются пузырьки) удалить канюли и пополнить трубку. Подключите канюли. Это должно занять всего несколько мкл раствора.
2. Имплантация Miniosmotic Насосы
Примечание: В этих экспериментах животных анестезировали 1% изофлуран (30% O 2, 70% N 2 O). Однако, если это не доступно, использование внутрибрюшинных инъекций анестезии также возможно 11.
- Расположить животное в стереотаксической устройства под анестезией и покрывают глаза с защитным мази, чтобы предотвратить сухость под наркозом. Подтвердите анестезии, наблюдая отсутствие реакции в задней лапы при нажатии пальцами или пинцетом. Не продолжайте, пока животное не полностью спала.
- Разрежьте мех на протяжении онобъявления либо с помощью ножниц или бритья машины. Сокращение в максимально возможной степени, не повреждая кожу.
- Очистите кожу с 70% этанола и дезинфицирующего средства с антибактериальными и фунгицидными свойствами.
- Скальпелем открыть 1 см разрез немного правее от средней линии и подвергать черепа.
- Очистите череп с ватным тампоном. Замочите его с 70% этанола и передать его по черепу. Это будет стимулировать череп, чтобы высохнуть.
- Если череп имеет легкое кровотечение, использовать cauterizer, чтобы устранить любые точки кровотечение. Кровь предотвращает от высыхания CA надлежащим образом над костью раз канюли имплантируется.
- Используйте стереотаксической устройства, чтобы сделать отметку на точке черепа, где канюли будет имплантирован. Для желудочковой вливаний на левом полушарии координат -0.2 мм хвостовой, 0,9 мм сбоку брегмы (2А).
- Аккуратно развернуть над череп делает угол 45 ° с; это предотвращает сверло случайно происходит в Braiп. Неоднократно просверлить в течение нескольких секунд, а затем проверить, насколько глубоко отверстие. Остановите бурение раз череп был поредели, но еще не полностью проник.
- Перерыв мозговых оболочек с кончиком стерильной иглой, пока полный доступ к мозгу не будет достигнута. Сделайте так, осторожно, чтобы чтобы не повредить мозг.
- Очистите череп с 70% этанола с помощью ватного тампона.
- Представьте прямой пинцет под кожу животного в передне-каудальном направлении. Использование щипцов, чтобы открыть пространство под кожей в задней части животного, где насос будет имплантирован. Введение насоса в спине животного, оставляя катетер и канюлю внешней (Фигура 2В). Насос будет оставаться в этом положении, пока он не будет удален и не требует какой-либо фиксации.
- Осторожно установить четыре маленьких капель клея рядом с иглой в канюлю.
- Осторожно ввести иглу через череп, не перемещая его в сторону. Держите его в положении в течение 15-30 сек уntil канюли полностью прилагается (рис 2C.1). После того, как на месте, канюли достигнет 2,5 мм в брюшной дорзо направлении, если был использован один прокладочный диск. Если правильно прикреплен канюля не будет остаются прикрепленными к кости до конца эксперимента.
- Поместите один палец на вкладку съемной, а затем использовать другую руку, чтобы отрезать его за шею с набором ножницы (рис 2C.2).
- Закройте рану на коже с 5-0 шва и добавить несколько капель йода повидон-раствор (ПВП-I) в верхней части раны, чтобы предотвратить инфекцию (рис 2D).
- Перемещение животных в новую клетку. Не оставляйте оперированных животных с животными, которые до сих пор не оперированных. Держите животных, которые были имплантированы только в клетках насосов во время введения препарата.
- Не оставляйте без присмотра мышей, пока они не проснулись и восстановили грудины лежачее положение.
3. Насос RemovaL
Примечание: Обычно эксперимент закончится в конце разрешенного времени доставки с помощью насоса, однако можно снять насос с тем, чтобы сделать вторичные опыты в качестве последующей до доставки лекарств. Для того, чтобы сделать путей трассирующими инъекции он, таким образом, необходимо снять насос.
- Поместите животное в seterotactic устройства под наркозом и покрыть глаза с защитной мази для предотвращения сухости под наркозом. Подтвердите анестезии, наблюдая отсутствие реакции в задней лапы при нажатии пальцами или пинцетом. Не продолжайте, пока животное не полностью спала.
- Осторожно открыть кожу, проходящем через разрез сделано в день имплантации насоса.
- С хирургической зажим держать канюлю и вытащить его. Следует быть легко удалены из черепа. Как нежный кровотечение и ожидалось, остановить его, поставив ватный тампон и ждать в течение 1-2 мин.
- Потяните насос из катетером. ОнLP родом из толкая его, создавая давление на кожу.
- Закройте рану снова с 5-0 шва и добавить несколько капель PVP-I.
- Перемещение животных в новую клетку. Не кладите оперированных животных с животными, которые до сих пор не оперированных. Животные, которые прошли операцию можно поставить вместе.
- Не оставляйте без присмотра мышей, пока они не проснулись и восстановили грудины лежачее положение.
- Разрешить животных для восстановления в течение 10 дней, прежде чем приступить к инъекции трассирующей тракта.
4. Давление впрыска путей Tracer под углом 45 ° на правом Motor Cortex
- Поместите животное на стереотаксической устройства под наркозом и закрывала глаза защитным мази, чтобы предотвратить сухость под наркозом. Подтвердите анестезии, наблюдая отсутствие реакции в задней лапы при нажатии пальцами или пинцетом. Не продолжайте, пока животное не полностью спала.
- Откройте рану головы.
- Сопираться череп с 70% этанола с помощью ватного тампона.
- Ввести 5 мкл стеклянный шприц (26S GA) на вертикальной держателя устройства. Убедитесь, что нижний конец держателя стекла именно в удерживающей части. Шприц должен быть не слишком далеко под ним, как то будет невозможно поместить его под углом 45 ° от вертикального положения и выполнять инъекции.
- Расположите шприц непосредственно над брегмы а затем найдите нужные координаты. Для инъекции от координат моторной коры являются: точка # 1: +0.5 мм ростральной и 2,5 мм боковые по отношению к темени. Пункт # 2: 1,34 мм ростральной, 2,5 мм сбоку по отношению к темени.
- После того, как координаты были расположены, укажите свою позицию по поводу черепа с маркером с тонким наконечником. Сделайте только одна точка в черепе, как чрезмерное выпуска чернил может скрыть правильно координат.
- Осторожно развернуть череп, удерживая сверло в 45 °. Как и в шаге 2.8, проверьте череп часто, так что это не полностью перфорацияораторствовал для того, чтобы избежать повреждения мозга, вызванного сверла. Используйте кончик шприца, чтобы обеспечить, что все кости была удалена.
- Нагрузка 600 нл разбавления меченого тракта в шприц.
- Регулировка вертикального положения на 45 ° по отношению к правой стороне животного. Под микроскопом, поместить кончик иглы шприца прямо перед отверстием.
- Переместить его в вертикальном направлении на 1,5 мм. Пусть иглы устойчивый в этом положении на 30 секунд до 1 минуты, прежде чем делать инъекции давления.
- Вводят 300 нл разбавления примеси в три шага 100 нл отделенных друг от друга на 30 сек. После последней инъекции, оставить шприц устойчивый к 30 сек до 1 мин, чтобы избежать изотоп течь из мозга.
- Медленно вытяните шприц, переместить его на второе отверстие и повторите то же самое с оставшейся 300 NL, которые внутри шприца.
- После второй инъекции, удалите шприц и заполните закрыть WOUй с 5-0 шва и добавить несколько капель PVP-I.
- Перемещение животных в новую клетку. Не кладите оперированных животных с животными, которые до сих пор не оперированных. Животные, которые прошли операцию можно поставить вместе. Не оставляйте без присмотра мышей, пока они не проснулись и восстановили грудины лежачее положение.
- Разрешить животных для восстановления в течение 10 дней до жертвоприношения.
5. Тракт Tracer Наблюдение
- Обезболить животное полностью за институциональных принципов. Подтвердите анестезии, наблюдая отсутствие реакции в задней лапы при нажатии пальцами или пинцетом. Не продолжайте, пока животное не полностью спала.
- Заливать животных 4% параформальдегидом в PBS (рН 7) при стандартных протоколов 6.
- Снимите мозга и после исправить это O / N погружения в 4% параформальдегида.
- Cryoprotect мозги в сахарозы на 30% до тех пор, пока мозг тонуть. Затем удалите мозги и заморозить их на 10 сек Immersion в жидком азоте. Хранить мозги -80 ° С до секции не производятся.
- Изготовление секций на 20 мкм для ретроградного анализа индикаторного тракта и при 40 мкм для анализа индикаторного антероградной тракта секционирования на криостате.
Примечание: FG помечены нейроны могут наблюдаться в виде белых клеток при возбуждении ультрафиолетовым светом. BDA обнаруживается O / N инкубации с авидин-биотин-пероксидаза сложным и 3,3 'диаминобензидина с добавлением никеля на 0,4% до повышения контрастности волокон 6,7.
Результаты
Мы представлены животных 30 мин окклюзии средней мозговой артерии с помощью внутрипросветного методом шовного вызывая повреждение в левой стриатуме, а затем доставляется рчЭпо непосредственно в мозг с помощью miniosmotic насосов (рис 1, рис 3) в течение 30 дней, начиная через 3 дня после Ход 6. На фиг.4 показана схема кортико спинного тракта, что было прослежено после CB и БДА инъекции и области, где инъецировали трассеры. Мы показали улучшение прочности сцепления и двигательной (рис 5) после 14 и 42 дней соответственно рчЭпо доставки. Доставка BDA в правой моторной коры животных, получивших инсульт в левой стриатуме, показали увеличение моторных волокон пересечения средней линии на уровне красного и лица ядра (рис 5), демонстрируя успешное окрашивание прорастания волокон в качестве следствием медикаментозного лечения с miniosmotIC насосы. Лечение рчЭпо также увеличилась выживаемость нейронов, задержка диффузный астроцитоз, снижает образование рубцовой глиальных и увеличение кровеносных сосудов в исследуемый период 6. Используя этот же метод для инъекций индикаторного тракта, мы можем успешно обнаруживать ядра таламуса, которые связаны с корой инъекцией ретроградной индикаторного тракта FG (рис 6).

Рисунок 1. Компоненты miniosmotic насоса, используемого в данном протоколе. Прокладка диска, канюли и съемный вкладке катетер, течь модератором и miniosmotic насос можно наблюдать. Аспект полностью собранном насоса можно увидеть на рисунке 2А. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
ithin-страница = "1"> 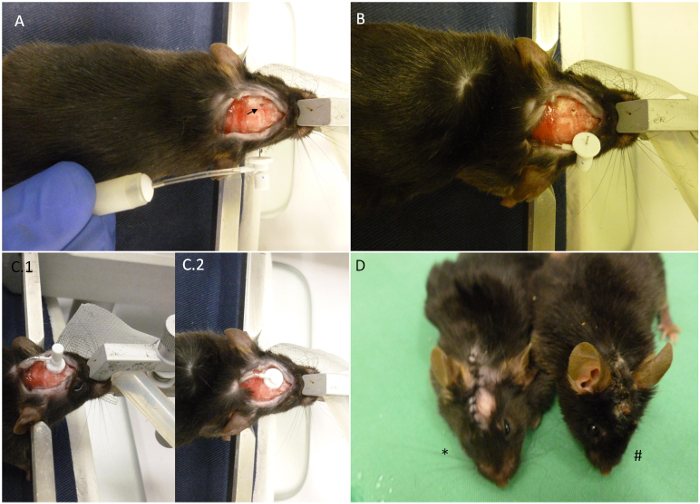
Рисунок 2. Резюме насос имплантации ключевых точек. (А) Мышь показано, как размещены на стереотаксической устройства с полностью построенной miniosmotic насоса рядом с ним. Стрелка указывает координаты, выбранные для имплантации. (Б) Насос был введен на спине животного, и только канюля остается на внешней. Череп уже пробурено. (С) Формат головы после имплантации. (С.1) Канюля находится в положении, но вкладка съемный не были сокращены. (С.2) Вкладка съемный была сокращена и сшивание Теперь рана может начать. (D) Звездочка показывает недавно имплантированный животное по сравнению с животным за 30 дней после имплантации (#). При правильно расположен, рана должна оставаться закрытой до конца процедуры, как показано на изображении.ove.com/files/ftp_upload/52932/52932fig2large.jpg "целевых =" _blank "> Нажмите здесь, чтобы посмотреть большую версию этой фигуры.
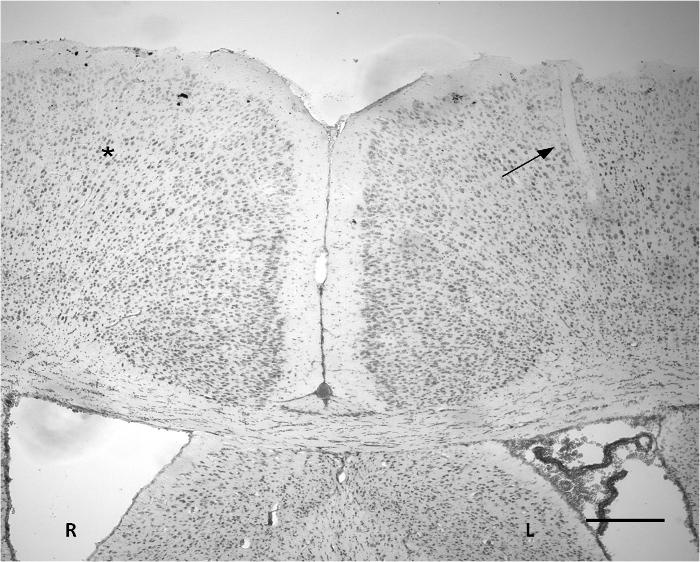
Рисунок 3. Нисслю окрашивание указывает на месте имплантации на коре. Маленький разрез можно наблюдать на части левого мозга (стрелки). Ширина проникшего области примерно 50 мкм. Нет очевидных изменений тяжелые ткани на основе окрашивания Нисслю по сравнению с соответствующей контралатеральной в области (*). Р: Правое полушарие. L: левое полушарие. Масштаб бар = 300 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
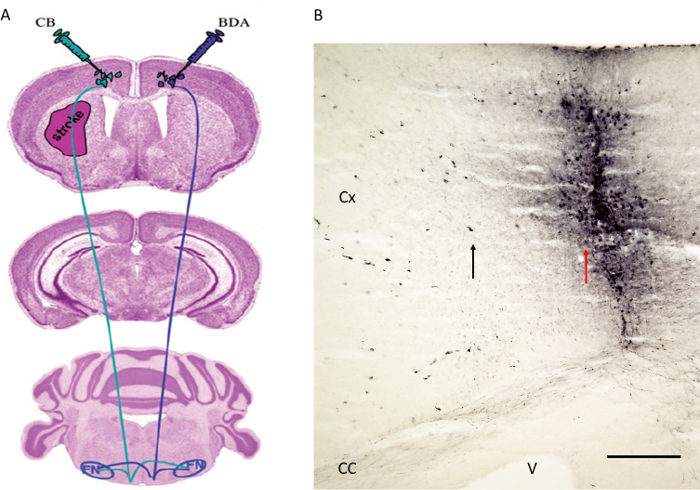
Рисунок 4. Тракттрассирующими впрыск топлива, опубликованной перед самим Reitmeier др. 6,7. (А) Схема, показывающая места инъекций для трейсера тракта BDA в контралатеральной моторной коры, тогда как ЦБ вводили в моторной коре инфарктом полушарии. Вслед к красному ядру (не показан) и ядра лицевого (рисунок 5). (B) в месте инъекции меченого атома антероградную тракта БДА рядом с моторной коре показано волокон. Обратите внимание на красную стрелку, указывающую трек иглы в то время как черная стрелка показывает несколько корковых клеток, меченных с BDA. Сх: Cortex. CC: Корпус мозолистого тела. В: желудочек. FN: ядро лице. Бар Шкала в B = 200 мкм. 4А воспроизводится с любезного разрешения 6. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 5. Восстановление из инфаркта мозга после родов рчЭПО. (А) вводят АРП в contralesional моторной коре затем обнаружен в corticobulbar волокон на уровне ядра лицевого (темени -5,8 мм до -6,3 мм). Пересечение линии на каждом полушарии были сделаны параллельно средней линии и волокон, пересекающих каждую строку в направлении к ipsilesional и contralesional полушарии были подсчитаны и выражается в процентах от общего числа меченых волокон в корково-кишечного тракта. Эритропоэтин увеличилось переправы волокна в направлении к contralesional лица ядерных данные средства + - SD. Данные были проанализированы односторонним ANOVA с последующим наименее значимых различий испытаний, §P <0,05 по сравнению с обработанных носителем неишемических мышей. (Б) поведение двигателя показали улучшение ручной силы хвата и координации в тесте рота стержня. Данные средние ВалуES + - SD. Данные были проанализированы с помощью двусторонней повторные меры ANOVA с последующим односторонним ANOVA / младших различия тестов для каждой временной точки. §P <0,05 по сравнению с предварительно ишемической базового; * Р <0,05 по сравнению с транспортных средств лечение ишемических мышей. Рис 5А и Б воспроизводятся с любезного разрешения 6. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
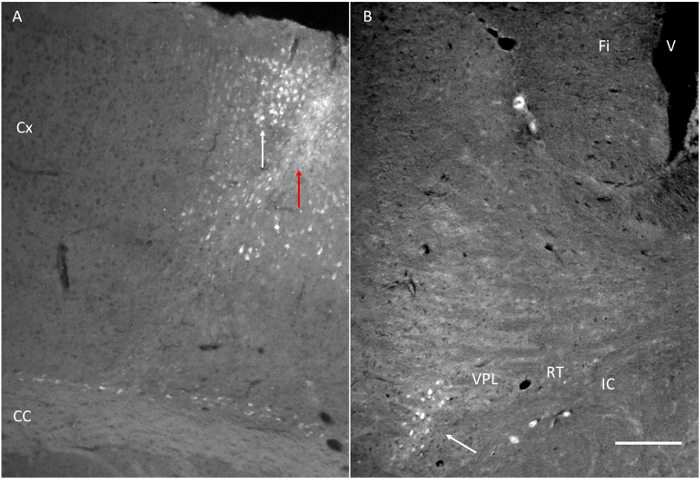
Рисунок 6. Целевые конструкции достигается после инъекции fluorogold (FG). (А) Инъекции сайт FG рядом с моторной коры, как показано на рисунке 1. Обратите внимание на красную стрелку, указывающую иглы трек и белая стрелка с указанием несколько меченых клеток в кора. (Б) Ф. вводят вблизи двигателякора обнаружены в VPL. Fi: Фимбрия. СК: Внутренняя капсула. RT: таламуса ретикулярного ядра. VPL: таламуса вентральной постеролатеральных ядро. Масштаб бар = 200 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
На протяжении многих лет, исследования нейродегенеративных заболеваний, как ишемическим инсультом или черепно-мозговой травмы была сосредоточена на разработке методов лечения, которые нейропротективных направленных на развитие нейронов выживание в острой фазе инсульта. Подавляющее большинство лекарственных терапий, которые были признаны эффективными в моделях грызунов неудачных при переводе в клинику. Причины этого терапевтического недостаточности, включают, но не ограничиваются отсутствием устойчивых эффектов препарата, в результате сохраняющейся функциональной неврологическое восстановление. Таким образом, важно разработать стратегии, способствующие ремоделирования головного мозга в долгосрочной перспективе. Потому что продвижение выживание нейронов не является достаточным, чтобы позволить успешное восстановление хода, как это было предложено большое количество неудачных испытаний нейропротекция, стимуляция нейронов пластичности недавно получил большой интерес в этой области.
Средства для доставки лекарственного средства внутрибрюшинного введения, хвост внутрисосудистого яnjection, бедренной инъекции, один стереотаксической инъекции векторов в мозг и продолжали постоянную доставку miniosmotic насосов. Последнее может включать в себя системную доставку, если насос не канюли, или которые могут быть направлены органа-, как мы показали, для доставки в мозг. За исключением miniosmotic насосов и использования вирусных векторов, все другие стратегии будет вызывать колеблющиеся концентрации препарата. Для долгосрочных экспериментов таким образом, становится необходимым, чтобы представить животное в стрессе получения частые инъекции. ГЭБ накладывает важную препятствием для поглощения мозга белков или препаратов из крови, что приводит к необходимости огромных белковых лекарственных дозах или в целях достижения терапевтической концентрации в головном мозге. Например Пеллегрини и др. (2013) 5 доставлены рчЭпо путем внутрибрюшинной инъекции в дозе, эквивалентной 75 МЕ / сут в течение животного 30 г (750 МЕ / сут в течение 300 г крыса). Для сравнения, направленную доставку rhEpО головного мозга позволило использовать значительно более низкую дозу только 10 МЕ / день в нашем исследовании для успешного восстановления хода, который позволил нам добиться восстановления на большой временной шкале по фиксированной ставке 0,25 мкл / ч.
В этой работе было показано, метод имплантации мини-насосов с канюли, соединенной с черепом, чтобы доставить пластичность, способствующих белок рчЭпо непосредственно в желудочка, в обход ГЭБ. С помощью этого метода, рчЭпо способствует неврологическое восстановление в ряде способами, в том числе сокращение размера инфаркта, уменьшения образования рубцов и глиальных индукции ангиогенеза. рчЭпо также способствовало выживанию нейронов и увеличение проекции от моторной коры contralesional к денервированной красного ядра и ядер лица. Прорастание волокон была обнаружена инъекции индикатора антероградной тракта BDA в моторной коре (4A и 5A). Функциональная коррелятом прорастание волокон прovided улучшением двигательных навыков (рис 5B). Кроме того, мы показали, что такой же подход для инъекций индикаторного тракта могут быть применены, чтобы представить таламо-кортикальных связей путем инъекции ретроградного индикаторного тракта FG (рис 6В).
При подготовке к miniosmotic насоса, важно рассмотреть целевую точку и использование прокладок. Мы используем одну прокладку, чтобы уменьшить длину иглы по 0,5 мм, как в этом случае самый кончик иглы находится в контакте с желудочка в заданные координаты (-0.2 мм хвостового 0,9 мм сбоку, 2,5 мм спинно вентральной, с уважение к темени). Однако, если более глубокие структуры являются объектом исследования, то без прокладок не будет необходимости. Точно так же, если более внешний точка доставки желательно (т.е.., Кора), то больше распорные диски будет необходимо. Катетер должен быть достаточно большим, чтобы насос не слишком близко к голове, как это будет препятствовать движениям муSE, но и не слишком долго, поскольку после имплантации чрезмерная длина может привести катетер, чтобы согнуть, тем самым увеличивая риск удаления канюли естественным движением мыши. Секция 2 см катетера дает очень хорошие результаты в плане мобильности и стабильности имплантата (фиг.1 и 2). Инкубация насоса при 37 ° CO / N позволяет насосу немедленно начать накачки препарата в головном мозге в момент имплантации.
В miniosmotic имплантации насоса важно, чтобы убедиться, что череп правильно высушены перед имплантацией канюли. Обычно очистка с 70% этанола вызовет кость, чтобы высохнуть, но если непрерывная кровотечение встречается, касаясь черепа осторожно cauterizer полностью высушите его. Очень важно, чтобы гарантировать, что введение иглы в вертикальной и медленно, насколько это возможно. После того как в положении, и в то время как клей сушки, поместив палец на верхней части канюли предотвращает его перемещение в сторону О.В.э череп. Особое внимание должно быть уделено раны и размещения канюли. Важно, что разрез не выполняется точно над средней линии черепа, но немного к правой стороне. При закрытии раны, если разрез был сделан на средней линии, кожа будет перегружен, таким образом, увеличивая риск раны открытия. Создание разрез немного в сторону позволит точки шовные быть вдали от самой высокой части канюли. Как следствие, будет меньше напряжения на точках шва и рана заживет должным образом. Животные должны быть в клетке в одиночестве и проверил каждый день, особенно в течение первых 10-15 дней после имплантации. В случае раневой расхождение краев раны, раны должны быть закрыты в кратчайшие сроки. Если канюля удаляется или животное представляет собой инфекцию, эксперимент будет прекращен. Re имплантации канюли не рекомендуется. Это очень важно для успешной имплантации использовать достаточное количество ткани объявлениемhesive (не слишком много!), как это ухудшает кости и увеличивает риск удаления канюли. Однако при использовании слишком мало клея также не будете держать канюлю, прикрепленную к кости. В miniosmotic насосы могут осуществлять лекарствами, растворенными в самых разнообразных веществ, будучи единственным ограничением к этому, что растворитель является биосовместимым. Кроме того, учитывая, что объем мал (200 мкл) необходимо определить, является ли концентрация, необходимая для эксперимента подходит и не вызовет осаждение внутри насоса.
Тракт трассировки либо Антероградный или ретроградных индикаторов очень хорошо создана методика исследования связи мозга и пластичности. Необходимо уделять использование стереотаксической кадров при введении, чтобы обеспечить точность таргетинга на область мозга одним желает учиться (т.е., для предотвращения инъекций в мозолистого тела при введении кору).
Для всех хирургических вмешательств и для того, чтобы уменьшить боль ивоспаление, животные должны быть обработаны с 0,1 мг / кг бупренорфина до вмешательства и Caprofen в дозе 4 мг / кг один раз в день в течение трех дней после вмешательства.
В заключение, этот подход обеспечивает надлежащее инструмент для изучения влияния белков или фармакологических соединений в поврежденном мозге, представляющий метод, который хорошо подходит для исследований по пластичности мозга.
Раскрытие информации
Производство и открытого доступа таксы, предусмотренные DURECT Corporation, которая производит miniosmotic насосов, используемых в этой статье.
Благодарности
This work was supported by the Dr. Werner Jackstädt Foundation (to Eduardo Sanchez-Mendoza), the German Academic Exchange Service (DAAD; to Jeismar Carballo), the German Research Council (HE3173/2-1, HE3173/2-2, and HE3173/3-1; to Dirk M. Hermann), Heinz Nixdorf Foundation (to Dirk M. Hermann).
Материалы
| Name | Company | Catalog Number | Comments |
| Alzet miniosmotic pump. Model 2004. | Alzet | 000298 | Drug container |
| Brain infusion kit 3 1-3 mm | Alzet | 0008851 | Drug brain delivery system |
| Loctite 454 Prism gel | Loctite | 45404 | Cyanoacrylate adhesive for cannula adhesion to the skull |
| 75N glass syringe | Hamilton | 87900/00 | Injection of tract tracers |
| Biotin Dextran Amine (10,000 MW) | Molecular probes | N-7167 | Anterograde tract tracer |
| Fluorogold | Fluorochrome, LLC. | Retrograde tract tracer | |
| Quintessential Stereotaxic Injector (QSI) | Stoelting | 53311 | Stereotactic device for coordinate determination, pump implantation and tract tracer injection. |
Ссылки
- Doeppner, T. R., et al. MicroRNA-124 protects against focal cerebral ischemia via mechanisms involving Usp14-dependent REST degradation. Acta Neuropathol. 126, 251-265 (2013).
- Hoyo-Becerra, C., et al. Rapid Regulation of Depression-Associated Genes in a New Mouse Model Mimicking Interferon-alpha-Related Depression in Hepatitis C Virus Infection. Mol Neurobiol. , (2014).
- Puntel, M., et al. Gene transfer into rat brain using adenoviral vectors. Curr Protoc Neurosci. Chapter 4, Unit 4.24 (2010).
- Miao, J., et al. Overexpression of adiponectin improves neurobehavioral outcomes after focal cerebral ischemia in aged mice. CNS Neurosci Ther. 19, 969-977 (2013).
- Pellegrini, L., et al. Therapeutic benefit of a combined strategy using erythropoietin and endothelial progenitor cells after transient focal cerebral ischemia in rats. Neurol Res. 35, 937-947 (2013).
- Reitmeir, R., et al. Post-acute delivery of erythropoietin induces stroke recovery by promoting perilesional tissue remodelling and contralesional pyramidal tract plasticity. Brain. 134, 84-99 (2011).
- Reitmeir, R., et al. Vascular endothelial growth factor induces contralesional corticobulbar plasticity and functional neurological recovery in the ischemic brain. Acta Neuropathol. 123, 273-284 (2012).
- Hermann, D. M., Chopp, M. Promoting brain remodelling and plasticity for stroke recovery: therapeutic promise and potential pitfalls of clinical translation. Lancet Neurol. 11, 369-380 (2012).
- Overman, J. J., et al. A role for ephrin-A5 in axonal sprouting, recovery, and activity-dependent plasticity after stroke. Proc Natl Acad Sci U S A. 109, E2230-E2239 (2012).
- Wolf, W. A., Martin, J. L., Kartje, G. L., Farrer, R. G. Evidence for Fibroblast Growth Factor-2 as a Mediator of Amphetamine-Enhanced Motor Improvement following Stroke. PLoS One. 9, e108031 (2014).
- Arras, M., Autenried, P., Rettich, A., Spaeni, D., Rulicke, T. Optimization of intraperitoneal injection anesthesia in mice: drugs, dosages, adverse effects, and anesthesia depth. Comp Med. 51, 443-456 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены