È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Costruzione di modelli per la previsione non distruttivo di principio Contenuti di mirtilli mediante spettroscopia nel vicino infrarosso Sulla base di HPLC Misure
In questo articolo
Riepilogo
We present here a protocol to construct and validate models for nondestructive prediction of total sugar, total organic acid, and total anthocyanin content in individual blueberries by near-infrared spectroscopy.
Abstract
Nondestructive prediction of ingredient contents of farm products is useful to ship and sell the products with guaranteed qualities. Here, near-infrared spectroscopy is used to predict nondestructively total sugar, total organic acid, and total anthocyanin content in each blueberry. The technique is expected to enable the selection of only delicious blueberries from all harvested ones. The near-infrared absorption spectra of blueberries are measured with the diffuse reflectance mode at the positions not on the calyx. The ingredient contents of a blueberry determined by high-performance liquid chromatography are used to construct models to predict the ingredient contents from observed spectra. Partial least squares regression is used for the construction of the models. It is necessary to properly select the pretreatments for the observed spectra and the wavelength regions of the spectra used for analyses. Validations are necessary for the constructed models to confirm that the ingredient contents are predicted with practical accuracies. Here we present a protocol to construct and validate the models for nondestructive prediction of ingredient contents in blueberries by near-infrared spectroscopy.
Introduzione
Spettroscopia nel vicino infrarosso (NIR) è ampiamente applicato come una tecnica non distruttiva per analizzare il contenuto di frutta e verdura di vario genere. 1,2 distruttivo analisi mediante spettroscopia NIR consentire la spedizione di solo frutta e verdura deliziosi con qualità garantita. spettroscopia NIR è già stato applicato a arancia, mela, melone, ciliegia, kiwi, mango, papaya, pesca e così via per conoscere il loro Brix che corrisponde al contenuto totale di zuccheri, acidità, TSC (solidi totali contenuti), e così via . Recentemente, abbiamo riportato l'applicazione della spettroscopia NIR per la valutazione della qualità di mirtilli. 3 Abbiamo misurato non solo il contenuto totale di zuccheri e il contenuto totale di acidi organici corrispondente acidità, ma anche il contenuto di antociani totale. Antociani è un componente bioattivo che si crede di migliorare la salute umana. E 'conveniente per i consumatori se possono comprare mirtilli deliziosi con una garanzia del loro contenuto di zucchero, acinva, e contenuto di antociani.
In NIR spettri di assorbimento di frutta e verdura, si osservano solo bande di assorbimento larghe. Sono principalmente le bande dovute alla fibra e umidità. Anche se molte band deboli dovuti a vari ingredienti del target non-distrutto si osservano simultaneamente, le bande osservate non possono essere assegnati a specifici modi vibrazionali di componenti specifici del target in molti casi. Pertanto, la tecnica tradizionale per determinare il contenuto di un componente specifico utilizzando la legge di Lambert-Beer non è efficace per spettri NIR. Invece, modelli di calibrazione per predire il contenuto dei componenti di destinazione dagli spettri osservati sono costruiti utilizzando chemiometria esaminando la correlazione tra gli spettri osservati e il contenuto degli ingredienti corrispondenti agli spettri. 4,5 Qui, un protocollo per costruire e validare i modelli per la previsione del contenuto totale di zuccheri, contenuto in acidi organici totale corrispondente a aCIDITy, e contenuto totale di antociani dei mirtilli da spettri NIR è presentato.
La Figura 1 mostra il diagramma di flusso generale di costruire modelli taratura affidabili e robusti. I campioni di numero sufficiente sono raccolti. Alcuni di essi sono utilizzati per la realizzazione di modelli, mentre gli altri sono usati per la validazione dei modelli costruiti. Per ciascuno dei campioni raccolti, uno spettro NIR è misurata, e quindi i componenti di destinazione vengono analizzati quantitativamente con metodi di analisi chimica distruttivi tradizionali. Qui, cromatografia liquida ad alta prestazione (HPLC) è utilizzato per le analisi chimiche di zuccheri, acidi organici, e antocianine. minimi quadrati parziali (PLS) regressione viene utilizzato per la realizzazione di modelli di calibrazione in cui analisi viene esaminata la correlazione tra gli spettri osservati ei contenuti ingredienti determinato dalla chimica. Al fine di costruire modelli robusti con la migliore capacità di previsione, i pretrattamenti di osserved spettri e le regioni lunghezza d'onda utilizzata per la previsione sono anche esaminati. Infine, i modelli costruiti sono validati per confermare la loro capacità di previsione sufficiente. Nella convalida, il contenuto previsto dallo spettro osservato dal modello costruito (valori previsti) sono confrontati con i contenuti determinate dalle analisi chimiche (valori osservati). Se la correlazione sufficiente non può essere trovato tra i valori previsti e osservati, il modello di calibrazione deve essere ri-costruito fino ad ottenere la correlazione sufficiente. Anche se è preferibile utilizzare diversi gruppi di campioni per la costruzione e la validazione di un modello come mostrato in questa figura (validazione esterna), campioni in uno stesso gruppo vengono utilizzati sia per la costruzione e la validazione (validazione incrociata) quando il numero di campioni non è abbastanza grande.
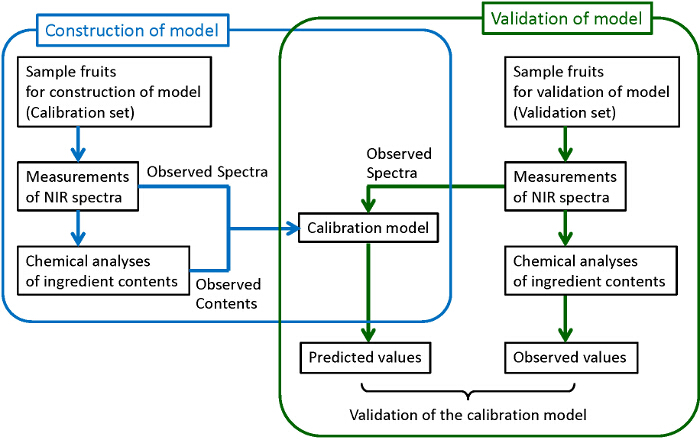
FIGURA 1. Diagramma di flusso per la costruzione e la validazione del modello di calibrazione. Le procedure, circondati da linee blu e verde corrispondono, rispettivamente, alla costruzione di un modello di calibrazione e la sua validazione. Cliccate qui per vedere una versione più grande di questa figura.
Protocollo
1. Raccolta dei campioni
- Decidere quali cultivar sarà incluso nel target del modello di calibrazione.
- Raccogliere il numero sufficiente e vari tipi di mirtilli campioni delle cultivar di destinazione.
- Raccogliere preferibilmente 100 mirtilli per la costruzione del modello di calibrazione, e almeno 10 per la validazione del modello costruito. Al fine di costruire modelli robusti, raccogliere campioni di vario tipo, cioè con i vari colori, dimensioni, e in diverse condizioni di maturazione.
- Pesare ogni mirtillo. Nota: I pesi misurati siano utilizzati per il calcolo del contenuto percentuale di ingredienti di ogni mirtillo.
2. Misure di Spectra
- Warm-up lo spettrofotometro sufficienza (più di 1 ora) prima che le misurazioni per ottenere spettri affidabile.
- Impostare lo spettrofotometro. Assicurarsi che le condizioni sono costanti attraverso tutte le misurazioni. Unesempio di condizioni tipiche per le misurazioni è riportata qui sotto.
- Impostare la gamma di misure per 12,500-3,600 cm -1.
- Impostare la risoluzione spettrale a 16 cm -1.
- Impostare l'accumulo a 32 volte.
- Selezionare riflettanza diffusa come modalità di misura.
- Mettere il riflettore standard sulla finestra dello spettrofotometro per misure di riflettanza diffusa. Utilizzando il comando "sfondo singolo canale", misurare lo spettro di fondo che viene utilizzato per i calcoli di relativa spettri di riflettanza dagli spettri di mirtilli campione misurato dopo.
- Mettere un campione mirtillo nel centro della finestra dello spettrofotometro per misure di riflettanza diffusa. Utilizzando il comando "campione singolo canale", misurare spettri di ogni mirtillo preferibilmente in diversi punti del frutto.
Nota: Kubelka-Munk trasformazione 6,7 verrà eseguita anche automente per gli spettri osservati di mirtilli campione se la condizione di acquisizione spettrale è impostato a farlo. Kubelka-Munk trasformazione altera gli spettri misurati in modalità riflettanza diffusa agli spettri equivalenti a quelli misurati nella modalità di trasmissione ed è necessaria per le analisi di spettri con elevata precisione. Spectra nella scala di assorbanza sono utilizzati per le analisi. - Calcolare lo spettro medio degli spettri di ciascun campione utilizzando un programma di elaborazione di dati come MS Excel se gli spettri di un campione di mirtillo sono misurate in più punti. Utilizzare lo spettro in media per le analisi.
3. pretrattamento per HPLC Misure di zuccheri e acidi organici 8
Nota: Estrarre zuccheri e acidi organici di ogni mirtillo, che sono solubili in acqua, con acqua ultrapura come segue. Tutta ciascun mirtillo è utilizzato per le analisi.
- Mantenere i mirtilli in un congelatore di sotto -30 ° C pronto foanalizza r chimiche se non vengono analizzati subito dopo le misure spettrali.
- Tagliare un mirtillo in vari pezzi in modo che possa essere facilmente omogeneizzato nei seguenti passi. Tagliare il mirtillo senza sbrinamento quando viene congelato.
- Mettere i pezzi in un bicchiere da 50 ml.
- Aggiungere ca. 10 ml di acqua ultrapura (acqua distillata la cui conduttività elettrica è inferiore a 0,1 mS / cm) al bicchiere.
- Riscaldare il mirtillo taglio in acqua ultrapura in un forno a microonde per 20 secondi per inattivare gli enzimi che possono decomporsi zuccheri durante l'analisi.
- Aggiungere circa 10 ml di acqua ultrapura nel becher.
- Omogeneizzare la miscela per 5 min a 12.000 rpm con un omogeneizzatore dotato di un albero standard e generatore.
- Centrifugare la miscela omogeneizzata per 10 minuti a 3000 rpm (2.000 × g).
- Raccogliere filtrato mediante filtrazione sotto vuoto del campione centrifugato utilizzando un filtro di carta 5B.
- Ripetere l'3,6-3,9 passi due volte su Thresidui di filtrazione e di raccogliere tutti gli zuccheri e acidi organici, e combinare tutti filtrati.
- Misurare il pH del filtrato e regolare a 7 con acido cloridrico diluito (0,1 e 0,01 mol L -1) e diluire soluzioni acquose di idrossido di sodio (0,1 e 0,01 mol L -1).
- Diluire il filtrato a 50 ml con acqua ultrapura.
- Suddividere il campione in due; una per l'analisi degli zuccheri e l'altro per l'analisi di acidi organici.
- Far passare la prima soluzione campione attraverso colonne (due C18, CM e QMA) collegato in serie ad escludere pigmenti, cationi e anioni. Buttare via i primi 1 ml di soluzione campione dalle colonne. Quindi utilizzare la soluzione campione dalle colonne per l'analisi degli zuccheri mediante HPLC.
- Far passare la seconda soluzione campione attraverso colonne (due C18 e CM) collegati in serie per escludere pigmenti e cationi. Buttare via i primi 1 ml di soluzione campione dalle colonne. Quindi utilizzare la soluzione di esempio dal columns per l'analisi di acidi organici mediante HPLC.
- Centrifugare ogni soluzione dalla procedura 3.14 e 3.15 a 6.600 rpm (5.800 × g), per 10 min in un microtubo dotato di un filtro da 0,45 micron con un mini-centrifuga prima dell'analisi mediante HPLC.
4. Le misurazioni HPLC degli zuccheri
Nota: In questo studio, contenuti somma di saccarosio, glucosio e fruttosio di ogni mirtillo è considerato come il contenuto totale di zuccheri. Pertanto, la curva di lavoro per ciascuno dei tre zuccheri si ottiene prima, e poi il contenuto somma degli zuccheri in ciascun mirtillo è ottenuto. I contenuti standard sono riportati come 0,3-0,4% in peso (saccarosio), 3.8-4.8% in peso (glucosio) e 4,2-5,3% in peso (fruttosio). 9
- Misura circa 200 mg di saccarosio con precisione, e scioglierlo in 50 ml di acqua ultrapura per preparare una soluzione standard. Diluire 5 ml della soluzione a 50 ml con acqua ultrapura per preparare il secondo soluzioni standard. Preparare allo stesso modo la terza posizionesoluzione ARD dalla seconda soluzione standard.
- Preparare le soluzioni standard di glucosio e fruttosio, in modo simile.
- Disporre il sistema HPLC come segue:
- Utilizzare una colonna di gel permeazione nel forno a colonna a 40 ° C.
- Utilizzare acqua ultrapura degasata con la portata di 0,1 ml / min come l'eluato.
- Utilizzare un rilevatore di indice di rifrazione.
- Misurare le spettrogrammi HPLC di soluzioni standard iniettando un'aliquota di 20 microlitri per ogni misurazione. Nota: Qui, PAC soluzione viene utilizzato come il software per la misurazione.
- Ottenere l'intensità della banda di zucchero sul cromatogramma di ciascuna soluzione standard zona cliccando 'ri-analisi' con il tasto destro del mouse.
- Tracciare le intensità zona contro le corrispondenti concentrazioni per ottenere la curva di lavoro per ogni zucchero dalla regressione lineare, in cui l'equazione che rappresenta la relazione tra l'intensità zona e la concentrazione viene ottenuta for ogni zucchero.
- Misurare le spettrogrammi HPLC di soluzioni campione iniettando un'aliquota di 20 microlitri per ogni misurazione.
- Ottenere le intensità delle bande di zuccheri sul cromatogramma di ciascuna soluzione campione zona come precedentemente descritto al punto 4.5.
- Ottenere le concentrazioni degli zuccheri negli soluzioni utilizzando le equazioni corrispondenti alle curve di lavoro ottenuti nel passo 4.6.
- Ottenere la quantità di ciascun zucchero in ogni mirtillo dalle concentrazioni della soluzione campione ottenuto nel passaggio precedente e il volume totale della soluzione campione (50 ml, vedere la fase 3.12).
- Ottenere gli importi totali di zucchero di ogni frutto sommando il contenuto di tre zuccheri.
- Ottenere la percentuale del contenuto di zucchero totale di ogni mirtillo utilizzando il peso misurato nel passo 1.3.
5. Le misurazioni HPLC degli acidi organici
Nota: In questo studio, contenuti somma di acido citrico, acido chinico, malicol'acido e l'acido succinico sono considerati il contenuto totale di acidi organici. Pertanto, la curva di lavoro per ciascuno dei quattro acidi organici è ottenuta prima, e poi il contenuto di acido organico in ogni mirtillo viene misurato. I contenuti standard sono riportati come 0,42-0,62% in peso (acido citrico), 0-0,15% in peso (acido quinic), 0,08-,23% in peso (acido malico), e 0,06-0,25% in peso (acido succinico). 9
- Misura circa 5 mg di acido citrico con precisione, e sciogliere in 50 ml di acqua ultrapura per preparare una soluzione standard. Diluire 5 ml della soluzione a 50 ml con acqua ultrapura per preparare il secondo soluzioni standard. Preparare simile terza soluzione standard dalla seconda soluzione standard.
- Preparare le soluzioni standard di acido chinico, acido malico e acido succinico, in modo simile.
- Disporre il sistema HPLC come segue:
- Utilizzare due colonne a scambio anionico collegati in serie in forno a colonna a 40 ° C.
- Uso degasato soluzione acquosa allo 0,1% di fosforicoacido con la portata di 0,02 ml / min come l'eluato.
- Utilizzare un set rivelatore UV-visibile a 210 nm.
- Misurare le spettrogrammi HPLC di soluzioni standard iniettando un'aliquota di 20 ml di soluzione standard per ogni misurazione.
- Ottenere l'intensità della banda di acido organico sul cromatogramma di ciascuna soluzione standard zona cliccando 'ri-analisi' con il tasto destro del mouse.
- Tracciare le intensità zona contro le corrispondenti concentrazioni per ottenere la curva di lavoro per ogni acido organico dalla regressione lineare, in cui si ottiene l'equazione che rappresenta la relazione tra l'intensità zona e la concentrazione per ciascun acido organico.
- Misurare le spettrogrammi HPLC di soluzioni campione iniettando un'aliquota di 20 microlitri del campione per ogni misurazione.
- Ottenere le intensità delle bande di acidi organici sul cromatogramma di ciascuna soluzione campione zona come descritto in precedenza al passo 5.5.
- Ottenere le concentrazioni degli acidi organici nelle soluzioni utilizzando le equazioni corrispondenti alle curve di lavoro ottenuti nel passo 5.6.
- Ottenere la quantità di ciascun acido organico in ciascuna mirtillo dalle concentrazioni della soluzione campione ottenuto nel passaggio precedente e il volume totale della soluzione campione (50 ml, vedere la fase 3.12).
- Ottenere la quantità di acido organico totale in ciascun mirtillo sommando i contenuti dei quattro acidi organici.
- Ottenere la percentuale contenuto di acido organico totale di ogni mirtillo utilizzando il peso misurato nel passo 1.3.
6. pretrattamento per HPLC Misure di antociani
- Tenere i mirtilli in congelatore a -80 ° C pronto per analisi chimiche se non vengono analizzati subito dopo le misure spettrali.
- Asciugare ogni frutto congelato con un liofilizzatore vuoto per 12 ore.
- Estrarre antocianine dal mirtillo essiccate in 1% soluzione di metanolo of acido trifluoroacetico [peso di mirtillo (g) / volume della soluzione (ml) = 1/10] lasciando la miscela in frigorifero a 4 ° C per 12 ore.
- Centrifugare l'estratto per 15 min in un microtubo 2 ml con un'ultracentrifuga a -8 ° C e 15.000 rpm (21.900 × g).
- Filtrare l'estratto attraverso un filtro da 0.45 micron per ottenere il campione per la misurazione HPLC.
7. Le misurazioni HPLC di antociani
Nota: Circa 13 tipo antociani sono compresi nel mirtilli. Poiché è difficile ottenere curve di lavoro per tutte le antocianine, una curva di lavoro solo cianidina-3- cloruro O -glucoside, una delle antocianine più popolari in mirtilli, si ottiene. La curva di lavoro è applicato per quantificazioni approssimativi di altri antociani.
- Misura circa 1,5 mg di cloruro -glucoside cianidina-3- O precisione e sciogliere in 10 ml di 1% soluzione metanolica di acido trifluoroacetico a prepare una soluzione standard. Diluire 5 ml della soluzione a 10 ml con 1% soluzione metanolica di acido trifluoroacetico per preparare il secondo soluzioni standard. Analogamente, preparare la terza e la quarta soluzioni standard sequenziale.
- Disporre il sistema HPLC come segue:
- Utilizzare una colonna a fase inversa C18 in un forno a colonna a 40 ° C.
- Applicare il metodo del gradiente usando eluati di acido 0,1% trifluoroacetico acquoso (eluire A) e acido trifluoroacetico 0,5% in acetonitrile (eluire B) alla portata di 0,1 ml / min, dove il rapporto di aumenti Eluire B dall'8% al 15% durante 0-50 min dopo l'iniezione, e dal 15% al 75% durante 50-60 min dopo l'iniezione.
- Utilizzare una matrice di controllo del rivelatore di fotodiodi a 520 nm.
- Misurare le spettrogrammi HPLC di soluzioni standard iniettando una aliquota di 10 microlitri per ogni misurazione. "LC Solution" viene utilizzato come il software per la misurazione.
- Ottenere l'intensità della banda di zonacloruro O -glucoside cianidina-3- sul cromatogramma di ogni soluzione standard cliccando 'ri-analisi' con il tasto destro del mouse.
- Tracciare le intensità zona contro le concentrazioni corrispondenti per ottenere la curva di lavoro per cianidina-3- cloruro O -glucoside dalla regressione lineare, in cui si ottiene l'equazione che rappresenta la relazione tra l'intensità e la concentrazione zona per cianidina-3- cloruro O -glucoside.
- Misurare le spettrogrammi HPLC di soluzioni campione iniettando una aliquota di 10 microlitri per ogni misurazione.
- Ottenere l'intensità della banda di ogni antocianina sul cromatogramma di ciascuna soluzione campione zona come precedentemente descritto al punto 7.4.
- Ottenere le concentrazioni di antociani nelle soluzioni utilizzando l'equazione corrispondente alla curva di lavoro ottenuta nello stadio 7.5.
- Ottenere la quantità di ciascun antociani in ogni mirtillo dalla concentrazione ottenuta nel precedentepasso e il volume totale della soluzione campione utilizzato nel passaggio 6.3.
- Ottenere la quantità totale di antociani in ogni mirtillo sommando i contenuti delle tredici antociani.
- Ottenere la percentuale contenuto della antocianina totale di ogni mirtillo utilizzando il peso misurato nel passo 1.3.
8. Costruzione di modelli di calibrazione per la previsione di principio contenuto
Nota: regressione PLS, 4,5, che è un tipo di tecnica di regressione multipla utilizzando varianti latenti, viene utilizzato per la realizzazione di modelli di calibrazione per ogni ingrediente dagli spettri osservati ei contenuti ingredienti determinati da analisi chimiche. PLS regressione viene effettuata sia con i programmi commerciali o insieme ai programmi in casa. Vedere riferimenti 5,10 per i processi dettagliati della costruzione di modelli.
- Esaminare quali pretrattamenti per spettri osservati sono più efficaci per un preciso eprevisione robusti.
- Costruire modelli di calibrazione mediante l'applicazione di uno o due dei seguenti pretrattamenti: MSC (Correzione Scatter moltiplicativo), 1,2,5 SNV (Standard Normal Variate), 1,2,5 MMN (Min-Max Normalizzazione), COE (Constant Offset eliminazione ), e il primo o il secondo calcolo derivata da SG (Savitzky-Golay) metodo. 1,2,5 Pronostica il contenuto ingredienti della convalida del gruppo dai loro spettri con i modelli costruiti.
Nota: In MMN, uno spettro è normalizzata in modo che i valori minimo e diventano 0 e 1, rispettivamente. In COE, l'ordinata di uno spettro viene spostata in modo che il valore minimo diventa zero. - Calcola coefficiente di determinazione, R 2, e la deviazione residua predittiva, RPD, tra l'osservato e valori della convalida set esaminare quali pretrattamenti per gli spettri osservati sono più efficaci previsto. Scegliere la combinazione di pretrattamenti dando maggioreR 2 e RPD.
- Costruire modelli di calibrazione mediante l'applicazione di uno o due dei seguenti pretrattamenti: MSC (Correzione Scatter moltiplicativo), 1,2,5 SNV (Standard Normal Variate), 1,2,5 MMN (Min-Max Normalizzazione), COE (Constant Offset eliminazione ), e il primo o il secondo calcolo derivata da SG (Savitzky-Golay) metodo. 1,2,5 Pronostica il contenuto ingredienti della convalida del gruppo dai loro spettri con i modelli costruiti.
- Esaminate quali regioni wavenumber sono efficaci per la predizione accurata e robusto applicando, ad esempio, si spostano-finestre PLS tecnica 11 per cercare le regioni efficaci.
Nota: La procedura corrisponde alla rimozione delle regioni numero d'onda in cui gli spettri non contengono informazioni efficace per le previsioni o che contengono informazioni che interferisce con le previsioni.
9. validazione dei modelli di taratura
Nota: Vedere riferimenti 5,10 per i processi dettagliati del validazione dei modelli costruiti.
- Prevedere contenuti ingredienti della convalida del gruppo dai loro spettri con i modelli di calibrazione costruiti con la migliore combinazione di pretrattamenti e per le regioni wavenumber efficaci per la predizione. 5,10
- Calcolare R 2 e RPD tra l'osservato e predettoI valori del set di validazione. 5,10
- Esaminare se i criteri generali per l'esecuzione pratica dei modelli di calibrazione, 12,13 R 2> 0.85 e RPD> 2.5, sono soddisfatti. Si consideri la ricostruzione del modello se i criteri non sono soddisfatti.
Risultati
La figura 2 mostra un esempio di un insieme di spettri NIR assorbimento di mirtilli dove spettri di 70 mirtilli sono presenti simultaneamente. Dal momento che le bande sicuramente assegnabili a zuccheri, acidi organici, o antocianine non vengono osservate negli spettri NIR, la legge tradizionale di Lambert-Beer non è applicabile per quantificare il contenuto degli ingredienti. Pertanto, la costruzione di modelli per la previsione dei contenuti ingrediente è necessario....
Discussione
Alcuni ulteriori commenti sul protocollo sono descritte qui. In primo luogo, nel passo 1.1, è menzionato per decidere le cultivar incluse nel bersaglio. Anche se è possibile costruire modelli che coprono mirtilli da molte cultivar o senza specificare cultivar, le precisioni pronostici con i modelli sono a volte molto inferiori a quelli con i modelli per una singola cultivar e per le cultivar limitate. Va inoltre notato che i modelli di calibrazione devono essere costruiti per i mirtilli da ogni sito di produzione per ...
Divulgazioni
We have nothing to disclose.
Riconoscimenti
This work was partially supported by the project "A Scheme to Revitalize Agriculture and Fisheries in Disaster Area through Deploying Highly Advanced Technology" of Ministry of Agriculture, Forestry and Fisheries, Japan.
Materiali
| Name | Company | Catalog Number | Comments |
| FT-NIR spectrophotometer | Bruker Optics GmbH | MPA | |
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45000-31, 228-45018-31, | For sugar analysis |
| 223-04500-31, 228-45010-31, 228-45095-31 | Refractive Index Detector | ||
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45003-31, 228-45000-31, | For organic acid analysis |
| 228-45018-31, 228-45010-31, 223-04500-31 | Ultraviolet-Visible Detector | ||
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45018-31, 228-45000-31, | For anthocyanin analysis |
| 228-45012-31, 228-45119-31, 228-45005-31, | Photodiode Array Detector | ||
| 228-45009-31 | |||
| pH meter | Mettler-Toledo | 30019028 | S220, Automatic temperature compensation |
| Ultra-pure water treatment equipment | ORGANO Corporation | ORG-ULXXXM1; PRA-0015-0V0 | PURELAB ultra; PURELITE |
| Biomedical Freezers | SANYO | 2-6780-01 | MDF-U338 |
| Ultra-Low Temperature Freezer | Panasonic healthcare Co.,Ltd. | KM-DU73Y1 | -80°C |
| Vacuum lyophilizer | IWAKI GLASS Co.,Ltd | 119770 | DRC-3L;FRD-82M |
| Homoginizer | Microtec Co., Ltd. | Physcotron | |
| Ultracentrifuge | Hitachi Koki Co.,Ltd | S204567 | CF15RXII |
| Mini-centrifuge | LMS CO.,LTD. | KN3136572 | MCF-2360 |
| Centrifuge | Kokusan Co.,Ltd | 2-5534-01 | H-103N |
| Filter Paper | Advantec | 1521070 | 5B, Eqivalent to Whatman 40 |
| Sep-Pak C18 column | Waters Corporation Milford | WAT020515 | |
| Sep-Pak CM column | Waters Corporation Milford | WAT020550 | |
| Sep-Pak QMA column | Waters Corporation Milford | WAT020545 | |
| Centrifugal Filter Unit | Merck Millipore Corporation | R2SA18503 | PVDF, 0.45 μm |
| Microtube | As One Corporation | 1-1600-02 | PP, 2 mL |
| Syringe Filter | GE Healthcare CO.,LTD. | 6788-1304 | PP, 0.45 μm |
| Sucrose | Wako Pure Chemical Industries,Ltd | 194-00011 | Reagent-grade |
| Glucose | Wako Pure Chemical Industries,Ltd | 049-31165 | Reagent-grade |
| Fructose | Wako Pure Chemical Industries,Ltd | 123-02762 | Reagent-grade |
| Citric acid | Wako Pure Chemical Industries,Ltd | 036-05522 | Reagent-grade |
| Malic acid | Wako Pure Chemical Industries,Ltd | 355-17971 | Reagent-grade |
| Succinic acid | Wako Pure Chemical Industries,Ltd | 190-04332 | Reagent-grade |
| Quinic acid | Alfa Aesar, A Johnson Matthey Company | 10176328 | Reagent-grade |
| Phosphoric acid | Wako Pure Chemical Industries,Ltd | 162-20492 | HPLC-grade |
| Trifluoroacetic acid | Wako Pure Chemical Industries,Ltd | 208-02746 | Reagent-grade |
| Methanol | Wako Pure Chemical Industries,Ltd | 131-01826 | Reagent-grade |
| Acetonitrile | Wako Pure Chemical Industries,Ltd | 015-08633 | HPLC-grade |
| Grade cyanidin-3-O-glucoside chloride | Wako Pure Chemical Industries,Ltd | 306-37661 | HPLC-grade |
| Software for analyses | Bruker Optics GmbH | OPUS ver. 6.5 | |
| Softoware for preprocessing | Microsoft | Excel powered by Visual Basic for Applications | |
| Software for construction of models | Freemat 4.0 | http://freemat.sourceforge.net/ |
Riferimenti
- Ozaki, Y., McClure, W. F., Christy, A. A. . Near-infrared Spectroscopy in Food Science and Technology. , (2007).
- Sun, D. W. . Infrared Spectroscopy for Food Quality Analysis and Control. , (2009).
- Bai, W., Yoshimura, N., Takayanagi, M. Quantitative analysis of ingredients of blueberry fruits by near infrared spectroscopy. J. Near Infrared Spectrosc. 22, 357-365 (2014).
- Hasegawa, T., Tasumi, M. . Chemometrics in infrared spectroscopic analysis. In: Introduction to Experimental Infrared Spectroscopy. , 97-113 (2015).
- Varmuza, K., Filzmoser, P. . Introduction to Multivariate Statistical Analysis in Chemometrics. , (2009).
- Kubelka, P. New contributions to the optics of intensely light-scattering materials. Part I. J. Opt. Soc. Am. 38, 448-457 (1948).
- Juang, R. H., Storey, D. E. Quantitative determination of the extent of neutralization of carboxylic acid functionality in carbopol 974P NF by diffuse reflectance fourier transform infrared spectrometry using Kubelka-Munk function. Pharm Res. 15, 1714-1720 (1998).
- Ogiwara, I., Ohtsuka, Y., Yoneda, Y., Sakurai, K., Hakoda, N., Shimura, I. Extraction method by water followed by microwave heating for analyzing sugars in strawberry fruits. J. Jpn. Soc. Hort. Sci. 68, 949-953 (1999).
- Che, J., Suzuki, S., Ishikawa, S., Koike, H., Ogiwara, I. Fruit ripening and quality profile of 64 cultivars in three species of blueberries grown in Tokyo. Hort. Res. (Japan). 8, 257-265 (2009).
- Pomerantsev, A. L. . Chemometrics in Excel. , (2014).
- Jiang, H. J., Berry, R. J., Siesler, H. W., Ozaki, Y. Wavelength Interval Selection in Multicomponent spectral analysis by moving window partial least-squares regression with applications to mid-infrared and near-infrared spectroscopic data. Anal. Chem. 74, 3555-3565 (2002).
- Edney, M. J., Morgan, J. E., Williams, P. C., Campbell, L. D. Analysis of feed barley by near infrared reflectance spectroscopy. J. Near-Infrared Spectrosc. 2, 33-41 (1994).
- Mathison, G. W., et al. Prediction of composition and ruminal degradability characteristics of barley straw by near infrared reflectance spectroscopy. Can. J. Anim. Sci. 79, 519-523 (1999).
- Chiara, F., et al. Analysis of anthocyanins in commercial fruit juices by using nano-liquid chromatography electrospray-mass spectrometry and high performance liquid chromatography with UV-vis detector. J. Separation Sci. 34, 150-159 (2011).
- Li, Q., et al. Antioxidant anthocyanins screening through spectrum-effect relationships and DPPH-HPLC-DAD analysis on nine cultivars of introduced rabbiteye blueberry in China. Food Chemistry. 132, 759-765 (2013).
- Sinelli, N. Evaluation of quality and nutraceutical content of blueberries (Vaccinium corymbosum L.) by near and mid-infrared spectroscopy. Postharvest Biol. Technol. 50, 31-36 (2008).
- Giusti, M. M., Wrolsted, R. E., Wrolstad, R. E., Schwartz, S. J. Anthocyanins: characterization and measurement with UV-visible spectroscopy. Current Protocols in Food Analytical Chemistry. , 1-13 (2001).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon