Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Dissection et Flat-montage de l'épinoche à trois épines branchiale Squelette
Dans cet article
Résumé
The branchial skeleton, including gill rakers, pharyngeal teeth, and branchial bones, serves as the primary site of food processing in most fish. Here we describe a protocol to dissect and flat-mount this internal skeleton in threespine sticklebacks. This method is also applicable to a variety of other fish species.
Résumé
The posterior pharyngeal segments of the vertebrate head give rise to the branchial skeleton, the primary site of food processing in fish. The morphology of the fish branchial skeleton is matched to a species' diet. Threespine stickleback fish (Gasterosteus aculeatus) have emerged as a model system to study the genetic and developmental basis of evolved differences in a variety of traits. Marine populations of sticklebacks have repeatedly colonized countless new freshwater lakes and creeks. Adaptation to the new diet in these freshwater environments likely underlies a series of craniofacial changes that have evolved repeatedly in independently derived freshwater populations. These include three major patterning changes to the branchial skeleton: reductions in the number and length of gill raker bones, increases in pharyngeal tooth number, and increased branchial bone lengths. Here we describe a detailed protocol to dissect and flat-mount the internal branchial skeleton in threespine stickleback fish. Dissection of the entire three-dimensional branchial skeleton and mounting it flat into a largely two-dimensional prep allows for the easy visualization and quantification of branchial skeleton morphology. This dissection method is inexpensive, fast, relatively easy, and applicable to a wide variety of fish species. In sticklebacks, this efficient method allows the quantification of skeletal morphology in genetic crosses to map genomic regions controlling craniofacial patterning.
Introduction
Une quantité incroyable de diversité existe dans le squelette de la tête chez les vertébrés, en particulier chez les poissons. Dans de nombreux cas , cette diversité facilite les stratégies d'alimentation différentes : 1 - 4, et peut impliquer des changements majeurs à la fois un motif craniofaciale externe et interne. Le squelette branchial est situé à l'intérieur de la gorge d'un poisson et qui entoure la majeure partie de la cavité buccale. Le squelette branchial est composé de 5 segments en série homologues, les quatre antérieure qui soutiennent les branchies. Ensemble , ces cinq segments fonctionnent comme une interface entre les poissons et leur nourriture 5. Variation dans une multitude de traits, y compris branchiospines, dents pharyngiennes, et les os branchiaux contribuent à la recherche de nourriture efficace sur les différents types d'aliments.
Épinoches ont subi une radiation adaptative après des formes océaniques ancestrales colonisées lacs d'eau douce et les criques tout l'hémisphère nord. Le changement dans le régime alimentairedu petit zooplancton dans l'océan à des proies plus grosses en eau douce a donné lieu à une variation trophique dramatique dans plusieurs traits craniofaciales 6. Alors que de nombreuses études ont porté sur les différences craniofaciales externes dans épinoches 7 - 13, des changements importants craniofaciales évoluent de façon répétée dans le squelette branchial interne. La possibilité de créer des hybrides fertiles entre les populations d'épinoches morphologiquement distinctes offre une excellente occasion de cartographier la base génétique des changements ont évolué vers le squelette branchial.
Un trait trophique d'importance écologique est la structuration des branchicténies, des os dermiques périodiques qui tapissent les faces antérieure et postérieure des os branchies et sont utilisés pour filtrer les proies. Les poissons qui se nourrissent généralement sur de petits objets de proies ont tendance à avoir plus et plus densément maillant espacées branchicténies par rapport aux poissons qui se nourrissent de proies plus grosses 14,15. Variation branchicténies a été rapporté à la fois wSEIN et entre les espèces 14-19, et les aspects de la branchicténies patterning contribuent à des niches trophiques et remise en forme 16. Des décennies de recherche ont largement documenté nombre maillant racloir et la variation de longueur dans épinoches à trois épines 17 - 21; Toutefois, ces études se concentrent généralement sur la première rangée de branchiospines. Des travaux récents ont montré la modularité dans le contrôle génétique du nombre maillant racloir à travers le squelette branchial 22,23 et à travers une seule ligne dans branchicténies espacement 23 et la longueur 24 mettant en évidence l'importance d'étudier plus de ramer un ou une seule raker maillant pour comprendre le base génétique du développement de la réduction des branchies racloir.
Un second trait trophique de signification à la fois écologique et biomédicale est le motif de dents pharyngées. Dents chez les poissons peuvent être situés à la fois dans la mâchoire, et par voie orale dans le squelette branchial, connu sous le nom de dents pharyngées. dents orales sont utilisées principalement pour prey capturer tout les dents pharyngées sont utilisés pour la mastication et la proie manipulation 25 - 27. Les deux ensembles forment par l' intermédiaire des mécanismes de développement partagés et sont considérés comme de développement homologue 28. Modularité intéressante se produit où certaines espèces, comme le poisson zèbre, le manque de dents pharyngée orale et dorsale 29 tandis que d' autres espèces ont plusieurs cératobranchiaux dentées, pharyngobranchials, et parfois dentées basihyal et hypobranchiaux 30. Dans épinoches dents pharyngiennes se trouvent sur le côté ventral et cinquième ceratobranchial dorsalement sur la partie antérieure et postérieure pharyngobranchials 31. Cinématique sur l' épinoche alimentation montrent la mâchoire orale est principalement utilisé pour la capture des proies et de faciliter l' aspiration d' alimentation 9 en laissant la mastication à la mâchoire du pharynx. Dans cichlidés, inférieure morphologie pharyngée de la mâchoire varie considérablement 32,33 et a été montré pour être adaptatif et en corrélation avec niche trophique 34. Multiles populations d' eau douce d'épinoches ples ont évolué une augmentation spectaculaire de pharyngée ventral nombre de dents 23,35,36. Des travaux récents ont montré que la base génétique du développement de ce gain de dent évolué est en grande partie distincte dans deux populations dérivées indépendamment des épinoches d'eau douce 36. Contrairement à dents de mammifères, les poissons se régénèrent leurs dents en permanence tout au long de la vie adulte 37. Ces deux populations précédemment décrites en eau douce dentées élevées ont évolué un taux de remplacement de la dent accélérée, fournissant un système de vertébrés rares pour étudier la base génétique de la régénération 36.
Un troisième trait trophique qui a évolué à plusieurs reprises dans les épinoches d'eau douce est plus long os épibranchiales et ceratobranchial, les branchies homologues arc segmentaire de la mâchoire supérieure et inférieure, respectivement 38. Plus longs os branchiaux confèrent une plus grande cavité buccale et probablement sont adaptatifs pour permettre à de plus grandes proies soient consumed. En outre, dans d' autres poissons, les os épibranchiales sont importants pour la dépression des dorsale pharynx dents plaques 25. Comme branchicténies et les dents pharyngées, les os branchiaux sont internes et donc, difficile de visualiser facilement ou quantifier.
Nous présentons ici un protocole détaillé pour disséquer et plat monter le squelette branchial, permettant une visualisation facile et la quantification d'une variété de traits craniofaciales importants. Bien que ce protocole décrit une dissection de l'épinoche, cette même méthode fonctionne sur une variété d'autres poissons.
Protocole
Tous les travaux de poisson a été approuvé par le soin et l'utilisation des animaux Commission institutionnelle de l'Université de Californie à Berkeley (numéro de protocole R330). Euthanasie a été réalisée en utilisant l' immersion dans 0,025% Tricaine-S tamponnée avec 0,1% de bicarbonate de sodium 39. Toutes les étapes sont effectuées à température ambiante.
1. Préparation
Remarque: Effectuer les étapes 1.1-1.5 dans des tubes coniques ou des flacons de scintillation qui peut sceller hermétiquement et être posés horizontalement. Les poissons ne doivent être constamment secoué, mais essayez de mélanger la solution aussi souvent que possible en retournant doucement ou en secouant la grille de tubes ou flacons pour exposer tous les côtés du poisson à la solution de coloration et de permettre aux taches de pénétrer le tissu uniformément. Ne placez pas un grand lot de poisson sur une plate-forme shaker, comme le poids lourd du liquide va briser le shaker.
- Fixer soit du poisson ou du poisson fraîchement euthanasiés stocké dans de l'éthanol avec 10% de formol neutre tamponné (FBN) pendant la nuit. Vous pouvez également utiliser 4% paraformaldéhyde en solution 1 x PBS au lieu de NBF à 10%.
Remarque: Si l'extraction de l'ADN, attachez une petite partie des caudale ou nageoires pectorales avant la fixation et à stocker dans l'éthanol. - Dispose de fixer correctement dans une hotte chimique et remplacer l'eau du robinet (qui est ~ pH 7,0) pendant 2 heures. Évitez d'utiliser l'eau de-ionisée car il peut souvent être acide et peut détartrer os.
- Enlever l'eau et le poisson tache avec 0,008% Alizarine Rouge S dans 1% de KOH dans de l'eau pendant 24 heures. Pour les poissons de moins de 20 mm de longueur standard, utilisez 0,004% Alizarine Red S. (Faire un 100x (0,8%) solution mère de Alizarine Red S qui peut ensuite être diluée).
- Retirer la tache (mise en conteneur à déchets approprié dans la hotte) et placer le poisson dans l'eau du robinet pendant quelques heures. Changer l'eau au besoin jusqu'à ce que l'eau de rinçage est la plupart du temps clair.
- Retirer le poisson de l'eau et le lieu dans 50% de glycérol, 0,25% de KOH pour la compensation légère et la dissection ultérieure.
Remarque: Ce protocole de coloration est modifiée à partir de méthodes 40,41 décrites précédemment.
Note: Voir la Figure 1 pour un examen de la tête pertinente morphologie squelettique.

Figure 1:. Tête Stickleback morphologie du squelette Alizarine rouge tachée tête épinoche à trois épines imagé avec fluorescence sous un ensemble de rhodamine filtre B. morphologie utile est étiqueté: Op = opercule, Sous-op = subopercle, BSR = branchiostèges rayons, Preop = préopercule, Infraorb 1-3 = infraorbital 1-3 (également appelés circumorbitals ou suborbitaux), Dent = du dentaire, Premax = prémaxillaire, Max = maxillaires , Nas = nasale, Lat. ETHM = ethmoïde latéral, PSPH = parasphénoïde, Fron = os frontal. Pour obtenir une description plus détaillée de l'épinoche tête squelette, voir Anker (1974) 31. S'il vous plaît cliquer ici pour voir une version plus grandecette figure.
- Poser le poisson plat (figure 2A) et insérer une pince de forte # 5 horloger dans le côté de l'œil à un angle de 45 ° ~ pour perforer la membrane qui recouvre l'œil.
- Peler la membrane loin de l'œil, semblable à peler un couvercle de yogourt (figure 2B).
- Insérez une pince ouverte derrière l'œil, attraper le nerf optique derrière l'œil, et enlever l'œil (figure 2C). Ne pas percer l'oeil car il fuira la mélanine. Si perforé, la mélanine peut être lavé au cours des étapes ultérieures.
- Répétez de l'autre côté.
- A partir de la partie postérieure, placez une petite lame de ciseaux de dissection sous le rabat de l' opercule, la lame de ciseaux glisser dorsalement ci - dessus opercule, puis couper les tissus mous grâce à la prise de l' oeil (figure 2D). Couper dorsale à l'os de l'opercule.
- Couper l'os frontal (dorsale à l'orbite de l' oeil) (Figure 2F).
- Couper l'os parasphénoïde midline autour til centre des orbites (Figure 2F).
- Répétez l'opercule coupe sur le côté opposé.
- Insérez une pince sous l'opercule et pelez lentement le visage loin du corps, le parage tout tissu mou encore attaché (Figure 2G - H). Prenez soin de ne pas perturber la première rangée de branchiospines.
- Avec des pinces, détacher les cératohyaux des deux côtés de la basihyal médiane tout en détachant et en enlevant le squelette craniofacial antérieure (l'ensemble de la mâchoire y compris le dentary, prémaxillaire et maxillaire, l'ensemble du squelette de hyoïde y compris l'opercule dermique extérieur, préopercule, subopercle, et rayons branchiostèges et la dorsale sous - jacente et des éléments endochondrale ventrales, et la partie antérieure du crâne , y compris le nez, ethmoïde latéral, et les os sous - orbitaire, voir les figures 1 et 2I).
- épines pelviennes peuvent être pliés hors du corps, et peut servir de poignée pour une pince pour agripper of lorsqu'il est présent. Épines verrouillent en place. Pour déverrouiller, tirez doucement la colonne vertébrale avec une pince directement loin du corps de poisson, puis pliez doucement en arrière pour presser la colonne vertébrale à plat contre les poissons.
- Insérer fermé pince postérieure et ventrale au squelette branchial (juste en dessous de tube de l' intestin) et des pinces de glisser en avant, à démêler les muscles et les ligaments qui restent attachés au squelette branchial (Figure 2J - K).
- En utilisant les conseils de pinces fermées, gratter les muscles attachés dorsal squelette branchial la braincase ventrale dans un postérieur à la direction antérieure (Figure 2L).
- Répétez 2.9 et 2.10 sur le côté opposé.
- Saisissez la base du tube de l' intestin et tirez en avant pour enlever le squelette et le tube intestin branchial (Figure 2M - N).
- Séparer le tube de l' intestin en faisant un postérieur perpendiculaire de coupe à la fin de la cinquième ceratobranchial (Figure 2O ).
- Après avoir enlevé tous les fragments d'os restants de la boîte crânienne sur la face dorsale du squelette branchial, insérer des ciseaux dans le panier branchiale pour faire une coupe dorsale (coupe antérieure à postérieure) entre les ensembles bilatéraux de plaques dorsales de dents (Figure 3A - D). Assurez-coupe est centrée pour éviter d'endommager les plaques dorsales de dents.
- Faire deux coupes latérales peu profondes dans la lumière intestinale caoutchouteux à la fin postérieure du squelette branchial (extrémité antérieure du tube de l' intestin) pour aider à ouvrir le squelette branchial (Figure 3E).
- Placer le poisson et tous les morceaux de tissu dans un bocal et placez-le squelette branchial dans un tube à centrifuger avec 50% de glycérol, 0,25% de KOH continuer compensation douce, ou 100% de glycérol si aucune autre compensation est nécessaire. bocaux d'étiquetage et les tubes avec un identifiant unique afin qu'ils puissent être suivis. Le montant de la compensation requise est en grande partie fonction de la taille des poissons, gros poissons adultes (plus de 40 mm de longueur standard) nécessitent généralement de compensation supplémentaire.

Figure 2:. Stickleback branchiale squelette dissection Alizarine rouge tachée poisson épinoche à trois épines prête pour la dissection. L'œil est dépigmentée d'une vaste clairière. Les flèches bleues indiquent la direction du mouvement. (A) Vue latérale de la tête de l' épinoche, antérieure se trouve à droite. (B) Enlèvement de la membrane recouvrant l'œil. (C) L' élimination de l'oeil. (D) Dorsale coupé au- dessus de la opercule. (E) Frontal coupe osseuse. (F) parasphenoid coupé. (G - I) Retrait du squelette facial. (J) Suppression des connexions ventrales des tissus mous du squelette branchial. (K - L) Enlèvement des dorsales branchiaux connexions squelette. ( M - N) Retrait du squelette branchial. (O) Séparer le tube intestinal du squelette branchial. Voir les étapes 2.1 à 2.16 pour plus de détails. Barre d' échelle = 5 mm. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
3. branchiale Squelette Re-coloration (si nécessaire)
- Pour colorer le plus sombre squelette branchial ou d'un tissu clair plus, supprimer 50% de glycérol, solution de KOH 0,25% et laver avec 1% KOH deux fois (un lavage de cinq minutes suivi d'un second lavage de 24 heures tout en secouant horizontalement sur une plate-forme shaker).
- Retirer 1% de KOH et re-tache avec 0,008% Alizarine Rouge S dans 1% de KOH pendant 24 heures.
- Retirer la tache et le remplacer par 1% de KOH pendant 24 heures.
- Retirer la solution KOH et le remplacer par 50% de glycérol, 0,25% de KOH.
4. Montage branchiale Squelette
- Retirer le squelette branchialà partir de 50% de glycérol, 0,25% de KOH ou 100% de glycérol et lieu près du fond d'un 22 mm x 60 mm lamelle en verre avec la face dorsale vers le haut (figure 3F). Ajouter quelques gouttes de glycérol à 50%, 0,25% de KOH ou 100% de glycérol sur le dessus du squelette branchial. Si la transition de 50% de glycérol, 0,25% de KOH à 100% de glycérol, le changement solution dans un tube à centrifuger et agiter pendant> 5 min avant de monter pour équilibrer les tissus.
- Rouler deux petites boules de pâte à modeler et placer sur chaque extrémité de la lamelle à agir comme entretoises.
- Librement placer une deuxième lamelle sur le dessus avec une pression suffisante pour aplatir le squelette branchial antérieur (figure 3G).
- Peel ouvrir le rabat dorsal gauche y compris les plaques de dents dorsales, aplatir, et glisser entre les lamelles (figure 3H).
- Répéter technique avec rabat droit dorsal et pousser tout le squelette branchial loin du bord de la lamelle (figure 3I).
- Modifiernativement, tenir les deux volets dorsales ouvertes avec une pince et placer soigneusement la lamelle sur, aplatir le squelette branchial dans un mouvement fluide.
- Vous pouvez également monter le squelette branchial à l'envers sur une lamelle, évasement chaque côté dorsal latéralement de façon gravité ne permet pas le squelette branchial pour fermer back up. Puis couvrir avec la deuxième 22 mm x 60 mm couvercle en verre de glissement et inverser prep.
Remarque: les techniques de montage différentes ont tendance à travailler mieux ou pire pour chaque individu. Essayez chacune et de voir ce qui se sent plus à l'aise.
- Appuyez légèrement sur le dessus lamelle pour aplatir des balles assez pour garder le squelette branchial d'argile monté à plat, mais prendre soin de ne pas écraser l'échantillon.
- Au cours du processus de montage, cératobranchiaux peuvent tourner et obscurcir une rangée de rakers. Remédier au forceps entre les lamelles et réorientant les cératobranchiaux ou squelette entier branchiale coulissant.
- Magasin preps plat dans des plateaux coulissants à rotempérature om. Monté dans 100% de glycerol, préparations peuvent être conservés entre les lamelles couvre-pontés pendant au moins dix ans. pinces propres et des ciseaux avec de l'isopropanol ou de l'éthanol et des conseils de couverture.
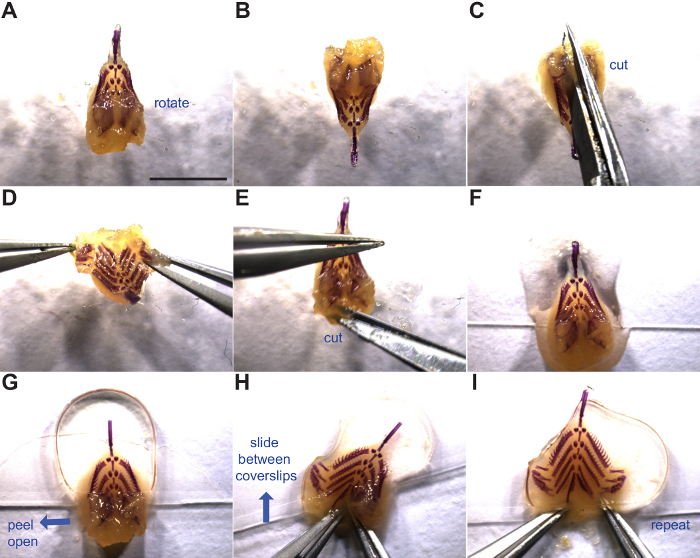
Figure 3:. Montage plat squelette branchial Manipulation et montage du squelette branchial est représenté. Les flèches bleues indiquent la direction du mouvement. (A) branchiale dorsale squelette vers le haut. (B - D) Rotation et incision entre les plaques dorsale de la dent. (E) coupé dans un tissu mou latéral pour ouvrir davantage la base du tube intestinal. (F) branchiale squelette placé au fond d'une lamelle couvre -objet prêt pour le montage. (G) Deuxième lamelle placée sur la moitié antérieure du squelette branchial ( au- dessus des plaques de dents dorsales). (H - I)montage plat du squelette branchial par l'ouverture dorsale dents volets de plaque et de glissement entre deux lamelles. Voir les étapes 4.1 à 4.6 pour plus de détails. Barre d' échelle = 5 mm. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Résultats
Ce protocole se traduit par un squelette branchial monté disséqué et plat (figure 4) où une variété de traits trophiques importants peuvent être quantifiés. Du point de vue dorsale, toutes les lignes de branchicténies, toutes les plaques pharyngée à dents, et presque tous les os branchies peuvent être facilement visualisées et quantifiées 22 - 24,35,36,38,42. Alizarine Red S fluoresces également sur un rhodamine...
Discussion
The branchial skeleton is a complex set of bones in the throat of a fish that manipulates, filters, and masticates food items on their way to the esophagus. Many interesting trophic traits including the patterning of gill rakers, pharyngeal teeth, and branchial bones vary across and within species. The majority of these traits are difficult to near impossible to accurately measure with the branchial skeleton in situ (e.g., gill raker length, branchial bone length). This flat-mounting protocol places all...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was funded in part by NIH R01 #DE021475 to CTM and an NSF Graduate Research Fellowship to NAE. Thanks to Miles Johnson for assistance with imaging and Priscilla Erickson for critical reading of the manuscript.
matériels
| Name | Company | Catalog Number | Comments |
| Potassium Hydroxide (KOH) | EMD | PX1480-1 | |
| Glycerol | Sigma-Aldrich | G7893-4L | |
| 10% Neutral Buffered Formalin (NBF) | Azer Scientific | NBF-4-G | |
| Alizarin Red S | EMD | AX0485-3 | |
| Microscope Cover Glasses 22 mm x 60 mm | VWR | 16004-350 | |
| 100 mm x 10 mm Glass Petri Dish | Kimble Chase | 23064-10010 | To dissect samples on |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | Can be poured into glass or plastic Petri dishes to make dissecting plates |
| Modeling Clay | Sargent Art | 22-4000 | 1 lb cream |
| Scintillation Vials (case of 500) | Wheaton | 986586 | Borosilicate Glass with Screw Cap |
| Forceps-Dumont #5 Inox (Biologie tip) | FST | 11252-20 | Dumostars are an alternative |
| Dissecting Scissors | FST | 15003-08 | Alternate sizes are available depending on size of sample |
| Dissecting Microscope | Leica | S6E with KL300 LED | Many other models work nicely, having a flat base helps |
| Microcentrifuge Tubes 1.7 ml | Denville | C2170 | |
| Cardboard slide tray | Fisher | 12-587-10 |
Références
- Cooper, W. J., Westneat, M. W. Form and function of damselfish skulls: rapid and repeated evolution into a limited number of trophic niches. BMC Evol. Biol. 9 (24), (2009).
- Albertson, R. C., Kocher, T. D. Genetic and developmental basis of cichlid trophic diversity. Heredity. 97 (3), 211-221 (2006).
- Martin, C. H., Wainwright, P. C. Trophic novelty is linked to exceptional rates of morphological diversification in two adaptive radiations of cyprinodon pupfish. Evolution. 65 (8), 2197-2212 (2011).
- Wainwright, P. C., et al. The evolution of pharyngognathy: A phylogenetic and functional appraisal of the pharyngeal jaw key innovation in labroid fishes and beyond. Syst. Biol. 61 (6), 1001-1027 (2012).
- Sibbing, F. Food capture and oral processing. Cyprinid Fishes. , 377-412 (1991).
- Bell, M., Foster, S. . The Evolutionary Biology of the Threespine Stickleback. , (1994).
- Kimmel, C. B., et al. Evolution and development of facial bone morphology in threespine sticklebacks. Proc. Natl. Acad. Sci. U. S. A. 102 (16), 5791-5796 (2005).
- Mcgee, M. D., Wainwright, P. C. Convergent evolution as a generator of phenotypic diversity in threespine stickleback. Evolution. 67 (4), 1204-1208 (2013).
- McGee, M. D., Schluter, D., Wainwright, P. C. Functional basis of ecological divergence in sympatric stickleback. BMC Evol. Biol. 13, 277 (2013).
- McGuigan, K., Nishimura, N., Currey, M., Hurwit, D., Cresko, W. A. Quantitative genetic variation in static allometry in the threespine stickleback. Integr. Comp. Biol. 50 (6), 1067-1080 (2010).
- Caldecutt, W. J., Bell, M. A., Buckland-Nicks, J. A. Sexual dimorphism and geographic variation in dentition of threespine stickleback, Gasterosteus aculeatus. Copeia. 2001 (4), 936-944 (2001).
- Berner, D., Moser, D., Roesti, M., Buescher, H., Salzburger, W. Genetic architecture of skeletal evolution in european lake and stream stickleback. Evolution. 68 (6), 1792-1805 (2014).
- Jamniczky, H. a., Barry, T. N., Rogers, S. M. Eco-evo-devo in the study of adaptive divergence: examples from threespine stickleback (Gasterosteus aculeatus). Integr. Comp. Biol. 55 (1), 166-178 (2015).
- Magnuson, J., Heitz, J. Gill raker apparatus and food selectivity among mackerels, tunas, and dolphins. Fish. Bull. 69 (2), 361-370 (1971).
- Kahilainen, K. K., et al. The role of gill raker number variability in adaptive radiation of coregonid fish. Evol. Ecol. 25 (3), 573-588 (2011).
- Arnegard, M. E., et al. Genetics of ecological divergence during speciation. Nature. 511 (7509), 307-311 (2014).
- Gross, H. P., Anderson, J. M., Gross, H. P., Anderson, J. Geographic variation in the gillrakers and diet of European threespine sticklebacks, Gasterosteus aculeatus. Copeia. 1984 (1), 87-97 (1984).
- Hagen, D., Gilbertson, L. Geographic variation and environmental selection in Gasterosteus aculeatus L in the Pacific Northwest, America. Evolution. 26 (1), 32-51 (1972).
- McPhail, J. D. Ecology and evolution of sympatric sticklebacks (Gasterosteus): morphological and genetic evidence for a species pair in Enos Lake, British Columbia. Can. J. Zool. 62 (7), 1402-1408 (1984).
- Schluter, D., McPhail, J. D. Ecological character displacement and speciation in sticklebacks. Am. Nat. 140 (1), 85-108 (1992).
- Robinson, B. Trade offs in Habitat-specific foraging efficiency and the nascent adaptive divergence of sticklebacks in lakes. Behaviour. 137 (7), 865-888 (2000).
- Glazer, A. M., Cleves, P. A., Erickson, P. A., Lam, A. Y., Miller, C. T. Parallel developmental genetic features underlie stickleback gill raker evolution. Evodevo. 5 (1), (2014).
- Miller, C. T., Glazer, A. M., et al. Modular skeletal evolution in sticklebacks is controlled by additive and clustered quantitative trait loci. Genetics. 197 (1), 405-420 (2014).
- Glazer, A. M., Killingbeck, E. E., Mitros, T., Rokhsar, D. S., Miller, C. T. Genome assembly improvement and mapping convergently evolved skeletal traits in sticklebacks with Genotyping-by-Sequencing. G3. 5, 1463-1472 (2015).
- Wainwright, P. Functional morphology of the pharyngeal jaw apparatus. Fish Physiol. Fish Biomech. , 77-102 (2006).
- Hulsey, C. D., Fraser, G. J., Streelman, J. T. Evolution and development of complex biomechanical systems: 300 million years of fish jaws. Zebrafish. 2 (4), 243-257 (2005).
- Lauder, G. Functional design and evolution of the pharyngeal jaw apparatus in euteleostean fishes. Zool. J. Linn. Soc. 77, 1-38 (1983).
- Fraser, G. J., et al. An ancient gene network is co-opted for teeth on old and new jaws. PLoS Biol. 7 (2), e1000031 (2009).
- Stock, D. Zebrafish dentition in comparative context. J. Exp. Zool. B. Mol. Dev. Evol. 308, 523-549 (2007).
- Liem, K., Greenwood, P. A functional approach to the phylogeny of the pharyngognath teleosts. Am. Zool. 21 (1), 83-101 (1981).
- Anker, G. C. Morphology and kinetics of the head of the stickleback, Gasterosteus aculeatus. Trans. Zool. Soc. London. 32 (5), 311-416 (1974).
- Meyer, A. Morphometrics and allometry in the trophically polymorphic cichlid fish, Cichlusomu citrinelfum: Alternative adaptations and ontogenetic changes in shape. J. Zool., Lond. 221, 237-260 (1990).
- Huysseune, A. Phenotypic plasticity in the lower pharyngeal jaw dentition of Astatoreochromis alluaudi (Teleostei: Cichlidae). Arch. Oral Biol. 40 (11), 1005-1014 (1995).
- Muschick, M., Indermaur, A., Salzburger, W. Convergent Evolution within an adaptive radiation of cichlid fishes. Curr. Biol. 22 (24), 2362-2368 (2012).
- Cleves, P. A., et al. Evolved tooth gain in sticklebacks is associated with a cis-regulatory allele of Bmp6. Proc. Natl. Acad. Sci. 111 (38), 13912-13917 (2014).
- Ellis, N. A., et al. Distinct developmental and genetic mechanisms underlie convergently evolved tooth gain in sticklebacks. Development. (142), 2442-2451 (2015).
- Tucker, A. S., Fraser, G. J. Evolution and developmental diversity of tooth regeneration. Semin. Cell Dev. Biol. 25-26, 71-80 (2014).
- Erickson, P. A., Glazer, A. M., Cleves, P. A., Smith, A. S., Miller, C. T. Two developmentally temporal quantitative trait loci underlie convergent evolution of increased branchial bone length in sticklebacks. Proc. R. Soc. B. 281, (2014).
- Leary, S., et al. . AVMA Guidelines for the Euthanasia of Animals. , (2013).
- Bell, M. A. Evolutionary phenetics and genetics. Evol. Genet. Fishes. , 431-528 (1984).
- Taylor, W. R., Van Dyke, G. C. Revised procedures for staining and clearing small fishes and other vertebrates for bone and cartilage study. Cybium. 9 (2), 107-119 (1985).
- Erickson, P. A., et al. A 190 base pair, TGF-β responsive tooth and fin enhancer is required for stickleback Bmp6 expression. Dev. Biol. 401 (2), 310-323 (2015).
- Miller, C. T., et al. cis-Regulatory changes in Kit ligand expression and parallel evolution of pigmentation in sticklebacks and humans. Cell. 131 (6), 1179-1189 (2007).
- Aigler, S. R., Jandzik, D., Hatta, K., Uesugi, K., Stock, D. W. Selection and constraint underlie irreversibility of tooth loss in cypriniform fishes. Proc. Natl. Acad. Sci. U. S. A. 111 (21), 7707-7712 (2014).
- Pasco-Viel, E., et al. Evolutionary trends of the pharyngeal dentition in Cypriniformes (Actinopterygii Ostariophysi). PLoS One. 5 (6), e11293 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon