Method Article
Purificazione di H3 e H4 proteine istoniche e la quantificazione degli istoni acetilati marchi nelle cellule e tessuto cerebrale
In questo articolo
Riepilogo
Lo scopo di questo articolo è quello di fornire una guida completa, sistematica per la purificazione efficiente degli istoni H3 e H4 e la quantificazione dei residui degli istoni acetilati.
Abstract
In tutti gli organismi eucarioti, cromatina, il modello fisiologico delle informazioni genetiche di tutto, è essenziale per eredità. Cromatina è soggetta a una serie di modifiche di posttranslational diversificate (PTM) che per lo più si verificano in termini amminici delle proteine istoniche (cioè, istone coda) e regolano l'accessibilità e lo stato funzionale del DNA sottostante. Istoni estendono dal nucleo del nucleosoma e sono soggette all'aggiunta di gruppi acetile da utilizzando istone acetiltransferasi (Hat) e la rimozione di gruppi acetile di istone deacetilasi (HDACs) durante la crescita cellulare e la differenziazione. Modelli di acetilazione specifici sui residui di lisina (K) su istoni determinano un'omeostasi dinamica tra cromatina trascrizionalmente attiva o trascrizionalmente repressa influenzando il gruppo degli istoni del nucleo (1) e (2) reclutamento sinergica o antagonistiche proteine della cromatina associate al sito di trascrizione. Il meccanismo normativo fondamentale della natura complessa della coda dell'istone PTMs influenza la maggior parte dei processi basati su modelli della cromatina e si traduce in cambiamenti nella maturazione delle cellule e differenziazione nello sviluppo sia normale che patologica. L'obiettivo del report corrente è quello di fornire novizi con un metodo efficiente per purificare proteine istoniche core dalle cellule e tessuto cerebrale e quantificare in modo affidabile segni acetilazione degli istoni H3 e H4.
Introduzione
L'epigenetica di termine si riferisce ai cambiamenti ereditabili in attività del gene che si verificano indipendentemente dai cambiamenti nella sequenza del DNA1,2. Repressione e trascrizione genica sono determinati da (1) l'accessibilità del DNA cromosomico avvolto intorno un istonico di istoni di nucleo (due copie ciascuna di H2A, H2B, H3 e H4) e da (2) la disponibilità di fattori di trascrizione e dell'impalcatura di proteine reclutato a promotore specifici siti3,4. Trascrizione del gene è regolata da enzima-mediata modifiche dei siti specifici di promotore del DNA e la PTMs di istone Code5,6,7. La N-termini dell'istone H3 e H4 sono tra le sequenze più altamente conservate conosciute in organismi eucarioti3, e loro modifiche di posttranslational sono stati ampiamente documentati per svolgere un ruolo centrale nel determinare la struttura della cromatina e funzione8,9. PTMs a istoni (cioè, acetilazione, metilazione, fosforilazione e ubiquitinazione) modificare il potenziale di interazione delle code, influenzano lo stato strutturale e pieghevole della fibra di cromatina e quindi, regolano l'accessibilità del DNA e l'elaborazione di4,10,11,12. Gruppi acetilici vengono aggiunti a e rimosso dai residui K su istoni da un insieme di specifici istone-interagendo su enzimi epigenetici, vale a dire Cappelli e HDACs, rispettivamente13. Ad esempio, l'acetilazione dell'istone H4 a lisina 12 (H4K12ac) precedentemente è stato indicato per attivare la trascrizione di geni correlati alla acquisizione e consolidamento di memoria14. Inoltre, parecchie linee di prova suggeriscono che l'enzima-mediata di controllo epigenetico della trascrizione genica è un aspetto cruciale di sano cellulare crescita e differenziazione6,15. Alternanza in regolazione epigenetica dell'espressione genica, da modificazioni epigenetiche del DNA o da una mutazione degli enzimi epigenetici essi stessi, ha dimostrato di essere dysregulated in patologia umana dove il cambiamento in un'attività particolare gene è un marchio di garanzia di patologia (ad es., cancro)6,16,17. Così, la valutazione delle modifiche dell'istone core PTMs sta emergendo come un obiettivo di alto valore per interventi terapeutici potenziali. Tuttavia, determinare l'abbondanza, interattori e ruoli specifici di istoni PTMs ha dimostrato impegnativo18.
Nel rapporto corrente, una strategia di medio-trasmissione dei dati, ottimizzata per purificare gli istoni di nucleo dalle cellule e tessuti di cervello in una singola frazione e un protocollo completo per la quantificazione degli istoni H3 e H4 PTMs è descritto. Di nota, anche se attualmente pubblicati basati su acido basati su anticorpi istone rilevamento strategie e tecniche di depurazione sono state ampiamente adottate per la caratterizzazione dell'istone, mancano dettagli descrittivi per quanto riguarda i punti critici della procedura, così ostacolanti istone replicabile e veloce estrazione e quantificazione. Ad esempio, estrarre l'elaborazione della cella e le biopsie del tessuto richiede diversi strumenti e tecnologie per l'estrazione di successo. Inoltre, il protocollo ottimizzato presentato nel manoscritto attuale dimostra un approccio pratico, medio-throughput. Gli istoni nucleo vengono estratti come frazione unica, pura, che consente un affidabile rilevamento PTM anticorpo-mediata a valle senza alcuna interferenza da impurità. Inoltre, nel manoscritto attuale, sono state eluse le sfide per quanto riguarda la rilevazione dell'istone dovuto il loro piccolo peso molecolare. In genere, la mancanza di compatibilità tra purificazione, quantificazione e protocolli di elettroforesi del gel di ostacolare gli scienziati da ottenendo risultati replicabili e conclusive. Qui, è presentato un flusso di lavoro ottimizzato per purificare gli istoni di nucleo da cellule e tessuti e li preparano a valle PTM analisi tramite western blot.
L'attuale protocollo permette la purificazione di proteine istoniche core, preservando le loro modifiche di posttranslational nativi (cioè, acetilazione, metilazione e fosforilazione). Figura 1 illustra la sequenza temporale del protocollo di purificazione dell'istone.
Protocollo
Tutti i topi sono stati alloggiati in un'umidità e temperatura-controllata, AAALAC-accreditato animale struttura presso l'University of Miami Miller School of Medicine. Tutti gli esperimenti sono stati approvati dall'Università di Miami Miller School di medicina istituzionale Animal Care ed uso Committee (IACUC) e condotto secondo le specifiche del NIH.
1. preparazione dell'estratto del campione
-
Cellule aderenti
- Cellule di piastra in piatti di 10cm in terreni di coltura appropriati (1 x 106 a 1 x 109 celle per ogni piatto per linee cellulari, quali BV2, HEK-293 e SH-SY5Y, ma ~ 1 x 1015 celle per ogni piatto per cellule primarie, quali neuroni corticali primari). Assicurare che le cellule sono equamente distribuite su tutta la superficie della piastra e permettono alle cellule di crescere per 48 h raggiungere la confluenza di ~ 100% (37 ° C, 5% CO2).
- Una volta che le cellule hanno raggiunto la confluenza desiderata, delicatamente i terreni di coltura di aspirare e lavare le cellule 2 x con media privo di siero preriscaldata sotto una cappa di coltura del tessuto.
- Aspirare i media privo di siero dal piatto e aggiungere 1 mL di tampone di estrazione ghiacciata (0,4 M acido solforico, 1 mM KCl, 1 mM MgCl2, 50 mM Tris-HCl [pH 8,0] e 1 x cocktail di inibitore della proteasi) ad ogni piatto.
- Utilizzare un raschietto di plastica cella per raccogliere tutte le celle nel buffer dell'estrazione (raschiando) e trasferirli in un 1,5 mL etichettato tubo con una pipetta di 1.000 µ l. Dispensare le celle su e giù 3 x per facilitare l'omogeneizzazione.
- Chiudere tutte le provette e metterli immediatamente in ghiaccio.
-
Tessuto cerebrale
- Se viene utilizzato il tessuto congelato, posizionare il tessuto in un tubo di prechilled 1,5 mL e brevemente scongelare su ghiaccio. Se viene utilizzato il tessuto fresco, passare immediatamente al punto 1.2.2.
Nota: Il protocollo attuale descrive procedure usando cervello congelato del mouse e mouse corteccia prefrontale campioni. - Omogeneizzare il tessuto utilizzando un omogeneizzatore lisata palmare utilizzando la giusta quantità di tampone di estrazione e il numero consigliato di tratti (tabella 1). Per evitare eccessivi della cromatina triturazione, non superare il numero di colpi consigliati.
- Utilizzando una pipetta di singolo canale 1.000 µ l, trasferire l'omogeneizzato in una provetta di prechilled 1,5 mL. Chiudere tutte le provette e metterli immediatamente in ghiaccio.
- Se viene utilizzato il tessuto congelato, posizionare il tessuto in un tubo di prechilled 1,5 mL e brevemente scongelare su ghiaccio. Se viene utilizzato il tessuto fresco, passare immediatamente al punto 1.2.2.
2. preparazione dell'estratto grezzo dell'istone
- Disporre le provette da 1,5 mL contenente le cellule o i tessuti sospese in tampone di estrazione su una piattaforma rotante e ruotarlo a 15 giri/min a 4 ° C per consentire l'estrazione del greggi istoni.
Nota: Il tempo di estrazione può variare per diverse tipi di celle e tessuto e deve essere ottimizzato per ogni procedura. Il protocollo attuale presenta risultati ottenuti a seguito di 15 min, 2 h e 24 h di estrazione (Figura 2, Figura 3, Figura 4e Figura 5). - Prechill microcentrifuga a 4 ° C. Una volta trascorso il tempo di estrazione desiderato, centrifugare le provette a massima velocità per 10 min a 4 ° C.
- Trasferire il surnatante compreso i greggi istoni in una provetta da 1,5 mL nuovo, prechilled. Scartare il pellet.
- Conservare il supernatante a-80 ° C (l'estrazione può essere interrotta in questo passaggio, vedere "Passo Stop" nella Figura 1) o immediatamente procedere al passaggio successivo.
- Neutralizzare gli istoni grezzi con un 1/4 del volume di tampone di neutralizzazione: 5x (ad esempio, aggiungere 250 µ l di tampone di neutralizzazione: 5x a 1 mL di istoni grezzi). Miscelare bene pipettando su e giù x 6.
- Controllare il pH della miscela con strisce pH. Regolare di conseguenza aggiungendo più tampone di neutralizzazione per raggiungere un pH di 7.
- Valutare la presenza dell'istone ed estratto proteico di nonhistone nell'istone grezza come segue (Figura 2).
- Aggiungere 37,5 µ l del campione a 12,5 µ l di tampone del campione (Laemmli): 4x e denaturare per 10 min a 99 ° C.
- Caricare il campione su un gel di SDS-PAGE ed eseguire il gel per 1 h a 100 V.
- Macchia il gel durante la notte con soluzione colorante Coomassie Brilliant Blue R-250 e decolorare durante tre lavaggi consecutivi (1 h/lavaggio) con soluzione decolorante Coomassie Brilliant Blue R-250.
Nota: Gli istoni grezzi (Figura 2) possono essere paragonati eluiti e purificati istoni (cioè, l'input di colonna [Figura 5A]).
3. purificazione degli istoni di nucleo
-
Equilibrazione colonna spin
- Aggiungere 500 µ l di tampone di equilibrazione a ogni colonna di spin in uso. Non toccare la membrana di colonna.
- Centrifugare a 4 ° C per 3 min 800 x g. Scartare il flusso continuo. Ripetere 1 x.
-
Purificazione dell'istone
- Aggiungere 500 µ l di campione di interesse dal passaggio 2.6 alla colonna. Centrifugare a 4 ° C per 3 min 800 x g. Raccogliere il flusso continuo.
- Ripetere il passaggio precedente come tante volte quanto necessario per caricare l'intero campione sulla colonna. Non riempire eccessivamente la colonna di spin.
- Combinare il flusso-attraverso ogni passaggio di centrifugazione per analizzare l'efficienza di associazione di colonna (Figura 3).
- Seguire il passaggio 2.7 per analizzare il flusso-attraverso la colonna.
-
Lavaggio di colonna
- Aggiungere 500 µ l di tampone di lavaggio per ogni colonna. Centrifugare a 4 ° C per 3 min 800 x g. Raccogliere il flusso continuo da lavare (#1).
- Ripetere il passaggio 3.3.1 per un totale di tre lavaggi. Raccogliere i flusso attraverso lavaggi #2 e #3. La piscina non il colonna consecutivi flusso-attraverso lavaggi.
- Per valutare ulteriormente l'efficienza della colonna istone-associazione, analizzare i lavaggi tre colonna eseguendo il passaggio 2.7 (Figura 4).
-
Eluizione dell'istone
- Trasferire la colonna in una nuova provetta etichettati 1,5 mL.
- Aggiungere 50 µ l di tampone di eluizione di istone. Centrifugare a 4 ° C per 3 min 800 x g. Salvare il flusso attraverso proteine istoniche che contiene.
- Per un'eluizione aggiuntive, ripetere il punto 3.4.2. Non combinare i primi e secondo passaggio eluati come si differenziano in purezza e quantità dell'istone.
4. precipitazione degli istoni di nucleo
- Aggiungere acido perclorico (PCA) a istoni purificati a una concentrazione finale del 4% PCA (ad esempio, aggiungere 3 µ l di 70% PCA per 50 µ l di istoni purificati dal punto 3.4.2.
- Centrifugare per 3 s per raccogliere il liquido residuo dalla parete del tubo. Mescolare pipettando su e giù x 6.
- Disporre le provette in un rack e incubare per 24 h a 4 ° C.
- Il giorno successivo, prechill un microcentrifuge a 4 ° C e centrifugare i campioni per 75 min alla massima velocità a 4 ° C.
- Al termine della centrifugazione, una piccola pallina bianca contenente gli istoni precipitati sarà visibile sul fondo della provetta. Non centrifugare il campione.
- Accuratamente aspirare il supernatante e, senza disturbare il pellet, aggiungere 500 µ l di ghiacciata 4% PCA al campione.
- Centrifugare a 4 ° C per 10 minuti alla massima velocità. Aspirare accuratamente il supernatante.
- Ripetere il passaggio 4,7 2 x.
- Senza disturbare il pellet, aggiungere 500 µ l di acetone ghiacciata. Centrifugare a 4 ° C per 10 minuti alla massima velocità. Aspirare accuratamente il supernatante.
- Ripetere il passaggio 4,9 2 x.
- Attentamente aspirare il supernatante, lasciare i tubi non livellati e lasciare asciugare su ghiaccio per 30 min. Check in se tutti i residui acetone evaporato il campione.
- Lasciare le provette non livellate e lasciare asciugare a temperatura ambiente (TA) il campione per 5 min.
- Risospendere il pellet in 30 µ l di acqua sterile. Non pipettare su e giù. Scorri il tubo delicatamente con un dito.
- Tutti i tubi di Cap e consentire istoni ricostituire il ghiaccio per 30-50 minuti, a seconda della dimensione della pallina. Verifica se il pellet è risospeso.
- Tutti i tubi di Cap e consentire il pellet risospendere ulteriormente a RT per 5 min.
Nota: Questa soluzione (eluizione prima e la seconda dal punto 3.4.3) è costituito degli istoni purificati e dissalati e può essere utilizzato per ulteriori analisi di acetilazione di quantificazione e istone.
5. quantificazione delle proteine istoniche eluiti
- Utilizzare uno spettrofotometro secondo il protocollo del produttore per quantificare le proteine dell'istone totale ottenute dopo l'eluizione finale nel passaggio 4,15. Misurare l'assorbanza a 230 nm. Registrare il rapporto A260/A280 indicativo della contaminazione del campione con acido nucleico.
- Utilizzare la seguente formula per calcolare la concentrazione dell'istone (x):
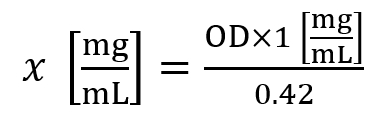
Qui, OD è la densità ottica misurata a A230 nm. - Una concentrazione dell'istone di ~1.5 mg/mL è considerata un rendimento medio per linee cellulari, mentre una concentrazione dell'istone di ~5.0 mg/mL è considerata un rendimento medio per 30 mg di tessuto.
6. Western Blot analisi
- Regolare l'istone purificato ed eluiti dal passaggio 4,15 a ~ 10 µ g di proteine istoniche/campione.
- Aggiungere il volume appropriato di acqua e 4 x Laemmli tampone per regolare i volumi di carico.
- Denaturare i campioni per 10 min a 99 ° C. Raffreddarli su ghiaccio. Centrifugare per 3 s per raccogliere tutti i residui di liquido e condensa dalla parete del tubo.
- Caricare i campioni su un gel di SDS-PAGE ed eseguire il gel per 1 h a 100 V.
- Per visualizzare la proteina totale istone, macchia il gel durante la notte con soluzione colorante Coomassie Brilliant Blue R-250 e decolorare durante tre lavaggi consecutivi (1 h/lavaggio) in soluzione decolorante Coomassie Brilliant Blue R-250.
Nota: Il primo eluizione delle proteine istoniche contiene alta qualità istoni (Figura 5A) mentre l'eluizione secondo contiene basso a nessun livello degli istoni (figura 5B). - Per quantificare istone PTMs, utilizzare un sistema di trasferimento (Vedi Tabella materiali) per trasferire la proteina istone dal gel SDS-PAGE (punto 6.4) su una membrana PVDF.
- Per assemblare il panino di trasferimento, aprire la cassetta del sistema e posizionare la risma di membrana PVDF (etichettata come fondo +) sul fondo della cassetta con la membrana rivolta verso l'alto. Rotolo di membrana delicatamente con un rullo della macchia per rimuovere qualsiasi aria tra lo stack e la membrana.
- Disporre il gel sulla parte superiore della membrana, roll il gel delicatamente con un rullo della macchia per eliminare l'aria tra la membrana e il gel e posizionare il superiore dello stack sul gel. Tirare delicatamente ancora e posizionare il coperchio del cassetto in cima il panino, premete con forza e ruotare in senso orario per bloccare il nob.
- Inserire la cassetta nello slot del sistema di trasferimento. Sullo schermo dell'apparecchio, selezionare il Protocollo di Turbo. Utilizzare un protocollo di 3 min per un singolo gel mini o un protocollo di 7 min per più di due mini gel.
- Macchia la membrana con la macchia di Ponceau S per 5 min e visualizzare le proteine istoniche totale.
- Lavarli in 1x soluzione fisiologica tamponata (TBS) con 0.1% Tween 20 per 2 h e blocco in 5% di latte per 1 h. incubazione con anticorpo primario e secondario (durante la notte a 4 ° C o 1 h a RT, rispettivamente) o secondo un protocollo precedentemente ottimizzato.
Nota: nel protocollo attuale, gli anticorpi contro gli istoni acetilati H4K12 (Figura 6 e Figura 7) e H3K27 (Figura 8) sono stati usati.
Risultati
Per illustrare la progressione del protocollo di purificazione dell'istone e composizione di tutte le frazioni analizzate, abbiamo valutato diversi istone estratti da cellule microglial umano BV2. Per dimostrare la quantificazione degli istoni H3 e H4 PTMs (cioè, acetilazione), abbiamo usato lysates del tessuto di cervello.
Le cellule BV2 erano placcate a 5 x 106 cellule per piatto in piatti di coltura del tessuto-trattati di 10cm e ha permesso di crescere di confluenza per 48 h. cellule allora sono stati raccolti, e gli istoni sono stati rilasciati dalla cromatina da un'incubazione in tampone di estrazione contenente 0,4 M acido solforico, 1 mM KCl, 1 mM MgCl2, 50 mM Tris-HCl (pH 8.0) e 1 x inibitore della proteasi. Il tempo di estrazione, tra 15 minuti e 24 h, non ha influenzato la composizione degli estratti grezzi istone come determinato da Coomassie Brilliant Blue macchiatura (Figura 2). Successivo, greggi istoni furono passati attraverso le colonne dell'istone equilibrato e il flusso continuo è stata analizzata. Alta efficienza di associazione di colonna è determinata dall'assenza di proteine istoniche nel flusso continuo quando analizzato dalla macchiatura Coomassie Brilliant Blue. Abbiamo determinato l'efficienza di associazione di colonna al 100% come non c'erano nessun rilevabile istoni presenti nel flusso-attraverso analizzato (Figura 3). Tutte le membrane con gli istoni associati sono stati poi lavate tre volte con tampone di lavaggio per rimuovere eventuali impurità rimanenti, lasciando solo istoni associati a gel di silice. Abbiamo stabilito che, per l'estrazione di istone tutte le volte (cioè, 15 min, 2 h e 24 h), il primo lavaggio membrana era il più importante rimuovere contaminazioni nonhistone da colonne, mentre i secondo e il terzi lavaggi non hanno influenzato la purezza del campione. Così, a seconda del tipo di campione, le ultime due lavaggi possono essere omesse. In seguito il primo eluizione delle proteine istoniche dalla colonna (mediante tampone di eluizione contenente 1mM NaCl ed EDTA), istoni erano precipitati durante la notte con 4% acido perclorico e quindi pellettati, lavati e analizzati per l'arricchimento di purificato istoni H3 e H4. Abbiamo osservato che 24 h di estrazione tempo aumenta la quantità degli istoni H3 e H4 nella frazione purificata rispetto a 15 min e 2 ore di tempo di estrazione (Figura 5A). L'eluizione secondo dalla colonna non ha provocato di alta qualità o alta-quantità istoni (figura 5B).
Successivamente, abbiamo usato omogenati di cervello per quantificare istone H3 e H4 PTMs, vale a dire l'acetilazione. Selvaggio-tipo (C57BL6/J) topi maschii sono stati amministrati una largamente d'azione inibitore HDAC (tributirrina) ad una dose di 5 g/kg per via orale per 3 tessuto d. del intero-cervello è stato raccolto il giorno 4 e grezzi istoni sono stati estratti secondo il protocollo descritto. Utilizzando un spaiati t-test, abbiamo determinato che tributirrina aumenta l'acetilazione degli istoni in greggio estratto (t(6) = 6.184, P = 0,0004); Tuttavia, le impurità vengono rilevate nell'estratto (le bande di istone non sono chiaramente definite). Così, H4K12ac anticorpo non ha un'alta specificità (Figura 6). Per più ulteriormente valutare l'applicabilità del protocollo presentato più piccole sezioni di tessuto, abbiamo raccolto la corteccia prefrontale dalla triplo transgenici del morbo di Alzheimer (3 x Tg-AD) i topi trattati giornalmente con 10 mg/kg M344, una classe io e inibitore HDAC IIb, per quattro mesi. Precipitazioni e purificazione degli istoni è stato eseguito secondo il protocollo descritto nel presente documento. Utilizzando il purificato dell'istone H3 e H4 frazione, abbiamo determinato che M344 aumenta l'acetilazione H4K12 2,4 (t(6) = 13.03, P < 0,0001), con un'alta specificità dell'anticorpo H4K12ac (Figura 7). Allo stesso modo, abbiamo osservato un aumento l'acetilazione dell'istone H3 in cellule BV2 in risposta ad un altro inibitore HDAC, vale a dire l'inibitore selettivo di HDAC3, RGFP-966. 10 µM di RGFP-966 cause un aumento di circa duplice di acetilazione alle istone H3K27 dopo 24 h di trattamento. Studente di spaiati t-test è stato utilizzato per confrontare le cellule contro trattati di controllo.
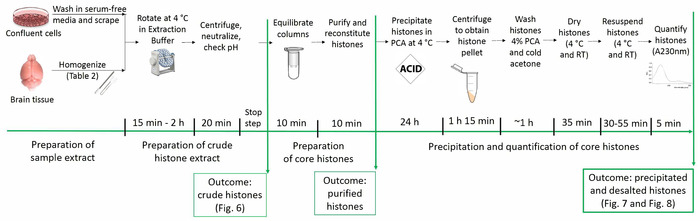
Figura 1: Timeline del protocollo di purificazione di istone. Seguito sono riportati tutti i passaggi per le analisi dell'istone insieme il tempo ritenuto necessario per ogni passaggio. Figure raffiguranti l'esito della procedura particolare e presentato all'interno del manoscritto sono previste le parentesi. Clicca qui per visualizzare una versione più grande di questa figura.
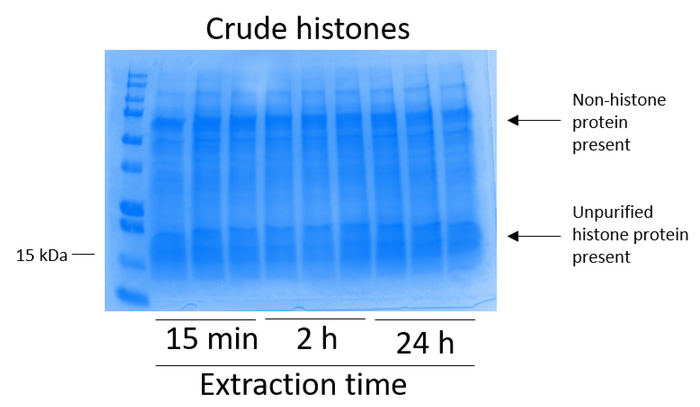
Figura 2: rappresentante macchiato di Coomassie Brilliant Blue gel dimostrando istoni greggi estratti dalle cellule BV2. BV2 cellule sono state coltivate per 48 h prima che iniziasse il protocollo di estrazione dell'istone. Gli istoni grezzi sono stati estratti per 15 min, 2 h e 24 h, con tre repliche per ogni punto di tempo (questo è anche il caso in Figura 3, Figura 4e Figura 5). Nonhistone sia dell'istone le proteine sono presenti nell'estratto grezzo dell'istone. Clicca qui per visualizzare una versione più grande di questa figura.
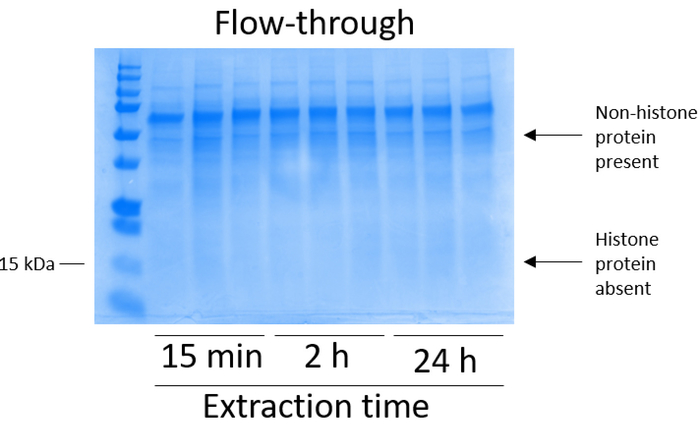
Figura 3: rappresentante macchiato di Coomassie Brilliant Blue gel dimostrando purificazione di istone seguente del flusso continuo di colonna a pochi passi da cellule BV2. A seguito dell'istone grezzo passa attraverso la colonna di associazione dell'istone, solo nonhistone proteine sono presenti nel flusso continuo. Proteine istoniche sono assenti in questa frazione. Clicca qui per visualizzare una versione più grande di questa figura.
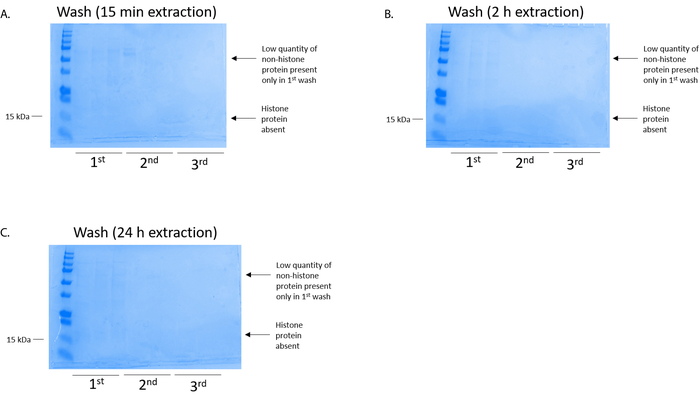
Figura 4: rappresentante macchiato di Coomassie Brilliant Blue gel dimostrando un lavaggio di colonna dopo una fase di purificazione dell'istone dalle cellule BV2. Indipendentemente dal fatto i tempi di estrazione dell'istone, che erano (A) 15 min, (B), 2 h, o (C), 24 h, bassa quantità di proteine nonhistone erano solo presenti nella colonna histonebinding primo-lavaggio. Proteine istoniche erano assenti in tutti i lavaggi. Clicca qui per visualizzare una versione più grande di questa figura.
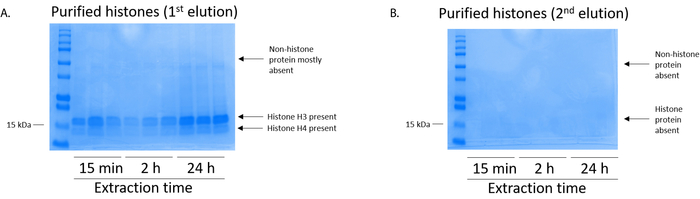
Figura 5: rappresentante macchiato di Coomassie Brilliant Blue gel dimostrando eluizioni segue una fase di purificazione dell'istone dalle cellule BV2. (A) alta qualità purificata e dissalato istone H3 e H4 sono stati rilevati dopo l'eluizione prima dalla colonna di purificazione dell'istone. Colonna (B) la seconda eluizione da purificazione dell'istone non ha dato un alta qualità o quantità degli istoni H3 o H4. Clicca qui per visualizzare una versione più grande di questa figura.
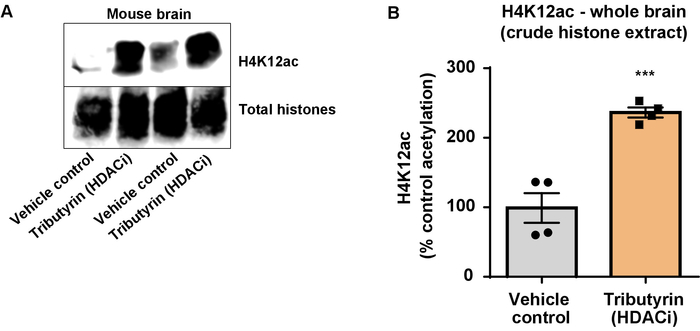
Figura 6: la largamente agendo HDAC inibitore, tributirrina, aumenta l'acetilazione H4K12 in tutto il cervello di topi wild-type. (A) questo pannello mostra un rappresentante western blot raffigurante un aumento di acetilazione di H4K12 nell'istone greggio estratto raccolti dall'intero cervello di topi wild-type in risposta alle HDAC largamente recitazione inibitore, tributirrina. (B), questo pannello mostra la quantificazione dell'aumento in H4K12 acetilazione in vivo. Spaiati t-test è stato utilizzato per confrontare i gruppi (t(6) = 6.076, P = 0,0005). Le barre rappresentano la media ± errore standard della media (SEM). N = 8. P < 0,0001. Clicca qui per visualizzare una versione più grande di questa figura.
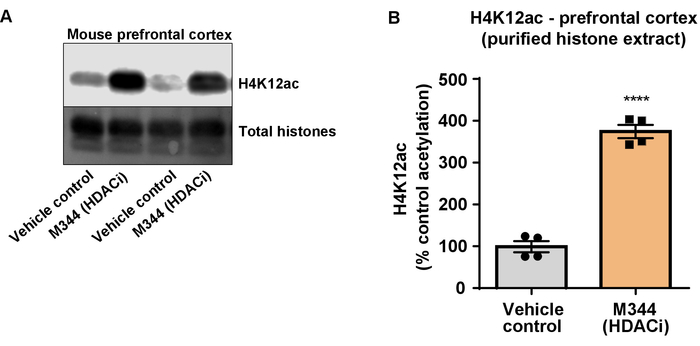
Figura 7: la classe I e inibitore HDAC IIb, M344, aumenta H4K12 acetilazione nella corteccia prefrontale di triplo transgenico di Alzheimer (3 x Tg-AD) topi. (A) questo pannello mostra un rappresentante western blot raffigurante un aumento di acetilazione di H4K12 in purificato ed Estratto di istone dissalate raccolte dalla corteccia prefrontale di 3 x topi Tg-AD in risposta all'inibizione di HDAC da M344. (B) questo pannello mostra la quantificazione dell'aumento di acetilazione di H4K12 in risposta a M344 somministrato ad una dose giornaliera di 10 mg/kg per quattro mesi. Spaiati t-test è stato utilizzato per confrontare i gruppi (t(6) = 13.30, P < 0,0001). Le barre rappresentano la media ± SEM. N = 8. P < 0,00001. Clicca qui per visualizzare una versione più grande di questa figura.
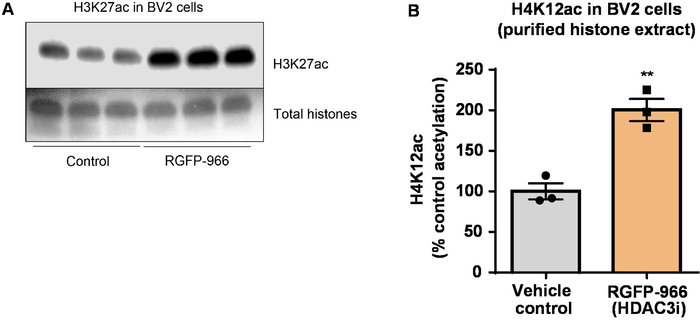
Figura 8: l'inibitore selettivo di HDAC3, RGFP-966, aumenta H3K27 acetilazione in cellule microglial BV2. (A), questo pannello mostra un rappresentante western blot raffigurante un aumento di acetilazione di H3K27 nell'estratto purificato e dissalate istone raccolti da cellule BV2 in risposta all'inibizione di HDAC3 di RGFP-966. (B) RGFP-966 provoca un aumento di circa duplice di acetilazione dell'istone H3 e lisina (K) 27 dopo 24 h di trattamento. Spaiati t-test è stato utilizzato per confrontare le cellule contro trattati di controllo (t(4) = 5.981, P = 0,002). Le barre rappresentano la media ± SEM. N = 6. P < 0.01. Clicca qui per visualizzare una versione più grande di questa figura.
| Rappresentante dei tessuti (un emisfero) * | Tessuto di medio peso (mg) | Tampone di estrazione (mL) | Numero di tratti |
| Cervelletto di topo | 40 | 1 | 40 |
| Corteccia frontale del mouse | 30 | 0.3 | 20 |
| Ippocampo del mouse | 27 | 0.3 | 18 |
| Corteccia entorinale mouse | 19 | 0.3 | 17 |
| * Tutti gli esperimenti sono stati effettuati su topi del maschio adulto. | |||
| Età media: 16 mesi. Peso medio: 30 grammi. | |||
Tabella 1: Condizione ottimizzata per l'omogeneizzazione del tessuto di cervello.
Discussione
Nel lavoro attuale, abbiamo dimostrato un metodo ottimizzato per purificare proteine istoniche core e quantificare istone H3 e H4 PTMs (ad es., acetilazione). Il protocollo presentato è un flusso di lavoro completo che incorpora ottimizzate procedure relative alle celle e preparazione del tessuto di cervello, eluizione dell'istone purificazione e precipitazioni dettagliate dell'istone, grezzo e quantificazione, cui sono seguiti da l'elettroforesi dell'istone e robusto istone PTM quantificazione. La grande quantità di dettagli forniti qui consente una generazione replicabile di dati di alta qualità, nonostante la necessità di lunghe manipolazioni dei campioni dell'istone.
Molti protocolli attualmente pubblicati richiedono l'utilizzo di HPLC per isolare frazioni pure di istoni H3 e H419. Anche se HPLC è una tecnica potente, la sua complessità e bassa produttività trattenere la maggior parte biologi molecolari e nonexperts dal suo uso frequente. Infatti, HPLC non è disponibile per molti laboratori, e personale altamente qualificato è necessaria per il funzionamento dello strumento. HPLC è spesso lunghi, costosi e potenzialmente pericolose. Una strategia di medio-trasmissione dei dati, poco costoso per ottenere risultati di qualità simile che bypassa HPLC è presentato qui. La strategia ha segnalata è anche più pratico e adatto per l'uso in quasi ogni laboratorio come utilizza un approccio di colonna di rotazione semplice che non richiede abilità operative strumento specializzato. Inoltre, tetramero di istone H3/H4 viene estratto come singolo, puro e abbondante frazione, consentendo una quantificazione affidabile di PTMs conservato su ciascuna delle proteine.
PTM sono estremamente sensibili ai cambiamenti nello sforzo ossidativo e cambiamenti nel pH20,21. Quindi, contrariamente ai metodi precedentemente pubblicati18, segnaliamo un'efficace strategia di risciacquo le cellule in terreni privi di siero per garantire una minima dispersione metabolica delle cellule e per evitare l'interferenza del PTMs nativo con componenti del siero. Il protocollo attuale non solo ignora l'isolamento di nuclei tradizionali, ma fornisce anche tempi ottimali per lisi cellulare e la procedura di omogeneizzazione esatta del tessuto che permette per la conservazione della busta nucleare, evitando l'aggregazione nucleare. Anche se il tempo di estrazione possa essere manipolato in base al numero di cellule, il tipo di cella utilizzata, la dimensione del tessuto, ecc., Lisi estesa non sono auspicabile in quanto potrebbe comportare la lisi dei nuclei e rilascio di DNA, il campione rendendo difficile da gestire. Cosa importante, più posti di blocco all'interno del protocollo esiste per la validazione di purificazione di successo dell'istone (ad esempio, passaggi 2.7 e 3.2.3). Questa strategia inoltre facilita la risoluzione dei problemi in tutta la lunga procedura.
Un'altra caratteristica importante ed unica del protocollo presentato è la piena compatibilità con strumenti di analisi a valle occidentale della macchia e gli altri se lo si desidera. Proteine istoniche vengono rilevate a ~ 15 kDa13,22,23 e, analogamente ad altre proteine di piccolo peso molecolare, sono state dimostrate impegnative per rilevare mediante tecniche di immunoblotting standard. Permette l'uso di un sistema di trasferimento di alto-rendimento e ad alte prestazioni in combinazione con i gel di proteina risoluzione ottimale per il mantenimento della proteina nativa conferma (in assenza di SDS) e attività in assenza di SDS e alta efficienza di trasferimento delle proteine a basso peso molecolare dell'istone, garantendo così una quantificazione di PTM istone affidabile.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori esprimono la loro gratitudine per la Florida reparto di salute Ed ed Ethel Moore Alzheimer Research Program (sovvenzioni 6AZ08 e 7AZ26), il NIH-NIAAA (grant 5R01AA023781-03) e l'American Heart Association (grant 17PRE33660831).
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes | ThermoFiser Scientific | 05-408-129 | or equivalent from other sources |
| Sterile water | Gibco | 15-230-204 | or equivalent from other sources |
| 70% perchloric acid | Sigma Aldrich | 311421 | or equivalent from other sources |
| 100% acetone | Sigma Aldrich | 270725 | or equivalent from other sources |
| pH-indicator strips, non-bleeding | Milliipore Sigma | 1095310001 | |
| 4x SDS sample buffer | BIO-RAD | 161-0747 | |
| Benchtop rotor | Cole-Parmer | UX-04397-34 | or equivalent from other sources |
| 1.5 mL tube rack | ThermoFiser Scientific | 05-541 | or equivalent from other sources |
| Histone purification mini kit | Active Motif | 40026 | spin columns included in the kit |
| Protease Inhibitor Cocktail | ThermoFiser Scientific | 78430 | or equivalent from other sources |
| Nanodrop instrument | ThermoFiser Scientific | ND-2000 | |
| Tissue culture dishes | VWR | 10062-880 | required for histone extraction from cultured cells |
| Tissue culute media | varies based on cell line used | varies based on cell line used | required for histone extraction from cultured cells |
| Low-serum media | ThermoFiser Scientific | 51985091 | required for histone extraction from cultured cells |
| Plastic cell scraper | Falcon | 353086 | required for histone extraction from cultured cells |
| SDS-PAGE gradient gel | BIO-RAD | 456-9035 | required for histone extraction from cultured cells |
| Coomassie Brilliant Blue R-250 Staining Solution | BIO-RAD | 1610436 | required for histone extraction from cultured cells |
| Coomassie Brilliant Blue R-250 Destaining Solution | BIO-RAD | 1610438 | required for histone extraction from cultured cells |
| Trans-Blot Turbo Mini PVDF Transfer Packs | BIO-RAD | 1704156 | required for histone extraction from cultured cells |
| Trans-Blot Turbo Transfer System | RIO-RAD | 1704150 | required for histone extraction from cultured cells |
| Ponceau S stain | CellSignalling | 59803S | required for histone extraction from cultured cells |
| Dounce homogenizer (size/cap sc 7mL) with a small size clearance | Kimble Chase | 885302-0007 | required for histone extraction from tissues |
| 100% bleach | Clorox | 68973 | required for histone extraction from tissues |
| H4K12ac antibody | Active Motif | 39166 | required for PTMs quantification via WB |
| H3K27ac antibody | Active Motif | 39134 | required for PTMs quantification via WB |
Riferimenti
- Holliday, R. Is there an Epigenetic Component in Long-term Memory?. Journal of Theoretical Biology. 200, 339-341 (1999).
- DeWoskin, V. A., Million, R. P. The epigenetics pipeline. Nature Reviews Drug Discovery. 12, 661-662 (2013).
- Eberharter, A., Becker, P. B. Histone acetylation: a switch between repressive and permissive chromatin. EMBO Reports. 3, 224-229 (2002).
- Grunstein, M. Histone acetylation in chromatin structure and transcription. Nature. 389, 349-352 (1997).
- Sartor, G. C., Powell, S. K., Brothers, S. P., Wahlestedt, C. Epigenetic Readers of Lysine Acetylation Regulate Cocaine-Induced Plasticity. The Journal of Neuroscience. 35, 15062-15072 (2015).
- Komatsu, N., et al. SAHA, a HDAC inhibitor, has profound anti-growth activity against non-small cell lung cancer cells. Oncology Reports. 15, 187-191 (2006).
- Bahari-Javan, S., Sananbenesi, F., Fischer, A. Histone-acetylation: a link between Alzheimer's disease and post-traumatic stress disorder. Frontiers in Neuroscience. 8, 160 (2014).
- Roh, T. -. Y., Cuddapah, S., Zhao, K. Active chromatin domains are defined by acetylation islands revealed by genome-wide mapping. Genes & Development. 19, 542-552 (2005).
- Mutskov, V., Felsenfeld, G. Silencing of transgene transcription precedes methylation of promoter DNA and histone H3 lysine 9. The EMBO Journal. 23, 138-149 (2004).
- Howe, L., Brown, C. E., Lechner, T., Workman, J. L. Histone acetyltransferase complexes and their link to transcription. Critical Reviews in Eukaryotic Gene Expression. 9, 231-243 (1999).
- Jenuwein, T., Allis, C. D. Translating the histone code. Science. 293, 1074-1080 (2001).
- Bowman, G. D., Poirier, M. G. Post-Translational Modifications of Histones That Influence Nucleosome Dynamics. Chemical Reviews. 115, 2274-2295 (2015).
- Volmar, C. -. H., Wahlestedt, C. Histone deacetylases (HDACs) and brain function. Neuroepigenetics. 1, 20-27 (2015).
- Plagg, B., Ehrlich, D., Kniewallner, K. M., Marksteiner, J., Humpel, C. Increased Acetylation of Histone H4 at Lysine 12 (H4K12) in Monocytes of Transgenic Alzheimer's Mice and in Human Patients. Current Alzheimer Research. 12, 752-760 (2015).
- Bhaskara, S., et al. Hdac3 is essential for the maintenance of chromatin structure and genome stability. Cancer Cell. 18, 436-447 (2010).
- Mottamal, M., Zheng, S., Huang, T. L., Wang, G. Histone Deacetylase Inhibitors in Clinical Studies as Templates for New Anticancer Agents. Molecules. 20, 3898-3941 (2015).
- Ramakrishnan, S., et al. HDAC 1 and 6 modulate cell invasion and migration in clear cell renal cell carcinoma. BMC Cancer. 16, 617 (2016).
- Wapenaar, H., Dekker, F. J. Histone acetyltransferases: challenges in targeting bi-substrate enzymes. Clinical Epigenetics. 8, 59 (2016).
- Klinker, H., Haas, C., Harrer, N., Becker, P. B., Mueller-Planitz, F. Rapid Purification of Recombinant Histones. PLoS ONE. 9, e104029 (2014).
- Chen, K., et al. Neurodegenerative Disease Proteinopathies Are Connected to Distinct Histone Post-translational Modification Landscapes. ACS Chemical Neuroscience. 9, 838-848 (2018).
- Simithy, J., Sidoli, S., Garcia, B. A. Integrating Proteomics and Targeted Metabolomics to Understand Global Changes in Histone Modifications. Proteomics. , (2018).
- Volmar, C. -. H., et al. An Epigenetic Approach for the Modulation of Amyloid Precursor Protein (APP) Processing and Improvement of Memory in Alzheimer's Disease. Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology. 40, S470 (2015).
- Volmar, C. -. H., et al. M344 promotes nonamyloidogenic amyloid precursor protein processing while normalizing Alzheimer’s disease genes and improving memory. Proceedings of the National Academy of Sciences. 114 (43), E9135-E9144 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon