Method Article
Подготовка и использование свежеизолированных человеческих детрузора гладкие мышечные клетки для характеристики 9-фенантрол чувствительных контов
В этой статье
Резюме
Мы описываем метод подготовки одного свежеизолированного детрузора гладких мышечных клеток из образцов мочевого пузыря человека, использующих двухступенчатую ферментативную процедуру. Полученные жизнеспособные клетки DSM могут быть изучены с помощью различных одноклеточных методов, включая описанную амфотерицину-B патч-зажим электрофизиологии, чтобы выявить физиологические и фармакологические свойства.
Аннотация
Detrusor гладкой мышцы (DSM) клетки, присутствующие в мочевом пузыре стены в конечном итоге облегчить хранение мочи и аннулирования. Подготовка жизнеспособных, свежих и изолированных клеток DSM представляет собой важную техническую проблему, достижение которой обеспечивает оптимальные клетки для последующих функциональных и молекулярных исследований. Метод, разработанный и разработанный в настоящем документе, успешно используемый нашей группой на протяжении более десяти лет, описывает вскрытие образцов мочевого пузыря человека, полученных в результате открытых операций мочевого пузыря с последующим ферментативным двухступенчатым лечением частей DSM и механической трикуляцией для получения свежеизолированных клеток DSM. Первоначальный шаг включает в себя вскрытие отделить слой DSM (также известный как muscularis propria) от слизистой оболочки (уротелиум, ламиновая проприия, и мускоза muscularis) и прилегающих соединительной, сосудистой и жировой ткани настоящее время. DSM затем разрезается на куски (2-3 мм х 4-6 мм) в номинальном Ca2 ",содержащийраствор вскрытия / пищеварения (DS). DSM части затем переданы и последовательно обрабатываются отдельно с DS, содержащим папаин и коллагенеза на 37 градусов по Цельсию в течение 30-45 минут за шаг. После моетливания с DS, содержащей без ферментов сыворотки крупного рогатого скота и тритурации с огнем полированной пипетки, куски релиз одного DSM клеток. Свежеизолированные клетки DSM идеально подходят для электрофизиологических и фармакологических характеристик ионных каналов. В частности, мы показываем, что блокатор канала TRPM4 9-фенантрол уменьшает напряжение-шаг вызвал катифика токи, записанные с амфотерицин-B перфорированный патч-зажим подход. DSM клетки также могут быть изучены с помощью других методов, таких как одноклеточные RT-PCR, анализ микроаррей, иммуноцитохимия, на месте перевязки анализа, и Ca2 "изображений. Основным преимуществом использования отдельных клеток DSM является то, что сделанные наблюдения непосредственно связаны с выявленными характеристиками одной клетки. Исследования свежеизолированных клеток DSM человека предоставили важные идеи, характеризующие свойства различных ионных каналов, включая катион-проницаемые в мочевом пузыре и будет продолжаться как золотой стандарт в выяснении DSM клеточных свойств и регулирующих механизмов.
Введение
Клетки демрузорной гладкой мышцы (DSM) представляют собой наиболее распространенный тип клеток мочевого пузыря и в конечном итоге контролируют хранение мочи и аннулирование через релаксацию и сжатие, соответственно. DSM клетки образуют гладкие мышечные пучки, которые переплетаются с прилегающей соединительной ткани, нервных процессов, интерстициальных клеток и других типов клеток1. Текущее понимание роли Клеток DSM в функции мочевого пузыря было достигнуто благодаря многоуровневому комплексному подходу. Каждый экспериментальный метод - будь то на основе изолированных одиночных клеток in vitro, тканевые полоски, содержащие гладкие мышечные пучки in vitro/ex vivo, или in vivo (такие как цитометрия и оценки функций аннулирования) - обеспечивает важное и конкретное понимание физиологических и фармакологических свойств DSM (см. обзоры1,2,3,4,5,6 для деталей). Однако интерпретация результатов, полученных из изолированных одиночных ячеек, позволяет делать выводы, специально приписываемые самому типу одной ячейки. Это осознание было движущей силой для создания надежного и воспроизводимого метода для получения свежеизолированных клеток DSM от всей толщины образцов мочевого пузыря. В отличие от многих других типов клеток, гладкие мышечные клетки не могут быть надежно культивированы из-за потери родного фенотипа, включая конкретные изменения в их электрофизиологических и сократительных свойств7,8. Этот факт еще больше подчеркивает важность исследований, проводимых на физиологически активных свежеизолированных клетках DSM.
В конце 1980-х и начале 1990-х годов группа Изенберга (Германия) опубликовала серию электрофизиологических исследований на свежеизолированных клетках DSM, полученных из мочевых пузырей морской свинки9,10,11,12,13 (Таблица 1). Метод выделил два важных замечания, которые помогли в получении жизненно важных клеток и служил в качестве первоначального ориентира для других следовать. Они были 1) предварительно лечения изолированных частей DSM с Ca2 "бесплатноерешение / средний до ферментативного лечения и 2) пищеварения ткани с раствором, содержащим коллагеназы. Эти два критических шага были включены во все последующие варианты процедур диссоциации клеток DSM(таблица 1). В настоящее время наша группа использует двухступенчатый последовательный подход к диссоциации папано-коллагенеза. Части DSM сначала обрабатываются ферментным раствором, содержащим папаин, а затем коллагеназой типа II растворяются в том же растворе (DS, раствор рассечения/пищеварения). Этот подход дает одиночные клетки DSM от различных видов включая морскую свинку, свинку, крысу, мышь, и важно людейшед(таблица 1).
Одиночные клетки DSM обеспечивают источник для множественных молекулярной биологии и физиологических экспериментов. До сих пор протеиновые и мРНК экспрессии изучались с помощью иммуноцитохимии, или RT-PCR/qRT-PCR определения показали высокий уровень обнаружения для различных ионных каналов, включая большое напряжение провода- и Ca2 "активирован(BK), небольшой проводимости Ca2 "-активированныйKи тип 3 (SK3), напряжение-gated K(K v), L-тип напряжения-gated Ca2 "(Ca v),и переходный рецептор потенциал апремносциона типа 4 (TRPM4) каналов, а также Na / Ca2 "обменник 14,15,16,17,18,19,20,21,22. Все они, как полагают, контролировать возбудимость DSM, внутриклеточные уровни Ca2 "и контрактности. Патч-зажим электрофизиологических подходов, выполняемых непосредственно на морских свинках, мыши, крысы, или человека DSM клеток, при условии прямой демонстрации биофизических и фармакологических свойств L-типа Cav, Kv (Kv2.x. Kv7), SK, BK, и TRPM4 каналов17,19,20,21,22,23,24,25 ,26,27,28,29,30,31. Подходы включали в себя обычные цельноклеточные зажим напряжения, перфорированное напряжение-зажим, и одноканальные записи (ячейка прилагается, наизнанку и за пределами конфигураций). Кроме того, мембранная потенциальная запись DSM с использованием тока-зажима предоставила доказательства того, что целевые фармакологические агенты изменяют возбудимость клеток. Например, ингибитор TRPM4 9-фенантрол индуцированной гиперполяризации в клетках DSM, полученных от людей, морских свинок, и крыс мочевого пузыря19,20,22,31. Среди различных электрофизиологических методов, амфотерицин-В (и нистатин, грамицидин, и к-эсцин) перфорированные патч-зажим записи обеспечивают ключевое преимущество, сохраняя внутриклеточные молекулы сигнализации и пути. Только низкий молекулярный вес катионов и в меньшей степени, Cl- но не белки или сигнальные молекулы, включая Ca2 " - проницаемы через плазменные мембраны поры, образованные амфотерицин-B или нистатин32. Успешный результат перфорированных патч-зажим экспериментов зависит от нескольких общих переменных, уникальных для этой техники. Здесь мы описываем детали процедуры использования амфотерицина-B, что наша группа успешно использовала на протяжениимногихлет,22,33,34,35,36,37,38,39.
Возможно, неселективные каналы катионов остаются одним из наименее понятных типов каналов в клетках DSM. Первый доклад о неселективном канале, похожем на катуляцию, датируется 1993 годом. В документе, в статье Веллнера и Isenberg11 описаны 33 pS стрейч-активированный одинканал, отображающий следующий ранг порядка ионной проницаемости: Kйgt;Naйgt;Csйgt; Почти десять лет спустя, Торнело и Нельсон40 описалNaи проницаемые катионные токи в клетках DSM мыши, ингибируемые Gd3 ",используя всеклеточные записи. Поскольку молекулярная идентичность неселективных каналов катации и их биофизические характеристики еще предстоит определить, будущие исследования в этой области исследований являются оправданными. Протокол, описанный в настоящем для записи неселективных катионных токов канала - с использованием внеклеточных и пипетковых внутриклеточных растворов, содержащихCs,TEAи нифедипин(Таблица 2), что физиологически и фармакологически смягчить Kv и Cav токи - был и будет продолжать быть полезным в электрофизиологических исследований неселективных каналов катуляции. Мы использовали этот конкретный протокол для определения степени ингибирования цельноклеточных катионов блокатором канала TRPM4 9-фенантрол в морских свинки, крысы и человека DSM клеток19,20,22.
Взятые вместе, метод, описанный здесь для получения свежеизолированных отдельных клеток DSM из человеческого мочевого пузыря обеспечивает жизнеспособные клетки очень подходит для электрофизиологических исследований с использованием различных конфигураций патч-зажим техники, Ca2 "-изображения,иммуноцитохимии, в situ проксимальной судебного анализа, и одноклеточных RT-PCR / qRT-PCR, а также передовые методы молекулярной биологии, включая Использование метода амфотерицина-B перфорированного патч-зажима сохраняет среду родной клетки в отличие от других конфигураций. При проведении с использованием конкретных условий, изложенных здесь, предназначенных для свести на нет вклады Kи Ca2 "токов в клетках DSM, напряжение-шаг индуцированных токов отображения свойств неселективных катионов подходит для биофизических и фармакологических характеристик.
протокол
Все методы, описанные здесь, были одобрены Комитетами Институционального Совета по обзору Университета Теннесси (Мемфис, Штат Теннесси, IRB 17-05714-XP) и Медицинским университетом южной Каролины (Чарльстон, SC, IRB' 00045232). Утвержденные процедуры позволяют целую толщину мочевого пузыря образцов (1 см по йgt;1 см) - содержащие все слои, включая слизистую оболочку, детрузор гладкой мышцы, и serosa также прилагаются кровеносные сосуды и жировой ткани) - должны быть собраны из пациентов-доноров, проходящих хирургическое частичное извлечение мочевого пузыря. Пациенты-доноры являются взрослыми (возрастной диапазон изучал до сих пор: от 25 до 87 лет), либо мужчины или женщины, с или без симптомов гиперактивного мочевого пузыря (как классифицируется Американской урологической ассоциации I-PSS оценка41). Хирургические процедуры включают в себя различные медицинские условия, включая радикальную цистэктомию для уротелиальной карциномы и аденокарциномы. В таких случаях собранный образец мочевого пузыря удален от места опухоли.
1. Рассечение тканей DSM и подготовка без слизистой оболочки DSM
- Изучите всю толщину образца мочевого пузыря, который прибыл в лабораторию из операционной в плотно герметичной емкости, наполненной холодным раствором вскрытия/пищеварения(рисунок 1 и таблица 2 для состава DS).
ПРИМЕЧАНИЕ: Образец обычно хранится в холодной DS от нескольких часов до ночи до прибытия в лабораторию. Для более длительного хранения, DS (Таблица 2) дополняется 1 мМ CaCl2. - Удалить и промыть человека всю толщину образца DSM (содержащий все слои, включая слизистую оболочку, DSM, и serosa) с ледяной DS для мытья прилагается мусора и крови.
- Прикрепите образец мочевого пузыря, слизистую оболочку вверх и серозу вниз, на силиконовое энантиомерное покрытие (Таблица Материалов) 150 мм диаметром круглую тарелку, наполненную ледяной DS(Рисунок 1B).
- Удалите соседние жировые ткани, кровеносные сосуды, эпителий (уротелий) и слизистую оболочку мускоза из образца путем резкого вскрытия с помощью микросциссоров и щипцы.
- Вырежьте несколько без слизистой оболочки DSM (длиной 2-3 мм и шириной 4-6 мм)(рисунок 1С).
2. Энзиматическая диссоциация частей DSM, приносящих свежеизолированные одиночные клетки DSM
- Поместите от 3 до 6 частей DSM в трубку, содержащую от 1 до 2 мл предварительно разогретого (No 37 кВС), DS, содержащего папаин и дитиотрейтол (DS-P, таблица 2) и инкубировать части DSM в DS-P в течение 30-45 мин при 37-C мягко встряхивая трубку время от времени (раз в 10-15 минут).
ПРИМЕЧАНИЕ: Для оптимального контроля температуры для ферментатической обработки, трубки с кусочками ткани и ферментные растворы помещаются либо в стеклянную камеру ткани, наполненную водой, соединенной с циркулирующей водяной баной(рисунок 1D),либо высокоточной температурно-контролируемой встряхивающей водяной бане(рисунок 1E). - Удалить DS-P из трубки, кратко мыть DSM штук с ледяной DS, отбросить холодный DS из трубки оставляя DSM штук, сидя в нижней части трубки.
- Добавьте от 1 до 2 мл DS-содержащего коллагеназа типа II (DS-C, таблица 2) в трубку с частями DSM, аккуратно перемешайте; и инкубировать в течение 25-40 мин при 37 градусов по Цельсию мягко встряхивая трубку время от времени (каждые 10-15 мин).
- Откажитесь от DS-C и промойте ферментообработанные части DSM 5-10 раз с помощью ледяного DS.
- После последней стирки, оставьте dS решение внутри трубки; нежно triturate с огнем полированной пастерной пипетки несколько раз, чтобы освободить один очных dSM-клеток.
- Поместите несколько капель раствора DS, содержащего рассеянные клетки DSM, на стеклянно-нижнюю камеру или крышку и визуально проинспектируйте качество под микроскопом (с помощью 20x или 40x цели) после того, как по крайней мере 5 минут после применения, чтобы позволить клеткам придерживаться дно.
- Немедленно используйте свежеизолированные клетки DSM для электрофизиологических экспериментов или храните клетки в трубке, содержащей DS при 4 градусах По Цельсия либо на льду, либо в холодильнике до использования (обычно для подготовки до 8 ч).
ПРИМЕЧАНИЕ: В рамках той же подготовки качество клеток варьируется от весьма жизнеспособных переуваченных, мертвых клеток DSM (Рисунок 2). Когда последовательный метод папаин-коллагенеза дает очень большое количество нежизнеспособных клеток, препарат отбрасывается, и проводится новое пищеварение частей DSM, но с уменьшенными инкубационными интервалами. Если процедура приводит к слишком мало DSM клеток, то для последующего переваривания частей DSM, инкубационные интервалы увеличиваются. Положительная иммунореактивность к плавным мышечным актину подтверждает идентичность клеток DSM(рисунок 3).
3. Запись напряжения шаг индуцированных катионов из клеток DSM с помощью амфотерицин-B перфорированных цельноклеточного напряжения патч-зажим техники
- Пипетка 0,25-1 мл клеточной подвески на стеклянную нижнюю камеру, сидящую на сцене перевернутого микроскопа, позволяет клеткам прилипать к стекольному дну.
- После инкубации в течение по крайней мере 45 мин, удалить DS из ванны и заменить решение E (Таблица 2) путем переливания, где поток раствора помогает гравитации через впускные трубки замедление заменяет DS с новым раствором в то время как выход трубки подключен к вакуумной отходы судна удаляет решение камеры и предотвращает переполнение. Обратите внимание, что e раствор содержит тетраэтиламмоний (TEA)и ионы цезия (Cs)для ингибирования ТоковК.
- Подготовьте рабочий запасной раствор амфотерицина-В в диметилсульфодокси (ДМСО) (1 мг на 10 л ДМСО). Чтобы полностью растворить амфотерицин порошок, sonicate (не менее 15 мин) и вихрь раствор хорошо.
ПРИМЕЧАНИЕ: Этот шаг обычно занимает менее 10 мин. Растворение 3-4 мг амфотерицина-В в 30-40 Л Л DSMO в 1,5 мл микроцентрифугной трубки хорошо работает. Более высокие количества амфотерицина-B требуют более DSMO растворителя обычно приводит к более длительному интервалу для смешивания и неполной растворимостизации твердых частиц амфотерицина-В, присутствующих в трубке. - Растворите запасной раствор амфотерицина-В в растворе пипетки (решение P, таблица 2),чтобы получить окончательную концентрацию 200-500 мкг/мл. Этот шаг требует обширной звуковой и вихревой на высокоскоростной настройки (8-10/10) в течение 30 до 60 минут на шаг, чтобы обеспечить оптимальное смешивание и профилактику образования амфотерицина-B осадка в растворе пипетки.
ПРИМЕЧАНИЕ: Амфотерицин-B будет осаждать сверхурочные и светочувствительным. Рабочий раствор пипетки, содержащий Амфотерицин-В, проверяется на растворимость, смешивается вручную до заполнения пипетки и хранится в темноте. - Потяните несколько электродов патч, огне-польский электрод советы, и (при необходимости) пальто советы с зубным воском.
- Заполните кончик патч электрода с раствором пипетки (решение P, Таблица 2) без амфотерицина-B, кратко окуная электрод в раствор.
- Заполните электрод тем же раствором пипетки, содержащим амфотерицин-В.
- Установите электрод на держатель, подключенный к головной убор усилителя патч-зажима.
- Используя микроманипулятор, поместите электрод чуть ниже поверхности внеклеточного раствора, чтобы кончик электрода был просто погружен.
- В режиме напряжения-зажима установите потенциал удержания до 0 мВт и отрегулируйте ток до 0 pA с помощью компенсаторного циферблата пипетки на коммерческом усилителе(Таблица материалов).
- Определите сопротивление электрода с помощью окна/функции теста Membrane(Таблица материалов). Чтобы активировать нажмите Инструменты»gt;Membrane Test'gt;Play или значок ярлыка в программном обеспечении. Определенное сопротивление электрода должно находиться в диапазоне от 2 до 5 МЗ.
ПРИМЕЧАНИЕ: Функция Membrane Test, представленная в программном обеспечении для коммерческого приобретения или опции Seal Test на усилителе, может быть использована для мониторинга сопротивления электродов, повторяя шаги напряжения. - Продолжить мониторинг сопротивления электродов при продвижении электрода к выбранной ячейке DSM с помощью микроманипулятора(рисунок 4А).
ПРИМЕЧАНИЕ: Чтобы считаться жизнеспособной ячейкой DSM, клетка должна показать спиннообразную удлиненную морфологию, четко определенный ореол вокруг клетки, четкие края и полуконтрактный (серпантин) внешний вид. - При приприкосновении к поверхности клетки с помощью электрода - о чем свидетельствует быстрое увеличение сопротивления электрода, измеряемого с функцией Membrane Test - образуйте гига-печать, применяя нежное быстрое отрицательное давление на держатель электрода через трубку. Это приводит к отрицательному давлению, создаваемому на кончике электрода, который тянет клеточную мембрану в электрод, помогающий в формировании гига-печати или очень плотный контакт между электродом и плазменной мембраной(Рисунок 4B).
- Как только гига-печать формируется, компенсировать емость пипетки, регулируя быстрые и медленные циферблаты на коммерческом усилителе и контролируя гига-печать стабильности (утечка тока) с помощью функции Membrane Test.
- Разрешить время, как правило, 30-60 мин, для амфотерицина-B, чтобы рассеять вниз пипетка и быть вставлены в плазменной мембраны формирования пор в первую очередь избирательно к моновалентным катионов. Во время этого шага продолжайте мониторинг гига-печати с функцией теста Membrane. По мере увеличения клеточной перфорации увеличивается и амплитуда переходных емки (сравните рисунок 4В против рисунка 4С, не отображающий и эффективную клеточную перфорацию, соответственно), измеренную с функцией Membrane Test.
- Когда перфорация патча является оптимальной (судя по стабильной устойчивости серии, как правило, ниже 50 МЗ), отменить конденсаторов, регулируя циферблаты для емкости клеток и устойчивости серии на усилителе. Серия сопротивления компенсации также может быть выполнена в это время(Рисунок 4D).
- После того, как стабильные напряжения шаг индуцированных катионных токов, вызванных указанным протоколом наблюдаются, применять соединение или физиологическое состояние для проверки путем переливания и записывать ответы на контроль-, тест-условие, и вымывание (если это возможно) с коммерческое программное обеспечение приобретения.
- Запись токов с обычным протоколом напряжения-шага, который включает в себя проведение DSM-клеток на -64 или -74 мВ и активизации напряжения в 10 мВт шагом для 400 или 500 мс от -94 до 96 или 106 мВ и возвращение к холдингу потенциал.
ПРИМЕЧАНИЕ: Потенциальные значения мембраны корректируются на потенциал жидкого соединения 14 мВ (с использованием решений P и E, таблица 2). Потенциал жидкого соединения получен в программном обеспечении для коммерческих приобретений(Таблица материалов), нажав кнопку(Инструменты)Gt;Junction Potentials) и ввод концентраций компонентов ионов раствора. Протокол рампы также может быть использован для получения текущих записей. - Запустите протокол напряжения в непрерывном интервале 1 мин во время эксперимента записи токов для предварительного добавления управления, состояние теста, и вымывание.
- Запись токов с обычным протоколом напряжения-шага, который включает в себя проведение DSM-клеток на -64 или -74 мВ и активизации напряжения в 10 мВт шагом для 400 или 500 мс от -94 до 96 или 106 мВ и возвращение к холдингу потенциал.
4. Анализ и визуализация данных
- Открытые записанные файлы в коммерческом программном обеспечении для анализа данных(Таблица материалов) для управления, условия тестирования и вымывания, нажав файла и открытые данные и выбор файлов, представляющих интерес для открытия.
ПРИМЕЧАНИЕ: Для анализа обычно открываются и анализируются три файла (каждый из которых содержит один набор следов одного протокола) для каждого состояния. Ответы впоследствии усредняются, чтобы получить средний ответ для каждого состояния. Программное обеспечение, используемое для сбора данных, содержит возможность автоматически собирать указанные пользователем несколько тестовых запусков и усреднять их для одного выходного файла, который может быть использован в качестве альтернативы. - Получить средний ответ за последние 200 мс для текущего следа, измеренного при каждом напряжении; выбранный интервал продолжительности отражает устойчивый уровень активации тока напряжения-шага. Для этого следуйте приведению ниже.
- Выберите файл, представляющий интерес для анализа в программном обеспечении для коммерческого анализа(Таблица материалов).
ПРИМЕЧАНИЕ: Программное обеспечение позиционирует самый недавно импортированный файл в свое активное окно отображения. Открытый файл отображает ряд перекрывающихся следов, полученных с помощью протокола напряжения-шага. По умолчанию в активном окне отображаются четыре курсора (отображение значений x и y для выделенного следа). - Выберите диапазон для анализа, позиционируя курсор 2 в конце шага напряжения 400 или 500 мс и курсор 1 с интервалом 200 мс до этого, так что диапазон анализа составляет 200 мс.
- Получить ответы для каждого напряжения, нажав Анализ »gt;Быстрый График»GT;IV (или значок быстрого ярлыка) (в быстром окне перед генерацией данных подтверждают, что для y-оси (Текущий) параметры региона сигнала "Курсоры 1..2" и "Средний" выбраны). Нажмите OK для создания i-V-графика и поместить данные в столбец результаты листа, которые могут быть просмотрены путем доступа к Windows и результаты.
- Проанализируйте дополнительные файлы, повторяя шаги 4.2.1 - 4.2.3. Нажмите На кнопку «Анализ»;Быстрый график»;IV или ярлык IV значка, выберите приложение, а не замените, чтобы добавить дополнительные данные в лист результатов при обработке следов.
- Копирование данных в электронную таблицу, выбрав интересующие колонки и нажав на CTRL-C для копирования и CTRL-V для вставки. Храните лист результатов в программном обеспечении для коммерческого анализа(Таблица материалов)в формате (.rlt), нажав файла;Сохранить как.
- Выберите файл, представляющий интерес для анализа в программном обеспечении для коммерческого анализа(Таблица материалов).
- Для каждой ячейки нормализовать ответы для всех трех условий к значению максимального шага напряжения для предварительного контроля добавления (в соответствии с формулой: Response/ResponseControl-Max)и график ответов как текущие (или текущая плотность) значения по сравнению с отношениями напряжения(рисунок 6).
- В процессоре листа определите средние ответы как токи (pA) или текущую плотность (pA/pF) для управления, состояния теста (в данном примере, 9-фенантрол) и вымывания на каждом шагу напряжения.
- Разделите значения для каждого напряжения каждого состояния (контроль, 9-фенантрол, и вымывание) на максимальный контрольный ответ, полученный на самом высоком напряжении (96 мВ на рисунке 6) для предварительного контроля добавления после формулы: Нормализованный ответ для состояния (x) - Ответ(x)/Ответ управления-Макс для (x).
- Для краткого анализа расположите данные в формате, который может быть легко скопирован в графическую программу (например, GraphPad Prism) для визуализации.
Результаты
Энзиматическая диссоциация частей DSM обеспечивает здоровые свежеизолированные клетки DSM, обычно используемые в функциональных и молекулярных исследованиях, таких как: электрофизиология патч-зажима и иммуноцитохимия. Рисунок 1 обобщает шаги вскрытия и визуализирует установки, используемые для контроля температуры ферментативных этапов лечения. Рисунок 2 иллюстрирует яркие полевые изображения клеток DSM, полученных из трех образцов мочевого пузыря человека каждый из различных пациентов-доноров. Здоровые одиночные клетки DSM характеризуются шпиндель-образной морфологией, четкими четко определенными краями, четко определенным ореолом вокруг клетки и полуконтрактным (серпантином- как) появлением под микроскопом (см. DSM-клетки, обозначенные белыми стрелками на рисунке 2). Они также реагируют на сокращение стимулирующих агентов, таких как мускариновый агонист карбахол или высокой Kq (60 мМ) приложений. DSM-клетки показывают положительную иммунореактивность для плавных мышечных актинов, подтверждающих их идентичность(рисунок 3).
DSM-клетки идеально подходят для электрофизиологических исследований ионных каналов. Здесь мы описываем амфотерицин-B перфорированный патч-зажим записи метода с использованием пипетки и внеклеточных решений (Таблица 2) для оптимальной записи напряжения шаг индуцированных каналов катации. В конкретных условиях, блокада Kv и L-типа Ca2 "токи с Cs /TEA и нифедипин, соответственно, обеспечили устранение вклада этих ионных компонентов в цельноклеточное напряжение вызванных токов. Рисунок 4 и Рисунок 5 показывают, соответственно, экспериментальные шаги метода перфорекции-B перфорированного патч-зажима и репрезентативных цельноклеточных токов, измеренных либо с напряжением-шагом индуцированной или протокол ампана в трех различных человеческих клеток DSM, каждый из разных доноров. Обратите внимание, что записи отображают определенную степень изменчивости с точки зрения текущей амплитуды и внешней выправления. Дополнительные эксперименты показали, что 9-фенантрол, ингибитор канала TRPM4, эффективно и обратимо ингибирует человеческие катионные токи DSM при отрицательном и положительном напряжении(рисунок 6). 9-фенантрол чувствительных ток компонент иллюстрирует более сильное торможение при положительном напряжении и внешней исправления(Рисунок 6C).
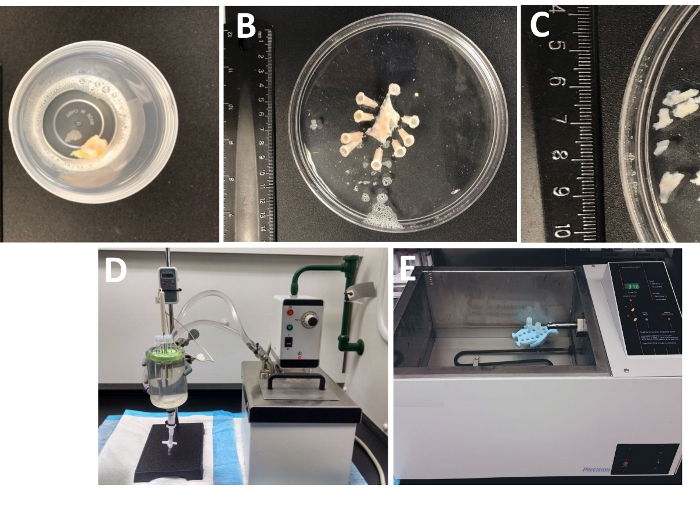
Рисунок 1: Резюме вскрытия шагов, приводящих к подготовке детрузор гладких мышц (DSM) штук и установки, используемой для ферментативной диссоциации. Показаны изображения: (A) целая толщина человека мочевого пузыря образца, предоставляемые от открытой хирургии мочевого пузыря в качестве постороннего хирургического материала в ледяной DS, (B) тот же препарат после закрепления с частично расчлененный слой DSM, (C) DSM части переменных размеров вырезать из слоя DSM готовы к ферментативному пищеварению (меньшие куски) или других экспериментальных исследований (большие куски), (D, E) альтернативные установки, используемые для ферментативного пищеварения частей DSM либо (1) циркулирующая водяная ванна, соединенная через трубку к большой стеклянной камере, наполненной водой, резиновый держатель для трубок, пластиковые трубки, содержащие части DSM и ферментные растворы, подготовленные в растворе вскрытия/пищеварения (DS, либо DS-P или DS-C, Таблица 2) и температурный зонд, связанный с дисплеем, позволяющим осуществлять непрерывный мониторинг(D),или (2) большую наполненную водой температурно-управляемую ванну, содержащую держатель и трубки с dSM-растворами и ферментными растворами (E ). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
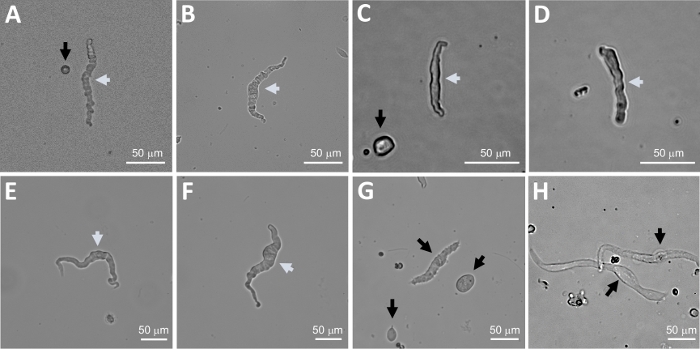
Рисунок 2: Представитель ярко-поля изображения человека свежеизолированных клеток DSM, полученных с помощью последовательного папан-коллагенеза пищеварения метода. (A-F) Отображаются изображения жизнеспособных, физиологически активных клеток DSM считается подходящим кандидатом для попытки перфорированных патч-зажим записей. (G, H) Изображения нежизнеспособных или переваренных клеток; таких клеток избегали для экспериментов с патч-зажимом. Белые и черные стрелки в панелях(A-H) указывают на DSM-клетки, считающиеся жизнеспособными и нежизнеспособными, соответственно, для попытки записи патч-зажима. Обратите внимание, что черные стрелки в панелях(A, C и G) указывают на фрагменты клеток (круглые части) или небольшие клетки, не имеющие морфологии DSM и в (H) клетки кажутся бледными и расширенными. Изображения из трех различных образцов мочевого пузыря(A и B : пациент-донор источник один, C и D : пациент-донор источник два, и E-H : пациент-донор источник три). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
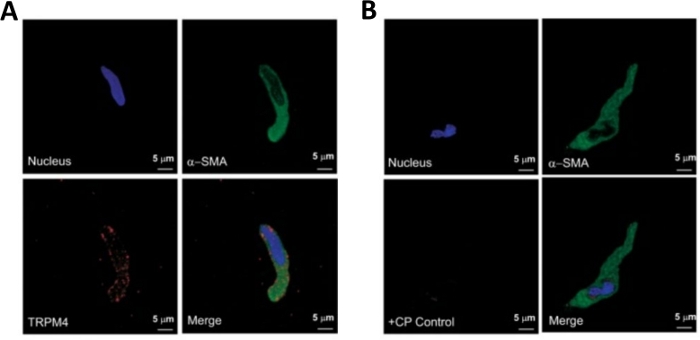
Рисунок 3: Выражение переходного рецептора потенциал апрементного типа 4 (TRPM4) канал и - гладкая мышца специфический актин иммунореактивности в отдельных человеческих клеток DSM иммуноцитохимии анализа. (A) Показаны конфокальные изображения, показывающие иммуноцитохимическое обнаружение экспрессии белка канала TRPM4 в клетке DSM человека. Красное окрашивание (внизу слева) указывает на белки канала TRPM4; синий (DAPI) окрашивание обнаруживает ядра клеток (вверху слева); зеленое окрашивание указывает на плавный мышечный актин (З-СМА, в правом верхнем правом); объединенное изображение (внизу справа) иллюстрирует перекрытие всех трех изображений. (B) Конфокальные изображения, иллюстрирующие затукание иммуноцитохимического обнаружения экспрессии белка канала TRPM4 в присутствии TRPM4-специфического конкурирующих пептида (CP) в изолированных клетках DSM человека. Синий (DAPI) окрашивание указывает на ядра клеток (вверху слева); зеленое окрашивание для з-гладкого мышечного актива (З-СМА, вверху справа); объединенное изображение (внизу справа) иллюстрирует перекрытие всех трех изображений. Результаты были проверены в четырех отдельных экспериментах с использованием DSM целые ткани или несколько клеток DSM изолированы от четырех пациентов. Изображения от Hristov et al. (2016)22 и использованы с разрешения. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
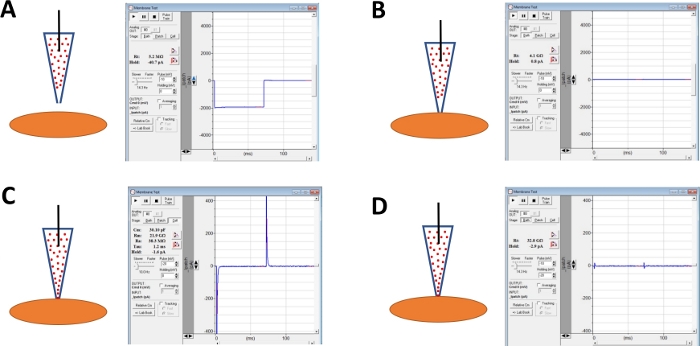
Рисунок 4: Схематическая иллюстрация шагов, связанных с формированием гига-уплотнения и перфорацией амфотерицина-В клеток ДСМ человека. Иллюстрированные пространственные позиции амфотерицина-B, содержащего пипетку и ячейку DSM, а также связанные ответы на мембранные тесты, полученные в программном обеспечении для коммерческих приобретений(Таблица материалов), путем изменения ступеней напряжения (или -10 или -20 мВ в этом примере), определяющих сопротивление. Конфигурации: (A) до клеточного подхода с электродом, (B) после гига-уплотнения формирования, полученные путем позиционирования амфотерицин-B, содержащий пипетки (амфотерицин-B представлены красными точками) на поверхность клетки и применения отрицательного давления, (C) на-клетки конфигурации показано 45 мин после гига-печать формирования, в этом времени точки амфотерицин-B рассеял вниз пипетка и его молекулы вставили в плазменной мембране на кончике электрода формирования катиона проницаемые поры, и (D) той же конфигурации, как в (C), но с конденсацией переходных отменены с помощью циферблатов для питания цельноклеточных и серии сопротивления на усилителе. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
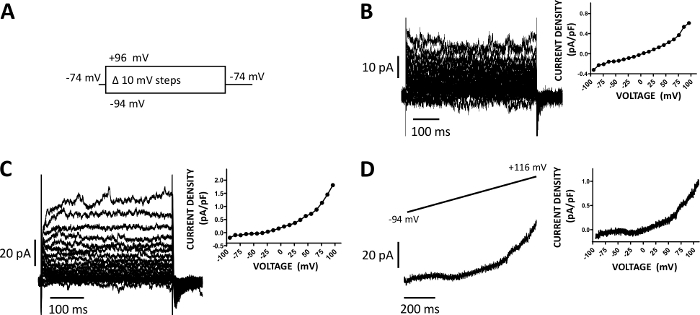
Рисунок 5: Цельноклеточные катионные токи, записанные с помощью перфотерного метода перфорированного патч-зажима в клетках DSM человека. (A) Диаграмма протокола напряжения-шага иллюстрирует потенциал держать -74 mV и напряжения-шаги 400 ms продолжительность от -94 до 96 mV унесено в приращениях 10 mV и после этого возвратило к -74 mV. (B, C) Представитель текущих следов наряду с текущей плотности напряжения участков из двух различных человеческих клеток DSM, каждый из различных мочевого пузыря образца / пациента-донора, полученные с напряжением шаг протокола, описанного в (A). (D) Пример текущего следа, полученного с протоколом рампы (графически представленв в верхней вставке, как изменение напряжения от -94 до 116 мВ в течение 1 с длительностью на 0,21 мВ/мс, удерживая потенциал был -94 мВ). Справа в панелях (B-D), графики отображают текущую плотность напряжения отношения для каждой ячейки DSM записаны. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
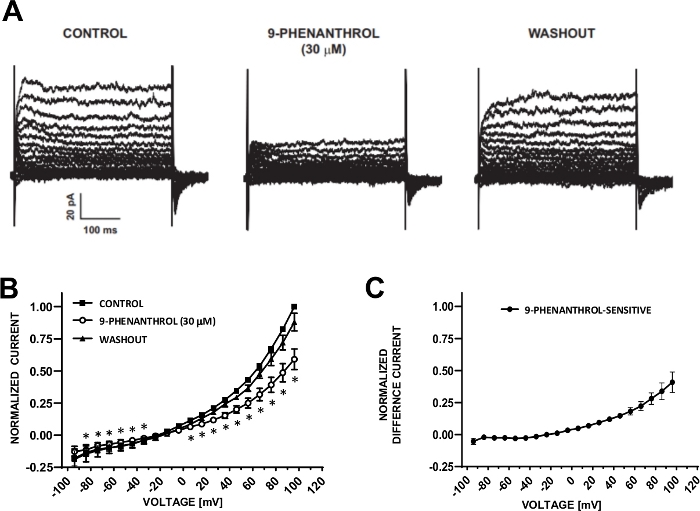
Рисунок 6: БЛОКатор канала TRPM4 9-фенантрол-опосредованное ингибирование напряжения-шаг индуцированных катионов в клетках DSM человека. (A) Показаны репрезентативные токи, измеренные с протоколом напряжения-шага, описанным в рисе. 5A для управления, 9-фенантрола и вымывания. (B) Резюме нормализованных ответов по сравнению с напряжением для контроля, 9-фенантрол, и вымывание в семи клетках DSM (из семи различных пациентов-доноров). (C) Разница ток для 9-фенантрол чувствительный компонент, полученный путем вычитания значений в присутствии 9-фенантрол (30 мкм) от тех, контроля показано в (B). Данные в (B)и (C) отображаются в качестве средств с барами ошибок для SEM, - это значение (p'lt;0.05, тест в паре студента) для сравнения контроля против 9-фенантрола при каждом напряжении. Панели(A)и (B) были воспроизведены из Hristov et al. (2016)22 и использованы с разрешения. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Видов | Детали процедуры | Ссылки | |
| Гвинейская свинья | DSM куски промыть с Ca2 "-свободнойсреде (в мМ: 100 NaCl, 10 KCl, 1.2 KH2PO4, 5 MgCl2, 20 глюкозы, 50 таурин, измеренный pCa 6 (или 1 мМ), а затем разрезать на куски и лечение, как правило, 90-120 мин (4 периода 30 мин) с ферментом среднего (mM, 20 таурин, 5 пируват, 5 креатин, 10 мМ HEPES, скорректированы с метанцульфоновой кислотой до рН 7,4, 1 мг/мл коллагена, 0,2 мг/мл проназе E, 1 мг/мл жирных кислот свободный альбумин, pCa-4.2 (63 мм) или 3,7 (200 мм). Одноместные DSM-клетки хранились в Kraft-Bruhe (KB)-средний (в мМ: 85 KCl, 30 K2PO4,5 MgSO4, 5 Na2ATP, 5 K-pyruvate, 5 creatine, 20 таурин, 5 бета-OH-бутират, 1 мг/мл жирных кислот бесплатно альбом, скорректированный с KOH до pH 7.2). Альтернативный метод: DSM штук промыть в течение 10 минут в Ca2 "свободнойсреде (в мМ): 140 NaCl, 5 KCl, 1,2 MgCl2, 10 глюкозы, 20 таурин, 5 HEPES, с поправкой на NaOH до рН 7,4). Затем DSM штук, инкубированных в том же Ca2 "-свободнойсреде дополняется 5 мг% коллагеназы, 2 мг% проназа и 100 мкм CaCl2 для 2x20 мин помешивания. | Клокнер и Изенберг (1985)13,34 Клокнер и Исенберг (1986)35 Шнайдер и др. (1991)10 Бонев и Изенберг (1992)9 Вайдельт и Исенберг (2000)36 и др. | |
| Гвинея свиньи, Landrace свиньи, и человека | DSM штук предварительно инкубируется в течение 5 мин в Ca2 "свободныйкребс решение затем разрезать на куски и ферментативно усваивается в Ca2 "-свободныйкребс раствор, содержащий 0,5-2 мг/мл коллагеназы типа I и 0,1-0,5 мг/мл проназы при 36"C на 20-30 минут постоянно перемешивают. В некоторых случаях, переваренные куски были дополнительно взволнован тупой наконечником пипетки или спиннинг до получения клеток. Изолированные клетки хранились в модифицированном растворе Krebs (описанном в Klockner и Isenberg13) и обычно использовались в пределах 3 ч. Состав решения Кребса был (мМ): 140 Na,6 K,2 Ca2 ", 1,2 Mg2 ",152,4 Cl-, 10 глюкозы, 10 HEPES, рН 7,35-7,4 с Tris. Для решения Ca2 --бесплатно, Ca2 "и Mg2" были опущены из решения Кребс. | Иноуэ и Брадинг (1990)37 Иноуэ и Брадинг (1991)38 Накаяма и Брадинг (1995)39,40 | |
| Человека | DSM штук, размещенных в Ca2 -бесплатноHEPES Tyrode решение (в mM: 105.4 NaCl, 20.0 или 22.3 NaHCO3, 3.6 KCl, 0.9 MgCl2, 0.42PO4, 19.5 или 4.9 HEPES, 5.4 или 5.5 глюкозы, 4.5 или 5.5 Na-pyruvate) и разрезать на части DSM. DSM штук, пропитанных ферментным раствором (Ca2 "свободный раствор HEPES с 0,7 мг/мл коллагеназы типа I, 0,7 мг/мл папаин, 1 мг/мл альбумина) на ночь при 4 градусах Цельсия. Полосы затем нагревали при 36,5 градусов по Цельсию в течение 15-30 мин, промывают и аккуратно тритурировали в свежем растворе. Изолированные ячейки, которые хранились в Ca2, содержащие раствор HEPES Tyrode или немедленно используемые для экспериментов. | Монтгомери и Фрай (1992)24 Гальегос и Фрай (1994)41 Фрай и др. (1994)42 Sui et al. (2001)43 Wu et al. (2002)44 | |
| Гвинейская свинья | DSM разрезать на куски в PSS (в MM: 137 NaCl, 5.4 KCl, 2 MgCl2, 2 CaCl2, 0,42 KH2P04, 4.17 NaHCO3, 10 глюкозы, 10 HEPES, рН 7,4 с NaOH). DSM штук, помещенных в течение 10 мин в следующем растворе пищеварения (в ММ: 80 Na-глутамата, 55 NaCl, 6 KCl, 10 HEPES, 11 глюкозы, 2 MgCl2, и 0,2 CaCl2), а затем переданы в флакон, содержащий тот же раствор, но с 1 мг / мл коллагена 2, 1 мг / мл трипсин ингибитор (иногда опущены), 1 мг / мкм обезжиренного быка альбомина, для 70 мин при 35"C или 60 м. Одиночные DSM-клетки были получены путем тритурации через пипетку Pasteur в том же растворе без кальция и ферментов. После тритурации, Ca2 "(1 мМ) был добавлен и клетки были сохранены при 4 "C. Клетки всегда использовались в один и тот же день. | Бонев и Нельсон (1993)53,54 Хеппнер и др. (1997)26 Петков и др. (2001)47 Shieh et al. (2001, 2007)48,49 | |
| Гвинея свиньи, мыши, крысы и человека | Протокол использует двухступенчатую ферментативную диссоциацию после резкого вскрытия в растворе без пищеварения Ca2(в ММ: 80 Na-глутамата, 55 NaCl, 6 KCl, 10 HEPES, 11 глюкозы и 2 MgCl2). Во-первых, части DSM лечились в течение 25-45 мин при 37 градусах по Цельсию при 1-2 мг/мл папаина, 1 мг/мл дитиоэритрийтрола и 1 мг/мл булбумисированной сыворотки крупного рогатого скота в растворе диссоциации (в мМ: 80 мононатриевый глутамат, 55 NaCl, 6 KCl, 2 MgCl2, 10 HEPES, и 10 глюкозы,скорректированы на рН 7,3 с NaOH), а затем DSM штук, переданных в раствор пищеварения, содержащий 1-5 мг/мл коллагеназы XI (Сигма) или коллагеназы типа 2, 1 мг /мл булбормин крупной сыворотки, 0 или 1 мг/мл трипсина ингибитор и 100М. После инкубации, переваренная ткань промывалась несколько раз в растворе пищеварения без ферментов и Ca2 ", а затем мягко triturated для получения одной гладкой мышечной клетки. | Петков и др. (2001)50 Торнело и Нельсон (2003)51 Торнело и Нельсон (2004)33 Петков и Нельсон (2005)27 Христов и др. (2008)52 Лейн и др. (2010)53 Христов и др. (2011)15 Xin et al. (2012)54 Parajuli et al. (2012)25 Malysz et al. (2013)29 Parajuli et al. (2013)31 Lee et al. (2013)55 Malysz et al. (2014)23 Smith et al. (2013), 103 ( 2013) 20 Христов et al. (2016)22 Lee et al. (2017)56 Ярошский и др. (2018)57 | |
Таблица 1: Резюме ферментативных подходов, используемых для изоляции отдельных клеток DSM из мочевыводящих пузырей различных видов.
| Тип решения | Композиция (в мМ) |
| DS (Решение для рассечения/пищеварения) | 80 На-глютамат, 55 NaCl, 6 KCl, 10 HEPES, 2 MgCl2, и 11 глюкозы, рН скорректированы до 7,4 (с 10 M NaOH) |
| DS-P (Папейн-содержащий DS) | DS, содержащий 1-2 мг/мл папаина, 1 мг/мл дитиотрийтол и 1 мг/мл булбумистого сыворотки крупного рогатого скота |
| DS-C (Коллагеназа-содержащий DS) | DS раствор, содержащий 1-2 мг/мл коллагеназы II типа, 1 мг/мл булбумина из крупной сыворотки, 0 или 1 мг/мл трипсина ингибитор и 100-200 мкм Ca2 |
| P (Пипетта) | 110 CsOH, 110 аспарговая кислота, 10 NaCl, 1 MgCl2, 10 HEPES, 0.05 EGTA, и 30 CsCl,pH скорректированы до 7,2 с CsOH, и дополнены амфотерицин-B (300-500 мкг/мл) |
| E (Экстрацеллальные) | 10 тетраэтатиламмониххлоида (TEA), 6 CsCl, 124 NaCl, 1 MgCl2, 2 CaCl2, 10 HEPES, и 10 глюкозы, рН скорректированы до 7,3-7,4 с NaOH или CSOH, и 0,002-3 (2-3 мМ) нифедипин |
Таблица 2: Композиции раствора вскрытия/пищеварения (DS), а также пипетки и внеклеточные решения, используемые в перфорированных экспериментах по зажиму.
Обсуждение
Описанные здесь процедуры объясняют шаги, связанные с подготовкой жизнеспособных, свежеизолированных клеток DSM из целой толщины человеческих образцов мочевого пузыря с использованием ферментативного пищеварения и в записи цельноклеточных катионных токов, чувствительных к ингибитору канала TRPM4 9-фенантрол с использованием амфотерицина-B перфорированного патч-зажима подход. Ферментативная процедура опирается на двухступенчатый последовательный воздействия называют сяврющегося папан-коллагенеза метод пищеварения. DSM ткани сначала обрабатываются папаин и дитиотрийтол (фермент стабилизирующий агент) при номинальном Ca2 "-бесплатноесостояние, а затем на втором этапе коллагеназа типа II в присутствии низких Ca 2". Обоснование для проведения папаин пищеварения в условиях низких Ca2 "в гладких мышечных клеток восходит к концу 1980-х годов. Свежеизолированная сонная артерия гладкие мышечные клетки, подготовленные с папаином, показали удлиненную форму, показали жизнеспособность (устойчивость к trypan Blue поглощения) и ответил на сократительные стимулы (выше Ca2 " и гистамин)65. Годы спустя, этот метод был применен в подготовке клеток DSM (см. Таблица 1). Выбор коллагеназа типа II, а не других типов относится к его относительно высокой протеолитической активности идеально подходит для гладких мышечных тканей, включая DSM. Действительно, лечение коллагеназой только может дать одиночный DSM клеток, хотя и требует широкого воздействия фермента (60 мин)53,54. Так как активность коллагеназы зависит от Ca2 "и фермент неактивен в условиях Ca2 ",свободных, оптимальное ферментативное пищеварение частей DSM требует присутствия Ca2' 66. В нашем случае, DS-C содержит 100-200 ММ (Ca2)(таблица 2). После ферментативной обработки, переваренные части DSM промывают нежно несколько времен с холодным DS без энзимов или Ca2', чтобы удалить любой фермент, связанный с тканями. Ледяной DS помогает сохранить целостность клеток DSM и ограничить ферментативную активность любых оставшихся папаин или коллагеназы. На последнем этапе тритурация ферментообработанных частей DSM с огненной полированной пипеткой Pasteur высвобождает одну клетку DSM. DSM-клетки либо сразу же помещаются в камеру записи для исследования патч-зажима или других видов экспериментов, либо хранятся на льду в DS для использования позже в тот же день (обычно в течение 8 часов подготовки, но клетки остаются жизнеспособными до 24 ч).
Мы определили несколько важных соображений для успешного получения отдельных DSM-клеток. Первый относится к человеческому качеству исходного кода DSM. Для оптимального сохранения целостности тканей образцы DSM, полученные в результате операций на открытом мочевом пузыре, помещаются в ледяные DS как можно скорее и поддерживаются в холодной среде. В частности, при хирургической извлечении у пациента образец мочевого пузыря сразу же помещается на полностью подготовленный боковой стол в операционной. Валовое исследование всего образца (обычно полученное во время радикальной или простой цистэктомии) и его открытие следует. После визуального осмотра, кусок всей толщины мочевой лестницы образца удаляется из удаленной области образца грубо не связанных с опухолью и сразу же помещается в чашку (или 50 или 100 мл), содержащий холодный (No 4 КК) Разрешение для различения (DS) (Таблица 2), а затем плотно закрыт крышкой. В связи с планируемым характером уборки тканей, персонал операционной и вспомогательный персонал, занимающийся уборкой, предупреждены в начале хирургического дела, чтобы иметь материалы, доступные в операционной на момент извлечения ткани. Эти меры предосторожности наряду с рутиной, повторяющимся характером этапов обработки сохраняют теплое время ишемии для тканей - от экстракции до размещения в охлажденный контейнер с раствором DS - до менее чем 5 мин. Контейнер помещается в холодильник или на лед в холодильнике для поддержания холодной среды и транспортируется (ледяной) в лабораторию. Как только образец прибывает в лабораторию, начинаются рассечение и ферментативные действия диссоциации. Очень трудно предсказать, даст ли данный образец DSM высокое качество DSM-клеток после ферментативной диссоциации, поэтому мы приступим к ферментативным шагам диссоциации. Во многих случаях, параллельно с электрофизиологическими экспериментами, наша группа проводит изометрические записи напряжения на полосках DSM, подготовленных из тех же образцов DSM. Мы обнаружили, что мы обычно можем получить высокое качество DSM-клеток из препаратов, которые также успешно обеспечивают жизнеспособные полосы для изометрических исследований сокращения (наше неопубликованное наблюдение).
Второй фактор связан с различными вариульциями ферментов. Мы заметили, что как для папаина, так и для коллагенатипа II, каждый раз, когда новая партия фермента поступает от поставщика, активность фермента в DS для пищеварения тканей может варьироваться. Поэтому мы регулярно оптимизируем концентрацию ферментов и инкубационные интервалы для каждой новой партии. Чтобы свести к минимуму вклад в изменчивость лота, мы заказываем большие количества одного и того же лота и делаем большую партию биржевых растворов в 2 мл aliquots ферментов и храним их при 20 градусах Цельсия до использования. Со временем, однако, замороженные запасы (хранящиеся до 2 недель) могут потерять свою ферментативную активность. Третья переменная относится к температуре ферментного лечения пищеварения. Ферментативные действия как папаина, так и коллагеназы отображают температурно-зависимость. Папаин и коллагеназа II типа проявляют активность в температурных диапазонах, охватывающих нормальную физиологию тела67,68. Таким образом, мы стремимся поддерживать фермент лечения стабильной на 37 градусов по Цельсию, избегая более высоких температур, чтобы сохранить целостность клеток DSM. Четвертое соображение касается изменчивости качества клеток DSM, присутствующих в рамках каждого препарата, начиная от высокожизнеспособных (демонстрируя отличные классические гладкие мышечные характеристики) до нездоровых, переваренных клеток. Длительный инкубационный интервал фермента является одной из основных причин получения большого количества поврежденных клеток. Чрезмерное лечение ферментами также ухудшает белковые структуры ионных каналов, рецепторов и транспортеров, отрицательно влияя на их функциональность. Интерпретация результатов, полученных из ферментативно полученных, свежеизолированных клеток должны иметь это соображение в виду. Оптимизация условий пищеварения ферментов направлена на увеличение доли высокожизнеспособных клеток. Экспериментальные подходы, опирающиеся на большее количество жизнеспособных клеток, таких как анализ микроаря, требуют более надежной оптимизации, чем те, которые успешно проводятся на меньшем количестве клеток, таких как одноклеточные патч-зажим электрофизиологии или Ca2 "изображений. Рассмотрение вышеупомянутых факторов руководствовалось нашими исследовательскими усилиями в течение последнего десятилетия в получении высококачественных одиночных DSM-клеток.
Перфорированный патч-зажим метод был основой электрофизиологического подхода на протяжении более четверти века. В нескольких публикациях приводится подробная информация о технических соображениях69,70,71,72,73. Клеточная перфорация может быть получена с помощью амфотерицина-В, нистатина, грамицидина или з-эсцина (см. справку32для обзора каждого). Основным преимуществом перфорированных записей патч-зажима по сравнению с другими электрофизиологическими подходами является то, что родная внутриклеточная среда - включая внутриклеточные Ca2 еврои сигнальные молекулы (например, CAMP, PKA, фосфаты и фосфодиестеразы) - сохраняются. Этот метод, следовательно, идеально подходит для исследования токов ионного канала цельноялонных каналов и их регулятивных механизмов в почти физиологических условиях. Ключевым предостережением является то, что внутриклеточный состав клеток не может быть точно контролируется в отличие от других электрофизиологических методов, таких как обычные цельноклеточные и одноканальные вырезанные-патч (внутри и вне) записи. По нашему опыту, три фактора обычно способствуют успешным экспериментальным результатам экспериментов по амфотерицину-B-перфорированным патч-зажиму. Во-первых, качество ячейки DSM, выбранной для попытки записи. Когда DSM клетки весьма жизнеспособны отображения полу-контрактильной (серпантин-как), высококонтрастный блестящий внешний вид с четко определенным ореолом вокруг поверхности клетки и плотно прикрепить к стеклянному дну камеры записи, то гига-печать формирования и клеточной перфорации происходят относительно легко. Второй и третий факторы успеха, соответственно, связаны с качеством источника и растворителем амфотерицина-В (в диметилсульфоки/ДМСО и внутриклеточном растворе пипетки). Мы наблюдали расхождения между различными поставщиками с точки зрения изменчивости источников и лотов. Каждый день мы готовим свежий раствор амфотерицина-B бульонного раствора из порошка с последующим его разбавлением во внутриклеточном растворе пипетки. Эти шаги требуют обширного звукозависимости и вихря. Со свежеприготовленным амфотерицином-B-содержащим раствором пипетки, успешной клеточной перфорацией (<50 MΩ) following giga-seal formation can be usually obtained within 30 min. The concentration of amphotericin-B in the pipette solution also requires optimization dependent on the amphotericin-B lot and source. Under our experimental conditions, the final amphotericin-B concentrations in the pipette range from 200 to 500 µg/mL. Since amphotericin-B exhibits light sensitivity, its solutions need to be kept in the dark. Using the amphotericin-B perforated patch-clamp technique, our group recorded voltage-step induced K mω)="" following="" giga-seal="" formation="" can="" be="" usually="" obtained="" within="" 30="" min.="" the="" concentration="" of="" amphotericin-b="" in="" the="" pipette="" solution="" also="" requires="" optimization="" dependent="" on="" the="" amphotericin-b="" lot="" and="" source.="" under="" our="" experimental="" conditions,="" the="" final="" amphotericin-b="" concentrations="" in="" the="" pipette="" range="" from="" 200="" to="" 500="" µg/ml.="" since="" amphotericin-b="" exhibits="" light="" sensitivity,="" its="" solutions="" need="" to="" be="" kept="" in="" the="" dark.="" using="" the="" amphotericin-b="" perforated="" patch-clamp="" technique,="" our="" group="" recorded="" voltage-step="" induced="">+Ca2 евро, и неселективные катионные токи от человека, морской свинки, мыши, и / или крысы DSM клеток17,21,22,23,29,30,31,35,60. Здесь мы описываем условия записи неселективных катионных токов в клетках DSM человека. 9-Фенанттрол, блокатор каналов TRPM4, ослабленный напряжением-шаг индуцированных токов, поддерживающих роль этих каналов в контроле возбудимости DSM. Как примечание, оно обычно требует по крайней мере 45 минут после получать giga-уплотнение и начало перфорации для того чтобы записать оптимальное стабилизированное напряжение-шаг индуцированное non-селективные течения катиции. Воля пандусы также могут быть использованы в качестве альтернативы напряжения шаг протоколов30,64. Здесь, напряжение-шаг протокол из гиперполяризованного удерживая мембранный потенциал был предпочтительнее, а не протокол рампы, поскольку первый подход сводит к минимуму эффект напряжения зависимой инактивации и позволяет усреднение вызванного тока в течение продолжительности напряжения-шаг, где пандус обеспечивает одну точку данных на напряжение. Последний пункт особенно относится к клеткам DSM человека, поскольку токи показывают переменную активность во время шагов напряжения (Рисунок 5ИРисунок 6). Техника перфорированного патч-зажима амфотерина (amphotericin-B) имеет важное значение для определения свойств клеток DSM и других типов клеток и будет продолжать оказывать помощь в предоставлении новых открытий в будущем. Кроме того, свежеизолиты отдельные одноклеточные клетки DSM могут быть успешно использованы для измерения цельноклеточной K+Cl-, и Ca2 евротоки с обычным режимом метода патч-зажима, мембраны потенциальной записи с текущим зажимом, и записи одного канала, как это свидетельствует наши предыдущие доклады23,29,35,64.
В дополнение к одноклеточным патч-зажим методы, свежеисзоледов DSM клетки могут быть изучены с другими техническими подходами,включая Ca2 "изображения, RT-PCR/ q-RT-PCR, иммуноцитохимия, на месте перевязки анализа, и геномные подходы (например, microarray, РНК-сек, CHIP-Seq)15,18,30 , 33 , 33 ,33. По мере того как методы определения одиночной клетки транскриптома продолжают эволюционировать и будут высоки чувствительными, мы предусматриваем в будущей способности по заведенному порядку и специфически связать электрические или фармакологические свойства индивидуальных клеток DSM с их профилями транскриптома/протеомы. Это будет достигнуто путем первой записи из клетки DSM, а затем извлечения мРНК или белка с последующим транскриптомическим/протеомическим анализом. Хотя такие методы уже были протестированы в клетках, не относящихся к DSM, в настоящее время они являются технически сложными, не имеют чувствительности, чтобы считаться рутиной, и ограничиваются успешным обнаружением нескольких выбранных генных продуктов74. Функция молекулярное выражение профиля, связывающее исследования, когда делается на клетках DSM, полученных из мочевого пузыря, полученных из контроля и больных пациентов-доноров, обеспечит понимание физиологических процессов, необходимых для вождения нормальных функций DSM, патогенеза, и в определении эффективных новых терапевтических подходов.
Раскрытие информации
Ни один.
Благодарности
Эта работа была поддержана грантами NIH-R01DK106964 и P20DK123971 Георгию В. Петкову. Авторы благодарят доктора Виктора Яроцкого и сару Максвелл за критическую оценку рукописи. Мы также признательны хирургам урологии в MUSC и UTHSC: докторам Томасу Кину, Гарри Кларку, Стивену Сэвиджу, Россу Реймсу, Сандипу Прасаду, Джонатану Пикарду, Кристоферу Ледбеттеру и Энтони Паттерсону, а также жителям URology MUSC и UTHSC: д-р Тейлор Тейлор Воган, Сэмюэл Уокер Никлз, Мэтью Янг, Эрин Бернс, Джастин Эллетт, Райан Леви, Остин Янгер, Марк Каррин, Нима Барадаран, Олугбемисола Маккой, Трейси Типтон, Брайс Уайатт, Алиса Грейман, Сара Староста, Аарон Блох, Кристин Каллауэй, Люсиль Кокс, Люсин Кокс, Кристиан Деван, Эрин Хейтман, Брэдли Хьюстон, Стивен Легг, Роберт С. Либби, Коул Локлир, Кристен Марли, Моника О'Хэнлон, Патрик Пробст, Синтия Шарадин, Элизабет Турвилл, Даниэль Сапата за помощь в сборе тканей человека.
Материалы
| Name | Company | Catalog Number | Comments |
| 5 ml polystyrene round-bottom tube | Falcon | 352054 | Tubes for DS containing enzymes used in digestion steps |
| 9-Phenanthrol | Sigma-Aldrich | 211281 | TRPM4 channel inhibitor |
| Amphotericin-B | Fisher | BP928-250 | Used for patch/cell perforation |
| Amphotericin-B | European Pharmacopoeia Reference Standards | 5 | Used for patch/cell perforation |
| Amphotericin-B | Sigma-Aldrich | A9528-100MG | Used for patch/cell perforation |
| Analog vortex mixer | VWR | 58816-121 | |
| Aspartic acid | Sigma-Aldrich | A9006 | Intracellular pipette solution |
| Bovine serum albumin | Sigma-Aldrich | A7906 | DS |
| CaCl2 | Sigma-Aldrich | C1016 | Extracellular solution and DS |
| Capillary Glass | Sutter | BF150-110-7.5 | Capillary for preparation of pulled patch electrodes |
| Cesium hydroxide hydrate | Sigma-Aldrich | C8518 | Intracellular pipette solution |
| Clampex ver. 10 software includes data acqusition (Clampex) and analysis (Clampfit) programs | Axon Instruments/ Molecular Devices | pCLAMP-10 | Commerical software and part of patch-clamp rig setup |
| Collagenase type 2 | Worthington Biochemical Corporation | LS004177 | DS-C |
| CsCl | Sigma-Aldrich | 203025 | Extracellular and intracellular solutions |
| Dental wax | Miltex Dental Wax Technologies, Inc. | 18058351 | |
| Digital Thermometer with Probe | Fisher Scientific | 15-077-32 | Placed in tissue bath to monitor temperature |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | Solvent |
| DL-Dithiothreitol (DDT) | Sigma-Aldrich | D9779 | Reducing agents used together with Papain |
| EGTA | Sigma-Aldrich | E3889 | Ca2+ chelator, used in intracellular pipette solution |
| Flaming/Brown micropipette puller | Sutter | P-97 | Required to pull electrodes with very fine tips |
| Floating foam tube rack/holder | VWR Scientific | 82017-634 | Used for holding tubes with enzymes for temperature control |
| Glucose | Sigma | G8270 | |
| Glutamic acid (Na salt) | Sigma-Aldrich | G1626 | DS |
| HEPES | Sigma-Aldrich | H3375 | pH Buffer |
| KCl | Fisher Scientific | BP366-1 | Extracellular solution |
| Low Noise Data Acquisition System | Axon Instruments/ Molecular Devices | Digidata 1440A | Part of patch-clamp rig setup |
| Magnetic stirrer | VWR | 01-442-684 | |
| MgCl2 (hexahydrate) | Sigma-Aldrich | M2670 | Extracellular and intracellular solutions |
| MicroForge | Narishige | MF-830 | Used for fire-polishing electrodes |
| NaCl | Sigma-Aldrich | S7653 | Extracellular and intracellular solutions |
| NaOH | Sigma-Aldrich | S8045 | |
| Nifedipine | Sigma-Aldrich | N7634 | L-type voltage-gated Ca2+ channel blocker |
| Nikon inverted microscope, TS100 with T1-SM stage with 5x, 10x, 20x, and 40x objectives | Nikon | Discontinued | Part of Patch-clamp rig setup |
| Non-metalic syringe needle, MicroFil | WPI | MF-34G-5 | Filling of intracellular pipette solution |
| Papain | Worthington Biochemical Corporation | LS003126 | DS-P |
| Pasteur pipette | FisherBrand | 13-678-20A | Tips are broken off and fire-polished and used for titration of enzymatically treated tissues to release single DSM cells from pieces |
| Patch-clamp amplifier | Axon Instruments/ Molecular Devices | Axon Axopatch 200B | Part of patch-clamp rig setup |
| PC computer | DELL | Custom configuration | Part of patch-clamp rig setup |
| pH Meter | Aspera Instruments | PH700 | |
| Polyethylene tubing | Intramedic | 427-436 | Tubing for superfusion of extracellular bath connected to glass-bottom recording chamber |
| Tetraethylammonium chloride | Sigma-Aldrich | T2265 | Ion channel blocker of Kv and BK channels added to the extracellular bath solution |
| Thermo Scientific Precision shaking water bath (model 2870) | Thermo Scientific | Discontinued | Water bath for temperature control of enzymatic digestion employed as an alternative to tissue chamber-circulating bath setup |
| Tissue bath, 100 mL | Radnoti | 1583-101 | Connected to a circulating bath and filled with water, tubes with DS and DSM pieces are placed in the setup to control the temperature of digestion steps |
| Vinyl tubing | ColePalmer | 06405-3 | Multiple uses including for connecting tissue bath to circulating water bath |
| Water circulator bath, Haake D1 L | Haake | Discontinued | Connected to tissue bath |
| Weighting scale | Mettler Toledo | XS64 | |
| ZeissAxiovert 40C inverted microscope with 10x and 40x objectives | Carl-Zeiss | Discontinued | Part of patch-clamp rig setup |
Ссылки
- Andersson, K. E., Arner, A. Urinary bladder contraction and relaxation: physiology and pathophysiology. Physiological Reviews. 84 (3), 935-986 (2004).
- Brading, A. F., Brain, K. L., Andersson, K. E., Michel, M. C. Ion channel modulators and urinary tract function. Urinary Tract. 202, 375-393 (2011).
- Brading, A. F. Spontaneous activity of lower urinary tract smooth muscles: correlation between ion channels and tissue function. Journal of Physiology. 570, 13-22 (2006).
- Brading, A. F., Heaton, J. P., Hashitani, H. A survey of commonalities relevant to function and dysfunction in pelvic and sexual organs. International Journal of Impotence Research. 20 (1), 1-16 (2008).
- Petkov, G. V. Role of potassium ion channels in detrusor smooth muscle function and dysfunction. Nature Reviews Urology. 9 (1), 30-40 (2012).
- Andersson, K. E. Treatment-resistant detrusor overactivity--underlying pharmacology and potential mechanisms. International Journal of Clinical Practice Supplement. 151, 8-16 (2006).
- Sui, G. P., Wu, C., Fry, C. H. The electrophysiological properties of cultured and freshly isolated detrusor smooth muscle cells. Journal of Urology. 165 (2), 627-632 (2001).
- Kropp, B. P., et al. Characterization of cultured bladder smooth muscle cells: assessment of in vitro contractility. Journal of Urology. 162 (5), 1779-1784 (1999).
- Bonev, A., Isenberg, G. Arginine-vasopressin induces mode-2 gating in L-type Ca2+ channels (smooth muscle cells of the urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 420 (2), 219-222 (1992).
- Schneider, P., Hopp, H. H., Isenberg, G. Ca2+ influx through ATP-gated channels increments [Ca2+]i and inactivates ICa in myocytes from guinea-pig urinary bladder. Journal of Physiology. 440, 479-496 (1991).
- Wellner, M. C., Isenberg, G. Properties of stretch-activated channels in myocytes from the guinea-pig urinary bladder. Journal of Physiology. 466, 213-227 (1993).
- Wellner, M. C., Isenberg, G. Stretch-activated nonselective cation channels in urinary bladder myocytes: importance for pacemaker potentials and myogenic response. Experientia Supplementum. 66, 93-99 (1993).
- Klockner, U., Isenberg, G. Action potentials and net membrane currents of isolated smooth muscle cells (urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 405 (4), 329-339 (1985).
- Moore, E. D., et al. Organization of Ca2+ release units in excitable smooth muscle of the guinea-pig urinary bladder. Biophysical Journal. 87 (3), 1836-1847 (2004).
- Hristov, K. L., Chen, M., Kellett, W. F., Rovner, E. S., Petkov, G. V. Large conductance voltage- and Ca2+-activated K+ channels regulate human detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 301 (4), 903-912 (2011).
- Afeli, S. A., Rovner, E. S., Petkov, G. V. SK but not IK channels regulate human detrusor smooth muscle spontaneous and nerve-evoked contractions. American Journal of Physiology - Renal Physiology. 303 (4), 559-568 (2012).
- Hristov, K. L., et al. Kv2.1 and electrically silent Kv channel subunits control excitability and contractility of guinea pig detrusor smooth muscle. American Journal of Physiology - Cell Physiology. 302 (2), 360 (2012).
- Afeli, S. A., Malysz, J., Petkov, G. V. Molecular expression and pharmacological evidence for a functional role of Kv7 channel subtypes in Guinea pig urinary bladder smooth muscle. PLoS One. 8 (9), 75875 (2013).
- Smith, A. C., et al. TRPM4 channel: a new player in urinary bladder smooth muscle function in rats. American Journal of Physiology - Renal Physiology. 304 (7), 918-929 (2013).
- Smith, A. C., et al. Novel role for the transient potential receptor melastatin 4 channel in guinea pig detrusor smooth muscle physiology. American Journal of Physiology - Cell Physiology. 304 (5), 467 (2013).
- Hristov, K. L., Smith, A. C., Parajuli, S. P., Malysz, J., Petkov, G. V. Large-conductance voltage- and Ca2+-activated K+ channel regulation by protein kinase C in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 306 (5), 460-470 (2014).
- Hristov, K. L., et al. Novel regulatory mechanism in human urinary bladder: central role of transient receptor potential melastatin 4 channels in detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 310 (7), 600-611 (2016).
- Malysz, J., Afeli, S. A., Provence, A., Petkov, G. V. Ethanol-mediated relaxation of guinea pig urinary bladder smooth muscle: involvement of BK and L-type Ca2+ channels. American Journal of Physiology - Cell Physiology. 306 (1), 45-58 (2014).
- Montgomery, B. S., Fry, C. H. The action potential and net membrane currents in isolated human detrusor smooth muscle cells. Journal of Urology. 147 (1), 176-184 (1992).
- Parajuli, S. P., Soder, R. P., Hristov, K. L., Petkov, G. V. Pharmacological activation of small conductance calcium-activated potassium channels with naphtho[1,2-d]thiazol-2-ylamine decreases guinea pig detrusor smooth muscle excitability and contractility. Journal of Pharmacology and Experimental Therapeutics. 340 (1), 114-123 (2012).
- Heppner, T. J., Bonev, A. D., Nelson, M. T. Ca2+-activated K+ channels regulate action potential repolarization in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 273 (1), 110-117 (1997).
- Petkov, G. V., Nelson, M. T. Differential regulation of Ca2+-activated K+ channels by beta-adrenoceptors in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 288 (6), 1255-1263 (2005).
- Herrera, G. M., Etherton, B., Nausch, B., Nelson, M. T. Negative feedback regulation of nerve-mediated contractions by KCa channels in mouse urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 289 (2), 402-409 (2005).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archive - European Journal of Physiology. 465 (7), 965-975 (2013).
- Provence, A., Angoli, D., Petkov, G. V. Kv7 channel pharmacological activation by the novel activator ML213: role for heteromeric Kv7.4/Kv7.5 channels in guinea pig detrusor smooth muscle function. Journal of Pharmacology and Experimental Therapeutics. 364 (1), 131-144 (2018).
- Parajuli, S. P., et al. Control of urinary bladder smooth muscle excitability by the TRPM4 channel modulator 9-phenanthrol. Channels (Austin). 7 (6), 537-540 (2013).
- Ishibashi, H., Moorhouse, A. J., Nabekura, J., Okada, Y. Perforated whole-cell patch-clamp technique: a user's guide. Patch Clamp Techniques: From Beginning to Advanced Protocols. 4, 71-83 (2012).
- Provence, A., Rovner, E. S., Petkov, G. V. Regulation of transient receptor potential melastatin 4 channel by sarcoplasmic reticulum inositol trisphosphate receptors: Role in human detrusor smooth muscle function. Channels (Austin). 11 (5), 459-466 (2017).
- Hristov, K. L., et al. Suppression of human detrusor smooth muscle excitability and contractility via pharmacological activation of large conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 302 (11), 1632-1641 (2012).
- Xin, W., Soder, R. P., Cheng, Q., Petkov, G. V. Inhibition of phosphodiesterases relaxes detrusor smooth muscle via activation of the large conductance voltage- and Ca2+-activated K+ channel. American Journal of Physiology - Cell Physiology. 302 (9), 1361-1370 (2012).
- Hristov, K. L., et al. Neurogenic detrusor overactivity is associated with decreased expression and function of the large conductance voltage- and Ca2+-activated K+ channels. PLoS One. 8 (7), 68052 (2013).
- Hristov, K. L., Parajuli, S. P., Provence, A., Rovner, E. S., Petkov, G. V. Nongenomic modulation of the large conductance voltage- and Ca2+-activated K+ channels by estrogen: A novel regulatory mechanism in human detrusor smooth muscle. Physiological Reports. 5 (14), (2017).
- Parajuli, S. P., et al. Functional link between muscarinic receptors and large-conductance Ca2+ -activated K+ channels in freshly isolated human detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 467 (4), 665-675 (2015).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 465 (7), 965-975 (2013).
- Thorneloe, K. S., Nelson, M. T. Properties of a tonically active, sodium-permeable current in mouse urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 286 (6), 1246-1257 (2004).
- Barry, M. J., et al. The American Urological Association symptom index for benign prostatic hyperplasia. The Measurement Committee of the American Urological Association. Journal of Urology. 148 (5), 1549-1557 (1992).
- Klockner, U., Isenberg, G. Calcium currents of cesium loaded isolated smooth muscle cells (urinary bladder of the guinea pig). Pflügers Archiv - European Journal of Physiology. 405 (4), 340-348 (1985).
- Klockner, U., Isenberg, G. Tiapamil reduces the calcium inward current of isolated smooth muscle cells. Dependence on holding potential and pulse frequency. European Journal of Pharmacology. 127 (3), 165-171 (1986).
- Weidelt, T., Isenberg, G. Augmentation of SR Ca2+ release by rapamycin and FK506 causes K+-channel activation and membrane hyperpolarization in bladder smooth muscle. British Journal of Pharmacology. 129 (7), 1293-1300 (2000).
- Inoue, R., Brading, A. F. The properties of the ATP-induced depolarization and current in single cells isolated from the guinea-pig urinary bladder. British Journal of Pharmacology. 100 (3), 619-625 (1990).
- Inoue, R., Brading, A. F. Human, pig and guinea-pig bladder smooth muscle cells generate similar inward currents in response to purinoceptor activation. British Journal of Pharmacology. 103 (4), 1840-1841 (1991).
- Nakayama, S., Brading, A. F. Possible contribution of long open state to noninactivating Ca2+ current in detrusor cells. American Journal of Physiology - Cell Physiology. 269 (1), 48-54 (1995).
- Nakayama, S., Brading, A. F. Interaction of Ca2+ agonist and depolarization on Ca2+ channel current in guinea pig detrusor cells. Journal of General Physiology. 106 (6), 1211-1224 (1995).
- Gallegos, C. R., Fry, C. H. Alterations to the electrophysiology of isolated human detrusor smooth muscle cells in bladder disease. Journal of Urology. 151 (3), 754-758 (1994).
- JournalFry, C. H., Gallegos, C. R., Montgomery, B. S. The actions of extracellular H+ on the electrophysiological properties of isolated human detrusor smooth muscle cells. Journal of Physiology. 480, 71-80 (1994).
- Sui, G. P., Wu, C., Fry, C. H. A description of Ca2+ channels in human detrusor smooth muscle. BJU International Journal. 92 (4), 476 (2003).
- Wu, C., Sui, G., Fry, C. H. The role of the L-type Ca2+ channel in refilling functional intracellular Ca2+ stores in guinea-pig detrusor smooth muscle. Journal of Physiology. 538, 357-369 (2002).
- Bonev, A. D., Nelson, M. T. Muscarinic inhibition of ATP-sensitive K+ channels by protein kinase C in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 265 (6), 1723-1728 (1993).
- Bonev, A. D., Nelson, M. T. ATP-sensitive potassium channels in smooth muscle cells from guinea pig urinary bladder. American Journal of Physiology - Cell Physiology. 264 (5), 1190-1200 (1993).
- Petkov, G. V., Heppner, T. J., Bonev, A. D., Herrera, G. M., Nelson, M. T. Low levels of KATP channel activation decrease excitability and contractility of urinary bladder. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 280 (5), 1427-1433 (2001).
- Shieh, C. C., et al. Functional implication of spare ATP-sensitive K+ channels in bladder smooth muscle cells. Journal of Pharmacology and Experimental Therapeutics. 296 (3), 669-675 (2001).
- Shieh, C. C., et al. Characterization of a novel ATP-sensitive K+ channel opener, A-251179, on urinary bladder relaxation and cystometric parameters. British Journal of Pharmacology. 151 (4), 467-475 (2007).
- Petkov, G. V., et al. Beta1-subunit of the Ca2+-activated K+ channel regulates contractile activity of mouse urinary bladder smooth muscle. Journal of Physiology. 537, 443-452 (2001).
- Thorneloe, K. S., Nelson, M. T. Properties and molecular basis of the mouse urinary bladder voltage-gated K+ current. Journal of Physiology. 549, 65-74 (2003).
- Hristov, K. L., et al. Stimulation of beta3-adrenoceptors relaxes rat urinary bladder smooth muscle via activation of the large-conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 295 (5), 1344-1353 (2008).
- Layne, J. J., Nausch, B., Olesen, S. P., Nelson, M. T. BK channel activation by NS11021 decreases excitability and contractility of urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 298 (2), 378-384 (2010).
- Lee, H., Koh, B. H., Peri, L. E., Sanders, K. M., Koh, S. D. Functional expression of SK channels in murine detrusor PDGFRalpha+ cells. Journal of Physiology. 591 (2), 503-513 (2013).
- Lee, H., et al. Premature contractions of the bladder are suppressed by interactions between TRPV4 and SK3 channels in murine detrusor PDGFRalpha+ cells. Scientific Reports. 7 (1), 12245 (2017).
- Yarotskyy, V., Malysz, J., Petkov, G. V. Properties of single channel and whole-cell Cl- currents in guinea pig detrusor smooth muscle cells. American Journal of Physiology - Cell Physiology. 316 (5), 698-710 (2019).
- Driska, S. P., Porter, R. Isolation of smooth muscle cells from swine carotid artery by digestion with papain. American Journal of Physiology - Cell Physiology. 251 (3), 474-481 (1986).
- Seltzer, J. L., Welgus, H. G., Jeffrey, J. J., Eisen, A. Z. The function of Ca2+ in the action of mammalian collagenases. Archives of Biochemistry and Biophysics. 173 (1), 355-361 (1976).
- Skelton, G. S. Papaya proteinases. I. Temperature-and pH-stability curves. Enzymologia. 35 (5), 270-274 (1968).
- Petrova, D., Derekova, A., Vlahov, S. Purification and properties of individual collagenases from Streptomyces sp. strain 3B. Folia Microbiologica (Praha). 51 (2), 93-98 (2006).
- Sharpe, E. J., St Clair, J. R., Proenza, C. Methods for the isolation, culture, and functional characterization of sinoatrial node myocytes from adult mice. Journal of Visualized Experiments. (116), (2016).
- Brueggemann, L. I., Mani, B. K., Haick, J., Byron, K. L. Exploring arterial smooth muscle Kv7 potassium channel function using patch clamp electrophysiology and pressure myography. Journal of Visualized Experiments. (67), e4263 (2012).
- Jarriault, D., Grosmaitre, X. Perforated patch-clamp recording of mouse olfactory sensory neurons in intact neuroepithelium: functional analysis of neurons expressing an identified odorant receptor. Journal of Visualized Experiments. (101), e52652 (2015).
- Rae, J., Cooper, K., Gates, P., Watsky, M. Low access resistance perforated patch recordings using amphotericin B. Journal of Neuroscience Methods. 37 (1), 15-26 (1991).
- Knutson, K., et al. Whole cell electrophysiology of primary cultured murine enterochromaffin cells. Journal of Visualized Experiments. (139), (2018).
- Devienne, G., Le Gac, B., Piquet, J., Cauli, B. Single cell multiplex reverse transcription polymerase chain reaction after patch-clamp. Journal of Visualized Experiments. (136), (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены