Method Article
Один клеточный диссоциативный подход для молекулярного анализа мочевого пузыря в мыши после травмы спинного мозга
* Эти авторы внесли равный вклад
В этой статье
Резюме
Целью этого протокола является применение оптимизированного протокола диссоциации тканей к мышиной модели повреждения спинного мозга и проверка подхода к анализу одноклеточных с помощью цитометрии потока.
Аннотация
Мы описываем осуществление травмы спинного мозга у мышей, чтобы вызвать детрусор-сфинктер диссинергии, функциональные обструкции розетки мочевого пузыря, и последующее ремоделирование стенки мочевого пузыря. Для облегчения оценки клеточного состава стенки мочевого пузыря у неповторенных контрольных и спинного мозга травмированных мышей, мы разработали оптимизированный протокол диссоциации, который поддерживает высокую жизнеспособность клеток и позволяет обнаруживать дискретные субпопуляции по цитометрии потока.
Повреждение спинного мозга создается путем полной переливания грудного спинного мозга. Во время сбора тканей животное переливается фосфатно-буферным солевым раствором под глубокой анестезией, а мочевые пузыри собирают в буфер Тирода. Ткани измельчаются до инкубации в буфере пищеварения, который был оптимизирован на основе содержания коллагена в мочевом пузыре мыши, как это определено на допросе общедоступных баз данных экспрессии генов. После генерации одноклеточной суспензии материал анализируется цитометрией потока для оценки жизнеспособности клеток, количества клеток и конкретных субпопуляций. Мы демонстрируем, что метод дает популяции клеток с более чем 90% жизнеспособности, и надежное представление клеток мезенхимального и эпителиального происхождения. Этот метод позволит точный анализ вниз по течению дискретных типов клеток в мочевом пузыре мыши и потенциально других органов.
Введение
Возмущения нормальной функции мочевого пузыря может привести к снижению качества жизни для многих людей. Для того, чтобы получить лучшее понимание того, как травмы или болезни срывает нормальную функцию мочевого пузыря, важно, чтобы исследовать нормальное биологическое состояние клеток в мочевом пузыре и как они меняются под экспериментальным возмущением. На сегодняшний день, однако, конкретные популяции клеток, которые проживают в мочевом пузыре, и как они меняются с травмой, были неполно охарактеризованы.
Одноклеточные методы профилирования, такие как цитометрия потока или одноклеточное секвенирование РНК (scRNA-seq), могут пролить свет на конкретные типы клеток в мочевом пузыре. Тем не менее, для этих подходов, чтобы быть информативной ткани должны быть переварены таким образом, что не влияет на жизнеспособность, экспрессия генов, и репрезентативной популяции клеток процентов собранных тканей. Протоколы, которые используют энзиматические дезагрегирования может повлиять на выражение поверхностного маркера через неизбирательнуюактивность протеазы 1, тем самым влияя на идентификацию клеток по цитометрии потока, в то время как процесс диссоциации сам по себе может привести к индукции немедленного ранних генов, как описано недавно Ван ден Бринки коллеги 2. Авторы показали, что, хотя диссоциация пострадавших субпопуляции была небольшой, это может вызвать сильный загрязняющий сигнал в исследованиях массового выражения из-за высокого уровня экспрессии непосредственных ранних генов. Кроме того, продолжительность диссоциационного протокола повлияла на обнаруженные уровни экспрессии генов, которые, как было показано, являются уникальными для некоторых субпопуляций. Таким образом, наборы данных одноклеточных, генерируемые без учета воздействия протокола диссоциации, могут привести к изменениям экспрессии генов, возникающим в результате метода диссоциации, в отличие от основной биологии. Эти наблюдения свидетельствуют о том, что опубликованные данные одноклеточной транскриптомики следует интерпретировать с осторожностью и что результаты должны быть подтверждены независимыми методами.
Хотя, суровые и длительные методы диссоциации могут изменить экспрессию генов вклетках 2; эффективная изоляция клеток имеет важное значение для получения точного представления о присутствующих типах клеток. Поскольку мочевой пузырь представляет собой сложный орган, состоящий из нескольких типов клеток, некоторые популяции, такие как уротелиальные или стромальные клетки, могут быть относительно недопредставленными, в то время как другие типы клеток, такие как фибробласты, существуют во внеклеточной матрице и могут быть сложными для изоляции. Диссоциация становится еще более сложной задачей, если мочевой пузырь претерпел значительные реконструкции и фиброз, такие какнаблюдается в травме спинного мозга 3,4 или мочевогопузыря выход обструкции 5,6.
Здесь мы описываем оптимизированный метод диссоциации тканей для анализа одноклеточных клеток в травмированном мышечном пузыре спинного мозга. Используя цитометрию потока, мы сравнили четыре энзиматических протокола пищеварения за их способность производить одноклеточную суспензию, поддерживать жизнеспособность клеток и поддерживать правильную долю популяций клеток. Основываясь на этом анализе, мы приходим к выводу, что минимизация гибели клеток, клеточных агрегатов, неклеточных нуклеиновых кислот и потенциальных ингибиторов анализа ниже по течению имеет решающее значение для получения высококачественных данных.
протокол
Процедуры проводились в строгом соответствии с рекомендациями, содержащимися в Руководстве по уходу и использованию лабораторных животных Национальных институтов здравоохранения. Все эксперименты были одобрены Комитетом по уходу за животными и использованию Бостонской детской больницы.
ПРИМЕЧАНИЕ: Мыши были размещены в AAALAC аккредитованных животных объекта с объявлением libitum доступ к пище и воде. Для этих экспериментов использовались самки мышей в возрасте 8-201212 недель. Учитывая характер травмы, для обеспечения их благополучия мышам было предоставлено дополнительное обогащение питательными веществами.
1. Низкоторакальная трансекция спинного мозга у мышей
- Подготовка перед перевекацией спинного мозга
ПРИМЕЧАНИЕ: Хирургические инструменты, необходимые для этой процедуры микро препарирования пружинные ножницы, микро препарирования миппы, микро заковы иглы водителя, гемостаты, и 7-0 полиглактина 910 швов. Другие хирургические материалы, необходимые хирургические шторы, стерильные листы для хирургического поля, марлевовые губки, хлопчатобумажные аппликаторы, и 1 мл шприцы с 25 G иглы.- Автоклав хирургических инструментов и принадлежностей до операции.
- Очистите хирургическую зону и грелки спиртосодержатной салфеткой. Одна грелка будет использоваться во время операции, а другая в течение непосредственного послеоперационного периода для поддержания температуры тела животного до восстановления полной активности.
- Используйте увеличительные лупы (2,5x или более) для выполнения хирургической процедуры.
- Включите грелки, источник света и стерилизатор стеклянной шарика, чтобы быть готовым к использованию во время процедуры.
- Откройте хирургические шторы и инструменты. Используйте стерильные перчатки, чтобы драпировать хирургическое поле и поместить инструменты в хирургическом поле.
- Подготовка животных
- Принесите мышей в процедурную комнату, а также принести чистую клетку для спинного мозга раненых мышей.
- Администрирование анестезии путем размещения мыши в индукционной камере с изофлюран потока установлен на 3,0%, поток кислорода на 1 л / мин, и всасывания на 20 мм рт. ст., пока нет лапы-щепотку ответ.
- Немедленно взвесить животное, а затем поместить животное в положение склонных на грелке.
- Поместите обезболивающее конус плотно над носом мыши, переключить поток газа из индукционной камеры в нос конуса, и установить поток изофлюрана до 2% и поток кислорода до 1 л / мин.
- Подтвердите, что животное надлежащим образом обезболено при отсутствии реакции на щепотку лапы. Приклеить конечности животного к грелке. Поместите свернутый кусок марлевой губки под нижнюю грудь, чтобы поднять и сгибать открыть нижние грудные позвонки.
- Нанесите офтальмологическую смазку на оба глаза. Администрирование обезболивающих препаратов (мелоксикам, 10 мг/кг, подкожно) и антибиотиков (энрофлоксацин, 5 мг/кг, подкожно).
ПРИМЕЧАНИЕ: Конечные пользователи должны использовать обезболивающие препараты и антибиотики, рекомендованные их местным комитетом по уходу за животными и использованию. - Пальпировать наиболее заметный спинной процесс в грудном отделе позвоночника, который обычно соответствует T13 спинного процесса7. Бритье продольной прямоугольной области на задней части мыши от нижней части шеи до чуть ниже наиболее известных спинной процесс (T13) и на 1 см с каждой стороны средней линии.
- Хирургическая процедура
- Подготовьте бритую область с 10% раствором йода povidone и 70% этанола три раза в качестве альтернативы в круговой моды, начиная с места разреза работает наружу, а затем покрыть животное стерильной 4 х 4 марлевой губкой с окном в центре чрезмерно хирургического поля.
- Сделать 1,5 см разрез в средней линии спины с помощью тонких ножниц, который заканчивается в наиболее заметных спинной процесс (T13). Разрез должен включать кожу и поверхностную фасцию. Использование ножниц отделить кожу и поверхностные фасции с обеих сторон, чтобы разоблачить спинные процессы и окружающие паральные мышцы.
- Использование резкого и тупого вскрытия отделяет мышцы от спиновых процессов и ламина T9, T10 и T11 позвонков.
- Резко разделить межспиновые связки между T9 и T10 и между T10 и T11 с помощью тонких ножниц, а затем акцизный спинной процесс T10 и тщательно выполнять T10 ламинэктомии на двусторонней основе подвергать спинного мозга. Убедитесь, что ламина полностью вырезаны.
- Перерезать спинной мозг с помощью тонких ножниц. Минимальное кровотечение обычно происходит в этот момент из-за перегиба сосудов спинного мозга. Сжать кровотечение области с стерильным хлопком наконечником аппликатор для достижения гемостаз. После подтверждения полного гемостаз, закрыть кожу с 7-0 полиглактина 910 непрерывных швов.
- Администрирование 1 мл солевого раствора подкожно, чтобы предотвратить послеоперационное обезвоживание.
- Послеоперационный уход
- Поместите животное на грелку до полного выздоровления, а затем перенесите в клетку только для спинного мозга раненых мышей.
- Послеоперационный уход включает ежедневное наблюдение и взвешивание животных, а также мониторинг места разреза на наличие признаков инфекции на срок до 7 дней. Администрирование 1 мл солевой раствор, анальгетики (мелоксикам 10 мг/кг), и антибиотик (энрофлоксацин 5 мг/кг) все подкожно ежедневно в течение 3 дней.
ПРИМЕЧАНИЕ: Конечные пользователи должны использовать обезболивающие препараты и антибиотики, рекомендованные их местным комитетом по уходу за животными и использованию. - Выполните ручное выражение мочевого пузыря (маневр Кредо) каждые 12 ч, пока животное не сможет помочиться самостоятельно (обычно через 10-14 дней). Держите животное одной рукой и массируйте нижнюю часть живота другой рукой, затем почувствуйте и аккуратно сжмите растянутый мочевой пузырь указательным пальцем и большим пальцем. Нежное переходное сжатие должно чередоваться с расслаблением. После ручного выражения, мыть нижнюю часть живота с водопроводной водой и высушить осторожно с бумажным полотенцем без чрезмерного трения.
ПРИМЕЧАНИЕ: Небольшой размер мочевого пузыря до начала выражения и смачивания нижней части живота с мочой являются признаками того, что животное получило возможность аннулировать самостоятельно. - Чтобы свести к минимуму потерю веса, обеспечить обогащение питательных мышей в виде питательного геля и других питательных лечит (бекон softies, фруктовые хрустящие и вегетарианские укусы) размещены на полу клетки для легкого доступа ПРИМЕЧАНИЕ: В этом исследовании, мыши были пролиты и мочевых пузырей закуплены на 8 недель после SCI.
- Послеоперационные осложнения
- Свести к минимуму потенциал для разрыва мочевого пузыря из-за чрезмерного экспрессии ручного мочевого пузыря, не полностью выражая мочевого пузыря.
- Предотвращение excoriation промежности кожи от непрерывного воздействия мочи дриблинг от некомпетентных сфинктера путем мытья промежности области с водопроводной водой. Свести к минимуму воспаление с помощью тройной мази антибиотика.
ПРИМЕЧАНИЕ: Урефальная обструкция из-за сгустка крови в период преходящем гематурии или из спермы коагуляции из-за ретроградной эякуляции у мышей мужского пола может произойти после травмы спинного мозга. Полная уретальная обструкция у мышей мужского пола часто завершается разрывом мочевого пузыря и смертью. По нашему опыту частота уретальной обструкции у мышей мужского пола, которая привела к смерти, составила 10%.
2. Закупки перфузии и тканей
ПРИМЕЧАНИЕ: Для анализа вниз по течению некоторых типов клеток, таких как иммунные клетки в периферических тканях, полезно удалить кровь путем перфузии во время сбора урожая тканей, как описано ниже.
- Администрировать анестезию, как упоминалось в хирургической процедуре (шаг 2.2) и подтвердить, что животное адекватно анестезируется без ответа forepaw-щепотка (животное паралич, поэтому задние конечности уменьшились ощущения и задний план-щепотка ответ становится неуместным).
- Поместите животное в положение на спине и мазок живота и груди с 70% этанола, чтобы мокрый мех, чтобы предотвратить его попадание в операционную площадку.
- Выполните лапаротомию средней линии от таза до диафрагмы. Отрежьте диафрагму от ребер.
ПРИМЕЧАНИЕ: После этого шага, скорость имеет важное значение, поскольку торакального дифференциала давления больше не существует, и легкие не могут надуть, так что животное начинает задыхаться. - Вырежьте грудную клетку открытой вдоль ребер на левой и правой стороне после кости хряща границы на линии параллельно грудины, начиная с диафрагмы и продолжения, насколько первое ребро.
- Поместите полную переднюю грудную стенку над головой животного и зафиксните ее в этом положении с помощью зажимов для полотенец. Не отрезайте переднюю грудную стенку, так как это вызовет сильное кровотечение из двух внутренних грудных артерий.
- Отрежьте перикард с помощью тонких ножниц.
- Подключите иглу 23 G к аппарату перфузии, затем вставьте ее в левый желудочек и медленно в аорту, заботясь о том, чтобы не проколоть ее.
ПРИМЕЧАНИЕ: Перфузионный аппарат включает в себя перфузионный насос и 50 мл шприца, подключенного к внутривенной трубке. - Начните перфузии и быстро сделать небольшой разрез с кончиком тонких ножниц в правом атриуме для дренажа. Позаботьтесь о том, чтобы не вводить пузырьки воздуха во время вливания жидкости.
- Выполните перфузию с фосфатным буферным солевым раствором (PBS) на уровне 15 мл/мин. Перфузия является полной, когда дренаж ясно и облегченный цвет печени достигается (Рисунок 1).
ПРИМЕЧАНИЕ: Среднее время перфузии составило 3,5-4 мин. Неадекватная перфузия проявляется как медленное прогрессирование бланширования тканей и обычно происходит из-за неправильного позиционирования иглы в левом желудочковом. Корректировка иглы и продление продолжительности перфузии на 1-2 мин обеспечит адекватную перфузию тканей. - Прекратите перфузию и рассекйте мочевой пузырь, свободный от сосудистых педикюров и уретры, и поместите его в микроцентрифуговую трубку, содержащую ледяной раствор тирода.
3. Переваривание мочевого пузыря в контроле и спинного мозга травмированных мышей
ПРИМЕЧАНИЕ: Для того, чтобы сформулировать эффективную смесь пищеварения, которая предназначена для мыши мочевого пузыря мы стремились настроить единицу ферментов, используемых для деградации преобладающих внеклеточных компонентов матрицы, таких как коллагены и гиалуроновая кислота. Поэтому мы использовали общедоступные данные по секвенированию РНК, полученные в рамках проекта Mouse ENCODE (BioProject: PRJNA66167) для извлечения считывания на килобазу на миллион (RPKM) и Tabula Muris8 для оценки пространственного выражения в мочевом пузыре. Коллагены 1, 3 и 6 были тремя наиболее высоко выраженными генами среди 42 различных коллагенов(рисунок 2A). Выражение этих коллагенов и гиалуронан синтазы 1 (Has1) в основном наблюдались в мышечных клетках и фибробластах стенки мочевого пузыря(рисунок 2B).
- Подготовка буферов и решений
- Приготовьте раствор Tyrode натрия в соответствии с таблицей 1 в чистой бутылке 500 мл. Добавьте 300 мл ddH2O. Раствор кислый после приготовления. Отрегулируйте рН до 7,4 с помощью NaOH. Довейте объем до 500 мл с помощью двойного дистиллированного H2O, затем aliquot и храните при -20 градусах Цельсия.
ПРИМЕЧАНИЕ: Этот буфер поддерживает рН и осмотический баланс в буфере пищеварения и обеспечивает клетки водой и необходимыми неорганическими ионами. Содержит магний, а также глюкозу в качестве источника энергии. Калий в растворе оказывает защитное воздействие на электромеханическую активность в изолированном клеточном растворе. Порошковые соли гигроскопически и должны быть защищены от влаги. Все содержимое смеси следует использовать сразу после приготовления. Подготовка концентрированного раствора соли не рекомендуется, так как могут образовываться осадки. Стерилизация с использованием фильтрации (фильтр 0,22 мкм) может быть выполнена, если клетки будут культурны после анализа. - Подготовьте энзиматический раствор пищеварения в конической трубке объемом 15 мл, добавив рекомендуемые объемы и количества для каждого компонента(таблица 2). Добавьте раствор тирод натрия до 2,5 мл. Вихрь тщательно растворить.
ПРИМЕЧАНИЕ: Папаин является сульфгидрил протеазы из латекса папайи Carica. Папаин имеет широкую специфичность, и это ухудшит большинство белковых субстратов9. Папаин оказался менее разрушительным и более эффективным, чем другие протеи в протоколах диссоциации клеток10. Мы предоставляем подробную информацию о четырех протоколах диссоциации в таблице 2; мы наблюдали протокол раздел 3 для поддержки высокой жизнеспособности (93%) клеточных суспензий, приготовленных из мышелового пузыря.
- Приготовьте раствор Tyrode натрия в соответствии с таблицей 1 в чистой бутылке 500 мл. Добавьте 300 мл ddH2O. Раствор кислый после приготовления. Отрегулируйте рН до 7,4 с помощью NaOH. Довейте объем до 500 мл с помощью двойного дистиллированного H2O, затем aliquot и храните при -20 градусах Цельсия.
- Процедура диссоциации и подготовка клеточной подвески
- Соберите мочевой пузырь от мышей после перфузии.
- Прокол мочевого пузыря, чтобы освободить содержимое, если таковые имеются.
- Добавьте 100 мкл раствора Тирода в пустую центрифугу 1,5 мл трубки и тары. Поместите мочевой пузырь в трубку и снова взвесить, чтобы определить точный вес мочевого пузыря.
- Поместите мочевой пузырь на 10-сантиметровую чашку Петри на лед и добавьте 100 МКЛ раствора Тирода для доябивания.
- Используя хирургические ножницы, вырезать куски как можно меньше, минимизируя время зарубки до не более 2'u20123 мин на мочевой пузырь. Если объединение ткани мочевого пузыря от нескольких животных, фарш мочевых пузырей все сразу.
- Передача рубленого мочевого пузыря ткани с помощью широкой родила пипетки кончик в 2,5 мл буфера пищеварения для каждого мочевого пузыря. Отрегулируйте громкость, если несколько мочевых пузырей объединяются. Инкубировать ткани в растворе пищеварения при 37 градусов по Цельсию в инкубаторе на смеситель для гайки в течение 40 мин.
- В конце инкубационные периоды удалите трубку пищеварения из инкубатора. Тритурат (трубчатый вверх и вниз) раствор пищеварения с использованием 5 мл пипетки в течение 1 мин.
- Центрифуга в течение 10 мин при 350 x g при 4 градусах Цельсия. Удалите супернатант и повторно посовелите гранулы в 1 мл раствора клеточного отслоения. Поместите в инкубатор 37 градусов по Цельсию на смеситель nutator в течение 10 мин.
- Центрифуга в течение 10 мин при 350 x g при 4 градусах Цельсия. Удалите супернатант и повторно посовелите гранулы в 1 мл буфера лиза РБК (1x). Инкубировать в течение 1 мин.
- Добавьте 9 мл PBS, чтобы разбавить буфер РБК и остановить лиз РБК.
- Пройдите клетки через 70 мкм ситечко клеток в 50 мл конической трубки, используя поршень из шприца, чтобы слегка соскребать ситечко клетки, чтобы обеспечить полный проход клеток. Убедитесь в том, чтобы собрать жидкость, которая проходит через ситечко, но может быть пойман на нижней части ситечко.
- Центрифуга в течение 10 мин при 350 x g при 4 градусах Цельсия. Удалить супернатант и повторно гранулы в 200 йл буфера окрашивания клеток (PBS с 2% FBS).
- Считайте клетки.
- Иммунолабелирование специфических клеток для цитометрии потока
ПРИМЕЧАНИЕ: Для обнаружения различных типов клеток в мочевом пузыре, мы разработали многоцветный поток цитометрии панели. Для выполнения компенсации и разработки соответствующей стратегии закрытых, мы включаем неокрашиваемые и флуоресценции минус один (FMO) контроля. Контроль FMO имеет важное значение для ворот позитивного населения, особенно когда положительная доля тусклый. Процедура окрашивания заключается в следующем.-
Блокирование рецепторов FC-RII/III на клетках
ПРИМЕЧАНИЕ: Мы рекомендуем блокировать неспецифическое связывание моноклональных антител путем предварительной инкубации клеток с моноклональными антителами анти-Fc рецепторов, или рекомбинантный белок Fc.- Вымойте клетки центрифугации при 350 х г в течение 5 мин при 4 градусов по Цельсию и добавить буфер окрашивания клеток.
- Откажитесь от супернатантов и блокируйте рецепторы Fc-RII/III на клетках, чтобы предотвратить неспецифическое окрашивание антител, добавив антитела CD16 и CD32 в буфер окрашивания клеток при разбавлении 1:100.
- Инкубировать на льду в течение 10 минут.
ПРИМЕЧАНИЕ: Нет необходимости мыть клетки; клетки могут быть окрашены непосредственно после этого этапа.
-
Окрашивание для FMOs
ПРИМЕЧАНИЕ: Флуоресценция Минус Один (FMO) контроль трубки всех флуорохромов, используемых в эксперименте, который содержит все флуорохромы, кроме одного.- Например, если у человека есть 4 различных фторхрома (A, B C и D , Annexin V и propidium iodide (PI)), подготовьте трубки FMO следующим образом. FMO Tube 1: Антитела, спрягаемые с фторхромами B, C, D (Annexin V и PI); FMO Tube 2: Антитела, спряженные с фторхромами A, C, D (Annexin V и PI); FMO Tube 3: Антитела, спрягаемые с фторхромами A, B, C (Annexin V и PI); FMO Tube 4: Антитела, спрягаемые с A, B, C, D фторхромами (Приложение V); FMO Tube 5: Антитела, спрягаемые с фторхромами A, B, C, D (PI).
- Рассмотрим характер спряженного фторхрома для антитела Annexin V.
-
Окрашивание заблокированных клеток желаемыми антителами
- Инкубировать заблокированные клетки с соответствующими мастер-миксами фторфор-конъюгированных антител против желаемых белков в течение 20 мин на льду, защищенном от света. Не забудьте включить FMOs.
- Вымойте клетки с 1 мл буфера окрашивания клеток, добавленного в каждую трубку, а затем центрифуги снова при 350 x g в течение 5 минут при 10 градусах Цельсия.
- Отбросьте супернатант и повторно посовелайте клеточные гранулы в 200 МКЛ буфера окрашивания клеток. Держитесь на льду до тех пор, пока данные о флуоресценции не будут получены с помощью цитометра потока.
-
Применить приложение V / PI пятно.
- Подготовь рабочее решение PI (100 мкг/мл) в 1x annexin-связывающем буфере, как описано в протоколе производителя для комплекта апоптоза мертвых клеток.
- Определите плотность ячейки и обратите внимание на буфер и объем, в котором они хранятся.
- Образцы центрифуг на 350 х г в течение 5 мин, отбросьте сверхнатантные и повторно взятые клетки в 1x притягательном буфере с плотностью 1 х10 6 клеток/мл в объеме 100 мкл.
- Добавьте к каждому образцу (100 МКЛ) и рабочее решение PI (1 МЛ), как описано в протоколе производителя, и инкубировать при комнатной температуре в течение 15 минут.
- Добавьте к образцам 400 МКЛ буфера, связывающего 1x Annexin, смешайте инверсией и держите на льду до цитометрии потока.
-
Блокирование рецепторов FC-RII/III на клетках
- Калибровка FACS
-
Контроль цитометрии и чистоты потока
- Начните анализ цитометрии потока путем измерения необленных клеток для разграничения морфологии клеток и желобов фторхромов.
- Отрегулируйте боковой рассеяние (SSC) и вперед рассеяния (FSC) путем изменения напряжения каждого параметра флуоресценции. Измерьте выброс флуоресценции на уровне 530 нм (Приложение V) и 575 нм (PI).
- Определите отрицательную популяцию в первом десятилетии с помощью сеток на каждом точечном участке. Поместите каждый контроль FMO в цитометре и исправь спектральное перекрытие до тех пор, пока не будут выровнены отрицательные и положительные медианы популяции.
- Измерьте 100 000 событий. Измерьте ячейки, окрашенные определенными маркерами, и создайте ворота для групп клеток, представляющих интерес.
-
Контроль цитометрии и чистоты потока
- Анализ данных
- Сбор данных с цитометра потока. Откройте программное обеспечение для визуализации рабочего пространства для анализа.
- Создание рабочего пространства
- Импорт файлов FCS путем перетаскивания их в рабочее пространство. Файлы будут видны в примере и групповом разделе рабочего пространства. Дважды нажмите на имя образца, чтобы открыть файл.
- Используйте область бокового рассеяния (SSC-A) для области рассеяния y и вперед (FSC-A) для x-оси(рисунок 3A). Нажмите значок для полигона gating.
- Создайте ворота вокруг ячейки населения интерес в точку участка, нажав, чтобы сделать узел ворот, а затем продолжать нажав вокруг ячейки населения до конца; двойной клик, чтобы закрыть ворота.
- Назовите ворота в соответствии с захваченным населением (например, "Все ячейки") и нажмите OK.
ПРИМЕЧАНИЕ: Двойное нажатие в воротах "Все ячейки" откроет новое окно графика, показывающее только события, содержащиеся в "Всех ячейках". - Отрегулируйте y-ось нового участка точки к SSC-H (высота бокового рассеяния) путем щелкать в черной стрелке и выбрать для того чтобы изменить y-оси.
ПРИМЕЧАНИЕ: Это ворота для одиночных ячеек (синглетов) и исключает дублеты или большие агрегаты(рисунок 3B). Поскольку одиночные ячейки имеют пропорциональную ширину и длину, они должны быть представлены как популяция по диагонали. Клетки, падающие за пределы этих диагональных ворот, дублеты или большие агрегаты. - Двойное нажатие на ворота для анализа некротических (PI-положительных), ранних апоптотических (Annexin V-положительный, PI-отрицательный) и поздних апоптотических (Annexin V-положительных, PI-отрицательных) клеток(рисунок 3C).
- Наклеить ярлык x-оси как Annexin V и y-axis как PI.
ПРИМЕЧАНИЕ: В некоторых случаях, когда интенсивность сигнала низка, популяции клеток могут казаться отрицательными значениями флуоресценции в результате коррекции фона. В этом случае рекомендуется выполнить би-экспоненциальную трансформацию. Для этого нажмите на T рядом с оси y и выберите Настраиваемую ось. В новом окне измените шкалу на би-экспоненциальную (Biex), добавьте отрицательные значения к осям, увеличив ширину основы и нажмите Применить. Это позволит улучшить разрешение событий с низкой интенсивностью сигнала. - Показать данные в качестве графа участка. Используйте вкладку Option чуть ниже x-оси и выберите встречный участок из меню.
- Нарисуйте ворота Кват на участке, чтобы определить 4 дискретных целевых популяций.
- Нажмите в верхней части окна, чтобы открыть редактор макета, нажав в редакторе Layout и перетащите население в каждую отдельную область.
- Поместите участки в редактор макета, перетаскивая и сбрасывая популяции из рабочего пространства в окно редактора макета.
- Визуализация с помощью гистограмм
- Выберите гистограмму из вкладки Параметры.
- Применить ворота для выбора приложений V-положительных ячеек; в качестве альтернативы, положительные и отрицательные группы населения могут быть определены с помощью инструмента бисектора. В разделе выборки теперь должны быть показано различные популяции, которые были формы и их иерархии.
- Чтобы сравнить образцы, перетащите все гистограммы друг на друга; право нажмите на гистограмму и из гистограммы выберите Stagger Offset.
- Добавить статистический анализ
- Откройте вкладку Статистика, дважды нажав на население, представляющие интерес. Выберите функцию для применения и параметр.
- Повторите с другими популяциями, перетащив значок Sigma в имя популяции.
- Примените анализ ко всем образцам, выбрав стратегию гатинга из выборки интересов и втягивая ее в группу, определяемую маркером интереса, например, Приложение V.
- Создание ворот в образцах контроля FMO и определение отрицательных и положительных популяций; эта стратегия gating будет применяться ко всему эксперименту(рисунок 3D'u2012F).
ПРИМЕЧАНИЕ: Проверьте каждый образец по отдельности, чтобы убедиться, что gating является правильным и изменить, когда это необходимо. - Если клетки были окрашены маркерными антителами (например, CD45), используйте соответствующий FMO и ворота соответственно.
- Чтобы экспортировать макет, нажмите на файл | Экспорт изображения | Выберите формат файлов (например, jpg, pdf).
- Нажмите Создать таблицу, чтобы открыть окно с окончательной версией таблицы.
- Экспорт таблицы путем выбора файла | Сохранить как | Имя файла.
Результаты
Хирургическая процедура
Успех переливания грудного спинного мозга определяется оценкой ряда параметров, наиболее очевидным из которых является паралич спинного мозга. Зверь двигается только на своих задних конечностях, перетаскивая задние конечности. В противном случае уровни активности, включая кормление, уход и бдительность, как правило, являются нормальными. Кроме того, животные теряют волевой контроль мочевого пузыря в результате чего необходимость ручного выражения мочевого пузыря следователем каждые 12 ч до рефлекторной аннулирования возвращается на 10 до 14 дней после травмы. После эвтаназии, дополнительные признаки успеха травмы связаны в первую очередь с увеличением соотношения веса мочевого пузыря к телу, что свидетельствует о ремоделирования тканей. Гистологический анализ выявляет гиперплазию как в уротелиальных, так и в гладких мышечныхотсеках 3.
Подготовка одноклеточной подвески
Используя общедоступные данные экспрессии, было определено обогащение тканей мочевого пузыря для внеклеточныхматричных белков (рисунок 2)и использовано для информирования о составе смеси пищеварения. Так как коллагены являются ключевыми компонентами стенкимочевого пузыря 11,12, сначала мы стремились определить наиболее распространенный коллаген (ы) в мочевом пузыре мыши с помощью РНК профилирования наборов данных, генерируемых мышью ENCODEпроекта 13. Наш анализ показал, что коллаген 1A1, коллаген 3A1, коллаген 1A2 и коллаген 6A1 являются наиболее распространенными типами коллагена в мочевом пузыре мыши(рисунок 2A). Мы также использовали Tabula Muris (сборник одноклеточных данных транскриптома от мыши (Mus musculus))8 для определения уровня экспрессии мРНК коллагенов 1, 3, 6 и гиалуронана. Данные позволяют проводить прямое и контролируемое сравнение экспрессии генов в типах клеток, общих между тканями. Этот анализ показал, что экспрессия этих внеклеточных компонентов матрицы более распространена в мезенхимальных типах клеток, а не в уротелии(рисунок 2B).
Влияние диссоциации на жизнеспособность изолированных клеток из мочевого пузыря
Анализ цитометрии потока показал, что энзиматическое пищеварение с использованием 4 различных протоколов дало жизнеспособность 83%, 86%, 93% или 90%, соответственно. Таким образом, протокольный раздел 3 был признан наиболее ценным для сохранения жизнеспособности клеток. Мы также заметили, что примерно 4% клеток были некротическими(PI/ Annexin V-) (Рисунок 4A). Эти наблюдения подчеркивают эффективность протокола пищеварения и последующее преимущество жизнеспособности клеток.
Влияние травмы спинного мозга на различные популяции клеток мочевого пузыря
Мы наблюдали значительное увеличение общего числа клеток в мочевых пузырях SCI мышей по сравнению с контроля. Шаблон точечных участков, полученных из SCI мочевых пузырей, также немного отличался в соответствии с текущей реконструкцией органов из-за травмыспинного мозга (рисунок 4B: первый столбец). По сравнению с контролем, мочевые пузыри от SCI животных отображается значительное увеличение CD45-положительных клеток.
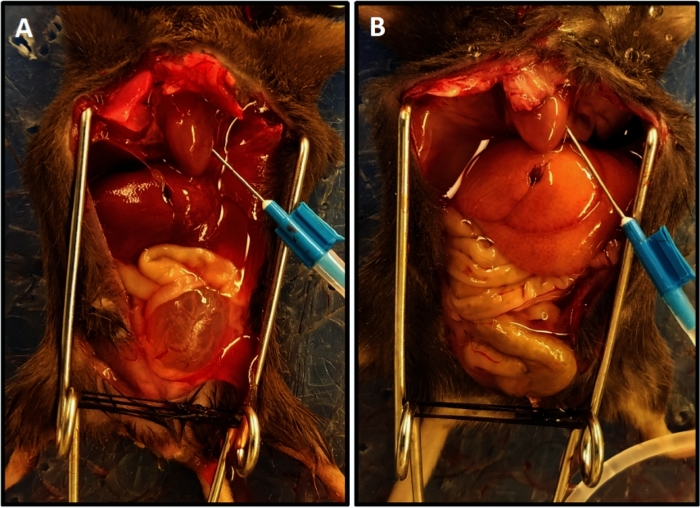
Рисунок 1: Представитель перфузии завершения с облегченный цвет печени. (A)Демонстрирует цвет печени в начале перфузии. (B)Показывает облегченный цвет печени в конце перфузии. Мышь в (A) была пересадка спинного мозга за две недели до перфузии в результате гипертрофии мочевого пузыря и его выступ из таза в отличие от мыши в (B), которые не имеют повреждения спинного мозга; в этом случае мочевой пузырь маленький и скрытый в тазу. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
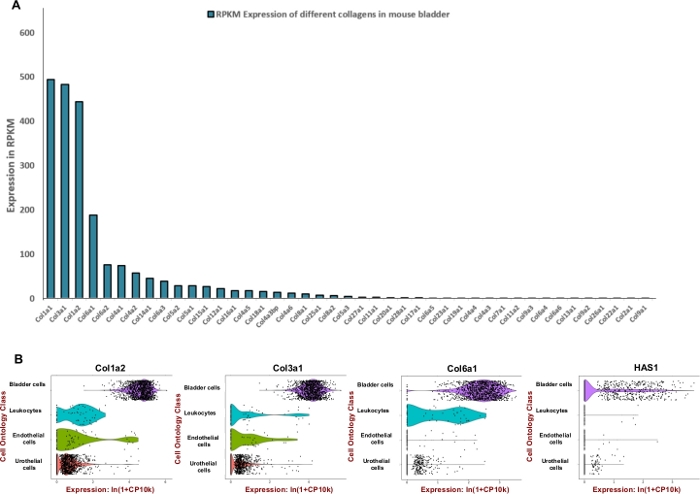
Рисунок 2: Транскриптомное выражение внеклеточных компонентов матрицы (ECM) в мочевом пузыре мыши. (A) Бар диаграммы 43 различных типов коллагена. Выражение указано читает за килобазу стенограммы, на миллион отображенных читает (RPKM) (данные собраны из BioProject: PRJNA66167)14. (B)Скрипка участки экспрессии генов в типах клеток, полученных из микрофлюидных капель на основе 3'-конец подсчета в бассейне мужчин и женщин диссоциированных образцов мочевого пузыря (мужчины и женщины). Графы были нормализованы журналом для каждой ячейки, используя естественный логаритм из 1 "кол-во на миллион ln (CPM-1)8. Псевдосчет 1 CPM был добавлен, прежде чем принимать logarithms. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
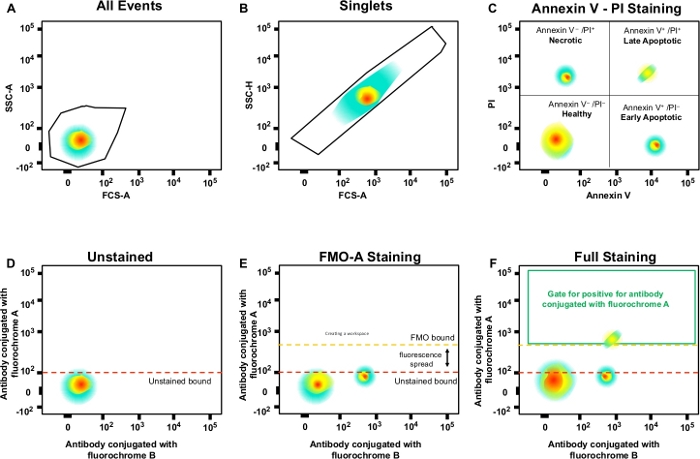
Рисунок 3: Стратегия Гэтинга и контроль FMO для определения распространения флуоресценции. (A)Выбор популяции клеток. (B)Gating стратегия для синглетов. (C) Gating для некротических, и ранних и поздних апоптотических клеток с использованием PI и Annexin V антитела. (Д'u2012F) Схематический точечный участок цитометрии многоцветного потока (например, антитела, спрягаемые с A, B, C, D флуорохромами (Annexin V и PI). Это показывает, что флуоресценция распространилась на антитела с флуорохромом каналом А, показанным управлением FMO по сравнению с необличанным контролем. Оранжевая пунктирная линия представляет границу закрытого FMO по сравнению с неокрасленной границей красным цветом. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
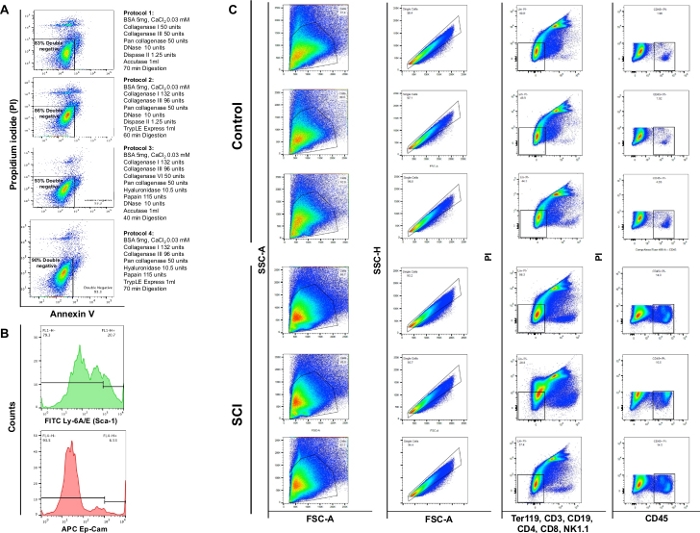
Рисунок 4: Поток цитометрии различных типов клеток в мочевом пузыре. (A)Annexin V/PI двойные диаграммы потока окрашивания. Различные комбинации ферментов и химических веществ, используемых для каждого протокола представлены перед соответствующим участком жизнеспособности. Эти данные свидетельствуют о высокой жизнеспособности, полученной в разделе протокола 3. (B)Репрезентативные гистограммы, иллюстрирующие интенсивность ли-6A/E (Sca-1) и CD326 (Ep-CAM), обнаруженные в отдельных каналах. (C)Влияние SCI на популяцию клеток мышелового пузыря. Верхняя панель показывает результаты окрашивания на трех диссоциированных мочевых пузырей, полученных от контроля нехирургических мышей и нижней панели показывает результаты окрашивания на трех животных с SCI. Первая колонка – это общая популяция ячеев. Во второй колонке показан выбор синглетного гатинга. Третий столбец показывает субпопуляцию живых клеток, которые являются отрицательными для В-клеток, Т-клеток и НК-клеток. В четвертой колонке показано окрашивание живых клеток, положительное для CD45. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Компонент | Сумма (за 500 мл) | Моларионити |
| Nacl | 4,091 г | 140 мМ |
| Kcl | 0,186 г | 5 мМ |
| MgCl2 | 0,0476 г | 1 мМ |
| D-Глюкоза | 0,9 г | 10 мМ |
| ГЕПЕС | 1,19 г | 10 мМ |
Таблица 1: Компоненты для приготовления раствора Тирода. Указанные компоненты для приготовления раствора Тирода 500 мл.
| Компонент | Сумма | Протокол раздел 1 | Протокол раздел 2 | Протокол раздел 3 | Протокол раздел 4 |
| Bsa | 5 мг | Да | Да | Да | Да |
| CaCl2 | 0,03 мМ | Да | Да | Да | Да |
| Коллагеназа типа I | 132,5 единицы | Да | Да | Да | Да |
| Коллагеназа Типа III | 96,4 единицы | Да | Да | Да | Да |
| Коллагеназа типа VI | 50 единиц | - | - | Да | - |
| DNase | 10 единиц | Да | Да | Да | - |
| Папаин | 115 единиц | - | - | Да | Да |
| Пан Коллагеназа | 50 единиц | - | - | Да | Да |
| Гиалуронидаза | 10,5 единиц | - | - | Да | Да |
| Диспасья II | 1.25 единиц | Да | Да | - | - |
| Решение для диссоциации клеток | 1 мл | Да | - | Да | - |
| Рекомбинантный фермент | 1 мл | - | Да | - | Да |
Таблица 2: Компоненты для подготовки буфера пищеварения. Указанные компоненты для приготовления смеси пищеварения 2,5 мл (1 U катализует гидролиз 1 ммоль субстрата в минуту при 37 градусах Цельсия. Обратитесь к листу данных о продукте для определения единицы каждого фермента).
Обсуждение
Модель травмы спинного мозга мыши, описанная здесь, обеспечивает воспроизводимый метод создания функциональной обструкции розетки мочевого пузыря из-за потери координации между сокращением мочевого пузыря и внешним расслаблением уретального сфинктера. Это, в свою очередь, вызывает глубокую реконструкцию стенки мочевого пузыря уже через 2 недели после травмы, характеризующейся расширением уротелеальных и гладких мышечных отсеков. Критические шаги в реализации модели SCI у грызунов включают i) пристальное внимание к ручному выражению мочевого пузыря в период спинного шока, который наступает в течение 10-201214 дней после травмы; ii) обогащение питательными веществами для сведения к минимуму потери веса; и iii) смягчение потенциала для обжига мочи, особенно для экспериментов, которые выходят за рамки возвращения рефлекторного аннулирования. Ограничения модели включают потенциал для уретры окклюзии у мышей от сгустков крови в период преходящей гематурии, и дополнительно у мышей мужского пола из спермы коагулюм после ретроградной эякуляции после операции.
Подход диссоциации тканей, описанный здесь, иллюстрирует важность рассмотрения структурных изменений в тканях, которые возникают в результате экспериментального оскорбления, в данном случае значительной ремоделирования тканей после SCI, которые могут влиять на анализы ниже по течению. С увеличением анализа одной клетки крайне важно обеспечить, чтобы различия, наблюдаемые в экспрессии генов, не были просто результатом диссоциализации, вызванных возмущениями, но действительно репрезентативны для основных биологических изменений, имеющих отношение к модели болезни. Использование общедоступных данных выражения позволило нам изменить формулировку буферов пищеварения, чтобы обеспечить эффективное переваривание внеклеточной матрицы при максимальной жизнеспособности. Дополнительные изменения, которые могут быть рассмотрены в будущих приложениях включают добавление актиномицина D, чтобы остановить транскрипцию непосредственных ранних генов, которые чувствительны к протоколу диссоциации15.
Техника трубы имеет решающее значение при диссоциации тканей или передачи клеток, которые уже находятся в подвеске. Чтобы уменьшить физический ущерб клеткам от стрижки сил, важно пипетки мягко и медленно во время повторного деления клеток. Как правило, рекомендуется использовать широкое отверстие пипетки советы. При использовании стандартных подсказок, это особенно важно пипетки подвески клетки мягко, чтобы избежать стрижки сил, которые в противном случае повреждения клеток. Использование клеточных ситечкой неизбежно в этом протоколе, однако, концентрация клеток может снизиться на 20% или более, сопровождается потерей объема 100 йл или более. Мы рекомендуем определить концентрацию клеток после напрягания, чтобы обеспечить точное количество клеток.
В цитометрии потока элементы управления FMO обеспечивают меру фона из-за кровотечения сигнала от перекрывающихся пиков выбросов. Они не являются мерой неспецифического связывания антител, или фоновое окрашивание, которое может присутствовать, когда антитела включены в этот канал. Для учета неспецифического связывания антител необходимо включить соответствующие элементы управления изотипом; для фонового окрашивания, нужно включить отрицательный контроль. В совокупности эти элементы управления обеспечивают точное измерение популяций клеток.
Раскрытие информации
Конфликтов интересов не объявлено.
Благодарности
Эта работа была поддержана грантами национальных институтов здравоохранения (R01 DK077195 на R.M.A, R01 DK104641 на R.M.A и D.R.B). Мы признаем ценный вклад д-ра Стюарта Оркина в отдел гематологии/онкологии, Бостонскую детскую больницу, отделение педиатрии, Гарвардскую медицинскую школу и Институт рака Дана-Фарбер. Мы также признаем поддержку со стороны Кайл Коста в послеоперационном уходе за мышами, Мэри Таглиенти и д-р Хабибалла Шоджайсаади (Лаборатория доктора Янг Ши, отдел педиатрии, Отдел медицины новорожденных, Кафедра педиатрии, Отдел медицины новорожденных, Бостонская детская больница, Гарвардская медицинская школа) для технической помощи и полезных дискуссий.
Материалы
| Name | Company | Catalog Number | Comments |
| 2.5 X Magnifying Loupes | |||
| 7-0 Vicryl suture, 6.5mm needle 3/8 circle | ETHICON | J546 | |
| 70 μm Cell Strainer | Thermofisher | 22363548 | |
| Accutase in BPBS, 0.5mM EDTA | Millipore | SCR005 | |
| Aerosol Filter Wide Orifice Pipettor Tips (1000 µL) | VWR | 89049-168 | |
| Aerosol Filter Wide Orifice Pipettor Tips (1000 µL) | VWR | 89049-168 | |
| APC anti-mouse CD326 (Ep-CAM), rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 118213 | |
| BB515 Rat Anti-Mouse CD45, rat monoclonal, IgG2b, κ, Clone 30-F11 | BD Biosciences | 564590 | |
| BONN Micro Dissecting Forceps, Straight, 1x2 teeth, 3.75" length, 0.3mm tip width, 0.12mm teeth | ROBOZ Surgical Instrument Company, Inc. | RS-5172 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Bovine Serum Albumin | Sigma | A9647-100G | |
| CaCl2 | Sigma | 2115-250ML | |
| CASTROVIEJO Micro Suturing Needle Holder, Straight with lock, 5.75" length | ROBOZ Surgical Instrument Company, Inc. | RS-6412 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Cell Counting Kit, 30 dual-chambered slides, 60 counts, with trypan blue | Biorad | 1450003 | |
| Cell Staining Buffer | BioLegend | 420201 | |
| Collagenase from Clostridium histolyticum | Sigma | C0130-1G | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Collagenase Type III | Worthington Biochemical Corporation | LS004182 | |
| Collagenase, Type 6 | Worthington Biochemical Corporation | LS005319 | |
| Dead Cell Apoptosis Kit with Annexin V Alexa Fluor 488 & Propidium Iodide (PI) | Thermofisher | V13241 | |
| Dispase II | Sigma | D4693-1G | |
| DNase | Sigma | DN25-1G | |
| Enrofloxacin (Baytril) | Bayer Health Care LLC, | NADA # 140-913 Approved by FDA. Lot No.: AH01CGP | 2.27% Injectable Solution |
| Falcon 15 ml conical centrifuge tubes | Fisher Scientific | 352096 | |
| Falcon 50 ml conical centrifuge tubes | Fisher Scientific | 352070 | |
| FITC anti-mouse Ly-6A/E (Sca-1) Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 122505 | |
| Hyaluronidase from sheep testes, Type II | Sigma | H2126 | |
| MACS SmartStrainers (100 µm) | Miltenyi Biotec, Inc. | 130-110-917 | |
| McPHERSON-VANNAS, Micro Dissecting Spring Scissors, Straight, 4" length, 0.15mm tip width | ROBOZ Surgical Instrument Company, Inc. | RS-5630 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Meloxicam | Patterson Veterinary | 07-891-7959 | |
| Papain | Worthington Biochemical Corporation | LS003119 | |
| PE/Cy5 anti-mouse CD19 Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 115509 | Dump Channel |
| PE/Cy5 anti-mouse CD3ε Antibody, Armenian hamster monoclonal, IgG, affinity purified | BioLegend | 100309 | Dump Channel |
| PE/Cy5 anti-mouse CD4 Antibody, rat monoclonal, IgG2b, κ, affinity purified | BioLegend | 100409 | Dump Channel |
| PE/Cy5 anti-mouse CD8a Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 100709 | Dump Channel |
| PE/Cy5 anti-mouse NK-1.1 Antibody, mouse monoclonal, IgG2a, κ, affinity purified | BioLegend | 108715 | Dump Channel |
| PE/Cy5 anti-mouse TER-119/Erythroid Cells Antibody, IgG2b, κ, affinity purified | BioLegend | 116209 | Dump Channel |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block), rat monoclonal, IgG2b, κ, Clone 2.4G2 | BD Biosciences | 553141 | |
| RBC Lysis Buffer (10X) | BioLegend | 420301 | |
| Red Blood Cell Lysis Buffer 1x | Biolegend | 420201 | |
| Screw-Cap microcentrifuge tubes, 1.5 ml | VWR | 89004-290 | |
| TC20 Automated Cell Counter | Biorad | 1450102 | |
| Triple antibiotic ointment (neomycin/polymyxin B/ bacitracin) | Patterson Veterinary | 07-893-7216 | skin protectant |
| TrypLE Select Enzyme (10X), no phenol red | Thermofisher | A1217701 | |
| Vetropolycin eye ointment | Dechra Veterinary Products | NADA # 065-016. Approved by FDA. | protect eyes during anesthesia |
Ссылки
- Grange, C., et al. Phenotypic characterization and functional analysis of human tumor immune infiltration after mechanical and enzymatic disaggregation. Journal of Immunological Methods. 372 (1-2), 119-126 (2011).
- van den Brink, S. C., et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Seth, A., et al. The impact of discrete modes of spinal cord injury on bladder muscle contractility. BMC Urology. 13, 24 (2013).
- Doyle, C., et al. Inosine attenuates spontaneous activity in the rat neurogenic bladder through an A2B pathway. Scientific Reports. 7, 44416 (2017).
- Gheinani, A. H., et al. Characterization of miRNA-regulated networks, hubs of signaling, and biomarkers in obstruction-induced bladder dysfunction. JCI Insight. 2 (2), 89560 (2017).
- Gheinani, A. H., et al. Concordant miRNA and mRNA expression profiles in humans and mice with bladder outlet obstruction. American Journal of Clinical and Experimental Urology. 6 (6), 219-233 (2018).
- Krishna, V., et al. A contusion model of severe spinal cord injury in rats. Journal of Visualized Experiments. (78), e50111 (2013).
- The Tabula Muris Consortium. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris. Nature. 562 (7727), 367-372 (2018).
- Gray, C. J., Boukouvalas, J., Szawelski, R. J., Wharton, C. W. Benzyloxycarbonylphenylalanylcitrulline p-nitroanilide as a substrate for papain and other plant cysteine proteinases. Biochemical Journal. 219 (1), 325-328 (1984).
- Feodorova, Y., Koch, M., Bultman, S., Michalakis, S., Solovei, I. Quick and reliable method for retina dissociation and separation of rod photoreceptor perikarya from adult mice. MethodsX. 2, 39-46 (2015).
- Aitken, K. J., Bagli, D. J. The bladder extracellular matrix. Part I: architecture, development and disease. Nature Reviews Urology. 6 (11), 596-611 (2009).
- Aitken, K. J., Bagli, D. J. The bladder extracellular matrix. Part II: regenerative applications. Nature Reviews Urology. 6 (11), 612-621 (2009).
- The ENCODE Project Consortium. An integrated encyclopedia of DNA elements in the human genome. Nature. 489 (7414), 57-74 (2012).
- Yue, F., et al. A comparative encyclopedia of DNA elements in the mouse genome. Nature. 515 (7527), 355-364 (2014).
- Wu, Y. E., Pan, L., Zuo, Y., Li, X., Hong, W. Detecting Activated Cell Populations Using Single-Cell RNA-Seq. Neuron. 96 (2), 313-329 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены