È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un approccio graduale semplificato alla guida dell'eco durante la riparazione della valvola mitrale percutanea
In questo articolo
Riepilogo
Questo protocollo presenta in dettaglio come eseguire la guida ecocardiografica in tempo reale durante la riparazione della valvola mitrale transcatetere. Le viste fondamentali e le misurazioni necessarie sono descritte per ogni fase della procedura.
Abstract
La ricostruzione percutanea transcatetere edge-to-edge della valvola mitrale è una terapia sicura e consolidata per il rigurgito mitrale sintomatico grave in pazienti ad alto rischio chirurgico. La guida ecocardiografica oltre alla fluoroscopia è il gold standard e dovrebbe essere eseguita utilizzando una tecnica standardizzata.
Questo articolo espone la nostra guida ecocardiografica riproducibile passo dopo passo che include viste, misurazioni e mette in evidenza le possibili difficoltà che possono sorgere durante la procedura.
Questo articolo fornisce viste ecocardiografiche dettagliate e cronologiche per ogni fase della procedura, in particolare le preferenze tra l'imaging 2D e 3D. Se necessario, vengono descritte le misurazioni dell'onda a impulsi, dell'onda continua e del color doppler. Inoltre, poiché non esistono raccomandazioni ufficiali per la quantificazione del rigurgito mitrale durante la procedura percutanea di riparazione da bordo a bordo, sono inclusi anche consigli per la quantificazione ecocardiografica dopo aver afferrato i foglietti mitrali e dopo l'implementazione del dispositivo. Inoltre, l'articolo si occupa di importanti viste ecocardiografiche per prevenire e affrontare possibili complicazioni durante la procedura.
La guida ecocardiografica durante la riparazione della valvola mitrale transcatetere è obbligatoria. Un approccio strutturato migliora la collaborazione tra interventista e imager ed è indispensabile per una procedura sicura ed efficace.
Introduzione
Il rigurgito mitrale (MR) è la seconda indicazione più frequente per la chirurgia valvolare in Europa1. Non trattata, può portare a grave insufficienza cardiaca e ridotta qualità della vita2,3,4. La riparazione percutanea della valvola mitrale (PMVR) è una tecnica basata sul catetere, che imita il metodo chirurgico del punto Alfieri alla riparazione mitrale collegando le capesante A2 e P25. Per i pazienti ad alto rischio chirurgico, questa tecnica offre un approccio minimamente invasivo per il trattamento della MR grave. I dati di diversi registri e studi hanno dimostrato che la procedura MitraClip, una terapia di riparazione della valvola mitrale transcatetere, è un metodo efficace e sicuro6,7,8,9. Nel 2019 è stato introdotto sul mercato un dispositivo simile, il sistema di riparazione delle valvole transcatetere PASCAL. Ha dimostrato fattibilità e sicurezza accettabile nel trattamento di pazienti con MR10grave . La durata e il successo del PMVR dipendono dall'abilità e dall'esperienza del singolo operatore11. A differenza di altre tecniche percutanee, come la sostituzione transvalvolare percutanea (TAVR), che può essere eseguita solo con fluoroscopia, pmvr richiede una guida ecocardiografica12,13.
Questo articolo descrive passo dopo passo l'approccio ecocardiografico durante la PMVR, comprese le misurazioni, i suggerimenti per la quantificazione intraprocedurale della MR e importanti viste per prevenire le complicanze periprocedurali.
Protocollo
Il protocollo segue le linee guida del comitato etico per la ricerca umana della nostra istituzione.
1. Valutazione prima dell'intervento
- Escludere il versamento pericardico prima della puntura transsettale. Se è presente un piccolo versamento pericardico, misurare lo spazio echilucido finale-diastolico massimo in una vista a quattro camere (4Ch) con un focus sul ventricolo destro (RV), una vista di afflusso-deflusso ventricolare destro medio-esofageo e una vista ad asse lungo (LAX).
- Valutare il modello di flusso venoso polmonare con doppler a onde di impulso (PW) nella vena polmonare superiore sinistra (LUPV) ed escludere la formazione di trombi nell'appendice atriale sinistra (LAA). Mostra la vista dell'asse corto (SAX) con messa a fuoco sul LAA, sweep quindi a 40-60 ° e ruota la sonda in senso antiorario per mostrare il LUPV. Valutare il flusso nella vena polmonare superiore destra (RUPV) spazzando a 90-110° (Figura 1 e Figura supplementare 1).
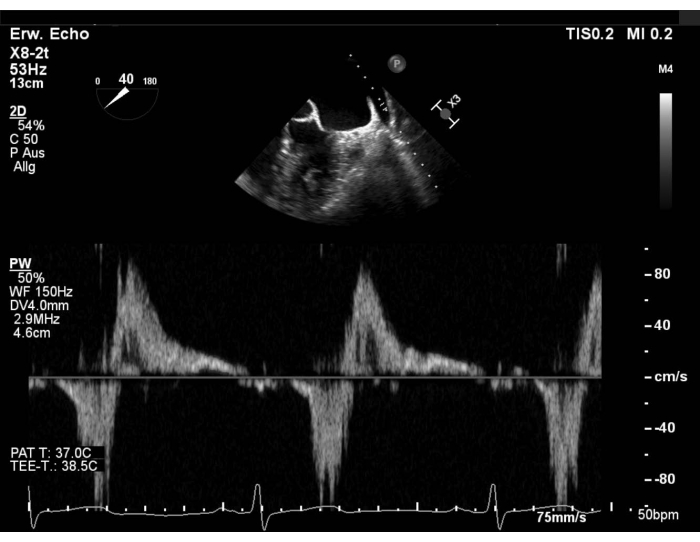
Figura 1: Vista SAX modificata: flusso PW nella vena polmonare superiore sinistra Fare clic qui per visualizzare una versione più grande di questa figura.
- Assicurarsi che lo stato emodinamico sia lo stesso durante la valutazione pre e post-procedurale.
NOTA: POICHÉ LA MR è una malattia valvolare dinamica, il rigurgito può sembrare meno grave in anestesia generale. In questo caso, consultare l'operatore e aumentare il postcarico e/o il precarico. - Trova la migliore vista intercommissurale (50-70°). Prendi una vista perpendicolare (piano X) nei tre segmenti con e senza color doppler e misura la lunghezza del foglietto mitrale posteriore (PML). Quindi, controllare nuovamente la morfologia del foglietto (Figura 2 e Figura supplementare 2).

Figura 2: Vista biplanare 2D della MT con color doppler: getto di insufficienza mediale Clicca qui per visualizzare una versione più grande di questa figura.
- Valutare il gradiente di pressione trasmettitore con doppler ad onda continua (CW) nella vista ad asse lungo (120-140°).
NOTA: un gradiente di pressione medio (MPG) > 5 mmHg è una controindicazione relativa per PMVR. - Prendi un set di dati 3D con color doppler o un'immagine zoom ad ampio settore con colore e misura la 3D-vena contracta (3D-VCA) (Figura 3).
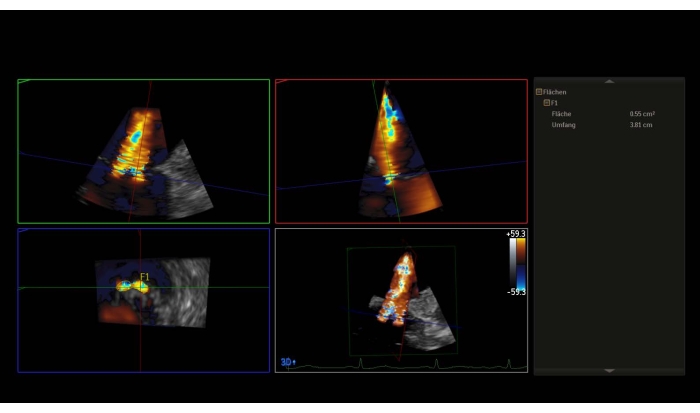
Figura 3: Ricostruzione multiplanari del set di dati 3D con color doppler: 3D-Vena contracta Fare clic qui per visualizzare una versione più grande di questa figura.
- Senza colore, utilizzare il volume 3D per misurare l'area della valvola mitrale (MVA) (Figura supplementare 3).
NOTA: Un'area < 4 cm2 è una controindicazione relativa, un'area < 3 cm2 una controindicazione assoluta per eseguire la procedura. Altrimenti valutare l'MVA nella vista SAX basale transgastrica. - Mostra la vista atriale chirurgica en-face 3D (valvola aortica a ore 12) della valvola mitrale.
NOTA: I segmenti della valvola sono denominati "laterale" per i segmenti 1 e "mediale" per i segmenti 3. La sequenza dei segmenti nella vista chirurgica en-face, è inversa alla sequenza nella vista commissurale. Eseguire una rotazione di 180° in senso orario nella vista chirurgica en-face 3D (valvola aortica a ore 6), che si tradurrà in una sequenza uguale di segmenti in entrambe le viste (Figura 4 e Figura 5).
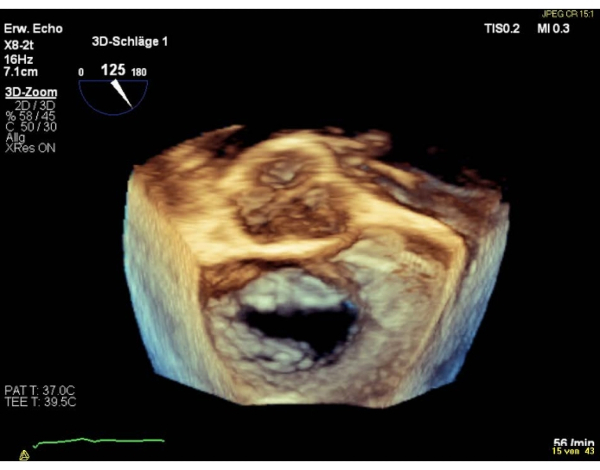
Figura 4: Immagine zoom ad ampio settore: vista atriale chirurgica 3D en-face (valvola aortica a ore 12) Fare clic qui per visualizzare una versione più grande di questa figura.
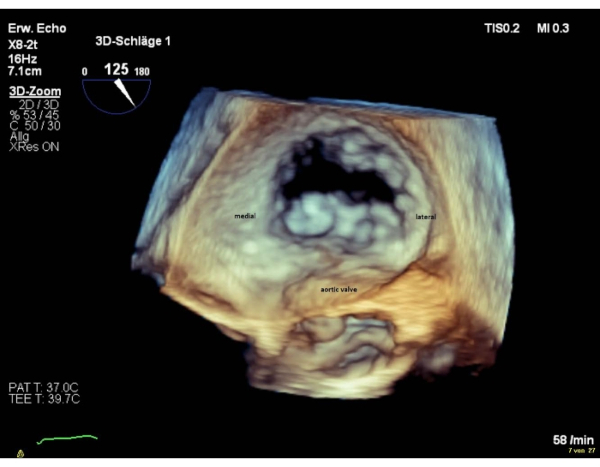
Figura 5: Immagine zoom a ampio settore: vista atriale en-face 3D (valvola aortica a ore 6) Fare clic qui per visualizzare una versione più grande di questa figura.
- Infine, prendi una vista bicaval (90-110°) con X-plane, per mostrare la valvola aortica (AV), per la puntura transsettale.
2. Strategia
- Discutere la strategia con l'operatore prima di inserire il catetere guida orientabile (SGC) e il sistema di erogazione della clip (CDS) nell'atrio sinistro.
- Valutare una strategia di un dispositivo se l'orifizio è largo < 1 cm e posizionare la clip direttamente sopra il getto di rigurgito se l'orifizio è circolare.
- Valutare l'impianto di ≥ 2 clip in caso di grandi getti ellittici o multipli. Impiantare il dispositivo a partire medialmente dall'orifizio rigurgitante, poiché il posizionamento di un secondo dispositivo è spesso più facile quando il primo è stato impiantato in questo modo, piuttosto che dopo l'avvio laterale (Figura supplementare 4).
3. Puntura transsettale
- Mostra una vista bicaval combinata con una vista SAX. Assicurarsi che l'AV sia visibile, per evitare lesioni aortiche.
- Assicurarsi che il sito di puntura sia leggermente superiore e posteriore (Figura 6).
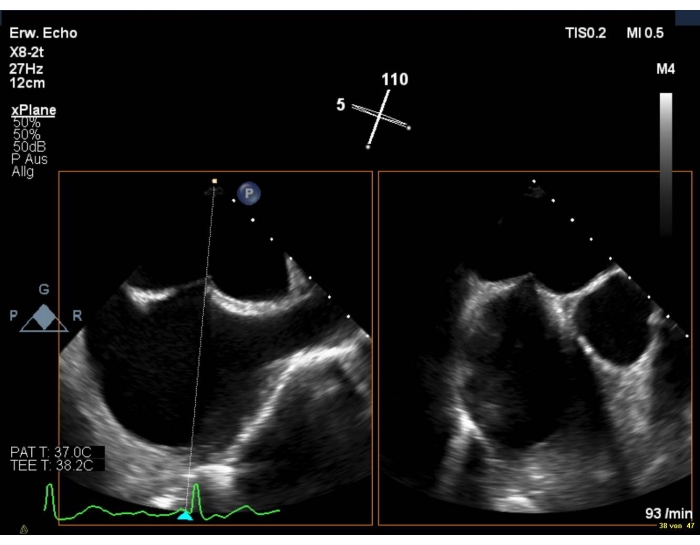
Figura 6: Vista biplanare 2D: foratura transsettale Fare clic qui per visualizzare una versione più grande di questa figura.
- Scegli un'altezza di puntura di 4-5 cm in caso di MR degenerativa (ad esempio, prolasso) e di > 3,5 in MR funzionale. Evita un foramen ovale percio, poiché l'ingresso è troppo anteriore.
- Una volta che l'ago transsettale porta alla tenting del setto interatriale, misurare l'altezza della puntura nella vista 4Ch a metà sistole (Figura supplementare 5).
NOTA: Nei pazienti con atri grandi, se il sito di puntura è troppo posteriore, la tenda non può essere visualizzata nella vista 4Ch. In questo caso, retroflessi e inserisci la sonda più in profondità nell'esofago. - Dopo la puntura transsettale, escludere sempre il versamento pericardico nella vista 4Ch.
- Mostra una vista SAX con un focus sul LAA e sulla vena polmonare per visualizzare l'ingresso del filo guida rigido nel LUPV.
4. Introduzione dell'SGC nella LA
- Visualizza la tenda e l'avanzamento dell'SGC con il dilatatore in una vista SAX con ecocardiografia 2D continua e guida fluoroscopica per evitare lesioni alla parete atriale sinistra.
NOTA: La punta dell'SGC è definita da un doppio anello luminoso radiopaco ed eco (Figura supplementare 6). - Mostrare all'operatore la vista SAX e la vista bicaval (90-120°) per posizionare l'SGC in direzione del ventricolo sinistro (LV).
5. Avanzamento del CDS nel LA
- Prendi un volume 3D che includa il setto interatriale, la cresta laterale sinistra e la MV e assicurati che la cresta laterale sinistra sia visibile perché la sporgenza del CDS è comune (Figura 7).

Figura 7: Immagine zoom a ampio settore: SGC nel LA compreso il setto interatriale, la cresta laterale sinistra e la MV Fare clic qui per visualizzare una versione più grande di questa figura.
- Altrimenti scegli la vista SAX e la vista LAX (X-plane) per assicurarti che il CDS non abbia contatto con la cresta e la parete LA.
NOTA: L'operatore può chiedere all'imager di mostrare il setto interatriale e tirare indietro l'SGC di alcuni millimetri per bypassare la cresta. Se non è possibile visualizzare il doppio anello in 3D, passare a 2D e visualizzare l'SGC nella vista SAX.
- Verificare che il CDS sia posizionato perpendicolarmente alla linea di coapitazione per garantire una traiettoria corretta.
- Mostra la vista intercommissurale in 2D a circa 60° per visualizzare il piano mediale - laterale e la vista LAX a 120-140° per identificare il piano anteriore - posteriore della MV (Figura supplementare 7).
- In alternativa, ottimizzare il posizionamento mediale, laterale, anteriore e posteriore del CDS nella vista en-face 3D (Figura supplementare 8).
6. Orientamento del dispositivo sopra e sotto la MT
- Prendi la vista en-face 3D per mostrare un posizionamento perpendicolare dei bracci alla linea di coapitazione.
- In caso di scarsa qualità dell'immagine, mostrare una vista intercommissurale combinata con una vista LAX (Figura 8 e Figura 9).
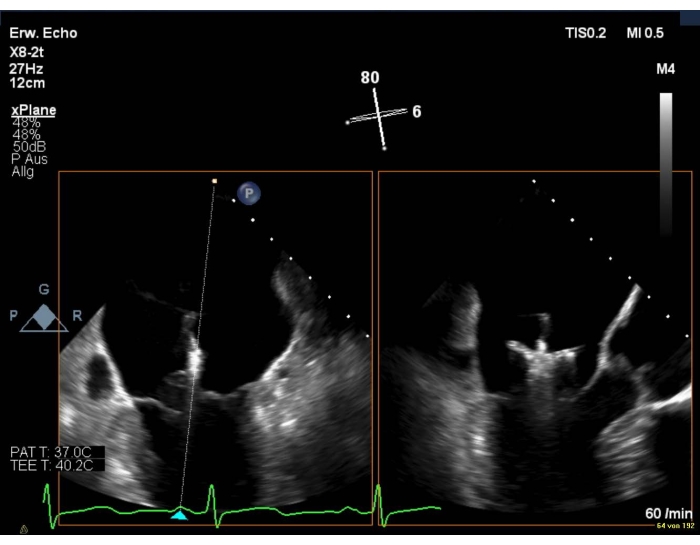
Figura 8: Vista biplanare 2D della MT: posizionamento del dispositivo sopra la valvola mitrale Fare clic qui per visualizzare una versione più grande di questa figura.
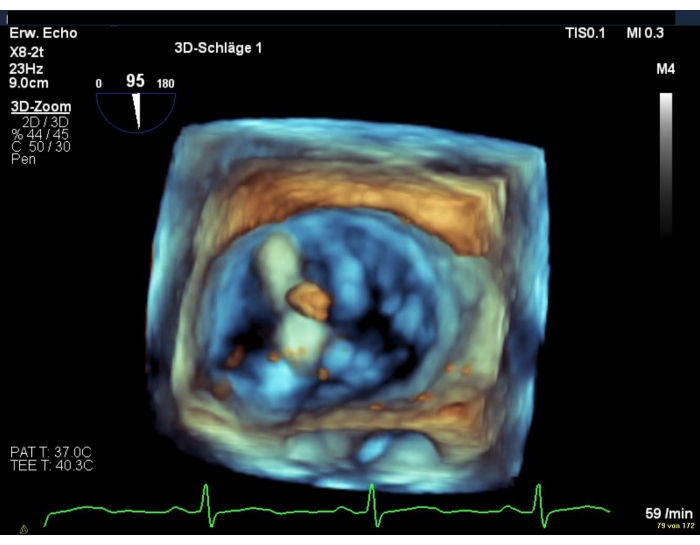
Figura 9: Immagine zoom a ampio settore: posizionamento del dispositivo sopra la valvola mitrale Fare clic qui per visualizzare una versione più grande di questa figura.
NOTA: i bracci della clip sono visibili solo nella vista LAX.
- Regolare l'angolo di visione intercommissurale per i dispositivi posizionati medialmente e lateralmente per visualizzare l'intera lunghezza di entrambi i bracci. Sweep a circa 30-45° per i dispositivi posizionati medialmente e a circa 70-90° per i dispositivi posizionati lateralmente.
- Scegli la vista intercommissurale combinata con una vista LAX per visualizzare l'avanzamento del CDS nel LV.
- Assicurarsi che il CDS sia posizionato a pochi millimetri sotto la MV.
- Verificate nella vista 3D en-face che i bracci della clip siano ancora nella posizione pianificata, poiché è frequente una rotazione della clip durante l'attraversamento della valvola.
NOTA: Se la posizione dei bracci della clip è cambiata, verrà eseguita una rotazione in senso orario o antiorario per ottenere una presa simmetrica. Fai attenzione durante questa manovra per ridurre al minimo l'entanglement cordale e subcordo. - Se è necessario un riorientamento grossolano del dispositivo, mostrare la vista intercommissurale con il piano X per visualizzare l'inversione della clip che verrà recuperata nel LA.
7. Presa dei foglietti mitrali e valutazione della MR prima e dopo la distribuzione della clip
- Registrare la presa dei volantini nella vista intercommissurale combinata con la vista LAX (piano X) o solo nella vista LAX (Figura supplementare 9).
- Chiedere all'anestesista di eseguire una manovra di tenuta del respiro per ridurre lo spostamento durante la ventilazione e facilitare la presa dei foglietti.
- Garantire una visualizzazione continua dell'inserimento del foglietto illustrativo per evitare il rotolamento dei foglietti illustrativi o delle schede.
NOTA: Afferrare un foglietto arrotolato o una chorda può comportare un distacco parziale del volantino e/o un aggravamento della MR. - Valutare attentamente la riduzione del rigurgito prima della distribuzione della clip. Assicurati che sia l'operatore che l'imager analizzino questo passaggio cruciale.
- Ruotare la sonda TEE medialmente e lateralmente verso la clip o utilizzare il piano X con color doppler per trovare getti eccentrici vicino alla clip (Figura supplementare 10).
NOTA: a causa di artefatti di ombreggiatura causati dal CDS può verificarsi una sottostima del MR. Inserire la sonda più in profondità nell'esofago o mostrare la vista transgastrica per visualizzare i getti di insufficienza residua senza ombreggiare artefatti. - Valutare il flusso di PW nelle vene polmonari.
NOTA: se una precedente inversione del flusso sistolico si trasforma in un modello sistolico dominante, probabilmente si è verificata una riduzione rilevante. - Misurare l'MPG attraverso la valvola mitrale.
NOTA: una pendenza > 5 mmHg è una controindicazione relativa per la distribuzione delle clip (Figura supplementare 11 e Figura supplementare 12). - Utilizzare la vista en-face 3D della MV o una vista SAX transgastrica della MV per mostrare il doppio orifizio (Figura 10).
- Ruotare la sonda TEE medialmente e lateralmente verso la clip o utilizzare il piano X con color doppler per trovare getti eccentrici vicino alla clip (Figura supplementare 10).

Figura 10: Immagine zoom a ampio settore: doppio orifizio della MV dopo la distribuzione del dispositivo Fare clic qui per visualizzare una versione più grande di questa figura.
- Infine, se il risultato è soddisfacente, controllare l'inserimento del foglietto illustrativo in 2D.
- Dopo aver rilasciato la clip dal CDS, ripetere gli ultimi cinque passaggi.
NOTA: A causa della tensione del sistema sulla MT, i getti di insufficienza residua dopo il rilascio del dispositivo possono essere aggravati. - Mostrare quando la punta del catetere di consegna viene recuperata dall'SGC nella vista LAX con il piano X e assicurarsi che il picco eviti il contatto con il LA (Figura supplementare 13).
8. Valutazione mr finale
- Mostra la vista intercommissurale con color doppler in combinazione con piani X perpendicolari nei getti di insufficienza residua se presenti.
- Calcola il 3D-VCA in un volume 3D. NOTA: di solito gli orifizi non sono sullo stesso piano. In questo caso misurare planimetrie separate di ciascun orifizio nei piani appropriati (Figura supplementare 14).
- Valutare ancora una volta il flusso della vena polmonare e il gradiente medio attraverso la valvola mitrale.
NOTA: il monitoraggio continuo della pressione LA può essere uno strumento utile durante la riparazione della valvola mitrale transcatetere. - Infine, mostra la vista 3D en-face della valvola mitrale.
9. Impianto di dispositivi aggiuntivi
- Assicurarsi che la riduzione della MR sia sufficiente.
NOTA: Se il risultato non è soddisfacente, valutare l'impianto di dispositivi aggiuntivi. - Assicurarsi che il dispositivo aggiuntivo non contatti il dispositivo impiantato immergendosi nel ventricolo sinistro.
NOTA: la fluoroscopia è essenziale per mostrare la distanza reale tra le clip. - Mostra la vista en-face 3D per visualizzare la linea commissurale, in quanto potrebbe essere differita dopo l'impianto della prima clip.
- Ripetere i cinque passaggi come spiegato al punto 7.4 per valutare la MR dopo aver afferrato i foglietti illustrativi con la clip aggiuntiva.
Risultati
La riparazione percutanea della valvola da bordo a bordo è un'alternativa alla riparazione o alla sostituzione chirurgica della valvola in pazienti non idonei per l'intervento chirurgico con MR grave sintomatica. La prima applicazione clinica del MitraClip è stata studiata nello studio Endovascular Valve Edge-to-Edge Repair Study I (EVEREST I)14. Molti altri studi hanno dimostrato l'efficacia della procedura con un miglioramento dei sintomi e bassi tassi di mortalità ospedaliera ed eventi avver...
Discussione
L'eco-guida per il PMVR è un metodo sicuro. Possono verificarsi complicazioni dovute all'ecocardiografia, ma raramente portano a danni significativi. Tuttavia, le lesioni esofagee sono possibili dopo aver eseguito l'ecocardiografia transesofagea. Questa incidenza si riduce con una durata più breve dell'intervento34. Al contrario, diverse complicazioni associate alla riparazione della valvola mitrale transcatetere bordo-bordo sono descritte35,3...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo la signora Dorothea Scheurlen per il supporto tecnico video.
Materiali
| Name | Company | Catalog Number | Comments |
| EPIQ 7 Ultrasound System | Philips | US218B0542 | Cardiac Ultrasound Machine |
| X8-2t xMATRIX 3D-TEE probe | Philips | B34YYK | TEE-probe |
| Sheath 6F 25 cm | Merit Medical | B60N25AQ | Sheath |
| Dilator 16 F | Abbott | 405544 | Dilator |
| BRK-1 transseptal needle 71 cm | St. Jude Medical | ABVA407201 | Transseptal Needle |
| Swartz Lamp 90° | St. Jude Medical | 407356 | Transseptal Guiding Introducer Sheath |
| Amplatz super stiff | Kook Medical | 46509 | Wire |
| Steerable Guide Catheter | Abbott | SGC0302 | Steerable Guide Catheter |
| MitraClip NTR Delivery System | Abbott | CDS0602-NTR | Clip Delivery System |
| MitraClip NTR Bundle | Abbott | MSK0602-NTR | Device |
Riferimenti
- Iung, B., et al. A prospective survey of patients with valvular heart disease in Europe: The Euro Heart Survey on Valvular Heart Disease. European Heart Journal. 24 (13), 1231-1243 (2003).
- Hauptman, P. J., Rector, T. S., Wentworth, D., Kubo, S. Quality of life in advanced heart failure: role of mitral regurgitation. American Heart Journal. 151 (1), 213-218 (2006).
- Lewis, E. F. Assessing the impact of heart failure therapeutics on quality of life and functional capacity. Current Treatment Options in Cardiovascular Medicine. 15 (4), 425-436 (2013).
- Vaishnava, P., Lewis, E. F. Assessment of quality of life in severe heart failure. Current Heart Failure Reports. 4 (3), 170-177 (2007).
- Feldman, T., et al. Percutaneous repair or surgery for mitral regurgitation. New England Journal of Medicine. 364 (15), 1395-1406 (2011).
- Feldman, T., et al. Percutaneous mitral repair with the MitraClip system: safety and midterm durability in the initial EVEREST (Endovascular Valve Edge-to-Edge REpair Study) cohort. Journal of the American College of Cardiology. 54 (8), 686-694 (2009).
- Whitlow, P. L., et al. Acute and 12-month results with catheter-based mitral valve leaflet repair: the EVEREST II (Endovascular Valve Edge-to-Edge Repair) High Risk Study. Journal of the American College of Cardiology. 59 (2), 130-139 (2012).
- Baldus, S., et al. MitraClip therapy in daily clinical practice: initial results from the German transcatheter mitral valve interventions (TRAMI) registry. European Journal of Heart Failure. 14 (9), 1050-1055 (2012).
- Stone, G. W., et al. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. New England Journal of Medicine. 379 (24), 2307-2318 (2018).
- Lim, D. S., et al. Transcatheter Valve Repair for Patients With Mitral Regurgitation: 30-Day Results of the CLASP Study. JACC: Cardiovascular Interventions. 12 (14), 1369-1378 (2019).
- Schillinger, W., et al. Impact of the learning curve on outcomes after percutaneous mitral valve repair with MitraClip and lessons learned after the first 75 consecutive patients. European Journal of Heart Failure. 13 (12), 1331-1339 (2011).
- Katz, W. E., Conrad Smith, A. J., Crock, F. W., Cavalcante, J. L. Echocardiographic evaluation and guidance for MitraClip procedure. Cardiovascular Diagnosis and Therapy. 7 (6), 616-632 (2017).
- Altiok, E., et al. Optimized guidance of percutaneous edge-to edge repair of the mitral valve using real-time 3-D transesophageal echocardiography. Clinical Research in Cardiology. 100 (8), 675-681 (2011).
- Feldman, T., et al. Percutaneous mitral valve repair using the edge-to-edge technique: six-month results of the EVEREST Phase I Clinical Trial. Journal of the American College of Cardiology. 46 (11), 2134-2140 (2005).
- Maisano, F., et al. Percutaneous mitral valve interventions in the real world: early and 1-year results from the ACCESS-EU, a prospective, multicenter, nonrandomized post-approval study of the MitraClip therapy in Europe. Journal of the American College of Cardiology. 62 (12), 1052-1061 (2013).
- Kalbacher, D., et al. Long-term outcome, survival and predictors of mortality after MitraClip therapy: Results from the German Transcatheter Mitral Valve Interventions (TRAMI) registry. International Journal of Cardiology. 277, 35-41 (2019).
- Glower, D. D., et al. Percutaneous mitral valve repair for mitral regurgitation in high-risk patients: results of the EVEREST II study. Journal of the American College of Cardiology. 64 (2), 172-181 (2014).
- Baumgartner, H., et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 38 (36), 2739-2791 (2017).
- Obadia, J. F., et al. MITRA-FR Investigators. Percutaneous Repair or Medical Treatment for Secondary Mitral Regurgitation. New England Journal of Medicine. 379 (24), 2297-2306 (2018).
- Stone, G. W., et al. COAPT Investigators. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. New England Journal of Medicine. 379 (24), 2307-2318 (2018).
- Vahanian, A., et al. Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC); European Association for Cardio-Thoracic Surgery (EACTS), Guidelines on the management of valvular heart disease (version 2012). European Heart Journal. 33 (19), 2451-2496 (2012).
- American College of Cardiology/American Heart Association Task Force on Practice Guidelines; Society of Cardiovascular Anesthesiologists; Society for Cardiovascular Angiography and Interventions. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 114 (5), 84 (2006).
- Praz, F., et al. Compassionate use of the PASCAL transcatheter mitral valve repair system for patients with severe mitral regurgitation: a multicentre, prospective, observational, first-in-man study. Lancet. 390 (10096), 773-780 (2017).
- McCarthy, K. P., Ring, L., Rana, B. S. Anatomy of the mitral valve: understanding the mitral valve complex in mitral regurgitation. European Journal of Echocardiography. 11 (10), 3-9 (2010).
- Zoghbi, W. A., et al. Recommendations for Noninvasive Evaluation of Native Valvular Regurgitation: A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Magnetic Resonance. Journal of the American Society of Echocardiography. 30 (4), 303-371 (2017).
- Zoghbi, W. A., et al. Guidelines for the Evaluation of Valvular Regurgitation Percutaneous Valve Repair or Replacement: A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Angiography and Interventions, Japanese Society of Echocardiography, and Society for Cardiovascular Magnetic Resonance. Journal of the American Society of Echocardiography. 32 (4), 431-475 (2019).
- Abudiab, M. M., Chao, C. J., Liu, S., Naqvi, T. Z. Quantitation of valve regurgitation severity by three-dimensional vena contracta area is superior to flow convergence method of quantitation on transesophageal echocardiography. Echocardiography. 34 (7), 992-1001 (2017).
- Dietl, A., et al. 3D vena contracta area after MitraClip procedure: precise quantification of residual mitral regurgitation and identification of prognostic information. Cardiovasc Ultrasound. 16 (1), 1 (2018).
- Ikenaga, H., et al. Usefulness of Intraprocedural Pulmonary Venous Flow for Predicting Recurrent Mitral Regurgitation and Clinical Outcomes After Percutaneous Mitral Valve Repair With the MitraClip. JACC: Cardiovascular Interventions. 12 (2), 140-150 (2019).
- Tang, G. H. L., et al. Continuous invasive hemodynamic monitoring using steerable guide catheter to optimize mitraclip transcatheter mitral valve repair: A multicenter, proof-of-concept study. Journal of Interventional Cardiology. 31 (6), 907-915 (2018).
- Maor, E., et al. Acute Changes in Left Atrial Pressure After MitraClip Are Associated With Improvement in 6-Minute Walk Distance. Circulation: Cardiovascular Interventions. 10 (4), 004856 (2017).
- Kuwata, S., et al. Continuous Direct Left Atrial Pressure: Intraprocedural Measurement Predicts Clinical Response Following MitraClip Therapy. JACC: Cardiovascular Interventions. 12 (2), 127-136 (2019).
- Corrigan, F. E., et al. Pulmonary Venous Waveforms Predict Rehospitalization and Mortality After Percutaneous Mitral Valve Repair. JACC Cardiovasc Imaging. 12 (10), 1905-1913 (2019).
- Ruf, T. F., et al. ELMSTREET (Esophageal Lesions during MitraClip uSing TRansEsophageal Echocardiography Trial. EuroIntervention. 13 (12), 1444-1451 (2017).
- Eggebrecht, H., et al. Risk and outcomes of complications during and after MitraClip implantation: Experience in 828 patients from the German TRAnscatheter mitral valve interventions (TRAMI) registry. Catheterization and Cardiovascular Interventions. 86 (4), 728-735 (2015).
- von Bardeleben, R. S., et al. Incidence and in-hospital safety outcomes of patients undergoing percutaneous mitral valve edge-to-edge repair using MitraClip: five-year German national patient sample including 13,575 implants. EuroIntervention. 14 (17), 1725-1732 (2019).
- Généreux, P., et al. Incidence, predictors, and prognostic impact of late bleeding complications after transcatheter aortic valve replacement. Journal of the American College of Cardiology. 64 (24), 2605-2615 (2014).
- Benito-González, T., Estévez-Loureiro, R., Gualis, J. Chordal Rupture Following MitraClip Implantation Resulting in Massive Mitral Regurgitation. Journal of Invasive Cardiology. 27 (10), 224-225 (2015).
- Kaneko, H., Neuss, M., Weissenborn, J., Butter, C. Impact of residual mitral regurgitation after MitraClip implantation. International Journal of Cardiology. 227, 813-819 (2017).
- Buzzatti, N., et al. What is a "good" result after transcatheter mitral repair? Impact of 2+ residual mitral regurgitation. Journal of Thoracic and Cardiovascular Surgery. 151 (1), 88-96 (2016).
- Feldman, T., Guerrero, M. Assessing the Balance Between Less Mitral Regurgitation and More Residual Transmitral Pressure Gradient After MitraClip. JACC: Cardiovascular Interventions. 10 (9), 940-941 (2017).
- Neuss, M., et al. Elevated Mitral Valve Pressure Gradient After MitraClip Implantation Deteriorates Long-Term Outcome in Patients With Severe Mitral Regurgitation and Severe Failure. JACC: Cardiovascular Interventions. 10 (9), 931-939 (2017).
- Katz, W. E., Conrad Smith, A. J., Crock, F. W., Cavalcante, J. L. Echocardiographic evaluation and guidance for MitraClip procedure. Cardiovascular Diagnosis and Therapy. 7 (6), 616-632 (2017).
- Labrousse, L., et al. Guidance of the MitraClip procedure by 2D and 3D imaging. Archives of Cardiovascular Diseases. 111 (6-7), 432-440 (2018).
- Khalique, O. K., Hahn, R. T. Percutaneous Mitral Valve Repair: Multi-Modality Cardiac Imaging for Patient Selection and Intra-Procedural Guidance. Frontiers in Cardiovascular Medicine. 6, 142 (2019).
- Bushari, L. I., et al. Percutaneous Transcatheter Edge-to-Edge MitraClip Technique: A Practical "Step-by-Step" 3-Dimensional Transesophageal Echocardiography Guide. Mayo Clinic Proceedings. 94 (1), 89-102 (2019).
- Sherif, M. A., et al. MitraClip step by step; how to simplify the procedure. Netherlands Heart Journal. 25 (2), 125 (2017).
- Guarracino, F., et al. Transesophageal echocardiography during MitraClip procedure. Anesthesia & Analgesia. 118 (6), 1188-1196 (2014).
- Avenatti, E., et al. Diagnostic Value of 3-Dimensional Vena Contracta Area for the Quantification of Residual Mitral Regurgitation After MitraClip Procedure. JACC: Cardiovascular Interventions. 12 (6), 582-591 (2019).
- Altiok, E., et al. Analysis of procedural effects of percutaneous edge-to-edge mitral valve repair by 2D and 3D echocardiography. Circulation: Cardiovascular Imaging. 5 (6), 748-755 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon