Method Article
単粒子クライオ電子顕微鏡:試料から構造まで
要約
cryoEMを用いた高分子複合体の構造決定は、ある種のタンパク質や複合体に対して日常的なものとなっている。ここでは、このパイプラインが要約され(サンプルの準備、スクリーニング、データの取得と処理)、読者は、より困難な標本の場合に変更される可能性があり、さらに詳細なリソースと変数に向けられています。
要約
クライオ電子顕微鏡(cryoEM)は、単一粒子分析(SPA)を介して高分子複合体の構造決定のための強力な技術です。全体的なプロセスは、i)cryoEMグリッドでサポートされている薄膜の標本を活性化することを含む。ii) 粒子分布と氷の品質を評価するために標本をスクリーニング;iii) グリッドが適切な場合は、分析用に単一のパーティクル データセットを収集します。とiv)画像処理は、EM密度マップを生成します。このプロトコルでは、これらの各手順の概要を示し、ワークフロー中にユーザーが変更できる変数と一般的な問題のトラブルシューティングを重点的に説明します。多くの施設で遠隔顕微鏡操作が標準となると、顕微鏡への物理的アクセスが制限される場合に、効率的な操作およびイメージングにおいてユーザを支援するイメージングプロトコルのバリエーションについて説明する。
概要
単粒子クライオエム
分子レベルで生命を調べるには、構造を理解する必要があります。NMR、X線結晶学、質量分析、電子顕微鏡(EM)など、タンパク質構造をプローブする多くの技術が利用可能です。現在までに、タンパク質データバンク(PDB)に堆積した構造の大部分は、X線結晶学を用いて解決されてきました。しかし、2012年から、クライオ電子顕微鏡(cryoEM)はタンパク質構造決定の主流の技術となり、その使用が劇的に増加しました。電子顕微鏡データバンク(EMDB)に堆積したEMマップの総数(2020年12月現在)は、2012年の1,566台に対して13,421台でした(図1、www.ebi.co.uk)。2012年には、PDBに堆積したクライオEM密度マップでモデル化された原子座標の数はわずか67でしたが、2020年12月現在、これまでに2,309の構造物が堆積し、35倍に増加しました。「分解能革命」と呼ばれる「分解革命」とも呼ばれるクライオEM密度マップの質と量のこの根本的な成長は、複数の分野での進歩の合体によって引き起こされた:直接電子検出器として知られているイメージングのための新しいカメラの開発。新しいソフトウェア。そしてより安定した顕微鏡2、3、4。
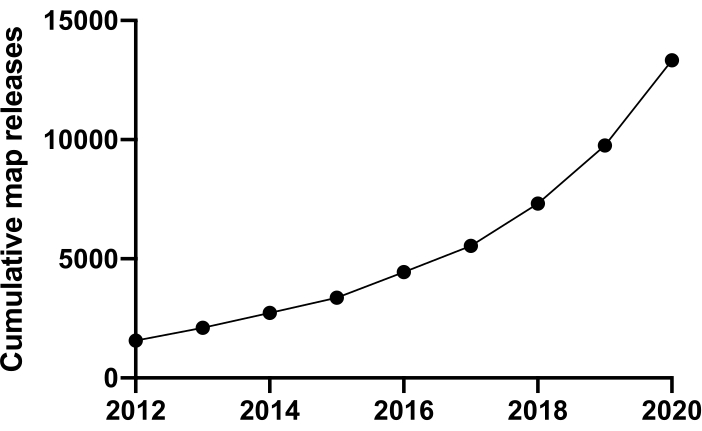
図1:2012年から2020年12月までのEMDBへの累積提出。
単一粒子分析(SPA)は、ウイルス7,8、膜タンパク質9,10、ヘリカルアセンブリ11および他の動的および異種の高分子複合体12,13を含む単離された複合体の高解像度構造を解明することによって、多種多様なサンプルタイプの生物学的洞察を生成する強力なツールです。14,15から数十メガダルトン)。ここでは、サンプルから構造までのクライオエム SPA の標準パイプラインのプロトコルについて説明します。
このパイプラインに着手する前に、精製されたサンプルは、下流の成功の可能性を評価するために生化学的分析を受ける必要があります。適切なサンプルの調製は、特に一過性および異種(組成および立体構造の両方)複合体に対するSPAにとって最も大きな障壁である。高分子複合体製剤は、各クライオEM顕微鏡写真で多くの粒子を得るのに十分な濃度で、かつcryoEM分析に適した緩衝組成物において、できるだけ少ない汚染物質を含むべきである。特定の緩衝成分は、スクロース、グリセロールおよび高い(サンプルサイズ、特性および他の緩衝剤の構成物に応じて、塩の350mM濃度を>する)、ガラス化のプロセスを妨げるか、または画像の信号対雑音比を減少させ、構造決定を妨げる。
一般的に、サイズ排除クロマトグラフィー(SEC)およびSDS-PAGEゲル分析は、サンプル純度17,18を評価するために使用されるべきであるが、循環二色化、機能的アッセイ、SECとマルチアングル光散乱、および熱安定性アッセイは、クライオエム分析前の高分子複合体製剤の質的分析に有用なツールである。しかし、これらの生化学的分析の結果は、サンプルの構造不均一性とcryoEMグリッド上でのその挙動に関する洞察をほとんど得ない。このため、負の汚れEMは、組成および立体構造の異質性を評価するための迅速で安価で強力なツールとして日常的に使用され、精製からどの溶出分が最も有望であるか、または異なる緩衝組成物をスクリーニングする良い方法である19,20。有望なサンプルが特定されたら、SPA cryoEM パイプラインに進むことができます。負の染色は、cryoEMに見られるその後の結果と必ずしも一致するとは限りません。時々サンプルは陰性の汚れによって貧弱に見えるが、cryoEMの中の膜炎で見ると改善する。対照的に、陰性染色ステップ中にサンプルが優れている場合がありますが、cryoEMに進行する際に大幅な最適化が必要になることがあります。しかし、ほとんどの場合、負の汚れは有用な品質管理ステップを提供する。
ガラス
電子顕微鏡の真空システム内の過酷な環境は、未固定の生物学的標本21に脱水と放射線損傷の両方を引き起こす。したがって、サンプルをネイティブのような状態で画像化するには、生物学的標本をイメージング前に保存する必要があります。高分子複合体の精製製剤の場合、ガラス化は、複合体の原子の細部を維持しながら、cryoEMによってその可視化を可能にする選択の方法です。試料調製方法としてのガラス化の発見は、2017年のノーベル化学賞でデュボシェが認められた生物学的標本の電子顕微鏡の根本的な進歩であった。サンプルガラス化は、目的の標本を含む溶液の薄い層を作成することを含みます, 典型的には数十 nm厚, cryoEMグリッド支持体に懸濁.次いで、薄膜は、~175°Cの液体エタン等の凍結剤で極めて速やかに凍結する。 凍結率は、〜106 °C/sであり、アモルファス、または硝子体の氷が形成されるほど速く、薄い固体膜22内に試料を懸濁させる。
考慮すべき最初の変数は、cryoEM グリッドサポート選択23です。EM グリッドは、通常、支持構造上の(規則的または不規則な)穿膜を有するアモルファス炭素膜から成り立つ。支持構造は、典型的には直径3.05mmの円形の金属格子であり、通常は銅からなされるが、金、又はモリブデン(好ましい熱膨張特性を有する24)のような他の金属が使用され得る。時には、グラフェン、酸化グラフェン、または薄い(〜1〜2 nm)アモルファス炭素層などのグリッド全体に追加の薄い連続支持が適用されることもあります。標準的なcryoEMグリッド(最も一般的には400-200メッシュ銅、穿孔された(1.2 μmの丸い穴は1.3 μm(r1.2/1.3)、または2 μmの炭素(r2/2)で区切られた)カーボン支持が、現在までに報告された多くの異なるパターンが利用可能であるが、カーボンサポートが使用されているが、現在までに報告された構造の大半では、大部分の異なるパターンが使用されているが、現在までに報告されている構造の大半では、炭素サポートが可能である。 導電性の向上と試料の動きの減少を伴う新しいグリッド技術が報告されている25.選択されたグリッドは、それらが親水性をレンダリングし、サンプルアプリケーション26に適したレンダリングするために、グロー放電/プラズマ洗浄処理を受けます。
グロー放電後、次の段階は薄膜形成です。この薄膜は、グリッドから余分な液体を除去するために濾紙を使用して最も一般的に形成される。これは手動で行うことができますが、Vitrobot Mk IV(サーモフィッシャーサイエンティフィック)、EM GP II(ライカ)、CP3(ガタン)など、数多くのプランジ冷凍装置が市販されています。これらのデバイスでは、溶液中のサンプルの3〜5μLがEMグリッドに塗布され、その後、フィルターペーパーを使用して過剰な溶液を消す。グリッドは、薄膜を横切って懸濁し、液体窒素(LN2)で冷却したエタンを~-175°Cにして液体エタンに突き落とす。 凍結すると、グリッドは、撮像の前およびイメージング中に、デシブポイント(-137°C)より低い温度で維持されます。
検体スクリーニングとデータ収集
クライオEMグリッドのガラス化後、次の段階は、グリッドをスクリーニングしてその品質を評価し、グリッドが高解像度データ収集に進むのに適しているかどうかを判断することです。理想的なcryoEMグリッドは、氷の厚さが標本の最も長い次元を収容するのに十分な氷の厚さ(結晶性氷とは対照的)を有し、周囲の氷が得られる画像にできるだけ少ないノイズを与えることを保証する。氷の中の粒子は、生化学と一致する大きさと(既知の場合)形状を有し、理想的には粒子配向のランダムな分布を有する単分散であるべきである。最後に、グリッドには、必要なデータ収集の長さを満たす十分な品質の領域が必要です。試料によっては、最適なグリッドが生成されるまで、ガラス化とスクリーニングの多くの反復が必要な場合があります。幸いにも残念にも、クライオEMグリッド上の粒子分布を変化させるために経験的にテストできる膨大な範囲の変数があります(16,27でレビュー)。本原稿では、膜蛋白質プロジェクト10の代表結果が示されている。
適切なグリッドが特定されると、データ収集を続行できます。生物標本用のクライオ透過型電子顕微鏡のモデルは、高解像度データを自動で収集するために最適化されています。通常、データは 300 kV または 200 kV システムで収集されます。自動データ収集は、EPU(サーモフィッシャーサイエンティフィック)28、レギノン29、JADAS30、SerialEM31,32などのソフトウェアを使用して実現できます。最新の検出器を使用した自動データ収集では、通常、24 時間の期間で生データのテラバイト (TB) が得られます (平均データセットのサイズは 4 TB です)。
COVID-19は世界の大部分で制限されているため(2020年12月の執筆時点)、多くの顕微鏡検査施設がリモートアクセスの提供に移行しました。グリッドが顕微鏡のオートローダーにロードされると、データ収集はリモートで行うことができます。
画像処理とモデル構築
データ収集セッションが通常 0.5 ~ 4 日の場合、コンピューティング リソースの可用性によっては、その後の画像処理に数週間から数か月かかる場合があります。初期画像処理ステップ、すなわち動き補正とコントラスト伝達関数(CTF)の推定は「オンザフライ」33,34で行われるのが標準です。ダウンストリーム処理では、多数のソフトウェア スイートが用意されています。粒子は「摘出」され、顕微鏡写真35,36から抽出される。パーティクルが抽出されると、標準プロトコルは、複数の分類ラウンド(2 次元(2D)と 3 次元(3D)の両方)を通してパーティクルを処理し、特定の領域に焦点を当てて、均質なサブセットのパーティクルに到達することです。この均質な粒子のサブセットを一緒に平均化して、3D再構成を行います。この時点でデータは、CTFの洗練、歪み補正37、ベイジアン研磨38など、可能な限り最高品質の地図を生成するためにさらに補正されることが多い。この画像処理の結果は、目的の生物学的標本の3Dクライオエムマップである。300kVの顕微鏡システムで収集されたデータは、タンパク質複合体のサイズと柔軟性に応じて通常10Åと2 Åの間である、十分な品質のグリッドから「標準」の自動単一粒子実験で到達した解像度範囲。理想的な標本によって、SPAワークフロー5を使用して、〜1.2 Åの解像度に達しました。このプロトコルはEM密度マップの取得に向けたステップを詳述していますが、これが手元に入ると、タンパク質モデルのフィッティングと精製(分解能が3.5Å<場合)またはde novo39構築によってさらに解釈できます。構造決定実験に関連するデータは、EM密度マップ(電子顕微鏡データバンク)40、結果として生じる原子座標(タンパク質データバンク)41および生データセット(電子顕微鏡パブリック画像アーカイブ)42を含むオンラインの公共リポジトリに堆積することができる。
このプロトコルでは、 ポルフィロモラス歯肉から 外膜タンパク質複合体RagAB(〜340kDa)が、高分子複合体10 (EMPIAR-10543)の例として用いられる。cryoEM が新たに追加された場合、iNEXT Discovery や指示などの資金を提供されたアクセス スキームを通じて、サンプルから構造までこのパイプラインを通じたサンプルのサポートが利用可能になり、ピアレビューが行われます。
プロトコル
1. グリッドガラス化
注: ステップ 1 および 2 のすべてのステップについて、すべての工具がクリーンで乾燥しており、室温で LN2 温度に冷却し、デカンドが新たに LN2 を 使用して氷の汚染を減らしていることを確認してください。可能であれば、20%の相対湿度を<湿度制御された環境内で作業します。作業を開始する前に、適切な個人用保護具とH&Sドキュメントが設置されていることを確認してください。
- 目的の標本がサンプル調製の準備ができていることを確認します。
- 適切なクライオEMグリッドを選択し、これらはグロー放電またはプラズマ処理を使用して親水性をレンダリングされていることを確認してください。プロトコルに対する多種多様なシステムとバリエーションが利用可能ですが、グリッドをグロー放電/プラズマクリーニングシステムに配置し、特定のガス混合物/化学蒸気または空気をシステムに導入する前に、チャンバーを所望の真空レベルにポンプで送るプログラムを実行する必要があります。電流がシステムを通過し、ガス粒子を電離し、グリッドの表面をより親水性にレンダリングするように誘導します。
- 背面の電源スイッチを使用してシステムをオンにしてグリッドガラス化用のプランジ凍結装置を起動し、タッチスクリーンがロードされるまで待ちます。
- 提供されたスタイラスまたは指を使用して、 コンソールで、チャンバーの所望の作業温度を設定する(利用可能な範囲は4〜60°Cであり、ほとんどの高分子4〜6°Cに推奨される)。
- 加湿器の底にあるゴムチューブを介して、注射器を使用して50mLのIIラボ水で加湿器を充填します。充填前にシリンジに閉じ込められた空気を取り除くことを確認してください。加湿器や水が部屋に出て出て行き過ぎないように注意してください。加湿器を充填したら、5~10mLずつシリンジプランジャーを引き戻し、真空シールを作成します。
- コンソールでは、チャンバーに所望の相対湿度を設定します(利用可能な範囲は0〜100%、湿度95〜100%が一般的に使用されます)。チャンバーが濡れすぎないように、グリッド作成の直前まで湿度を「オフ」に設定します。
- プランジ冷凍装置のピンセットを取得し、パッドに収まる適切なサイズにカットされたフィルターペーパーを購入するか、スタンプを使用して適切なサイズの絞りをカットします。
- 凍結凍結のための凍結を準備します。
- 金属クライオグリッドボックスホルダー、クライオゲンカップ、金属クモの脚をクーラント容器に入れます。
- 外側のチャンバーをLN2で満たして容器を冷やします。外側のチャンバーを上に置いて、クライオグリッドボックスホルダーの上部を覆います。〜1cmの追加のLN2 をクライオゲンカップに加え、LN2 温度へのシステムの平衡化を支援します。
注:アンチコンタミネーションリングは、クライオゲンカップの周りに凝縮し、クライオクーラント/エタン汚染につながる湿度の高い空気を制限するために使用することができます。これは、一般的に湿度制御環境では必要ありません。汚染防止リングを使用する場合は、容器にLN2 をオーバーフィルしないように注意するか、後で容器にリングを押し込む際にこぼれる可能性があります。 - 3~5分待ってクモの脚の沸騰を観察し、さらに3分待って、ガラス化培地を凝縮するためにクライオゲンカップが十分に冷たくなるようにします。
- クライオゲン(液体エタン)をクライオゲンカップに液化します。
- エタンシリンダーパイプに細いチューブとノズルを取り、ガスを分配します。カミソリの刃を使用して非常に先端を切り落とすことによって開いた開口部を持つP200ピペットの先端は、ここで理想的です。先端でエタンが固まり、ガスの流れを遮断するのを防ぐためには、より広い開口部が必要です。
- クライオゲンカップに残りのLN2が含まれていないことを確認し、エタンガスノズルを取り、クライオゲンカップ内に置きます。ガスボンベレギュレータを使用して、低流れを開始し、凍結原カップに凍結原ガスを分配してガスを凝縮させます。ガスが流れる先端をクライオゲンカップの壁に直接押し付けておきますが、表面に対してタッピング動作でゆっくりと前後に動かします。ガスの流れを調節して、低く安定した流れがクライオゲンカップ内で制御された方法で凝縮/リキフィーを開始できるようにします。
- カップを銀色のスパイダーリムのすぐ下に充填し、ガスの流れを止め、ガスラインを慎重に取り除き、周囲のLN2 をエタンで汚染しないように注意深く取り除いてください。
- 液状エタンにこぼれないように十分に注意して、LN2で冷却剤容器を上に上げろ。
- 液体エタンが十分に冷たい温度に平衡化されるように、〜3〜5分間の位置にクモの足を残します。クライオゲンは曇り/少し不透明に見え始めます。これは、その氷点に近いということを示します。この段階では、スパイダーを取り除くためにピンセットを使用します。LN2がクライオゲンカップを取り囲む容器内に保管されている限り、エタンは液化したままで、1-2時間のガラス化に適しています。しかし、氷の汚染を減らすために、特に非湿度制御室で、可能な限り迅速に手順を完了することを目指してください。
注:クモが「上に立ち往生している」ように見える場合は、ナットなどの金属オブジェクトを使用し、クモの足に保持して少しウォームアップし、脚を取り外します。
- サンプルガラス化用のプランジ凍結装置と付属品を準備します。
- 金属クライオグリッドボックスホルダーにグリッドストレージボックスを追加し、手順全体を通して、LN2 がグリッドボックスのレベルのすぐ上まで(通常は5分毎に)上に保たれていることを確認します。
- プランジ凍結デバイス画面では、[ プロセスパラメータ] ボックスに、ブロット時間(プランジ凍結デバイスパッドが一緒になる時間)、力(氷の形成の勾配を変えるグリッドからのブロッティングパッドの距離)、合計(ブロッティングパッドが満たすために入ってくる回数)を含む選択されたパラメータを入力します。個々のプランジ凍結装置と高分子の挙動に基づいて、これらのパラメータを選択します。典型的な値は、0から5の間のブロット力、1-6 sからのブロット時間、およびブロット合計1です。典型的な待ち時間(ブロットを開始してから、ブロット開始までの時間)とドレイン時間(突っ込む前のブロット後の時間)は0-2sです。
注:ユーザーの好みに応じて、 オプション の追加オプション、各プレスで次のステップに移動するために 足のペダルを使用する 、 グリッド転送をスキップ (トゥイザーアームがわずかに上げられた最後のステップをスキップ)、 プロセス中に湿度をオフ にする(サンプルが適用されている間、グリッドを見にくくすることができるチャンバーのアクティブな加湿を停止する)、 およびオートレイズEthanelifte (チャンバーに上げられてクーラント容器を上げるピンセットのステップを組み合わせる - エタンコンテナステップを上げます)。 ここでは、これらのオプションがすべてオンになっています。 - 冷却剤容器をチャンバーの下の移動プラットフォームアームにしっかりと置く
- 新鮮なブロッティングペーパーを各ブロッターアームに挿入し、プラスチック製のリングクリップが固定されていることを確認します。各フィルターペーパーは16のブロット(腕回転ブロッティング紙)を可能にします。[コントロール] セクションの [ブロット用紙のリセット] ボタンを押します。
- プランジ凍結装置ガラス化プロセスの1サイクルを実行して、各可動部分が期待どおりに動作していることを確認します。
- 押す (またはフットペダルを使用して) 新しいグリッドを配置し、 プロセスを開始し、次に 処理 してから 続行します。この段階では、ブロッティングアームが期待どおりに互いに接触していることを確認するために見てください。
- 加湿器を「オンにする」。水蒸気が生成されます(設定された湿度が現在のチャンバーよりも高い限り)。
- 関心のある標本をガラス化できるようになりました。フットペダルまたは プレイスニューグリッド を使用すると、突っ込んだロッドがチャンバーの外に降りると、ピンセットがマウントに取り付けられます。
- プランジ凍結装置ピンセットを使用して、望ましいグロー排出/プラズマ洗浄cryoEMグリッドをピックアップし、グリッドメーカーに応じてサンプルアプリケーションに使用する正しい側に注意してください。これはサポートを損傷するので、ピンセットとの過度/不必要な接触を避けるために注意して、リムでグリッドをピックアップ。ピンセットの隆起部分に黒いクリップを下に移動して、ピンセットのグリッドを固定します。グリッドはしっかりと保持する必要がありますが、クリップはブロッティングパッドに接触するため、あまり下に置かないようにしてください。
- クライオEMグリッドを保持するプランジ冷凍装置のピンセットを、あなたの支配的な手に向けた正しい側面を持つ空気圧アームに置きます。プランジ凍結装置ピンセットおよびチャンバーの設計は、サンプルがユーザーの手渡しに応じてチャンバーの右側または左側のいずれかを通して適用することができるようにである。
注: 同じブロッティング パラメータを持つ異なる側面にサンプルを適用しても、同等の結果が得られることはほとんどないので、左利きの研究者は右利きの同僚とは独立してブロッティングパラメータを調整する必要があります。 - スタートプロセスを押すとピンセットに保持されているグリッドはチャンバーに取り込まれ、クーラント容器が上がります。
- プレス 処理 とピンセットは、ピペットを使用して、グリッドに標本を適用できる位置にグリッドを移動します。グリッドの正しい側に面した側ポートを開き、ピペットチップがグリッドのサポート/ベンドグリッドの損傷につながる可能性があるため、ピペットチップがグリッドに触れないようにしてサンプルを適用しますが、液滴がグリッドに分配されるように液体を十分に近づけます。通常、3~5 μL が適用されます。
- [続行]を押すと、ユーザーが事前定義したパラメータを使用すると、グリッドがブロットされ、サンプルガラス化のためにクーラントカップに取り付けられたピンセットが突き出ます。ピンセットは、クーラント容器とクーラントを保持する腕と一緒に降下し、グリッドをクライオゲンに沈めておきます。
- 凍結原カップからLN2に沈められたグリッド収納ボックスにグリッドを転送します。
- ピンセットアームからピンセットを外し、クライオゲンカップの側面にガラス状のグリッドに接触しないように細心の注意を払います。ピンセットが快適に保持されるようにグリップを調整します。できるだけ迅速かつ慎重に、グリッドをクライオゲンから LN2 に移動します。片手で、ピンセットを指で閉じ、もう一方の手で黒いクリップを上方にスライドさせ、ピンセットを閉じます。グリップを取り込み、グリッドをグリッドストレージボックスに操作します。
- すべてのグリッドが作成されるまで、手順 1.10 ~ 1.19 を繰り返します(一般的なセッションでは 4 ~ 12 のグリッドを作成します)。次の段階まで LN2 デュワーでグリッドを含むすべてのグリッドストレージボックスを保管します。
オートローダー顕微鏡にローディングするためのクリッピンググリッド
- 前述の プロトコル 28 に従ってグリッドをオートグリッドアセンブリにクリップします。
3. リモートログを顕微鏡に安全に
注意:執筆時点でCOVID-19コントロールを使用するが、国際旅行に関連する環境問題にも伴い、より多くの顕微鏡検査施設がユーザーがリモートで操作するサービスを提供しています。この実装方法は、各施設のローカル IT 構成と、その内部および外部ユーザー コミュニティのニーズによって異なります。ここでは、eBICでクライオエームにリモートアクセスし、EPUソフトウェアを介して顕微鏡を制御するプロセスについて説明します。
- リモートでcryoEMのにログインします。リモート ログオンは、顕微鏡サポート PC にアクセスするために NoMachine ソフトウェアを介して仲介され、ユーザーの FedID ログオン資格情報を介して訪問に登録されたユーザーにのみアクセスできるように構成されています。アクセスは、セッションの間だけアクティブなままです。
- NoMachine を開き、パスワード認証を使用して nx-cloud.diamond.ac.uk する新しい NX 接続を開始します。
- 接続を開き、ユーザー名 fedid@fed.cclrc.ac.uk および FedID パスワードでログインします。利用可能なオプションから関連する顕微鏡に対応するアイコンをダブルクリックして、関連するサポートPCへの接続を開きます。
- Windows ログオン画面でユーザー名 clrc\FedID とパスワードを入力します。
- デスクトップアイコンからTeamViewerソフトウェアを開き、指定されたパスワードでパートナーID:TEMに接続します。これにより、サポート PC から TEM PC への接続が確立されます。TeamViewer リボンの [次のモニター ] ボタンを使用して、顕微鏡のユーザー インターフェイスと EPU ウィンドウを切り替えることができます。
- 顕微鏡機能は、EPUインターフェイスを介して直接ユーザーによって制御することができます。
4. オートローダー顕微鏡へのサンプルのロードと氷とサンプルの品質のスクリーニング
注:このセクションでは、オートローダーとEPUソフトウェアを搭載した顕微鏡をサンプルスクリーニングに使用しますが、これは他のソフトウェアと他のメーカーのサイドエントリーシステムとクライオOEMを使用して実現できます。
- 切り取ったグリッドを、前述のとおりに顕微鏡オートローダーにロードします28。
- 顕微鏡のユーザーインターフェイスの自動ローダータブで、矢印を使用して オプション ダイアログをタブアウトし、 インベントリ ボタンを押します。これにより、カセット内の各位置を順次チェックして、カートリッジが存在するかどうかを確認します。占有スロットは青色で表示されます。すべての占有スロットがマップされている場合は、 インベントリボタンを もう一度押して現在の位置の後に停止し、それ以外の場合は、すべての占有スロットがマップされるまで実行したままにします。表示されたボックスに、すべての占有スロットにサンプルの詳細をラベル付けします。
- マイクロスコープ列に転送するグリッドをハイライト表示し、[ 荷重]をクリックします。グリッドがステージに正常にロードされると、スロットラベルは青から黄色に変わります。グリッドのスクリーニングに進みます。
- EPUソフトウェアを開きます。[ 準備] ページで、[ 取得用の光学と設定 ] を選択し、ドロップダウン メニューから [アトラス ] プリセットを選択します。適切なビーム設定プリセット(例えば、64x名目マグ、スポットサイズ5、マイクロプローブ、ファルコン検出器の平行範囲の照光領域を使用して、ビーム設定プリセットを選択する詳細については、28を参照してください) [Set] を押して、パラメータを顕微鏡に押し込みます。
- [列バルブを開く] を押して、FluScreen を挿入します。ビームが見え、検出器を覆うために十分に広がり、中央に配置されていることを確認します。必要に応じて、ジョイスティックまたはステージメニューを使用してグリッドのより薄い領域にナビゲートし、X と Y のステージの動きを制御します。
- FluScreen を持ち上げて、EPU の プレビュー ボタンを使用して画像を撮ります。取得した画像に基づいて、より低い数のスポットサイズに移動することによって線量を増加させることができ、その逆もまた同様である。
- EPU で、アトラスページに移動し、新しいセッションを押します。MRC 画像形式を選択し、スクリーニングセッションを保存するための適切なフォルダ名と場所を入力し、[適用]をクリックします。
- 左側のメニューから[ スクリーニング ]を選択します。各グリッドの横にあるチェックボックスをオンにすると、アトラスモンタージュが取得されます。EPUでスクリーニングセッションを 開始 します。アトラスは、チェックされたグリッドごとに取得され、完了時に利用可能なグリッドの正方形が多数表示されます。各アトラスは、スクリーニングページでそれを強調表示することによって見ることができ、同様の予測氷の厚さを色でグループ化したグリッド正方形を示すマークアップが完成します。
- 完了したら、収集されたアトラスを確認し、より高い倍率(すなわち、厚い氷によって乾燥も隠れもされていないグリッド四角形の適切な数を持つもの)でサンプル品質を評価するのに適したグリッドを特定します。EPU スクリーニング メニューで選択したグリッドをハイライト表示し、[ サンプルの読み込み] をクリックします。
- 梁設定プリセット(各ステージで必要なビーム設定プリセットの説明については 28)とプレビュー機能を使用して、目的のグリッドの正方形をより詳細に確認します。
- アトラスのスクリーニングメニューから、現在ロードされているグリッドを選択し、グリッドイメージ上の目的の位置を右クリックしてグリッド四角形に移動を選択して、塗りつぶし穴を含むグリッド正方形にステージを移動します。
- EPU、準備ページに戻り、グリッドスクエアプリセットを選択します。
- EPU、自動機能ページを開き、GridSquareプリセットを使用してステージ傾斜による自動ユーセントリックを実行して、サンプルをユーセント高に移動します。
注:ビームチルトによる自動ユーセントリックも利用可能で、ステージチルトによる自動ユーセントリックよりも高速ですが、通常は精度が低くなります。 - EPU で、準備、新しいグリッドスクエア プレビューイメージを取ります。異なる穴の間で異なるグレーの値が異なって、異なる氷の厚さを示していることに注意してください。右クリックで右クリックして、ステージを穴の上に移動>ステージを移動します。穴/ユーセント高さのプリセットとプレビューを選択します。
注: 目的の粒子の分子量と形状によっては、穴/ユーセント高さの倍率で識別できる場合があります。 - [データ収集]プリセットを選択し、パーティクルを簡単に識別できる倍率を設定します(一般的に<2 Å/ピクセルのオブジェクトサンプリングに対応)。露光電子線量が〜40-80 e/Å2の場合は、脱焦点オフセットを~-3~-5 μmに設定します。
- 4.4のステップを反復処理して、グリッド全体の粒子分布、配向、汚染に対する氷の厚さの範囲を評価します。パーティクルの分布は、穴の中心と対するエッジの近くで変化する可能性があるため、穴を使用して異なる位置を調査することが重要です。
- 十分なグリッドの正方形を持っているようにアトラスからの約束を示すすべてのグリッドをスクリーニングします。これらを顕微鏡に保管してEPUを使用してデータ収集に進むか、サンプルを顕微鏡からアンロードし、データ収集がスケジュールされるまでLN2 の下に保管します。
5. 単一粒子クライオEMデータ収集(遠隔操作に焦点を当てた)
注: EPU を使用したデータ収集の詳細なプロトコルについては、製造元マニュアルおよび他社 28 に記載されています。ここでは、リモート操作(すなわち、作業を行うためのハンドパネルの使用を減らし、ソフトウェアベースの代替手段を使用する)のこのプロトコルの変更が強調されています。
- セッション中に収集済みの場合を除き、グリッドのアトラスを収集します。
- プロジェクトの実験ニーズに応じて、ビーム設定のプリセットをそれぞれ定義します。
- 画像シフトキャリブレーションを実行します28。
- EPU セッションをセットアップします。
- EPU で、[EPU] ページの [セッションのセットアップ] を選択し、環境設定から [新しいセッション] を選択し、[新規] を選択します。
- 以前の設定を使用するオプションを提供するポップアップが表示される [新しいセッション ] を選択します。 はい 、現在のEPUセッションに、以前のEPU(すなわち、検体キャリア、焦点解除範囲、自動焦点設定、グリッドタイプ)からの設定を自動的にロードします。 環境設定から「新規」を選択すると、ユーザーは保存された環境設定(フォーカス解除範囲、自動フォーカス設定、グリッドタイプ)を持つファイルを選択でき、この情報はEPUにプリロードされます。
- セッション名に有益な情報を入力します。ローカルの施設は、命名規則を提案する場合があります。
- [ タイプ] で、[手動] を選択 します。
- 取得モードでは、正確な穴中心または高速取得を選択します。
- [イメージ形式] で、目的の形式を選択します。
- 適切な ストレージフォルダ を選択すると、EPUはセッション名のディレクトリを作成します。
- 使用しているグリッドタイプと穴間隔(Quantifoil 1.2/1.3など)に応じて適切な 検体キャリアを選択し、[ 適用]を押します。このプロトコルは、ホールの通常の配列のテンプレートを生成するためのプロセスを記述します
- 初期グリッドの正方形を選択し、取得テンプレートを設定します。
- [四角の選択] をクリックし、すべての四角形が緑色の場合は、左上の [すべて選択解除] をクリックします。
- タイルを開く (開いているタイル>右クリックします)。正方形を選択します(右クリック>追加し、[ステージ>グリッドの正方形に移動]を右クリックします)。
- 穴選択に移動し、自動ユーセントリックを押します。これが完了し、グリッドスクエアの画像が撮影されるまで待ちます。オートファンクションが失敗した場合、高さが大幅にオフになっている可能性があります。場合は、グリッドスクエア倍率でFluScreenを使用して手動で調整することができます。
- 穴のサイズを測定します。黄色の円を移動し、正しいサイズと間隔で穴の上に表示されるように調整します。
- [穴を探す]を押します。穴が正しく見つかったことを確認します。穴のサイズを変更し、再び穴を見つける場合。穴が正しく見つかるまで、この操作を繰り返します。一貫して失敗する場合は、グリッドの正方形の倍率で低い(明るい)スポットサイズに移動することを検討してください。
- 右側の フィルター氷品質 ヒストグラムを使用して、穴の選択を調整します。これは、厚い氷と薄い氷のある領域を除外するのに役立ちます。このセッションで選択したグリッドの四角形に対しては、このオプションが記憶されます。
- 上部にある[選択]メニューのツールを使用して、穴の 選択 を最適化します。たとえば、[ グリッド バーの近くの穴を削除] をクリックします。
- テンプレート定義に移動し、取得を押します。
- [ 検索して中心の穴] をクリックします。今度は、穴の周りに黄色い円を持つ穴の画像が表示されます。
注: 穴の見つけるのに苦労する場合は、目的の絞りを挿入します。それでも穴が見つからない場合は、穴/ユーセント高さプリセットの露出時間を長くするか、このプリセットのデフォーカスを増やすか、画像をビンに入れてみてください。大きな焦点の変更は、イメージ シフトの位置を変更可能性があります。 - ステージシフト後の遅延とイメージシフト後の遅延時間を1~5sに変更します。
- [最大イメージ シフト値(オプションが使用可能な場合)] が必要な場合にオンにします。収差フリーイメージシフトコレクションが使用されている場合、この値はEPU構成ファイルで定義され、それ以外の場合は5μmが標準値になります。
- [ 取得領域を追加]をクリックし、画像上の任意の場所をクリックします。取得領域を目的の位置(すなわち、穴の端)に移動して、集録領域がビームで二重に露出しないようにします(緑色の円の正方形は検出器領域を表し、緑の円はビーム直径です)。
- 右上に、焦点を解除する範囲を追加します。次に、他の取得エリアを追加します。膜タンパク質プロジェクトの典型的な焦点脱焦点リストは-0.8~-3 μmの焦点脱焦点です。
- [ オートフォーカス領域を追加 ]をクリックし、画像上の任意の場所をクリックします。オートフォーカス領域を穴を囲むカーボンに移動します。標準的な方法は、正方形全体のz高さの変動に応じて、AFISを使用する場合、または5〜15μmごとに中心を置いた後に自動焦点を合わせる方法です。
- 0.05 nm/sの設定されたしきい値を使用して、グリッドの正方形ごとに1回実行される ドリフト測定領域を追加をクリックします。ドリフト測定領域は、オートフォーカス領域と直接重なることができます(そして、それは良い考えです)。ドリフト領域とオートフォーカス領域が取得領域と重ならないようにします。
メモ: テンプレートの実行機能を使用して、テンプレートを確認できます。これは、取得領域が移動する必要があるかどうかを確認することをお勧めします(例えば、画像にカーボンが多すぎる/不十分な炭素)が必要ではありません。 - [四角選択] に戻り、グリッドで取得する正方形を選択します。取得エリアの数と予想データ取得率 (検出器と実験設定に基づく施設から) を使用して、必要な取得エリアの数を予測します。
- 必要な四角形をすべて選択したら、[ すべての正方形を準備]を押します。
- 各正方形が収集されたら、グリッドの正方形間を移動し、 選択ブラシを使用して穴を微調整します。
- 標本上のステージの位置に移動し、ユーセントリックな高さを設定するために自動機能を使用します。前述の28のように顕微鏡の位置合わせを行いますが、コマフリーアライメントを実行して客観的な乱視を手動で補正する代わりに、ソフトウェア内のアライメントツールを使用します。簡単に言えば、ビーム条件を取得し、客観的な開口(OA)が除去され、ステージがユーセントリックな高さで標本のビーム安定した領域の上に配置されていることを確認します。OAを再挿入して中央に配置し、EPUで対物レンズの乱視を補正する前に、オートファンクション内でコマフリーアライメントを行います。両方のアライメントが適切な値(<150 nmの昏睡状態で、ゼロの乱視に近い)に収束することを確認します。
- 自動取得を開始する前に、オートローダーターボポンプの電源がオフになっていることを確認し、目的の絞りを挿入します。
- 自動取得で、[開始] をクリックして自動データ取得を開始します。
6. EM密度マップを生成する画像処理
注:cryoEM施設の大半は、顕微鏡写真映画の「オンザフライ」の前処理を提供しています。RELIONパイプライン28,33、cryoSPARC43、Scipion34、WarpEM44など、さまざまなソフトウェアパッケージとアプローチが用意されています。RELION ベースのパイプラインはここで説明されており、ユーザーがマイクログラフ ムービーをコンピューティング リソースにアクセスできる適切なストレージの場所に移動したと想定しています。膜タンパク質プロジェクトのプロセスと代表的な結果の概要が提供され、詳細な説明とステップバイステップチュートリアルは、RELIONホームページで見つけることができます: https://www3.mrc-lmb.cam.ac.uk/relion。
- 顕微鏡写真の動き補正とCTF推定の「オンザフライ」分析を行います。プロジェクト ディレクトリ内で RELION を起動します。インポート、モーション補正、CTF推定ジョブをスケジュールして、データ収集と転送と並行してループします。顕微鏡写真解析スクリプト28は、乱視と推定デフォーカス値に関するリアルタイムの視覚的フィードバックを提供する(代表的な結果を参照)。
- 事前に処理された顕微鏡写真からパーティクルを選択します。選択する自動パーティクルピッキングソフトウェアパッケージの数があります。RELION37 の [自動ピッキング] タブでは、参照無料およびテンプレート ベースのピッキング オプションを使用できます。他のプログラムは、例えば粒子ピッキング35のためにcrYOLOを使用して、様々なステップに使用され得る。
- CTF補正された顕微鏡写真から粒子を抽出する。
注: 初期の「クリーンアップ」、処理ステップ、抽出時のパーティクルのダウンスケール/ビンに必要な計算時間を短縮します。抽出ジョブの実行方法の詳細については、RELION 3.1 チュートリアルを参照してください。このプロジェクトでは、パーティクルは最初は 2 倍のビンでビン分割されていました。 - 2D クラスの平均化を実行します。100 ~200 クラスに分類すると、≥ 100,000 個のパーティクルを含むほとんどのデータセットに適しています。サンプルに高い対称性(すなわち、二面体ウイルス)がない限り、データセットが小さい場合でも、200以上のクラスまたは50クラス未満を使用することは推奨されません。粒子の最も長い次元を収容するのに十分な大きさのマスク直径を設定しますが、隣接するパーティクルを除外するのに十分な十分な長さを設定します(これは試行錯誤を必要とする場合があります)。
- サブセット選択ジョブを使用して、優れたクラス(構造詳細を含むクラス)を選択します。良い 2D クラス平均と悪い 2D クラスの平均の例は、代表的な結果セクションにあります。
- RELION の 3D 初期モデル ジョブを使用して、データから初期モデル デノボ を生成します。
注: クリーンでないパーティクル スタックは、ジャンク/最適でないパーティクルをふるいにかけることができる追加の機会を提供するため、多参照 ab initio SGD (確率的勾配降下) の改良の恩恵を受ける可能性があります。目的のパーティクルに対応できるマスク直径を選択し、[SGD] タブのフィールドの既定値は、通常は適切に機能するためそのままにしておきます。キメラ(または別の適切な視覚化プログラム)で初期モデルが妥当に見えるようにしてください(代表的な結果を参照)。 - ステップ 6.6 からの出力を参照モデルとして使用して、データ内の異質性に対処するために 3D 分類を実行します。キメラで結果のマップを評価します。独自の立体構造状態に対応するパーティクルスタックを独立して処理します。サブセット選択ジョブを使用して、対象となるクラス/クラスを選択し、関連付けられたパーティクルスタックの particles.star ファイルを生成します。
- 3D 自動調整を実行します。前の手順で取得した 3D クラスの平均を、対応するパーティクル スタックのリファインの参照として使用します。絞り込みの解像度がデータのナイキスト限界に近づいている場合は、ダウンスケーリングなしでパーティクルを再抽出します。再抽出した後、ビン分割されていないパーティクル スタックで 3D 自動調整ジョブを繰り返します。この場合、ピクセルとボックスのサイズが再抽出されたパーティクルイメージのサイズと一致するために、3D 参照モデルを再スケールする必要があります。この操作を実行するには、relion_image_handler コマンド ライン ツールを使用します。
- 必要に応じて、細分化で対称性を利用します。再構築されたマップに対称性がある場合は、relion_align_symmetry コマンド ライン ツールを使用して、適切な対称軸にマップを位置合わせします。作成された位置合わせマップは、参照タブで指定された適切な対称演算子を使用して、新しい 3D 自動細分化ジョブの参照として使用します。
- 3D 自動調整からマップをシャープにします。これは RELION の後処理ジョブを使用して行われますが、まず、適切なマスクを精製マップから作成する必要があります。マスク作成と後処理の手順は、RELION チュートリアルで詳しく説明しています (代表的な結果も参照)。
注: RELION のベイズ研磨機能と CTF 改良機能を使用すると、多くの再構成の解像度をさらに改善できます。CTF の改良ジョブ タイプを使用して、高次収差 (ビームチルト、トレフォイル収差、4 番目 の順序収差) を推定および修正し、別々のジョブとして異方性拡大と粒子単位の焦点の解除を推定および修正します。この後、ベイジアン研磨ジョブ(トレーニング済みまたはデフォルト値)を使用して、粒子単位でビーム誘発運動に対処します。RELION 3.1チュートリアルで取り上げたように、これらのジョブは反復的なアプローチ(CTF精製→ベイズ研磨→3D自動改良→後処理→の恩恵を受けるでしょう。ループ) 両方が高解像度モデルの恩恵を受けるので。 - 必要に応じて、EM密度マップの利き手を修正します。マップを調べて、既存の原子モデルに適合させようとするか、アルファらせん領域の利き手を評価することによって、利き手が正しいかどうかを判断します。必要に応じて、'vop zflip' コマンドを使用して UCSF Chimera45 の z 軸に沿ってマップを反転します。
結果
スクリーニングの際、グリッドはアトラスステージで廃棄することができ、低倍率で解決されたフィーチャはグリッドをデータ取得に適さないとマークします。たとえば、グリッドの大部分が壊れた状態で大きな機械的損傷を受けた場合(図 2A)、またはグリッドが「乾燥」しているように見える場合(図 2B)。このようなグリッドは、グリッドの四角形の端が鮮明で明確に表示されるため、通常は識別可能です。プランジ凍結装置を使用して作られたグリッドの大部分にわたって、氷の勾配が観察される(図2C、D)。粒子分布は、目的の標本に応じて、氷の厚さで劇的に変化する可能性があるため、粒子分布を評価するためにグリッドの正方形の範囲をスクリーニングすることが推奨されます。ツールは、ユーザーが同様または異なる氷の厚さのグリッドの正方形を識別するのに役立つアトラススクリーニングステップ中にEPUソフトウェア内に実装されています。

図2:スクリーニングセッションからの低倍率の「アトラス」モンタージュの例。A)グリッドの大部分が壊れて大きな被害を受けたグリッド - 収集には適していません。 B)氷のない乾燥グリッド - 収集には適していません。 C)使用できるグリッドの~50%で氷勾配を示すグリッド。 D)グリッドの33%が使用できる氷の勾配。 C および Dの両方が、使用できるグリッドの正方形が収集に適した氷の厚さを有する場合のデータ収集に適しており、かつ収集の最小持続時間(例えば、24時間) Eを満たすのに十分な獲得領域がある場合、氷の厚さの範囲を有するアトラスの例である。F)同じアトラスは、Eで提示されますが、グリッドの正方形は、氷の厚さに応じてEPUソフトウェアによって分類され、着色されています。 この図の大きなバージョンを表示するには、ここをクリックしてください。
粒子分布をスクリーニングする際には、予想される結果を正確に把握するために、倍率や全電子線量などの画像生成パラメータがデータ取得時に使用されると予想されるものと類似していることを確認してください。スクリーニング中、理想的な粒子分布は、粒子の配向の範囲を有する単分散である(粒子の形態の標本および既存の知識に応じて、これは確認するのが難しいかもしれない) (図3A)。氷は粒子の最大の次元を収容しながらできるだけ薄くする必要があり、氷が薄すぎると電子ビームで照らされたときに溶ける可能性があります。これにより、顕微鏡写真では過度の動きが発生し、この特性を示す領域は避けるべきです(図3B)。集合的な経験から、この効果は、バッファー内に洗剤がある場合に最も一般的に観察されます。これにより、穴の中心に非常に薄い氷が発生するため、パーティクルを物理的に除外してエッジに向かって強制することができます。この効果は図 3C で見られますが、この場合は極端な例ではなく、これらの画像がデータセットに役立ちます。最後に、氷は、渦満である必要があります。撮影した画像の大部分またはすべてが結晶氷(図3D)を示すグリッド(またはグリッド)の領域をデータ取得から除外します。多くの場合、非渦氷はグリッドの正方形の端で観察されます。読者は、グリッドガラス化16中に変更できる変数の詳細なレビューと、薄膜環境における粒子挙動の説明46,47に関する詳細な情報を参照する。

図3:異なる粒子分布を示す代表的な顕微鏡写真。A) さまざまな配向を採用した単分散粒子の「理想的な」分布。 B)電子ビームにばかばると変形する穴の真ん中の氷が過度に薄く、顕微鏡写真で過度の動きを引き起こす。この効果は、洗剤が緩衝液 C)の中心に氷が薄い場合に最も頻繁に観察され、これは物理的に中心から粒子を除外し、穴の端に向かって粒子の混雑を引き起こす。この場合、これらの画像が有用であることを防ぐほど極端ではありませんが、少し厚い領域をスクリーニングする価値があることを示唆しています。 D)氷は、この例の顕微鏡写真のように見える領域上で収集すべきではない。 この図の大きなバージョンを表示するには、ここをクリックしてください。
オンザフライ画像処理は、データ取得のエラーや問題を拾い上げるのに役立ちますので、可能な限り常にお勧めします。例えば、マイクログラフ内の過度の動きは、オートローダーターボポンプがアクティブであることを示すか、氷が電子ビーム内で大きく移動しているひび割れたグリッドの正方形にデータが収集され、グリッドの正方形をスキップする必要があることを示している可能性があります。その場でCTF推定は、(焦点がずれではなく)正の焦点点が適用される状況(CTF推定プログラムとこれらの点を見つけるためのパラメータが使用される)状況を明らかにし、ボルタ位相板48が使用される位相シフトを決定することができる。多くの場合、画像処理パイプラインには、データのグラフィカルな概要 (図 4A) が含まれ、ユーザーが顕微鏡写真の品質をすばやく評価し、データ収集の修正が必要かどうかを判断しやすくなります。
マイクログラフからの粒子の選択は、汚染やグリッド支持フィルムなどの「偽陽性」を避けながら、最適化を必要とすることができます。しかし、crYOLOなどのパーティクルピッカーは、データの「最初のパス」にデフォルトのパラメータを使用して十分に機能することが多く(図4B)、データの品質とダウンストリームの成功の可能性を評価することが容易な2Dクラス平均への進行を可能にします。ほとんどのプロジェクトでは、~> 10kのパーティクルの2D分類は、二次構造の詳細を持つクラスを明らかにし始める必要があります。3D に進むには、通常、2D 分類ステージで、パーティクルの向きの範囲を表すクラスを明らかにする必要があります。好ましい方位が明らかになっている場合、傾いたサンプルを有するサンプル調製16 またはさらなるデータ集録の反復が必要であり得る49。二次構造の詳細を示すクラスはすべて、3D解析に進むために選択する必要がありますが、「ジャンク」粒子は廃棄されます(図4C)。
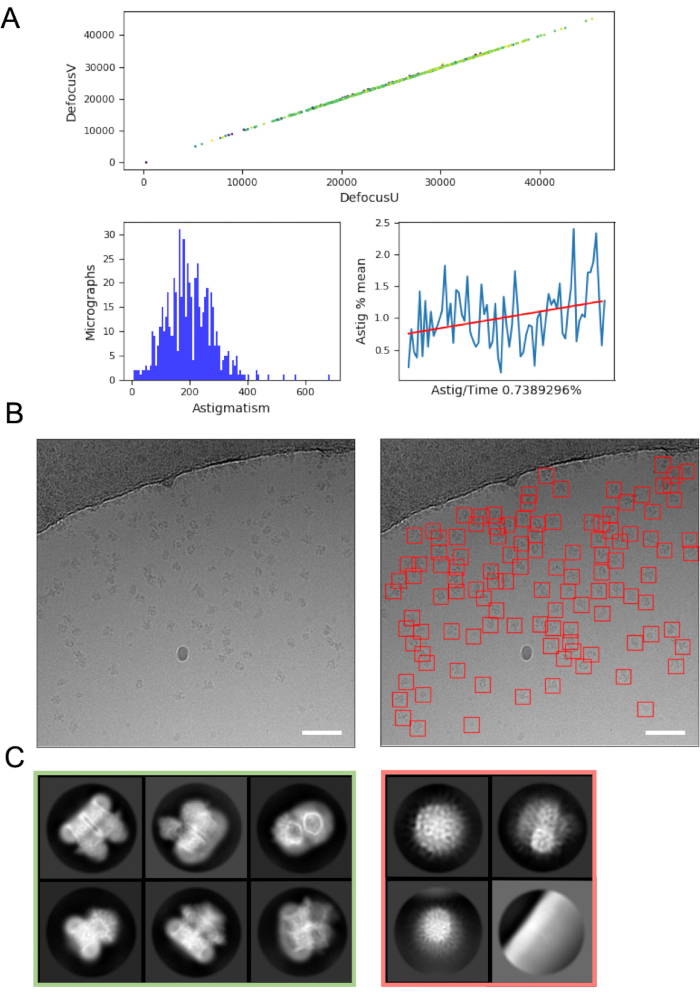
図4:初期画像処理手順A) 「オンザフライ」画像処理スクリプトからの出力。 B)例の顕微鏡写真(左)は、crYOLO一般モデルを用いて適切に自動摘出された粒子(右、赤い正方形に囲まれた粒子を有する)スケールバー(白)が50nmである。 C) 赤い四角に捨てられたクラスと、緑色でのさらなる処理のために選択されたパーティクルのクラスを示す2D分類の結果。 この図の大きなバージョンを表示するには、ここをクリックしてください。
小さなサブセットのパーティクルを使用して初期モデルを生成できます(図5A)。この初期モデルは、3D 分類および絞り込みで開始モデルとして使用できます。RagABの場合、データセットには3D分類中に分離できる3つの異なる適合者が含まれていました(図5B)。これらの各クラスに寄与するパーティクルは、独立して処理し、EM密度マップをリファインするために使用でき、さらに解釈やモデル構築の対象となります。
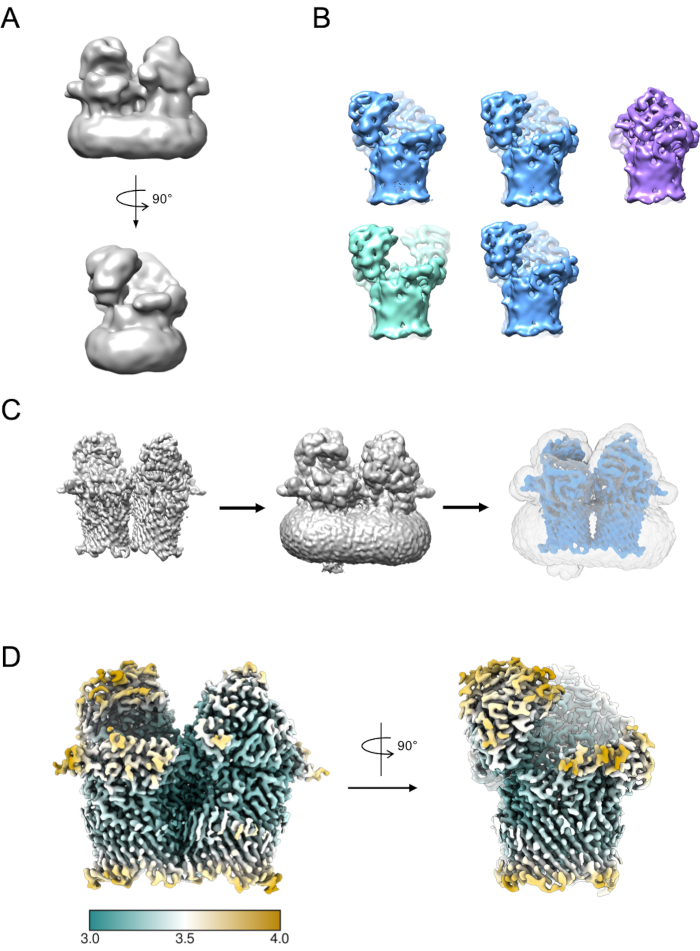
図 5: 3D EM 密度マップの生成A) RELIONを使用して生成された典型的な初期モデル。 B)3D分類は、開いた(緑)、開閉(青)、閉じた(紫)の3つの異なる立体状態への粒子の分離を示す5つのクラスにわたる。 C) マスク作成のプロセス。3D 絞り込み(左)からの地図はキメラで視覚化されるべきです。その後、ボリューム ビューアを使用して、マップが不整合な、騒がしい密度 (中央) から解放される最小のしきい値を識別できます。このしきい値は、RELION マスク作成ジョブの初期二値化しきい値として入力されます。マスク出力の例は、グレー (右) で示されています。 D)ラガブ(EMD-10245)のオープンクローズ状態の高解像度EM密度マップは、局所解像度(Å)によってフィルタリングされ、着色された。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
このプロトコルでは、ルーチンSPAに適した標本に適用可能な基本的なパイプラインを説明しました。薄膜形成およびガラス化のこのフィルターペーパーブロッティング方法は、これまでのSPAプロジェクトの大半での使用を考えると間違いなく成功しているが、それは多くの欠点を伴う。これらは、試料の浪費、薄膜を形成し、試料を凍結するために必要な遅いタイムスケール(秒)、報告された再現性27を報告し、過剰な液体50を消すために濾紙を使用することの悪影響を報告した。近年、薄膜生産の再現性を向上させる新技術が開発されました51,52。サンプル用途とガラス化の間の時間を短縮する他の技術が開発されています53,54,55。薄膜形成のためのフィルターペーパーベースの方法は、執筆時点でSPA cryoEMサンプル調製の最もユビキタスな方法のままですが、これらの新しい技術は、グリッドガラス化の効率と再現性の面で様々な利点をもたらし、硝化前に時間分解能や急速な混合などの追加の実験次元をもたらす新しい機会を生み出す可能性があります。
ほとんどのユーザーのためのグリッドスクリーニングのプロセスは、現在、粒子分布を評価するためにグリッド全体で高倍率画像を撮影し、低倍率アトラスの取得を含む定性的なプロセスです。これは一部の種類の標本では十分に堅牢なアプローチですが、例えば小さな(<200 kDa)サンプルや低解像度の形態によって粒子分布の範囲が存在する場合、研究者が画像を画像化しようとしているものや好ましい向きを持っている場合、検体が実際に望んでいる場合、目で評価することは困難です。一部のプロジェクトでは、例えば、リガンドが結合している場所や、サンプルがスクリーニングされている場所など、標本が望ましいかどうかを判断して、小さな(例えば、10 kDa)サブユニットがまだ複合体に関連しているかどうかを評価することは不可能です。これらのプロジェクトでは、2D分類、あるいは3D分類や絞り込みまでを進めることができる「短い」0.5-1-hコレクションと組み合わせたデータ分析のための完全に自動化されたパイプラインは、より長いコレクションが保証されているかどうかを効率的に判断するのに役立ちます。これらのパイプラインはまだ開発中であり、現在のところ広く実装されていませんが、特に困難な標本のために、cryoEMグリッドスクリーニングの効率を向上させる可能性があります。
直接電子検出器の改良、画像シフトデータ収集などの画像処理の進歩と合わせて顕微鏡の改変により、データ取得時に生成される画像のスループットと品質が向上しています。このデータ収集率の増加は、多数のデータが取得される前にcryoEMグリッドを徹底的にスクリーニングする必要性を強調しています。
CryoEM SPAは本当に主流の構造生物学技術となっており、多くの場合、異機種および不安定な高分子複合体のようないくつかのクラスの標本に対する「行く」アプローチとなっています。ここでのプロトコルは、SPAパイプラインの基本的な概要を説明していますが、ここで説明する各セクション(グリッドガラス化とスクリーニング、cryoEMと画像処理)は、それ自体のトピックであり、SPAプロジェクトの開発中に探査する価値があります。サンプル調製および顕微鏡技術が進歩し、新しい画像処理アルゴリズムとアプローチがオンラインになるにつれて、SPAは引き続きパイプラインとして発展し、研究者が複雑な生物学的システムに関する洞察を得るのを助けます。
開示事項
利益相反は報告されません。
謝辞
この研究は、欧州委員会のHorizon 2020プログラムが資金を提供するiNEXT-Discovery(グラント871037)によって支援されました。J B. R. ホワイトはウェルカムトラスト(215064/Z/18/Z)から資金提供を受けています。FEIタイタンクリオス顕微鏡は、リーズ大学(UoL ABSL賞)とウェルカムトラスト(108466/Z/15/Z)によって資金提供されました。私たちは、彼の顕微鏡写真分析スクリプトの使用のためのM Iadanzaに感謝します。我々は、ウェルカム・トラスト、MRC、BBRSCが出資する英国の電子バイオイメージングセンター(eBIC)のクライオEM施設へのアクセスと支援に対するダイヤモンド光源を認める。
資料
| Name | Company | Catalog Number | Comments |
| Blunt tweezers | Agar Scientific | AGT5022 | |
| Cryo EM round storage box | Agar Scientific | AGG3736 | |
| CryoEM autogrid boxes | ThermoFisher Scientific | 1084591 | |
| CryoEM grids | Quantifoil | N1-C14nCu30-01 | |
| Ethane gas | Boc | 270595-F | |
| LN2 foam dewar | Agar Scientific | AG81760-500 | |
| LN2 storage dewar | Worthington industries | HC 34 | |
| Pipette | Gilson | 10082012 | |
| Pipette tips | Star labs | s1111-1706 | |
| Syringe | BD | BD 300869 | |
| Type II lab water | Suez | select fusion | |
| Vitrobot | ThermoFisher Scientific | 1086439 | |
| Vitrobot filter paper | Whatman | 1001-055 | |
| Vitrobot styrophome container assembly | ThermoFisher Scientific | 1086439 | |
| Vitrobot tweesers | ThermoFisher Scientific | 72882-D | |
| Software | |||
| EPU | ThermoFisher Scientific | 2.8.1.10REL | |
| TEM server | ThermoFisher Scientific | 6.15.3.22415REL | |
| Tia | ThermoFisher Scientific | 5.0.0.2896REL | |
| Titan krios microscope | ThermoFisher Scientific | Titan Krios G2 |
参考文献
- Kuehlbrandt, W. The Resolution Revolution. Science. 343 (6178), 1443-1444 (2014).
- McMullan, G., Faruqi, A. R., Henderson, R. Direct Electron Detectors. Methods in Enzymology. , (2016).
- Elmlund, D., Le, S. N., Elmlund, H. High-resolution cryo-EM: the nuts and bolts. Current Opinion in Structural Biology. , (2017).
- Lyumkis, D. Challenges and opportunities in cryo-EM single-particle analysis. Journal of Biological Chemistry. , (2019).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. , (2020).
- Yip, K. M., Fischer, N., Paknia, E., Chari, A., Stark, H. Atomic-resolution protein structure determination by cryo-EM. Nature. , (2020).
- Conley, M. J., et al. Calicivirus VP2 forms a portal-like assembly following receptor engagement. Nature. 565 (7739), 377-381 (2019).
- Hesketh, E. L., et al. The 3.3 Å structure of a plant geminivirus using cryo-EM. Nature communications. 9 (1), 2369 (2018).
- Malone, L. A., et al. Cryo-EM structure of the spinach cytochrome b6 f complex at 3.6 A resolution. Nature. 575 (7783), 535-539 (2019).
- Madej, M., et al. Structural and functional insights into oligopeptide acquisition by the RagAB transporter from Porphyromonas gingivalis. Nature Microbiology. , (2020).
- Gallardo, R., et al. Fibril structures of diabetes-related amylin variants reveal a basis for surface-templated assembly. Nature Structural and Molecular Biology. , (2020).
- Scarff, C., et al. Structure of the shutdown state of myosin-2. Nature. , (2020).
- Scarff, C. A., et al. Structure of the protective nematode protease complex H-gal-GP and its conservation across roundworm parasites. PLoS Pathogens. 16 (4), 1008465 (2020).
- Wu, M., Lander, G. C. How low can we go? Structure determination of small biological complexes using single-particle cryo-EM. Current Opinion in Structural Biology. , (2020).
- Khoshouei, M., Radjainia, M., Baumeister, W., Danev, R. Cryo-EM structure of haemoglobin at 3.2 Å determined with the Volta phase plate. Nature Communications. , (2017).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta crystallographica. Section D, Structural biology. 74, 560-571 (2018).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Cheng, Y., Grigorieff, N., Penczek, P. A., Walz, T. A primer to single-particle cryo-electron microscopy. Cell. 161 (3), 438-449 (2015).
- Scarff, C. A., Fuller, M. J. G., Thompson, R. F., Iadanza, M. G. Variations on negative stain electron microscopy methods: tools for tackling challenging systems. Journal of Visualized Experiments. (132), e57199 (2018).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative Staining and Image Classification - Powerful Tools in Modern Electron Microscopy. Biological procedures online. 6, 23-34 (2004).
- Baker, L. A., Rubinstein, J. L. Radiation Damage in Electron Cryomicroscopy. Methods in enzymology. 481, 371-388 (2010).
- Dubochet, J., et al. Cryo-electron microscopy of vitrified specimens. Quarterly Reviews of Biophysics. 21 (02), 129-228 (1988).
- Passmore, L. A., Russo, C. J. Specimen Preparation for High-Resolution Cryo-EM. Methods in enzymology. 579, 51-86 (2016).
- Carragher, B., et al. Current outcomes when optimizing ‘standard’ sample preparation for single-particle cryo-EM. Journal of Microscopy. , (2019).
- Naydenova, K., Jia, P., Russo, C. J. Cryo-EM with sub-1 Å specimen movement. Science. , (2020).
- Passmore, L. A., Russo, C. J. Specimen Preparation for High-Resolution Cryo-EM. Methods in Enzymology. , (2016).
- Thompson, R. F., Iadanza, M. G., Hesketh, E. L., Rawson, S., Ranson, N. A. Collection, pre-processing and on-the-fly analysis of data for high-resolution, single-particle cryo-electron microscopy. Nature protocols. 14 (1), 100-118 (2019).
- Suloway, C., et al. Automated molecular microscopy: the new Leginon system. Journal of Structural Biology. 151 (1), 41-60 (2005).
- Zhang, J., et al. JADAS: A customizable automated data acquisition system and its application to ice-embedded single particles. Journal of Structural Biology. , (2009).
- Mastronarde, D. N. SerialEM: A program for automated tilt series acquisition on Tecnai microscopes using prediction of specimen position. Microscopy and Microanalysis. , (2003).
- Schorb, M., Haberbosch, I., Hagen, W. J. H., Schwab, Y., Mastronarde, D. N. Software tools for automated transmission electron microscopy. Nature Methods. , (2019).
- Fernandez-Leiro, R., Scheres, S. H. W. A pipeline approach to single-particle processing in RELION. Acta crystallographica. Section D, Structural biology. 73, 496-502 (2017).
- Gómez-Blanco, J., et al. Using Scipion for stream image processing at Cryo-EM facilities. Journal of Structural Biology. , (2018).
- Wagner, T., et al. SPHIRE-crYOLO is a fast and accurate fully automated particle picker for cryo-EM. Communications biology. 2 (1), 213-218 (2019).
- Bepler, T., et al. TOPAZ: A Positive-Unlabeled Convolutional Neural Network CryoEM Particle Picker that can Pick Any Size and Shape Particle. Microscopy and Microanalysis. , (2019).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 163 (2018).
- Zivanov, J., Nakane, T., Scheres, S. H. W. A Bayesian approach to beam-induced motion correction in cryo-EM single-particle analysis. IUCrJ. , (2019).
- Cianfrocco, M. A., Kellogg, E. H. What Could Go Wrong? A Practical Guide to Single-Particle Cryo-EM: From Biochemistry to Atomic Models. Journal of Chemical Information and Modeling. , (2020).
- Tagari, M., Newman, R., Chagoyen, M., Carazo, J. M., Henrick, K. New electron microscopy database and deposition system. Trends in Biochemical Sciences. , (2002).
- Berman, H. M., et al. The Protein Data Bank. Nucleic Acids Research. , (2000).
- Iudin, A., Korir, P. K., Salavert-Torres, J., Kleywegt, G. J., Patwardhan, A. EMPIAR: A public archive for raw electron microscopy image data. Nature Methods. , (2016).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. CryoSPARC: Algorithms for rapid unsupervised cryo-EM structure determination. Nature Methods. , (2017).
- Tegunov, D., Cramer, P. Real-time cryo-electron microscopy data preprocessing with Warp. Nature Methods. , (2019).
- Goddard, T. D., et al. UCSF ChimeraX: Meeting modern challenges in visualization and analysis. Protein Science. 27 (1), 14-25 (2018).
- Klebl, D. P., et al. Need for Speed: Examining Protein Behavior during CryoEM Grid Preparation at Different Timescales. Structure. , (2020).
- Noble, A. J., et al. Routine single particle CryoEM sample and grid characterization by tomography. eLife. 7, 32 (2018).
- Danev, R., Buijsse, B., Khoshouei, M., Plitzko, J. M., Baumeister, W. Volta potential phase plate for in-focus phase contrast transmission electron microscopy. Proceedings of the National Academy of Sciences. , (2014).
- Zi Tan, Y., et al. Addressing preferred specimen orientation in single-particle cryo-EMthrough tilting. Nature Methods. , (2017).
- Armstrong, M., Han, B. -. G., Gomez, S., Turner, J., Fletcher, D. A., Glaeser, R. M. Microscale Fluid Behavior during Cryo-EM Sample Blotting. Biophysical Journal. 118 (3), 708-719 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. , (2017).
- Dandey, V. P., et al. Spotiton: New Features and Applications. Journal of Structural Biology. , (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta crystallographica. Section D, Structural biology. 75, 1063-1070 (2019).
- Tan, Y. Z., Rubinstein, J. L. Through-grid wicking enables high-speed cryoEM specimen preparation. bioRxiv. , (2020).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: From sprays to jets and back. Acta Crystallographica Section D: Structural Biology. , (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved