このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
黒質のニューロメラニン感受性磁気共鳴イメージングのための標準化されたデータ取得
要約
このプロトコルは、黒質のニューロメラニン感受性磁気共鳴画像データを取得する方法を示しています。
要約
ドーパミン作動系は、健康な認知(例えば、報酬学習および不確実性)および神経精神障害(例えば、パーキンソン病および統合失調症)において重要な役割を果たす。ニューロメラニンは、黒質のドーパミン作動性ニューロンに蓄積するドーパミン合成の副産物である。ニューロメラニン感受性磁気共鳴画像法(NM-MRI)は、これらのドーパミン作動性ニューロンにおけるニューロメラニンを測定するための非侵襲的方法であり、黒質におけるドーパミン作動性細胞損失の直接測定およびドーパミン機能の代理測定を提供する。NM-MRIはさまざまな神経精神障害の研究に役立つことが示されていますが、劣った優れた方向の視野が限られているため、黒質の一部が誤って除外されるため、データが失われる可能性があります。さらに、この分野には、大規模なマルチサイト研究と臨床への翻訳を促進するための重要なステップであるNM-MRIデータを取得するための標準化されたプロトコルがありません。このプロトコルでは、黒質全体をカバーする高品質のデータを確実に取得するための段階的なNM-MRIボリューム配置手順とオンライン品質管理チェックについて説明します。
概要
ニューロメラニン(NM)は、黒質(SN)のドーパミン作動性ニューロンおよびコエルレウス座(LC)のノルアドレナリン作動性ニューロンに見られる暗い色素です1,2。NMは、細胞質ドーパミンとノルエピネフリンの鉄依存性酸化によって合成され、ソーマ3のオートファジー液胞に貯蔵されます。それは2〜3歳頃に人間に最初に現れ、1,4,5歳で蓄積します。
SNおよびLCニューロンのNM含有液胞内では、NMは鉄と複合体を形成する。これらのNM-鉄錯体は常磁性であるため、磁気共鳴画像法(MRI)を用いてNMを非侵襲的に可視化することができます6,7。NMを可視化できるMRIスキャンは、NM感度MRI(NM-MRI)として知られており、直接的または間接的な磁化伝達効果を使用して、NM濃度の高い領域(SNなど)と周囲の白質8,9との間のコントラストを提供します。
磁化移動コントラストは、高分子結合水プロトン(磁化移動パルスによって飽和している)と周囲の自由水プロトンとの間の相互作用の結果である。NM-MRIでは、NM-鉄錯体の常磁性が周囲の自由水陽子のT1 を短くし、その結果、磁化伝達効果が減少し、NM-MRIスキャンでNM濃度の高い領域が高輝度に見えると考えられている10。逆に、SNを取り巻く白質は高分子含有量が高いため、磁化移動効果が大きいため、NM-MRIスキャンではこれらの領域が低信号に見えるため、SNと周囲の白質とのコントラストが高くなります。
SNにおいて、NM−MRIは、ドーパミン作動性細胞喪失11およびドーパミン系機能12のマーカーを提供することができる。これらの2つのプロセスは、いくつかの神経精神障害に関連しており、膨大な量の臨床および前臨床研究によってサポートされています。例えば、ドーパミン機能の異常は統合失調症で広く観察されている。陽電子放出断層撮影(PET)を用いたin vivo研究では、線条体ドーパミン放出の増加13,14,15,16およびドーパミン合成能力の増加が示されています17,18,19,20,21,22.さらに、死後の研究では、統合失調症の患者は、大脳基底核23およびSN24,25におけるチロシンヒドロキシラーゼ(ドーパミン合成に関与する律速酵素)のレベルが上昇していることが示されています。
いくつかの研究は、特にパーキンソン病におけるドーパミン作動性細胞喪失のパターンを調査している。死後の研究では、SNの色素性ドーパミン作動性ニューロンがパーキンソン病の神経変性の主要な部位であり26,27、パーキンソン病のSN細胞喪失は正常な老化における細胞喪失と相関していないことが明らかになりました28、それは疾患の期間と相関しています29.ドーパミン作動系を調査するためのほとんどの方法とは異なり、非侵襲性、費用対効果、および電離放射線の欠如により、NM-MRIは用途の広いバイオマーカーとなっています30。
この論文で説明されているNM-MRIプロトコルは、NM-MRIの被験者内および被験者間の再現性の両方を高めるために開発されました。このプロトコルは、下方-上方向のNM-MRIスキャンのカバレッジが限られているにもかかわらず、SNの完全なカバレッジを保証します。このプロトコルは、矢状、冠状、および軸方向の3次元(3D)T1強調(T1w)画像を利用しており、適切なスライススタック配置を実現するための手順に従う必要があります。この論文で概説されているプロトコルは、複数の研究31,32で利用されており、広範囲にテストされています。Wenglerらは、NM-MRI画像が複数の日にわたって各参加者で2回取得されたこのプロトコルの信頼性の研究を完了しました32。クラス内相関係数は、関心領域(ROI)ベースおよびボクセルワイズ分析に対するこの方法の優れたテスト再テストの信頼性、および画像の高いコントラストを示しました。
プロトコル
注:このプロトコルを開発するために実施された研究は、ニューヨーク州精神医学研究所の治験審査委員会のガイドライン(IRB#7655)に準拠して実施されました。1人の被験者がプロトコルビデオを録画するためにスキャンされ、書面によるインフォームドコンセントが得られました。このプロトコルで使用されるMRIスキャナーの詳細については、 資料表 を参照してください。
1. MRI取得パラメータ
- 次のパラメータを持つ3D磁化準備高速取得勾配エコー(MPRAGE)シーケンスを使用して高解像度T1w画像を取得する準備をします:空間分解能= 0.8 x 0.8 x 0.8 mm3;視野 (FOV) = 176 x 240 x 240 mm3;エコー時間 (TE) = 3.43 ミリ秒;繰り返し時間 (TR) = 2462 ミリ秒;反転時間 (TI) = 1060 ミリ秒;フリップ角度= 8°;面内平行イメージング係数(ARC)= 2。スループレーンパラレルイメージングファクター(ARC)= 233;帯域幅 = 208 Hz/ピクセル;合計取得時間=6分39秒。
- 次のパラメータで磁化伝達コントラスト(2D GRE-MTC)を持つ2次元(2D)勾配想起エコーシーケンスを使用してNM-MRI画像を取得する準備をします:解像度= 0.43 x 0.43 mm2;視野 = 220 x 220 mm2;スライスの厚さ= 1.5 mm;20スライス;スライスギャップ= 0mm;TE = 4.8 ミリ秒;TR = 500 ミリ秒;フリップ角度= 40°;帯域幅 = 122 Hz/ピクセル;MT周波数オフセット= 1.2kHz;MTパルス持続時間 = 8 ms;MTフリップ角度= 670°;平均の数= 5;合計取得時間=10分4秒。
注意: 表示された結果はこれらのMRI取得パラメータを使用しましたが、このプロトコルはさまざまなT1wおよびNM-MRIイメージングプロトコルに有効です。NM-MRIプロトコルは、SNの完全なカバレッジを保証するために、下方-上位方向に~25mmをカバーする必要があります。
2. NM-MRIボリュームの配置
- 高解像度のT1w画像(≤1mm等方性ボクセルサイズ)を取得します。画像取得直後にオンラインで再フォーマットを使用して、前後交連(AC-PC)ラインと正中線に整列した高解像度のT1w画像を作成します。
- ベンダーが提供するソフトウェアを使用してオンラインで再フォーマットを実行します(たとえば、GEスキャナーでデータを取得する場合:計画のマルチプラナー再構築(MPR)、シーメンススキャナーでデータを取得する場合:3DタスクカードのMPR、フィリップススキャナーでデータを取得する場合:VolumeViewパッケージのレンダリングモードでMPR)。
- AC-PCラインに垂直な軸面で3D T1w画像の多面再構成を作成し、最小限のスライスギャップで脳全体をカバーします。
- AC-PCラインに垂直な冠状平面で3D T1w画像の多面再構成を作成し、最小限のスライスギャップで脳全体をカバーします。
- AC-PCラインに平行な矢状面に3D T1w画像の多面再構成を作成し、最小限のスライスギャップで脳全体をカバーします。
- ベンダーが提供するソフトウェアを使用してオンラインで再フォーマットを実行します(たとえば、GEスキャナーでデータを取得する場合:計画のマルチプラナー再構築(MPR)、シーメンススキャナーでデータを取得する場合:3DタスクカードのMPR、フィリップススキャナーでデータを取得する場合:VolumeViewパッケージのレンダリングモードでMPR)。
- 再フォーマットされた高解像度T1w画像の矢状、冠状、および軸方向のビューをロードし、表示された各スライスの位置を示す参照線が存在することを確認します。
- 中脳と視床の間の最大の分離を示す矢状画像を特定します(図1A)。これを行うには、この最大の分離を示すスライスが特定されるまで、再フォーマットされたT1w画像の矢状スライスを目視検査します。
- ステップ2.3の終わりの矢状画像を使用して、中脳の最も前方の側面を描く冠状面を視覚的に識別します(図1B)。
- ステップ2.4の終わりの冠状画像を使用して、第3脳室の下側を描写する軸面を視覚的に識別します(図1C)。
- ステップ2.3の終わりの矢状画像で、NM-MRIボリュームの上境界をステップ2.5で特定された軸面に合わせます(図1D)。
- NM-MRIボリュームの上境界を3 mm上方向に動かします(図1E)。
- NM-MRIボリュームを軸画像と冠状画像の正中線に合わせます(図1F)。
- NM-MRI画像を取得します。
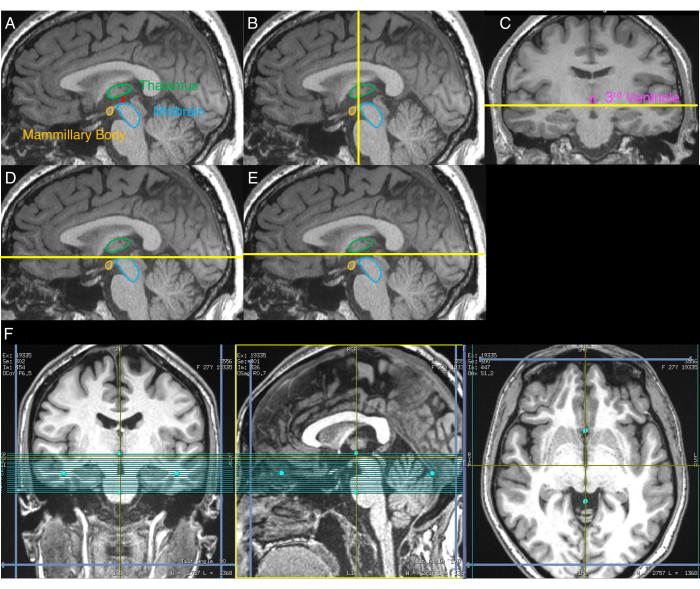
図1: NM-MRIボリュームの配置手順を段階的に示す画像。黄色の線は、プロトコルで説明されているボリューム配置に使用されるスライスの位置を示します。(A)まず、中脳と視床の間の最大の分離を有する矢状像が特定される(プロトコルのステップ2.3)。(B)第2に、 Aからの画像を用いて、中脳の最も前方の側面を描写する冠状平面を特定する(ステップ2.4)。(c)第3に、Bで特定された平面からの冠状画像上に 、 第3脳室の下側面を描写する軸面が特定される(ステップ2.5)。(D)第4に、 C で識別された軸面が A からの矢状像に表示される(ステップ2.6)。(E)第5に、軸面を D から上方向に3mmずらし、この平面がNM-MRIボリュームの上位境界を示す(ステップ2.7)。(F)冠状像が Cに対応し、矢状像が Aに対応し、軸像が Eの軸面に対応する最終的なNM-MRIボリューム配置。NM-MRIボリュームは、冠状および軸画像では脳正中線に、矢状画像ではAC-PCラインに位置合わせされます(ステップ2.8)。この図の一部は、 30日からエルゼビアの許可を得て転載されています。略語:NM-MRI =神経メラニン感受性磁気共鳴画像法;AC-PC =前交連-後交連。 この図の拡大版を表示するには、ここをクリックしてください。
3. 品質管理チェック
- 取得したNM-MRI画像がSN全体をカバーし、SNが中央の画像には表示されているが、NM-MRIボリュームの最も優れた画像または最も劣った画像には表示されないことを確認してください。それ以外の場合は(図2)、手順2.3〜2.9を繰り返して、NM-MRIボリュームが正しく配置されていることを確認します。高解像度T1wスキャンの取得以降、参加者が大幅に移動した場合は、手順2.1〜2.9を繰り返します。
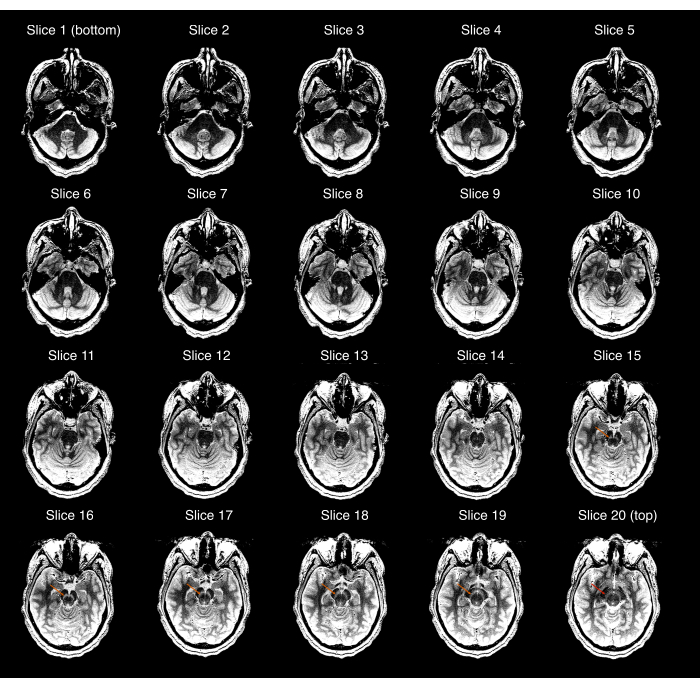
図2: 最初の品質管理チェック(プロトコルのステップ3.1)に失敗したNM-MRI取得の例。20個のNM-MRIスライスのそれぞれを、最も劣ったもの(左上の画像)から最も優れたもの(右下の画像)に表示しました。画像ウィンドウ/レベルは、黒質とクリュス・セレブリのコントラストを誇張するように設定されました。スライス15〜19のオレンジ色の矢印は、それらのスライス内の黒質の位置を示しています。最も優れたスライス(スライス20)の赤い矢印は、このスライスに黒質がまだ表示されていることを示しているため、取得は品質チェックに失敗します。略語:NM-MRI =神経メラニン感受性磁気共鳴画像法。 この図の拡大版を表示するには、ここをクリックしてください。
- 取得したNM-MRIスキャンの各スライスを視覚的に検査することにより、アーティファクト、特にSNと周囲の白質を通過するアーティファクトを確認します。
- 通常の解剖学的境界を尊重しない線形パターンで信号強度の急激な変化を探します。たとえば、これは、2つの高強度領域に隣接する低強度領域として表示される場合があります。
- アーチファクトが血管の結果である場合(図3A)、これらのアーティファクトは常に存在する可能性が高いため、NM-MRI画像を保持します。
- アーチファクトが参加者の頭の動きの結果である場合(図3B)、参加者にできるだけ静止し、ステップ3.2.5に従ってNM-MRI画像を再取得するように通知します。
- アーチファクトがあいまいな場合(図3C)、ステップ3.2.5に従ってNM-MRI画像を再取得します。再取得時にアーティファクトが残っている場合は、取得の問題の結果ではなく生物学的である可能性が高いため、これらの画像を進めます。
- NM-MRI 画像が手順 3.1 の品質管理チェックに合格した場合は、前の NM-MRI ボリューム配置をコピーします。NM-MRI画像がステップ3.1の品質管理チェックに失敗した場合は、手順2.3〜2.9を繰り返して、NM-MRIボリュームが正しく配置されていることを確認します(参加者が大幅に移動した場合は手順2.1〜2.9)。

図3:2回目の品質管理チェック(プロトコルのステップ3.2)に失敗したNM-MRI取得の例。ケースごとに 1 つの代表的なスライスのみが表示されます。(A)NM-MRI取得で、青い矢印で識別された血管の結果である血管アーチファクト(赤い矢印)が原因で品質管理チェックに失敗した場合。(B)モーションアーチファクト(赤い矢印)のために品質管理チェックに失敗したNM-MRI取得。(C)あいまいなアーティファクト(赤い矢印)のために品質管理チェックに失敗したNM-MRI取得。略語:NM-MRI =神経メラニン感受性磁気共鳴画像法。この図の拡大版を表示するには、ここをクリックしてください。
結果
図4 は、精神障害や神経障害のない28歳の女性参加者の代表的な結果を示しています。NM-MRIプロトコルは、 図1で概説したプロトコルのステップ2に従うことによって達成されるSNの完全なカバレッジと、プロトコルのステップ3に従うことによって満足のいくNM-MRI画像を保証します。SNとNM濃度が無視できる近隣の白質領域(すなわち、大脳)との間の優...
ディスカッション
ドーパミン作動系は、健康な認知および神経精神障害において重要な役割を果たします。 in vivo でドーパミン作動系を繰り返し調べるために使用できる非侵襲的方法の開発は、臨床的に意味のあるバイオマーカーの開発に不可欠です。ここで説明するプロトコルは、NM-MRIボリュームの配置や使用可能なデータを確保するための品質管理チェックなど、SNの高品質のNM-MRI画像を取得する?...
開示事項
ホルガ博士とウェングラー博士はそれぞれ、中枢神経系疾患におけるニューロメラニンイメージングの分析と使用に関する特許(WO2021034770A1、WO2020077098A1)を保有していると報告し、Terran Biosciencesにライセンス供与されましたが、ロイヤルティは受け取っていません。
謝辞
ホルガ博士はNIMH(R01-MH114965、R01-MH117323)から支援を受けました。ウェングラー博士はNIMH(F32-MH125540)から支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 3T Magnetic Resonance Imaging | General Electric | GE SIGNA Premier with 48-channel head coil |
参考文献
- Zecca, L., et al. New melanic pigments in the human brain that accumulate in aging and block environmental toxic metals. Proceedings of the National Academy of Sciences of the United States of America. 105 (45), 17567-17572 (2008).
- Zucca, F. A., et al. The neuromelanin of human substantia nigra: physiological and pathogenic aspects. Pigment Cell Research. 17 (6), 610-617 (2004).
- Sulzer, D., et al. Neuromelanin biosynthesis is driven by excess cytosolic catecholamines not accumulated by synaptic vesicles. Proceedings of the National Academy of Sciences of the United States of America. 97 (22), 11869-11874 (2000).
- Cowen, D. The melanoneurons of the human cerebellum (nucleus pigmentosus cerebellaris) and homologues in the monkey. Journal of Neuropathology & Experimental Neurology. 45 (3), 205-221 (1986).
- Zecca, L., et al. The absolute concentration of nigral neuromelanin, assayed by a new sensitive method, increases throughout the life and is dramatically decreased in Parkinson's disease. FEBS Letters. 510 (3), 216-220 (2002).
- Sulzer, D., et al. Neuromelanin detection by magnetic resonance imaging (MRI) and its promise as a biomarker for Parkinson's disease. NPJ Parkinson's Disease. 4 (1), 11 (2018).
- Zucca, F. A., et al. Neuromelanin organelles are specialized autolysosomes that accumulate undegraded proteins and lipids in aging human brain and are likely involved in Parkinson's disease. NPJ Parkinson's Disease. 4 (1), 17 (2018).
- Chen, X., et al. Simultaneous imaging of locus coeruleus and substantia nigra with a quantitative neuromelanin MRI approach. Magnetic Resonance Imaging. 32 (10), 1301-1306 (2014).
- Sasaki, M., et al. Neuromelanin magnetic resonance imaging of locus ceruleus and substantia nigra in Parkinson's disease. Neuroreport. 17 (11), 1215-1218 (2006).
- Trujillo, P., et al. Contrast mechanisms associated with neuromelanin-MRI. Magnetic Resonance in Medicine. 78 (5), 1790-1800 (2017).
- Kitao, S., et al. Correlation between pathology and neuromelanin MR imaging in Parkinson's disease and dementia with Lewy bodies. Neuroradiology. 55 (8), 947-953 (2013).
- Cassidy, C. M., et al. Neuromelanin-sensitive MRI as a noninvasive proxy measure of dopamine function in the human brain. Proceedings of the National Academy of Sciences of the United States of America. 116 (11), 5108-5117 (2019).
- Abi-Dargham, A., et al. Increased striatal dopamine transmission in schizophrenia: confirmation in a second cohort. American Journal of Psychiatry. 155 (6), 761-767 (1998).
- Laruelle, M., et al. Single photon emission computerized tomography imaging of amphetamine-induced dopamine release in drug-free schizophrenic subjects. Proceedings of the National Academy of Sciences of the United States of America. 93 (17), 9235-9240 (1996).
- Breier, A., et al. Schizophrenia is associated with elevated amphetamine-induced synaptic dopamine concentrations: evidence from a novel positron emission tomography method. Proceedings of the National Academy of Sciences of the United States of America. 94 (6), 2569-2574 (1997).
- Abi-Dargham, A., et al. Increased baseline occupancy of D-2 receptors by dopamine in schizophrenia. Proceedings of the National Academy of Sciences of the United States of America. 97 (14), 8104-8109 (2000).
- Hietala, J., et al. Presynaptic dopamine function in striatum of neuroleptic-naive schizophrenic patients. Lancet. 346 (8983), 1130-1131 (1995).
- Lindström, L. H., et al. Increased dopamine synthesis rate in medial prefrontal cortex and striatum in schizophrenia indicated by L-(β-11C) DOPA and PET. Biological Psychiatry. 46 (5), 681-688 (1999).
- Meyer-Lindenberg, A., et al. Reduced prefrontal activity predicts exaggerated striatal dopaminergic function in schizophrenia. Nature Neuroscience. 5 (3), 267-271 (2002).
- McGowan, S., Lawrence, A. D., Sales, T., Quested, D., Grasby, P. Presynaptic dopaminergic dysfunction in schizophrenia: a positron emission tomographic [18F] fluorodopa study. Archives of General Psychiatry. 61 (2), 134-142 (2004).
- Bose, S. K., et al. Classification of schizophrenic patients and healthy controls using [18F] fluorodopa PET imaging. Schizophrenia Research. 106 (2-3), 148-155 (2008).
- Kegeles, L. S., et al. Increased synaptic dopamine function in associative regions of the striatum in schizophrenia. Archives of General Psychiatry. 67 (3), 231-239 (2010).
- Toru, M., et al. Neurotransmitters, receptors and neuropeptides in post-mortem brains of chronic schizophrenic patients. Acta Psychiatrica Scandinavica. 78 (2), 121-137 (1988).
- Perez-Costas, E., Melendez-Ferro, M., Rice, M. W., Conley, R. R., Roberts, R. C. Dopamine pathology in schizophrenia: analysis of total and phosphorylated tyrosine hydroxylase in the substantia nigra. Frontiers in Psychiatry. 3, 31 (2012).
- Howes, O. D., et al. Midbrain dopamine function in schizophrenia and depression: a post-mortem and positron emission tomographic imaging study. Brain. 136 (11), 3242-3251 (2013).
- Bernheimer, H., Birkmayer, W., Hornykiewicz, O., Jellinger, K., Seitelberger, F. Brain dopamine and the syndromes of Parkinson and Huntington Clinical, morphological and neurochemical correlations. Journal of the Neurological Sciences. 20 (4), 415-455 (1973).
- Hirsch, E., Graybiel, A. M., Agid, Y. A. Melanized dopaminergic neurons are differentially susceptible to degeneration in Parkinson's disease. Nature. 334 (6180), 345 (1988).
- Fearnley, J. M., Lees, A. J. Ageing and Parkinson's disease: substantia nigra regional selectivity. Brain. 114 (5), 2283-2301 (1991).
- Damier, P., Hirsch, E., Agid, Y., Graybiel, A. The substantia nigra of the human brain: II. Patterns of loss of dopamine-containing neurons in Parkinson's disease. Brain. 122 (8), 1437-1448 (1999).
- Horga, G., Wengler, K., Cassidy, C. M. Neuromelanin-sensitive magnetic resonance imaging as a proxy marker for catecholamine function in psychiatry. JAMA Psychiatry. 78 (7), 788-789 (2021).
- Wengler, K., et al. Cross-scanner harmonization of neuromelanin-sensitive MRI for multisite studies. Journal of Magnetic Resonance Imaging. , (2021).
- Wengler, K., He, X., Abi-Dargham, A., Horga, G. Reproducibility assessment of neuromelanin-sensitive magnetic resonance imaging protocols for region-of-interest and voxelwise analyses. NeuroImage. 208, 116457 (2020).
- Griswold, M. A., et al. Generalized autocalibrating partially parallel acquisitions (GRAPPA). Magnetic Resonance in Medicine. 47 (6), 1202-1210 (2002).
- vander Pluijm, M., et al. Reliability and reproducibility of neuromelanin-sensitive imaging of the substantia nigra: a comparison of three different sequences. Journal of Magnetic Resonance Imaging. 53 (5), 712-721 (2020).
- Cassidy, C. M., et al. Evidence for dopamine abnormalities in the substantia nigra in cocaine addiction revealed by neuromelanin-sensitive MRI. American Journal of Psychiatry. 177 (11), 1038-1047 (2020).
- Wengler, K., et al. Association between neuromelanin-sensitive MRI signal and psychomotor slowing in late-life depression. Neuropsychopharmacology. 46, 1233-1239 (2020).
- Biondetti, E., et al. Spatiotemporal changes in substantia nigra neuromelanin content in Parkinson's disease. Brain. 143 (9), 2757-2770 (2020).
- Shibata, E., et al. Use of neuromelanin-sensitive MRI to distinguish schizophrenic and depressive patients and healthy individuals based on signal alterations in the substantia nigra and locus ceruleus. Biological Psychiatry. 64 (5), 401-406 (2008).
- Fabbri, M., et al. Substantia nigra neuromelanin as an imaging biomarker of disease progression in Parkinson's disease. Journal of Parkinson's Disease. 7 (3), 491-501 (2017).
- Matsuura, K., et al. Neuromelanin magnetic resonance imaging in Parkinson's disease and multiple system atrophy. European Neurology. 70 (1-2), 70-77 (2013).
- Watanabe, Y., et al. Neuromelanin magnetic resonance imaging reveals increased dopaminergic neuron activity in the substantia nigra of patients with schizophrenia. PLoS One. 9 (8), 104619 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved