Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Radioterapia de pintura de dosis basada en tomografía por emisión de positrones en un modelo de rata con glioblastoma utilizando la Plataforma de Investigación de Radiación en Animales Pequeños
En este artículo
Resumen
Aquí presentamos un protocolo para realizar radioterapia preclínica basada en tomografía por emisión de positrones en un modelo de glioblastoma de rata utilizando algoritmos desarrollados internamente para optimizar la precisión y la eficiencia.
Resumen
Previamente se estableció un modelo de glioblastoma de rata para imitar el tratamiento de quimio-radiación del glioblastoma humano en la clínica. Al igual que el tratamiento clínico, la tomografía computarizada (TC) y la resonancia magnética (IRM) se combinaron durante el proceso de planificación del tratamiento. Posteriormente se agregaron imágenes de tomografía por emisión de positrones (PET) para implementar el aumento de subvolumen utilizando un sistema de microirradiación. Sin embargo, la combinación de tres modalidades de imágenes (TC, RM y PET) utilizando un sistema de microirradiación demostró ser laboriosa porque las imágenes multimodales, la planificación del tratamiento y la administración de dosis deben completarse secuencialmente en el entorno preclínico. Esto también da como resultado un flujo de trabajo que es más propenso a errores humanos. Por lo tanto, se implementó un algoritmo fácil de usar para optimizar aún más la planificación del tratamiento de radiación preclínica basada en imágenes multimodales. Esta herramienta de software se utilizó para evaluar la precisión y la eficiencia de la radioterapia de pintura de dosis con microirradiación mediante el uso de un diseño de estudio in silico . La nueva metodología para la radioterapia de pintura de dosis es superior al método descrito anteriormente en términos de precisión, eficiencia de tiempo y variabilidad intra e interusuario. También es un paso importante hacia la implementación de la planificación inversa del tratamiento en microirradiadores, donde la planificación anticipada todavía se usa comúnmente, en contraste con los sistemas clínicos.
Introducción
El glioblastoma (GB) es un tumor cerebral primario maligno y muy agresivo. El GB es un tumor heterogéneo sólido caracterizado típicamente por límites infiltrativos, atipia nuclear y necrosis1. La presencia de la barrera hematoencefálica y el estatus del cerebro como un sitio inmunoprivilegiado hace que el descubrimiento de nuevos objetivos para la quimioterapia y la inmunoterapia sea una tarea desalentadora2,3,4. Cabe destacar que el tratamiento de los pacientes con GB apenas ha cambiado desde la introducción, en 2005, del protocolo Stupp que combina la radioterapia de haz externo (RT) con temozolomida concomitante, generalmente seguida de temozolomida adyuvante5. Por lo general, el protocolo Stupp está precedido por una resección quirúrgica máxima. Por lo tanto, los enfoques de tratamiento alternativos son de importancia fundamental.
La radioterapia actual para pacientes con glioblastoma administra una dosis de radiación uniforme al volumen tumoral definido. En oncología radioterápica, existe una importante correlación dosis-respuesta para el glioblastoma con el aumento de la dosis, que parece limitar alrededor de 60 Gy, debido al aumento de la toxicidad para el cerebro normal6,7. Sin embargo, los tumores pueden ser muy (radiobiológicamente) heterogéneos, con gradientes de nivel de oxígeno y/o grandes diferencias en la densidad celular. Las técnicas de imagen metabólica, como la PET, pueden visualizar estas características biológicas y se pueden utilizar para personalizar la prescripción de la dosis. Este enfoque se conoce como pintura de dosis RT. Este término fue introducido por Ling et al. en 2000. Los autores definieron la pintura de dosis RT como la producción de "distribuciones de dosis exquisitamente conformes dentro de las limitaciones de propagación y dispersión de la radiación"8.
Hay dos tipos de pintura de dosis RT, pintura de dosis por contornos (DPBC), mediante la cual se prescribe una dosis a un conjunto de subvolúmenes anidados, y pintura de dosis por números (DPBN), mediante la cual se prescribe una dosis a nivel de vóxel. La distribución de dosis para DPBN RT se puede extraer de imágenes funcionales. La dosis en cada vóxel está determinada por la intensidad I del vóxel correspondiente en la imagen, con un límite inferior y superior, para asegurarse de que, por un lado, se administra una dosis suficiente a cada parte del tumor. Por otro lado, las dosis no superan un límite superior para proteger los órganos de riesgo y evitar la toxicidad. El método más sencillo es una interpolación lineal (véase Eq. 1) entre la dosis mínima Dmin y la dosis máxima Dmax, variando proporcionalmente entre la intensidad mínima Imax y la intensidad máxima dentro del volumen objetivo9,10
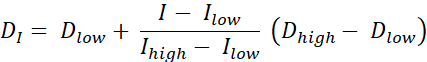 Eq. 1
Eq. 1
Debido a que existe cierto escepticismo sobre el aseguramiento de la calidad de DPBN RT, la deposición de la dosis debe verificarse a través de la investigación preclínica y clínica10. Sin embargo, solo se pueden obtener datos limitados de los ensayos clínicos, y se ha planteado la hipótesis de que se pueden obtener más conocimientos mediante la reducción de escala a animales de laboratorio11,12. Por lo tanto, los estudios preclínicos que utilizan plataformas de investigación de radiación guiadas por imágenes de precisión que permiten el acoplamiento con algunas técnicas muy específicas, como la autorradiografía, son adecuados para examinar problemas abiertos y allanar el camino hacia la medicina personalizada y las estrategias de tratamiento novedosas, como la pintura de dosis RT13,14. Sin embargo, la interpretación de los datos preclínicos debe realizarse con precaución, y se deben considerar los inconvenientes de estas configuraciones preclínicas14.
Los sistemas de microirradiación, como la Plataforma de Investigación de Radiación de Pequeños Animales (SARRP), están equipados con tecnologías similares a las de su contraparte clínica. Incluyen imágenes de TC de haz cónico (CBCT) a bordo, un sistema preclínico de planificación del tratamiento (PCTPS) y proporcionan una precisión submilimétrica. Los cálculos clínicos de dosis se realizan mediante la planificación inversa del tratamiento, mediante la cual se inicia a partir de la distribución de dosis deseada para determinar los haces a través de un algoritmo iterativo. Los irradiadores preclínicos a menudo utilizan la planificación anticipada. En la planificación anticipada, se seleccionan la cantidad y el ángulo requeridos de los haces, y el PCTPS calcula la distribución de dosis. La optimización de los planes se realiza mediante iteración manual, que requiere mucha mano de obra15.
Después de 2009, nuevos desarrollos han hecho posible la implementación de la planificación inversa en estas plataformas de investigación16,17,18. Para aumentar la similitud con el método clínico, se desarrolló un colimador rectangular variable motorizado (MVC) como contraparte preclínica del colimador multihoja. Cho et al.19 publicaron un método de pintura de dosis bidimensional utilizando un colimador variable. Este grupo de investigación implementó un protocolo tridimensional (3D) de planificación inversa del tratamiento en un microrrasor y determinó dosis mínimas y máximas para el volumen objetivo y una dosis máxima para los órganos en riesgo. Estas técnicas se han evaluado principalmente in silico, y sus aplicaciones preclínicas deben ser exploradas.
Este artículo presenta un estudio in silico para comparar dos metodologías para la pintura de dosis basada en PET [18F]-fluoro-etil-L-tirosina ([18F]FET) en un modelo de rata GB20,21,22 utilizando una plataforma de investigación de radiación en animales pequeños. Estas dos metodologías son (1) aumento de subvolumen utilizando tamaños de haz predefinidos y (2) pintura de dosis utilizando un colimador variable motorizado donde las dimensiones de la mandíbula se modifican en función de la captación del trazador PET en el volumen tumoral. [18F] FET es un trazador de PET utilizado a menudo en neuro-oncología debido a su capacidad para detectar tumores cerebrales23. [18F] FET es un aminoácido artificial que se internaliza en las células tumorales pero no se incorpora a las proteínas celulares. [18F] La captación de TJE se corresponde con la tasa de proliferación celular, la densidad de células tumorales y la angiogénesis24. Como este es el trazador de PET cerebral oncológico más utilizado en el instituto de estos autores, se eligió este radiotrazador para evaluar el nuevo flujo de trabajo.
Protocolo
El estudio fue aprobado por el comité de ética local para experimentos con animales (ECD 18/21). La monitorización de la anestesia se realiza adquiriendo la frecuencia respiratoria de los animales mediante un sensor.
1. Modelo de célula de rata F98 GB
- Cultive las células F98 GB en una monocapa utilizando el Medio Águila Modificada de Dulbecco, suplementado con suero de ternera al 10%, penicilina al 1%, estreptomicina al 1% y L-glutamina al 1%, y colóquelas en una incubadora de CO2 (5% CO2 y 37 °C).
- Inocular las células de glioma en el cerebro de ratas Fischer F344 hembras (peso corporal 170 g).
NOTA: Use instrumentos estériles y use guantes estériles en todo momento.- Anestesiar a las ratas mediante la inhalación de isoflurano (5% de inducción, 2% de mantenimiento) mezclado con oxígeno (0,3 ml/min) a través de un cono nasal. Confirmar la anestesia por la ausencia de reflejo de retirada de la extremidad, e inmovilizar las ratas en un dispositivo estereotáctico utilizando puntos de fijación para la nariz y las orejas. Aplique un gel ocular de carbómero para prevenir la sequedad ocular bajo anestesia. Mantenga la temperatura corporal mediante una almohadilla térmica termorregulada y una sonda rectal a 37 °C.
- Afeitar la rata desde el nivel de los ojos hasta la parte posterior del cráneo y desinfectar la piel con isobetadina. Inyecte xilocaína (con adrenalina 1:200000, 0.1 ml) por vía subcutánea para la anestesia local.
- Exponga el cráneo a través de una incisión en la línea media del cuero cabelludo y haga un pequeño orificio con una herramienta de perforación de 3 mm posterior y 3 mm lateral al bregma en el hemisferio derecho.
- Inserte una aguja de insulina guiada estereotácticamente (29 G) e inyecte 5 μL de suspensión celular (20.000 células F98 GB) de 3 mm de profundidad utilizando un controlador de bomba de microjeringa. Deje la aguja en su lugar durante 5 minutos, dando tiempo a la suspensión celular para que se difunda en el tejido.
- Retire la jeringa lentamente y cierre el orificio en el cráneo con cera ósea. Suturar la piel (poliamida 6, grosor 4-0) e inyectar meloxicam por vía subcutánea (1 mg/kg, 2 mg/ml). Aplicar gel de xilocaína.
- Estabilizar la temperatura corporal del animal después de la cirugía utilizando una lámpara roja. Monitoree el despertar de la rata hasta que haya recuperado la conciencia suficiente. No devuelva el animal a la compañía de otros animales hasta que esté completamente recuperado. Alojar a todos los animales en condiciones ambientalmente controladas (ciclo de luz /oscuridad de 12 h, 20-24 ° C y 40-70% de humedad relativa) con alimentos y agua ad libitum.
- Asegúrese de monitorear a los animales diariamente y mantener un registro diario del estado de salud verificando su peso corporal, alimentos, ingesta de agua y su actividad y comportamiento. Use una dosis letal de pentobarbital sódico para sacrificar a los animales (160 mg / kg) si se observa una disminución del 20% del peso corporal o cuando el comportamiento normal se deteriora gravemente (por ejemplo, falta de aseo).
2. Confirmación del crecimiento tumoral
- Evaluar el crecimiento tumoral 8 días después de la inoculación. Anestesiar a las ratas mediante la inhalación de isoflurano (5% de inducción, 2% de mantenimiento) mezclado con oxígeno (0,3 ml/min) a través de un cono nasal. Confirmar la anestesia por la ausencia de reflejo de abstinencia de la extremidad.
- Inyecte un agente de contraste que contenga gadolinio (0,4 ml/kg) a través de un tubo colocado por vía intravenosa en la vena lateral de la cola. Cubra al animal con una manta calefactora circulante de agua tibia y colóquelo en la cama de resonancia magnética. Aplique un gel ocular de carbómero para prevenir la sequedad ocular bajo anestesia. Coloque la cama de resonancia magnética en el soporte con una bobina de volumen cerebral Tx/Rx Rat.
- Realice una exploración localizadora seguida de una exploración de espín-eco ponderada en T2 para evaluar el crecimiento del tumor. Utilice estos ajustes de secuencia T2-MRI: tiempo de repetición (TR)/tiempo de eco (TE) 3661/37,1 ms, resolución isotrópica en plano de 109 μm, espesor de rebanada 600 μm, 4 promedios, 30 rebanadas, tiempo total de adquisición (TA) 9 min 45 s.
- Si se confirma un tumor en la adquisición ponderada en T2, realice una ecografía de espín con contraste mejorado ponderado en T1. Utilice estos ajustes de secuencia T1-MRI: TR/TE 1539/9,7 ms, resolución isotrópica en plano de 0,117 mm, espesor de la rebanada 600 μm, 3 medias, 30 rebanadas, TA 4 min 15 s.
- Después de la resonancia magnética, supervise continuamente al animal hasta que recupere la plena conciencia.
- Cuando el tumor alcanza un diámetro de 7 a 8 mm, generalmente observado 12 días después de la inoculación, seleccione el animal para la terapia.
3. Imágenes multimodales de selección de volumen objetivo
NOTA: La irradiación guiada por PET/MRI requiere la adquisición secuencial de un conjunto de datos multimodal. Después de la administración intravenosa del radiotrazador, se inician las imágenes de PET, seguidas de una resonancia magnética ponderada en T1 mejorada con contraste y, finalmente, una tomografía computarizada de planificación del tratamiento.
- Anestesiar al animal con isoflurano (5% de inducción, 2% de mantenimiento) mezclado con oxígeno (0,3 L/min) utilizando un cono nasal. Confirme la anestesia cuando las ratas no exhiban ningún reflejo de abstinencia de la extremidad. Aplique gel ocular carbómero para prevenir los ojos secos bajo anestesia.
- Inserte el tubo por vía intravenosa en la vena lateral de la cola, lo que permite la inyección de 10-12 MBq de trazador radiactivo PET disuelto en 200 μL de solución salina. Inyecte [18F]-FET, 1 h antes de la adquisición de PET. Deje que el animal recupere la conciencia mientras el trazador se distribuye a través del cuerpo.
- Anestesiar al animal de nuevo, como se describe en el paso 3.1. Coloque al animal en una cama multimodal (aquí, hecha en casa) y asegúrelo con sujetadores de gancho y lazo, manteniendo una posición fija durante la imagen y la microirradiación. Fije un capilar lleno con el agente mri / PET (consulte la Tabla de materiales) para facilitar el registro conjunto. Envuelva al animal en plástico de burbujas para preservar su temperatura corporal durante la terapia y las imágenes multimodalidad.
- Realice una tomografía por emisión de positrones 1 h después de la inyección del trazador de PET. Reconstruya el escaneo PET en un volumen 3D (matriz de 192 x 192 x 384) con un tamaño de vóxel de 0,4 mm aplicando un algoritmo de maximización de expectativas de máxima probabilidad (MLEM) utilizando 30 iteraciones.
NOTA: Se utilizó un escáner PET dedicado para imágenes de animales de laboratorio con un campo de visión axial de 130 mm y un diámetro de diámetro de 72 mm. Este sistema proporciona una resolución espacial inferior a mm (0,85 mm). - Inyecte un agente de contraste de resonancia magnética (0,4 ml/kg) por vía intravenosa en la vena de la cola. Coloque la rata, aún fija en la cama multimodal, en el soporte del animal del escáner de resonancia magnética (Tabla de Materiales). Realice un escaneo localizador seguido de una secuencia de espín-eco ponderada en T1 con contraste, análoga al paso 2.4.
- Coloque el animal, aún fijo en la cama multimodal, sobre un soporte de plástico asegurado en la mesa de posicionamiento robótica de cuatro ejes en el microrrasor. Realice una TC de haz cónico de planificación de tratamiento de alta resolución utilizando un voltaje de tubo de 70 kV, una corriente de tubo de 0,4 mA, un filtro de aluminio de 1 mm y un detector de panel plano Si amorfo de 20 x 20 cm (1024 x 1024 píxeles). Adquirir un total de 360 proyecciones sobre 360°. Reconstruir las imágenes de TC con un tamaño de vóxel isotrópico de 0,275 mm (matriz de 411 x 411 x 251).
4. Registro conjunto de imágenes
NOTA: El registro conjunto se realiza con un código MATLAB semiautomático desarrollado internamente. El código se puede encontrar en Github en https://github.com/sdonche/DosePainting. Los diferentes pasos se describen a continuación.
- Coloque las tres modalidades de imagen ([18F]FET PET, resonancia magnética ponderada en T1 con contraste mejorado y TC de haz cónico) en una carpeta. Convierta imágenes DICOM al formato NIfTI utilizando la función dcm2niix del visor de imágenes mricron24.
- Importe las imágenes convertidas a MATLAB y filtre la imagen PET con un filtro gaussiano utilizando un semimáx de ancho completo (FWHM) de 1 mm.
- Reorientar las imágenes para que los ejes cartesianos de todas las modalidades de imagen se correspondan entre sí.
NOTA: Para esta configuración, la imagen de TC se volteó alrededor del eje Y; la resonancia magnética se volteó alrededor del eje X, y la PET se volteó alrededor del eje Y. - Recorte la imagen PET para simplificar el registro conjunto automático.
NOTA: Para esta configuración, se establecieron 40 píxeles en cero desde ambos lados del eje X (izquierda y derecha del animal); en el lado dorsal y ventral del animal (eje Y), 60 y 40 píxeles se establecieron en cero, respectivamente; a lo largo del eje longitudinal (o eje Z), 170 y 30 píxeles se establecen en cero para el lado inferior y superior, respectivamente. - Mueva los centros de imágenes uno cerca del otro para simplificar el registro conjunto automático.
- Realice el co-registro real de cuerpo rígido utilizando Statistical Parametric Mapping (SPM) en MATLAB26. Utilice los siguientes parámetros de registro (otros por defecto): función objetiva: información mutua; separación: [4 1 0,2]; tolerancias: [0,02 0,02 0,02 0,001 0,001 0,001 0,01 0,01 0,01 0,001 0,001 0,001]; suavizado del histograma: [1 1]; interpolación: trilineal.
5. Planificación del tratamiento de radiación
NOTA: Se escribió una aplicación de MATLAB y varios scripts de MATLAB para la planificación del tratamiento de radiación. El código se puede encontrar en Github en https://github.com/sdonche/DosePainting. Los diferentes pasos se explican a continuación.
- Método 1
- Cargue las tres modalidades de imagen diferentes en la aplicación MATLAB. Coloque una generosa caja delimitadora alrededor de la mejora de contraste en la resonancia magnética ponderada en T1 (Figura 1). Determine el volumen mejorado con contraste mediante un umbral (Figura 2). Si se han seleccionado varias regiones, seleccione solo el volumen más grande, cuyo centro se considera como el primer isocentro en administrar una dosis prescrita para RT (Figura 3).
- Expanda la mejora de contraste de MRI previamente determinada en 10 píxeles en cada dirección. Si se detectan varias regiones, retenga solo el mayor volumen de PET, cuyo centro se considera el segundo isocentro en administrar una dosis prescrita para RT.
NOTA: En este volumen pet, el volumen de aumento de PET se define por los píxeles con una intensidad de señal superior a 0,90 × intensidad máxima de señal (en el cuadro delimitador) en este volumen. - Utilice los siguientes ajustes de irradiación para los isocentros calculados (Figura 4 y Tabla 1).
- Para el primer isocentro (MRI), administre una dosis prescrita de 2000 cGy usando 3 arcos no coplanares en las posiciones del sofá 0°, -45° y -90° con una rotación de pórtico de 120°, 120° y 60°, respectivamente. Use un tamaño de colimador fijo de 10 x 10 mm, pero use un colimador apropiado (por ejemplo, un colimador de 5 x 5 mm) cuando sea necesario irradiar tamaños de tumor más pequeños. Tenga cuidado al considerar el bienestar del animal cuando los volúmenes tumorales son mayores de 10 mm.
- Para el segundo isocentro (PET), administre una dosis prescrita de 800 cGy utilizando 3 arcos no coplanares en las posiciones del sofá 0°, -45° y -90° con una rotación de pórtico de 120°, 120° y 60°, respectivamente. Utilice un tamaño de colimador fijo de 3 x 3 mm.
- Calcule la distribución de la dosis dentro del animal y los parámetros de entrega del haz.
- Método 2
- Cargue las tres modalidades de imagen diferentes en la aplicación MATLAB. Coloque un generoso cuadro delimitador alrededor de la mejora de contraste en la imagen PET [18F]FET, análogo al paso 5.1.1.
- Determine los volúmenes definidos por los píxeles con una intensidad de señal superior a A × intensidad máxima de la señal (en el cuadro delimitador antes mencionado), con A igual a 0,50, 0,60, 0,70, 0,80 y 0,90. Asigne a estos volúmenes el nombre V50, V60, V70, V80 y V90, respectivamente.
- Determine los isocentros y las dimensiones de la mandíbula para cada haz necesarios para guiar el colimador variable motorizado mediante el script matlab (consulte la figura 5).
- Utilice la siguiente configuración para los isocentros calculados y las dimensiones de la mandíbula:
- Para V50, dé una dosis prescrita de 2000 cGy distribuidos en 16 vigas (cada una de 125 cGy; posiciones de sofá y pórtico en la Tabla 2). Utilice las dimensiones de mandíbula calculadas para el MVC.
NOTA: Aquí, se ha incluido un margen adicional de 1 mm para tener en cuenta la infiltración microscópica del tumor. - Para V60-V90, administre una dosis prescrita de 800 cGy distribuida en 40 vigas (cada una de 20 cGy; posiciones de sofá y pórtico en la Tabla 2). Utilice las dimensiones de mandíbula calculadas para el MVC.
- Para V50, dé una dosis prescrita de 2000 cGy distribuidos en 16 vigas (cada una de 125 cGy; posiciones de sofá y pórtico en la Tabla 2). Utilice las dimensiones de mandíbula calculadas para el MVC.
- Calcule la distribución de la dosis dentro del animal y los parámetros de entrega del haz.
6. Evaluación del plan
NOTA: Para comparar los dos métodos, calcule los histogramas de dosis-volumen (DVH) y el histograma de volumen Q (QVH) en el volumen de PET V50. Aquí, se utilizó un script de MATLAB, desarrollado internamente. El código se puede encontrar en Github en https://github.com/sdonche/DosePainting.
- Histograma dosis-volumen
- Generar DVH a partir de la distribución de dosis que se obtuvo del SARRP.
- Determine las dosis máximas, medias y mínimas de la DVH calculando la D10, D50 y D90, donde Dx representa la dosis recibida por x% del volumen.
- Histograma de volumen Q
- Calcule una dosis ideal para cada píxel utilizando Eq. 1, que es una interpolación lineal entre las dosis mínimas y máximas, que varía proporcionalmente entre la intensidad mínima de PET y la intensidad máxima de PET dentro del volumen objetivo para dar un mapa de dosis ideal.
- Calcule el valor Q Qp para cada píxel utilizando la siguiente ecuación (Eq. 2):
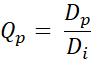 Eq. 2
Eq. 2
Siendo Dp la dosis obtenida por planificación y Di, el objetivo de dosis para la planificación. - Generar QVH a partir de los valores Q obtenidos.
- Calcular el factor de calidad (factor Q, QF) para evaluar la diferencia entre las dosis planificadas y previstas utilizando Eq. 3:
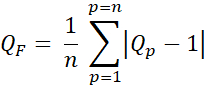 Eq. 3
Eq. 3
Resultados
Anteriormente se ha descrito la viabilidad de la irradiación guiada por PET y RM en un modelo de rata glioblastoma utilizando el SARRP para imitar la estrategia de tratamiento humano20,21,22. Si bien el animal se fijó en una cama multimodal hecha internamente, fue posible crear un plan de tratamiento de radiación aceptable que combinara tres modalidades de imágenes: PET, MRI y CT. En estos métodos, se utilizó un paquete de...
Discusión
Anteriormente se describió un modelo GB de rata para imitar el tratamiento de quimio-radiación en la clínica para pacientes con glioblastoma20. Al igual que el método clínico, la TC y la RM se combinaron durante el proceso de planificación del tratamiento para obtener una irradiación más precisa. Se utilizó una cama multimodal para minimizar el movimiento (de la cabeza) cuando el animal se movió de un sistema de imágenes a otro. Posteriormente, se añadieron imágenes pet al proceso de ...
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Los autores desean agradecer a la Fundación Lux Luka por apoyar este trabajo.
Materiales
| Name | Company | Catalog Number | Comments |
| Cell culture | |||
| F98 Glioblastoma Cell Line | ATCC | CRL-2397 | https://www.lgcstandards-atcc.org/products/all/CRL-2397 |
| Dulbeco's Modified Eagle Medium | Thermo Fisher Scientific | 22320-030 | |
| Cell culture flasks | Thermo Fisher Scientific | 178883 | 75 cm² |
| FBS | Thermo Fisher Scientific | 10270106 | |
| L-Glutamine | Thermo Fisher Scientific | 25030-032 | 200 mM |
| Penicilline-Streptomycin | Thermo Fisher Scientific | 15140-148 | 10,000 U/mL |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 14040-224 | |
| Trypsin-EDTA | Thermo Fisher Scientific | 25300-062 | 0.05% |
| GB Rat Model | |||
| Ball-shaped burr | Foredom | A-228 | 1.8 mm |
| Bone Wax | Aesculap | 1029754 | https://www.aesculapusa.com/en/healthcare-professionals/or-solutions/or-solutions-cranial-closure/hemostatic-bone-wax.html |
| Ethilon | Ethicon | 662G/662H | FS-2, 4-0, 3/8, 19 mm |
| Fischer F344/Ico crl Rats | Charles River | - | |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| IR Lamp | Philips | HP3616/01 | |
| Meloxicam (Metacam) | Boehringer Ingelheim | - | 2 mg/mL |
| Micromotor rotary tool | Foredom | K.1090-22 | |
| Micropump system | Stoelting Co. | 53312 | Stoelting Stereotaxic Injector |
| Stereotactic frame | Stoelting Co. | 51600 | |
| Xylocaine (1%, with adrenaline 1:200,000) | Aspen | - | 1%, with adrenaline 1:200,000 |
| Xylocaine gel (2%) | Aspen | - | 2% |
| Animal Irradiation | |||
| Micro-irradiator | X-Strahl | SARRP | Version 4.2.0 |
| Software | X-Strahl | Muriplan | Preclinical treatment planning system (PCTPC), version 2.2.2 |
| Small Animal PET | |||
| [18F]FET | Inhouse made | - | PET tracer; along with Prohance: MRI/PET agent |
| Micro-PET | Molecubes | Beta-Cube | https://www.molecubes.com/b-cube/ |
| Small Animal MRI | |||
| Micro-MRI | Bruker Biospin | Pharmascan 70/16 | https://www.bruker.com/products/mr/preclinical-mri/pharmascan.html |
| 30 G Needle for IV injection | Beckton-Dickinson | 305128 | |
| PE 10 Tubing | Instech Laboratories Inc | BTPE-10 | BTPE-10, polyethylene tubing 0.011 x 0.024 in (0.28 x 60 mm), non sterile, 30 m (98 ft) spool, Instech laboratories, Inc Plymouth meeting PA USA- (800) 443-4227- http://www.instechlabs.com |
| Prohance contrast agent | Bracco Imaging | - | 279.3 mg/mL, gadolinium-contrast agent (along with [18F]FET: MRI/PET agent) |
| Tx/Rx Rat Brain - Mouse Whole Body Volumecoil | Bruker Biospin | - | 40 mm diameter |
| Water-based Heating Unit | Bruker Biospin | MT0125 | |
| Consumables | |||
| Isoflurane | Zoetis | B506 | Anesthesia |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| Image Analysis | |||
| MATLAB | Mathworks | - | Version R2019b |
| PMOD | PMOD technologies LLC | Preclinical and molecular imaging software |
Referencias
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Wadajkar, A. S., et al. Tumor-targeted nanotherapeutics: Overcoming treatment barriers for glioblastoma. Wiley Interdisciplinary Reviews. Nanomedicine & Nanobiotechnology. 9 (4), (2016).
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews. Clinical Oncology. 15 (7), 422 (2018).
- McGranahan, T., Li, G., Nagpal, S. History and current state of immunotherapy in glioma and brain metastasis. Therapeutic Advances in Medical Oncology. 9 (5), 347-368 (2017).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Von Neubeck, C., Seidlitz, A., Kitzler, H. H., Beuthien-Baumann, B., Krause, M. Glioblastoma multiforme: Emerging treatments and stratification markers beyond new drugs. The British Journal of Radiology. 88 (1053), 20150354 (2015).
- Mann, J., Ramakrishna, R., Magge, R., Wernicke, A. G. Advances in radiotherapy for glioblastoma. Frontiers in Neurology. 8, 748 (2018).
- Ling, C. C., et al. Towards multidimensional radiotherapy (MD-CRT): Biological imaging and biological conformality. International Journal of Radiation Oncolology, Biology, Physics. 47 (3), 551-560 (2000).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Seminars in Radiation Oncology. 21 (2), 101-110 (2011).
- Bentzen, S. M. Theragnostic imaging for radiation oncology: Dose-painting by numbers. The Lancet. Oncology. 6 (2), 112-117 (2005).
- Wong, J., et al. High-resolution, small animal radiation research platform with X-ray tomographic guidance capabilities. International Journal of Radiation Oncolology, Biology, Physics. 71 (5), 1591-1599 (2008).
- Van Hoof, S. J., Granton, P. V., Verhaegen, F. Development and validation of a treatment planning system for small animal radiotherapy: SmART-Plan. Radiotherapy and Oncology. 109 (3), 361-366 (2013).
- Verhaegen, F., Granton, P., Tryggestad, E. Small animal radiotherapy research platforms. Physics in Medicine & Biology. 56 (12), 55-83 (2011).
- Butterworth, K. T., Prise, K. M., Verhaegen, F. Small animal image-guided radiotherapy: Status, considerations and potential for translational impact. The British Journal of Radiology. 88 (1045), 20140634 (2015).
- Nasr, A., Habash, A. Dosimetric analytic comparison of inverse and forward planned IMRT techniques in the treatment of head and neck cancer. Journal of the Egyptian National Cancer Institute. 26 (3), 119-125 (2014).
- Matinfar, M., Iyer, S., Ford, E., Wong, J., Kazanzides, P. Image guided complex dose delivery for small animal radiotherapy. IEEE International Symposium on Biomedical Imaging: From Nano to Macro. , 1243-1246 (2009).
- Matinfar, M., Iordachita, I., Wong, J., Kazanzides, P. Robotic delivery of complex radiation volumes for small animal research. IEEE International Conference on Robotics and Automation. , 2056-2061 (2010).
- Balvert, M., et al. A framework for inverse planning of beam-on times for 3D small animal radiotherapy using interactive multi-objective optimisation. Physics in Medicine & Biology. 60 (14), 5681-5698 (2015).
- Cho, N. B., Wong, J., Kazanzides, P. Dose Painting with a Variable Collimator for the Small Animal Radiation Research Platform (SARRP). The Midas Journal. , 1-8 (2014).
- Bolcaen, J., et al. MRI-guided 3D conformal arc micro-irradiation of a F98 glioblastoma rat model using the Small Animal Radiation Research Platform (SARRP). Journal of Neuro-oncology. 120 (2), 257-266 (2014).
- Bolcaen, J., Descamps, B., Boterberg, T., Vanhove, C., Goethals, I. PET and MRI guided irradiation of a glioblastoma rat model using a micro-irradiator. Journal of Visualized Experiments: JoVE. (130), e56601 (2017).
- Verhoeven, J., et al. Technical feasibility of [18F]FET and [18F]FAZA PET guided radiotherapy in a F98 glioblastoma rat model. Radiation Oncology. 14 (1), 89 (2019).
- Hutterer, M., et al. FET PET: a valuable diagnostic tool in neuro-oncology, but not all that glitters is glioma. Neuro-oncology. 15 (3), 341-351 (2013).
- Stockhammer, F., Plotkin, M., Amthauer, H., Landeghem, F. K. H., Woiciechowsky, C. Correlation of F-18-fluoro-ethyl-tyrosin uptake with vascular and cell density in non-contrast-enhancing gliomas. Journal of Neuro-oncology. 88 (2), 205-210 (2008).
- . Mricron dicom to nifti converter. neuroimaging informatics tools and resources clearinghouse (nitrc) Available from: https://www.nitrc.org/projects/mricron (2015)
- . SPM12 Manual Available from: https://www.fil.ion.ucl.ac.uk/spm/doc/spm12_manual.pdf (2014)
- España, S., Marcinkowski, R., Keereman, V., Vandenberghe, S., Van Holen, R. DigiPET: Sub-millimeter spatial resolution small-animal PET imaging using thin monolithic scintillators. Physics in Medicine & Biology. 59 (13), 3405-3420 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados