Method Article
Analyse cytométrique en flux de biomarqueurs apoptotiques dans les cellules cancéreuses SiHa traitées à l’actinomycine D
Dans cet article
Résumé
L’apoptose peut être caractérisée par l’analyse cytométrique en flux de biomarqueurs apoptotiques précoces et tardifs. La lignée cellulaire du cancer du col de l’utérus, SiHa, a été analysée pour les biomarqueurs de l’apoptose après un traitement avec l’actinomycine D à l’aide d’un cytomètre de flux de paillasse.
Résumé
Les biomarqueurs de l’apoptose ont été étudiés dans des cellules cancéreuses SiHa traitées à l’actinomycine D à l’aide d’un cytomètre de flux de paillasse. Les biomarqueurs précoces (annexine V et potentiel de la membrane mitochondriale) et les biomarqueurs tardifs (caspases 3 et 7 et dommages à l’ADN) de l’apoptose ont été mesurés dans des cultures expérimentales et témoins. Les cultures ont été incubées pendant 24 heures dans un incubateur humidifié à 37 °C avec 5% de CO2. Les cellules ont ensuite été détachées à l’aide de trypsine et énumérées à l’aide d’un test de numération cellulaire cytométrique en flux. Les cellules ont ensuite été analysées pour l’apoptose à l’aide d’un test d’annexine V, d’un test de potentiel transmembranaire électrochimique mitochondrial, d’un test de caspase 3/7 et d’un test de dommages à l’ADN. Cet article fournit un aperçu de l’apoptose et de la cytométrie en flux traditionnelle, et élabore des protocoles de cytométrie en flux pour le traitement et l’analyse des cellules SiHa. Les résultats décrivent des données expérimentales positives, négatives et sous-optimales. L’interprétation et les mises en garde relatives à l’analyse cytométrique en flux de l’apoptose à l’aide de cette plateforme analytique sont également abordées. L’analyse cytométrique en flux fournit une mesure précise des biomarqueurs précoces et tardifs de l’apoptose.
Introduction
L’apoptose, classée comme mort cellulaire programmée de type 11, assure un équilibre entre la prolifération cellulaire et la mort cellulaire2. L’apoptose est essentielle pendant le développement humain, après une blessure et pour la prévention de maladies telles que le cancer3. Les voies de signalisation de la mort cellulaire apoptotique intrinsèque et extrinsèque4 provoquent des changements intracellulaires biochimiques et morphologiques séquentiels 2,5,6. Les caractéristiques morphologiques apoptotiques peuvent être identifiées par microscopie et la perturbation biochimique peut être analysée par des essais biochimiques, y compris la cytométrie en flux (FC)7.
L’analyse cytométrique en flux pour identifier l’apoptose et comprendre les mécanismes intracellulaires associés a prospéré au cours des deux dernières décennies8. FC est une méthodologie scientifique qui analyse les cellules dans un fluide qui passe à travers des lasers à un ou plusieurs canaux (Figure 1)9,10,11. Les cellules du fluide sont focalisées en un seul fichier par le système fluidique du cytomètre en flux à l’aide d’une focalisation hydrodynamique. Lorsque les cellules traversent le laser, la lumière est diffusée ou émise par les cellules. La lumière diffusée peut être vers l’avant (diffusion vers l’avant) ou vers le côté (diffusion latérale) et fournit des informations sur la taille de la cellule et la granularité ou les structures internes, respectivement.
De plus, les réactifs fluorescents, tels que les colorants fluorescents ou les anticorps marqués avec des fluorophores, détectent des structures ou des molécules spécifiques de surface ou intracellulaires. Lorsque le laser excite les fluorophores, la lumière est émise à une longueur d’onde spécifique. Les détecteurs – généralement des tubes photomultiplicateurs – quantifient la lumière diffusée et émise par les échantillons de cellules. Les détecteurs produisent un courant quantifiable qui est proportionnel à la diffusion de la lumière et à l’émission de fluorescence. La sortie électronique est convertie en signaux numériques par un logiciel informatique pour identifier les populations cellulaires en fonction de la taille des cellules, de la granularité cellulaire et de la fluorescence cellulaire relative des molécules marquées au fluorophore 9,12,13.
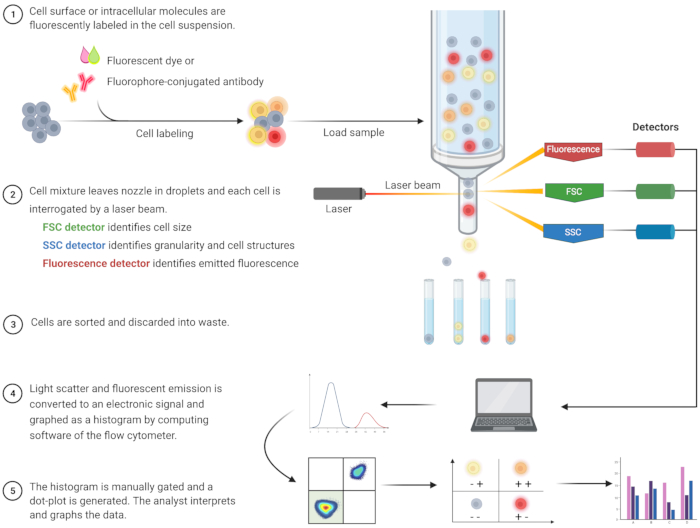
Figure 1 : Schéma décrivant le fonctionnement technique et le flux de travail de la cytométrie en flux traditionnelle. Les cellules sont colorées avec des réactifs fluorescents et sondées par un laser. Les signaux de fluorescence générés sont détectés et convertis en une sortie électronique, qui est ensuite numérisée et analysée par des logiciels informatiques et des programmes statistiques. Abréviations : FSC = diffusion vers l’avant; SSC = dispersion latérale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
FC est utilisé à la fois dans la recherche et le diagnostic de la santé. Les deux objectifs de FC en nécrobiologie sont l’élucidation des propriétés moléculaires et fonctionnelles de la mort cellulaire et la discrimination de divers modes de mort cellulaire 14,15,16,17,18. Les applications de la FC comprennent le dénombrement des cellules, le tri des populations cellulaires, l’immunophénotypage, la détection de biomarqueurs (p. ex. biomarqueurs de l’apoptose), les études de toxicité et l’ingénierie des protéines12. En outre, la FC est couramment appliquée aux diagnostics de santé pour aider au diagnostic et à la surveillance des patients atteints de tumeurs malignes hématologiques. Les progrès réalisés dans les domaines de l’instrumentation, de la détection des fluorophores et des systèmes de détection élargissent les applications de la FC pour inclure la cytométrie d’imagerie, la cytométrie de masse et la cytométrie spectrale avec des applications de recherche plus larges12.
L’analyse cytométrique en flux de l’apoptose offre des avantages par rapport aux techniques traditionnelles utilisées pour évaluer la santé cellulaire. FC peut analyser de nombreuses cellules individuelles dans un échantillon hétérogène rapidement et de manière reproductible pour estimer l’apoptose 3,5. La capacité de FC de fournir des informations quantitatives sur les phénotypes cellulaires sur une base cellulaire individuelle et d’éviter les analyses en vrac offre une sensibilité supérieure aux techniques de Western blotting, d’immuno-enzymatique (ELISA), de fluorométrie et de spectrophotométrie utilisées dans l’analyse de l’apoptose 8,19. De plus, la facilité relative de l’analyse des tests de FC par rapport aux étapes manuelles lourdes et peu reproductibles des transferts Western et des tests ELISA est avantageuse. L’analyse reproductible, précise et à haut débit de la FC est donc bénéfique dans la recherche sur le cancer20.
FC permet également l’analyse simultanée des paramètres du cycle cellulaire pour les populations de cellules apoptotiques saines et anormales21. Comme l’apoptose est un processus dynamique, différentes méthodes peuvent produire des résultats variables et dépendent du moment où les cellules sont récoltées22. L’évaluation quantitative simultanée de multiples paramètres du phénotype cellulaire permet de détecter des sous-populations mineures avec une grande précision, par exemple, des sous-ensembles de cellules rares avec une faible fréquence de 0,01% peuvent être détectés23. L’analyse multiparamétrique de la FC est particulièrement utile car la mort apoptotique se produit le long d’un spectre de changements biochimiques précoces et tardifs avec des cellules à divers points du continuum apoptotique. Par exemple, l’utilisation d’une double coloration à l’aide d’annexine V et d’iodure de propidium dans l’analyse FC des cellules apoptotiques permet la catégorisation des cellules apoptotiques précoces, des cellules apoptotiques tardives et des cellules mortes24. La détection précise de l’apoptose à plusieurs stades évite les erreurs de classification et les résultats faussement négatifs. Ainsi, l’analyse multiparamétrique par FC améliore la spécificité globale de la détection des phénotypes cellulaires et évite la classification erronée des populations mineures. De plus, le tri cellulaire par FC permet d’isoler des populations cellulaires d’une grande pureté pour une analyse ultérieure7.
L’inconvénient de la FC comprend l’utilisation de cellules en suspension, ce qui peut être difficile dans l’analyse des tissus, car la désagrégation des tissus en cellules peut altérer la fonction cellulaire19. De plus, le manque de normalisation de la configuration des instruments FC, de l’analyse des données et des rapports d’essai peut entraîner des variations dans les résultats19, soulignant la nécessité de former de manière optimale les opérateurs FC à la performance, à l’analyse et à la communication des données. Par exemple, la capacité de FC à distinguer les vrais débris apoptotiques des noyaux apoptotiques nécessite i) des réglages d’acquisition appropriés, ii) l’utilisation de billes d’étalonnage pour identifier un pic d’ADN diploïde, et iii) des contrôles cellulaires négatifs et positifs spécifiques à la cellule3. En outre, l’analyse multiparamétrique est limitée par le nombre de détecteurs, et une compensation optimale doit être effectuée pour éviter des résultats non spécifiques et des retombées d’émissions fluorescentes lors de l’utilisation de plusieurs réactifs fluorescents25. Les progrès de la technologie des instruments et des fluorophores ont amélioré la détection des paramètres à 30 paramètres12.
L’identification de la mort cellulaire apoptotique n’est pas toujours simple7, et des biomarqueurs sensibles et spécifiques doivent être envisagés. Le Nomenclature Committee on Cell Death (NCCD) recommande que plus d’un test soit utilisé pour étudier et quantifier le processus d’apoptose26. L’analyse microscopique des caractéristiques apoptotiques classiques26 est également recommandée pour confirmer l’apoptose et éviter les résultats faussement positifs7. Quatre caractéristiques biochimiques cardinales qui couvrent les événements apoptotiques précoces et tardifs sont (1) la perte de l’asymétrie de la membrane cellulaire; (2) potentiel de dissipation de la membrane mitochondriale (ΔΨm); 3° l’activation des caspases; et (4) dommages à l’ADN26.
Au cours de l’apoptose précoce, la phosphatidylsérine est extériorisée à la membrane cellulaire externe 27 et peut être détectée par l’annexine V marquée par fluorescence avec la phycoérythrine27,28,29. De plus, la double coloration avec le colorant fluorescent liant l’ADN, la 7-aminoactinomycine D (7-AAD), distingue les cellules vivantes, apoptotiques tardives et mortes. Par conséquent, les cellules apoptotiques précoces se colorent positives pour l’annexine V et négatives pour le 7-AAD, contrairement aux cellules apoptotiques tardives, qui colorent positives pour les deux colorants24.
Les signaux apoptotiques intrinsèques induisent la dissipation du potentiel membranaire mitochondrial (ΔΨm). Le ΔΨm perturbé provoque la libération précoce de protéines pro-apoptotiques de l’espace intermembranaire mitochondrial dans le cytosol27,29,30. La variation de ΔΨm peut être évaluée par double coloration avec le colorant lipophile chargé positivement, l’ester éthylique de tétraméthylrhodamine, l’EMTC et le 7-AAD. Le colorant TMRE s’accumule dans la membrane interne des mitochondries intactes lorsque le potentiel membranaire est élevé. Les mitochondries dépolarisées démontrent une diminution de la fluorescence. Les cellules vivantes avec mitochondries polarisées (membrane mitochondriale intacte) colorent positive pour TMRE et négative pour 7-AAD. Les cellules mortes avec coloration mitochondriale dépolarisée négative pour TMRE et positive pour 7-AAD31.
Les caspases sont une famille de protéases intracellulaires qui, lorsqu’elles sont activées, signalent et exécutent l’apoptose26,27. Les caspases terminales bourreaux (3,6,7) affectent l’apoptose tardive 29,32,33. Les activités des caspases-3 et -7 peuvent être mesurées par un substrat marqué par fluorescence qui, lorsqu’il est clivé, se lie à l’ADN et émet un signal fluorescent. De plus, toute atteinte à l’intégrité de la membrane cellulaire peut être évaluée par coloration au 7-AAD. Les cellules apoptotiques sont colorées positives pour le colorant liant l’ADN mais négatives pour le 7-AAD. Coloration tardive apoptotique et cellules mortes positive pour les deux colorants34.
L’apoptose tardive est caractérisée par des dommages à l’ADN27,29,35, qui peuvent être évalués par l’ataxiatelangiectasie phosphorylée kinase mutée (ATM) et l’histone H2A.X. Les cassures d’ADN double brin (DSB) provoquent la phosphorylation de H2A.X. Anticorps marqués par fluorescence contre ATM et H2A. X peut déterminer les dommages à l’ADN. Détection négative de l’ATM et du H2A. X indique qu’il n’y a pas de dommages à l’ADN, tandis que la détection des deux colorants indique la présence de cassures double brin dans l’ADN36.
L’actinomycine D est un puissant inducteur de l’apoptose et agit en se liant à l’ADN pour bloquer les événements de transcription etde traduction 37. Cette étude visait à évaluer l’apoptose biochimique induite par l’actinomycine D dans la lignée cellulaire SiHa en analysant les biomarqueurs précoces et avancés de l’apoptose. Quatre biomarqueurs biochimiques de l’apoptose ont évalué les étapes séquentielles de la cascade apoptotique qui comprenaient la perte d’asymétrie de la membrane cellulaire, le changement du potentiel de la membrane mitochondriale, l’activation des caspases terminales et les dommages à l’ADN.
Protocole
REMARQUE : Ce protocole décrit les étapes de la préparation cellulaire, du dénombrement cellulaire, de la coloration cellulaire et de l’analyse des cellules SiHa traitées à l’actinomycine D à l’aide de tests commerciaux de cytométrie en flux mesurés et analysés sur un cytomètre de flux de paillasse (Figure 2).
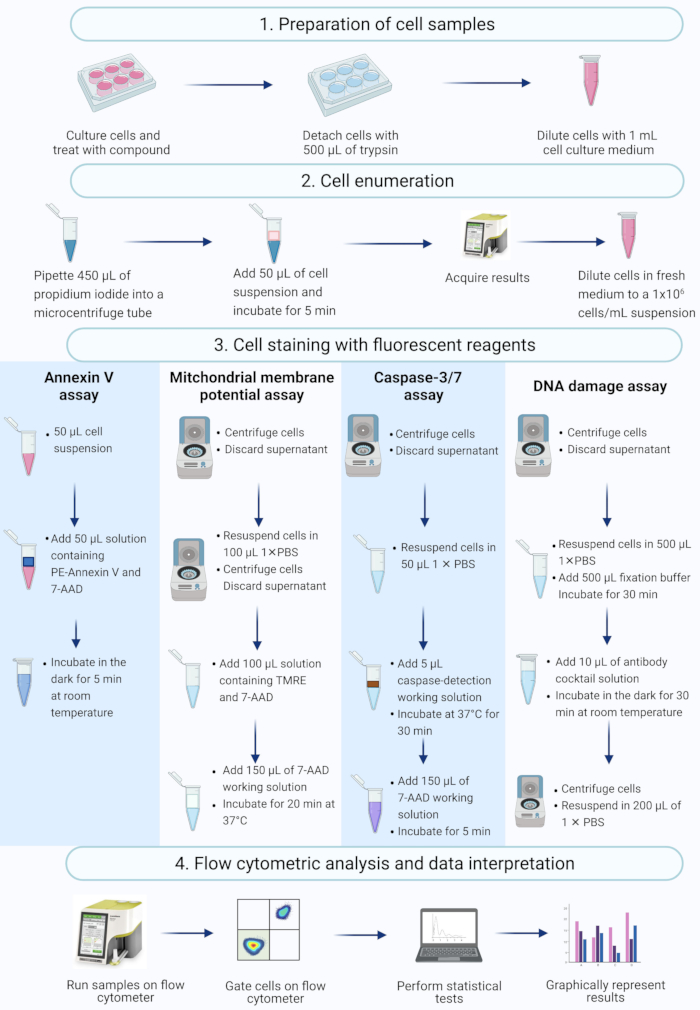
Figure 2 : Flux de travail pour la détection de biomarqueurs apoptotiques biochimiques par cytométrie en flux. Les cellules sont cultivées et traitées comme décrit à l’étape 1.1 du protocole. (1) Les cellules sont cultivées, (2) dénombrées et (3) colorées avec des réactifs fluorescents, et (4) analysées par un cytomètre de flux de paillasse. Les données sont ensuite examinées et analysées statistiquement. Abréviations : 7-AAD = 7-aminoactinomycine D; PBS = solution saline tamponnée au phosphate; PE = Phycoérythrine; TMRE = ester éthylique de tétraméthylrhodamine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Préparation de la culture cellulaire et traitements pour la cytométrie en flux
REMARQUE : Assurez-vous que la technique aseptique est suivie lors de la manipulation de cultures cellulaires.
- Cultiver des cultures cellulaires dans un environnement de CO 2 humidifié à 37 °C avec 5% de CO2. S’assurer que la culture cellulaire est confluente à environ 70 % dans le ballon parent avant de faire passer les cellules pour des expériences.
- Retirer le milieu de la fiole, laver les cellules avec 1x solution saline tamponnée au phosphate (PBS) et ajouter 500 μL de trypsine pour détacher les cellules. Une fois que les cellules commencent à s’arrondir et à se détacher de la fiole, frappez brusquement la base de la fiole sur le banc pour détacher les cellules. Ensuite, neutralisez la trypsine en ajoutant environ 5 ml de milieu de culture frais additionné de sérum de veau fœtal à 10% avant de compter les cellules.
- Cellules de semence à 15 000 cellules/mL dans 3 mL de milieu de culture cellulaire dans une plaque de culture cellulaire à 6 puits. Incuber les plaques de culture pendant une nuit à 37 °C avec 5% de CO2 pour permettre la fixation des cellules au fond du puits.
- Traiter les cultures expérimentales avec 100 ng/mL d’actinomycine D et les témoins en milieu et solvant avec un milieu de culture frais et du diméthylsulfoxyde (DMSO), respectivement, pendant 24 h. Recueillir le milieu usé dans un tube de 15 ml et laver les cellules avec 1x PBS. Ensuite, ajoutez le 1x lavage PBS au tube, puis ajoutez 500 μL de trypsine au puits. Ensuite, neutralisez la trypsine en ajoutant 5 ml de milieu de culture frais.
NOTE: (1) L’incubation prolongée de trypsine ou une neutralisation incomplète peut digérer les cellules et compromettre leur membrane cellulaire, ce qui peut fausser les résultats. En outre, il peut également modifier l’asymétrie de la membrane cellulaire et, par conséquent, l’accessibilité à la phosphatidylsérine. (2) Les cellules qui se sont détachées et ont flotté à la surface peuvent être incluses dans l’analyse ultérieure en centrifugeant le milieu retiré à 300 × g pendant 5 minutes et en remettant les cellules en suspension dans un milieu de culture frais.
2. Dénombrement des cellules à l’aide du test de viabilité
- Pipeter 450 μL d’iodure de propidium dans un tube de microcentrifugeuse. Ajouter 50 μL de la suspension cellulaire dans le tube microcentrifugeuse. Incuber le tube à température ambiante pendant 5 min. Dénombrer les cellules par cytométrie de flux (voir rubrique 4).
- Diluer tous les échantillons à une concentration de 1 × 106 cellules/mL avec un milieu de culture cellulaire avant de procéder aux tests d’apoptose.
3. Coloration des cellules pour la cytométrie en flux
REMARQUE : Les conditions stériles ne sont pas requises pour cette partie du protocole.
- Détection de l’externalisation de la phosphatidylsérine à l’aide de l’annexine V
- Ajouter 100 μL de suspension cellulaire dans un tube microcentrifuge. Ajouter 100 μL d’un mélange 1:1 d’annexine V conjuguée fluorescente et de réactif 7-AAD. Incuber à température ambiante pendant 20 min, à l’abri de la lumière.
- Analyse de la dépolarisation de la membrane mitochondriale
- Centrifuger 100 μL de la suspension cellulaire à 300 × g pendant 5 min et jeter le surnageant.
- Remettez les cellules en suspension dans 1 mL de 1x PBS, ajoutez 100 μL de solution de coloration TMRE à chaque échantillon et mélangez la suspension par rétropipetage doux.
- Incuber les cellules pendant 20 min dans un environnement de CO2 humidifié à 37 °C. Enveloppez les échantillons dans du papier d’aluminium propre pour les protéger de la lumière.
REMARQUE: Le potentiel de la membrane mitochondriale est un marqueur fonctionnel sensible aux changements mineurs de l’environnement cellulaire. Par conséquent, les échantillons doivent être incubés et mesurés dans des conditions identiques (température, pH et temps écoulé entre le début de l’incubation et la mesure fluorescente) pour maintenir la reproductibilité). Notez également qu’une protection inadéquate des échantillons contre la lumière provoque le photoblanchiment des fluorophores entraînant une fluorescence émise faussement faible. - Après l’incubation, ajouter 5 μL de la solution de coloration 7-AAD à chaque échantillon et mélanger. Incuber pendant 5 min à température ambiante, à l’abri de la lumière.
- Détection des caspases-3 et -7 terminales activées à l’aide du substrat de caspase DEVD
REMARQUE: Les solutions suivantes sont préparées avant d’effectuer ce test.- Diluez le peptide de liaison à l’ADN lié à DEVD dans du DMSO dans un rapport de 1:8 avec 1x PBS stérile pour que la solution de détection des caspases fonctionne. Conserver la solution sur de la glace ou à 2-8 °C, à l’abri de la lumière.
REMARQUE: Chaque échantillon nécessitera 5 μL de cette solution. - Ajouter 2 μL d’une solution mère 7-AAD à 148 μL de 1x PBS pour obtenir la solution de travail 7-AAD. Conserver la solution sur de la glace ou à 2-8 °C, à l’abri de la lumière.
REMARQUE: Chaque échantillon nécessitera 150 μL de cette solution. - Centrifuger 50 μL de la suspension cellulaire pendant 5 min à 300 × g. Jetez le surnageant. Remettez les cellules en suspension dans 50 μL de 1x PBS, suivi de 5 μL de la solution de travail de détection des caspases. Mélanger.
- Desserrer le bouchon des tubes et incuber pendant 30 min dans un environnement de CO2 humidifié à 37 °C, à l’abri de la lumière. Ajouter 150 μL de la solution de travail 7-AAD à chaque échantillon et mélanger. Incuber pendant 5 min à température ambiante, à l’abri de la lumière.
- Diluez le peptide de liaison à l’ADN lié à DEVD dans du DMSO dans un rapport de 1:8 avec 1x PBS stérile pour que la solution de détection des caspases fonctionne. Conserver la solution sur de la glace ou à 2-8 °C, à l’abri de la lumière.
- Détection des cassures d’ADN double brin et des dommages totaux à l’ADN
- Centrifuger 50 μL de la suspension cellulaire pendant 5 min à 300 × g. Jetez le surnageant.
- Remettez les cellules en suspension dans 500 μL de 1x PBS. Ajouter 500 μL d’un tampon de fixation à base de formaldéhyde et mélanger. Incuber les échantillons sur glace pendant 10 min.
- Centrifuger pendant 5 min à 300 × g et jeter le surnageant. Remettez les cellules en suspension dans 90 μL de 1x PBS dans un tube microcentrifugeux. Ajouter 10 μL de la solution d’anticorps dans le tube microcentrifugeux. Incuber à température ambiante pendant 30 min dans l’obscurité.
- Ajouter 100 μL de 1x PBS et centrifuger pendant 5 min à 300 × g. Jetez le surnageant. Remettez les cellules en suspension dans 200 μL de 1x PBS.
4. Exécutez des échantillons sur le cytomètre en flux.
- Vérifiez les performances analytiques du cytomètre en flux en exécutant le kit de vérification du système de l’instrument. Ne procédez pas à l’exécution d’échantillons tant que toutes les vérifications ne sont pas terminées et réussies.
- Localisez le test souhaité en parcourant le catalogue des tests préprogrammés sur l’instrument et sélectionnez Exécuter le test.
- Mélanger l’échantillon en l’arrosant doucement avant de charger l’échantillon sur le cytomètre en flux.
REMARQUE: Un mélange adéquat garantit que les cellules restent en suspension et empêche le faible nombre de cellules. - Tout d’abord, chargez un échantillon de contrôle négatif sur le cytomètre de flux et sélectionnez Exécuter (Ajuster les paramètres) afin que l’instrument commence à aspirer l’échantillon et fournisse un aperçu en temps réel des événements détectés. Reportez-vous au tableau des matériaux pour connaître le nom et les détails de l’instrument .
- À l’aide de l’aperçu en direct, ajustez les seuils de fluorescence et de taille de cellule et dessinez une porte rectangulaire autour de la population cellulaire. Faites glisser le marqueur de seuil pour exclure les débris cellulaires. Sélectionnez Suivant (Définir le profil d’intégrité) pour continuer.
REMARQUE: Il est important de connaître la taille des cellules. Faites glisser les curseurs et observez les changements dans la façon dont les événements détectés sont tracés sur l’aperçu en temps réel, car cela permettra une sélection précise des seuils. Si les débris cellulaires ne sont pas exclus à ce stade, ils ne peuvent pas être éliminés dans les analyses post-acquisition. - Appuyez et faites glisser les marqueurs de quadrant pour séparer les populations cellulaires et pour que l’instrument trace les événements détectés en temps réel. Utilisez ces diagrammes pour guider l’utilisateur final sur l’emplacement approprié des marqueurs du quadrant. Sélectionnez Suivant (Vérifier les échantillons) pour continuer afin que l’instrument affiche un résumé des paramètres. Après avoir examiné les paramètres, sélectionnez Suivant (Vérifier les paramètres) pour appliquer ces paramètres à tous les échantillons de l’expérience.
REMARQUE: L’instrument fournit un aperçu en direct de 2 minutes des cellules utilisées pour ajuster les paramètres de l’instrument. Si ce délai expire, l’instrument libère l’échantillon et les étapes 4.2.2 à 4.2.4 devront être répétées. Retirer l’échantillon et bien mélanger avant de recharger et de continuer. - Porte une population de cellules en dessinant une région autour de la population cellulaire. Ajustez les seuils de fluorescence et de taille de cellule à l’aide des curseurs situés sur les axes x et y de l’aperçu en direct. Appliquez ces paramètres à tous les échantillons de l’expérience.
- Mélangez le premier échantillon en l’arrosant doucement et chargez le premier échantillon sur le cytomètre en flux et sélectionnez Suivant. Nommez l’exemple et sélectionnez Exécuter pour que le système commence à exécuter l’exemple.
REMARQUE: L’instrument ne peut exécuter qu’un seul échantillon à la fois. - Une fois que tous les échantillons ont été exécutés, enregistrez l’expérience en lui donnant un titre approprié. Enregistrez les paramètres de l’expérience en cours pour les récupérer lors de futures exécutions (facultatif).
- Mélanger l’échantillon en l’arrosant doucement avant de charger l’échantillon sur le cytomètre en flux.
5. Analyse post-acquisition
- Si nécessaire, effectuer un réglage fin des barrières ou des marqueurs de quadrant après l’acquisition.
- Localisez l’expérience qui nécessite un ajustement en naviguant dans le navigateur de fichiers du système et ouvrez l’expérience.
- Appuyez sur l’aperçu miniature de l’intrigue pour l’agrandir. Appuyez sur les coins supérieur gauche ou inférieur droit de la porte de la cellule pour ajuster les dimensions de la porte. Pour ajuster les marqueurs de quadrant, appuyez sur l’intersection des lignes verticales et horizontales pour déplacer les marqueurs tels quels. Pour ajuster l’angle de l’une ou l’autre ligne, appuyez sur la ligne et faites glisser la poignée.
- Ajustez les marqueurs (comme décrit précédemment aux étapes 4.1.3 à 4.1.4) comme vous le souhaitez et appliquez ces paramètres à tous les échantillons de l’expérience en sélectionnant l’icône de coche , en marquant tous les échantillons et en sélectionnant Accepter.
6. Analyse statistique
- Effectuer des tests en triple exemplaire et effectuer une analyse de variance (ANOVA) avec un test de Bonferroni post-hoc pour évaluer les différences significatives entre les échantillons traités et les témoins.
REMARQUE : Le test statistique de choix dépend de l’investigateur et des variables analysées.
Résultats
Les résultats du nombre de cellules et de la viabilité (figure 3) ont montré que 95,2 % des cellules de l’échantillon étaient vivantes et 4,8 % étaient mortes. La concentration totale de cellules dans l’échantillon original était de 6,20 x 106 cellules/mL.
L’essai de l’annexine V et de la mort cellulaire (Figure 4) a montré une augmentation significative (p < 0,0001) des cellules apoptotiques dans les cellules SiHa traitées avec 100 ng/mL d’actinomycine D par rapport aux témoins. Étant donné que la coloration à l’annexine V est augmentée dans les cellules au cours de l’apoptose à un stade précoce, cette découverte suggère que 100 ng / mL d’actinomycine D a induit l’apoptose dans les cellules SiHa.
Le test de potentiel transmembranaire électrochimique mitochondrial (Figure 5) a démontré une diminution significative (p < 0,0001) des profils de santé cellulaire (vivants, dépolarisés et vivants, dépolarisés et morts, morts) entre l’actinomycine D, le contrôle du milieu et le contrôle des solvants. Ces données suggèrent que 100 ng/mL d’actinomycine D induisent une dépolarisation mitochondriale dans les cellules SiHa.
Le dosage des caspases 3/7 (Figure 6) a démontré une activation significative (p < 0,0001) des caspases 3 et 7 dans les cellules SiHa traitées avec 100 ng/mL d’actinomycine D par rapport aux témoins. Ces résultats démontrent que 100 ng/mL d’actinomycine D induisaient l’apoptose dans les cellules SiHa.
L’analyse des dommages à l’ADN (figure 7) a montré que 100 ng/mL d’actinomycine D induisaient significativement (p < 0,0001) des marqueurs de dommages à l’ADN, ATM et H2A. X, dans les cellules SiHa. Cette découverte suggère une augmentation significative des dommages à l’ADN dans les cellules SiHa traitées avec de l’actinomycine D.
Les résultats d’expériences sous-optimales (figure 8) démontrent des considérations analytiques dans tous les essais. La concentration cellulaire affecte l’exactitude des données. Dans la figure 8A, le nombre de cellules est inacceptablement bas. Les populations cellulaires fermées dans les 4 quadrants du diagramme de points ont une faible intensité de signal. Le fabricant optimise le dosage pour 300-700 cellules/μL dans le volume final de l’échantillon. Cet exemple illustre l’importance d’utiliser la concentration correcte de l’échantillon prescrite par le fabricant.
De plus, des concentrations cellulaires élevées ont également entraîné des résultats erronés (figure 8B). Les cultures moyennes et expérimentales ont démontré 99,95% et 100% de cellules vivantes, respectivement. Le débit des deux essais dépassait la concentration optimisée de 100 à 500 cellules/μL du fabricant et nécessitait une dilution avec 1x tampon de dosage pour éviter une analyse inexacte.
L’agglutination cellulaire doit être évitée lors de la préparation des cultures expérimentales car elle produit des résultats erronés en raison de l’augmentation des indices de taille cellulaire, comme illustré dans le test de l’annexe V. La figure 8C montre un double problème de concentration élevée de cellules qui dépasse les instructions du fabricant et d’agglutination des cellules, comme en témoignent les indices de taille des cellules supérieurs à 4 dans le milieu témoin SiHa. La concentration cellulaire élevée est illustrée par la feuille de cellules formant un plan rouge vif de cellules dans des cultures moyennes, démontrant des populations de cellules apoptotiques discordantes.
Une coloration prolongée des cultures peut entraîner une liaison non spécifique des protéines et entraîner des résultats erronés, comme l’a démontré le test de l’annexe V. La figure 8D montre des résultats similaires pour les cultures moyennes et expérimentales en raison d’une coloration prolongée.
Une mauvaise manipulation des échantillons, une trypsinisation prolongée des cellules adhérentes, un pipetage vigoureux pendant les étapes de lavage et des étapes de centrifugation prolongées et à grande vitesse provoquent une lyse cellulaire et de grandes quantités de débris cellulaires. Dans la figure 8E, les cultures analysées par le test de caspase 3/7 démontrent une augmentation des débris cellulaires mise en évidence par un indice de petite taille cellulaire (indice de taille cellulaire <2,2). Il faut donc faire preuve de prudence lors de la préparation des échantillons pour l’acquisition des données.
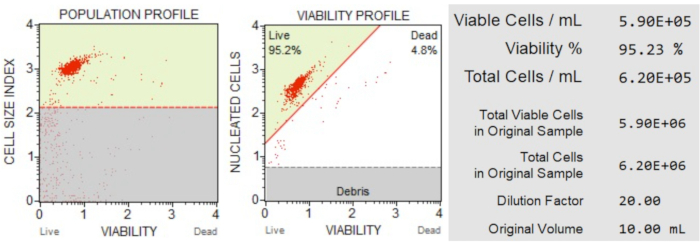
Figure 3 : Essai de numération cellulaire et de viabilité. Le profil de population sépare les débris des cellules vivantes et mortes. Le diagramme à points bidimensionnel est fermé et divise les populations de cellules vivantes et mortes. Le panneau d’information fournit des données quantitatives sur le nombre de cellules, le pourcentage de cellules viables totales et le nombre total de cellules viables dans l’échantillon. Ces données peuvent être utilisées pour normaliser le nombre de cellules dans tous les échantillons pour des analyses d’apoptose ultérieures. Veuillez cliquer ici pour voir une version agrandie de cette figure.
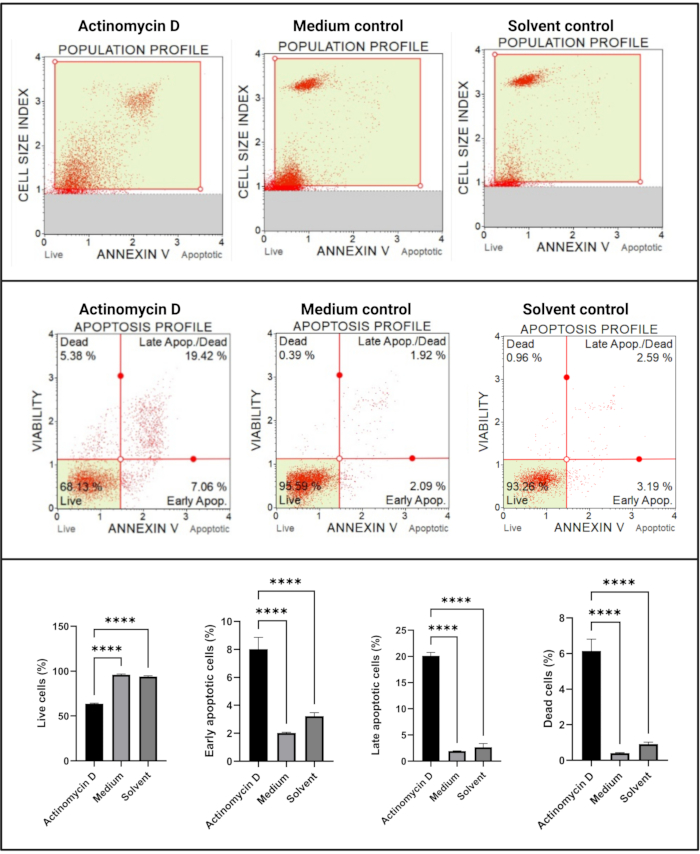
Figure 4 : Dosage de l’annexe V. Tous les échantillons présentent des paramètres de déclenchement identiques, et l’analyse statistique de chaque sous-population révèle une augmentation significative de l’apoptose dans les cellules traitées avec de l’actinomycine D. Tous les essais ont été effectués en trois expériences indépendantes, et chaque expérience a été dosée en trois exemplaires. Les données sont présentées sous forme de moyenne ± écart-type, et p < 0,05 a été considéré comme statistiquement significatif. p < 0,0001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
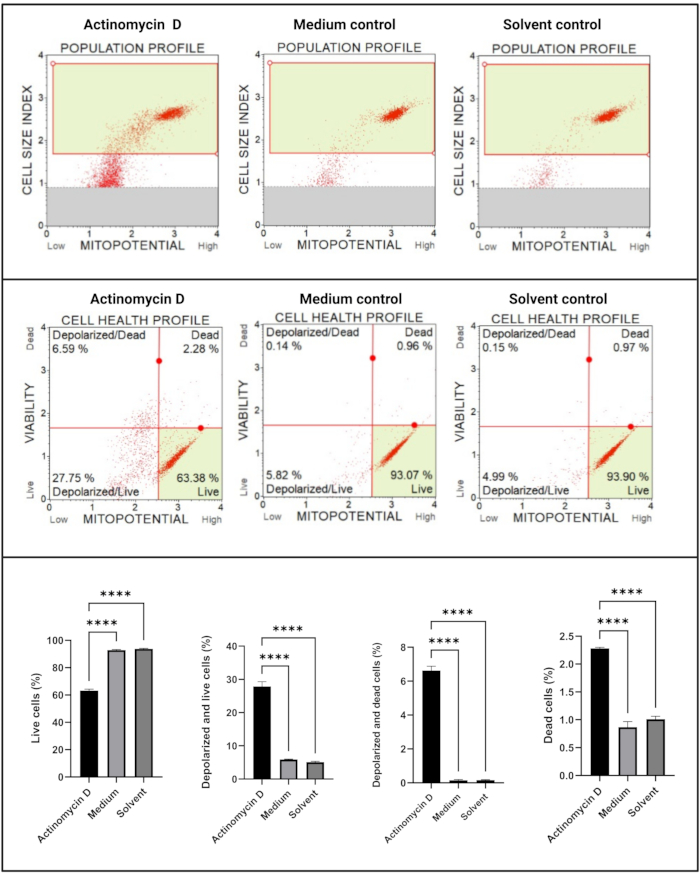
Figure 5 : Essai du potentiel transmembranaire électrochimique mitochondrial. Tous les échantillons présentent des paramètres de déclenchement identiques, et l’analyse statistique de chaque sous-population révèle une perturbation significative du potentiel de la membrane mitochondriale dans les cellules traitées à l’actinomycine D. Tous les essais ont été effectués en trois expériences indépendantes, et chaque expérience a été dosée en trois exemplaires. Les données sont présentées sous forme de moyenne ± écart-type, et p < 0,05 a été considéré comme statistiquement significatif. p < 0,0001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
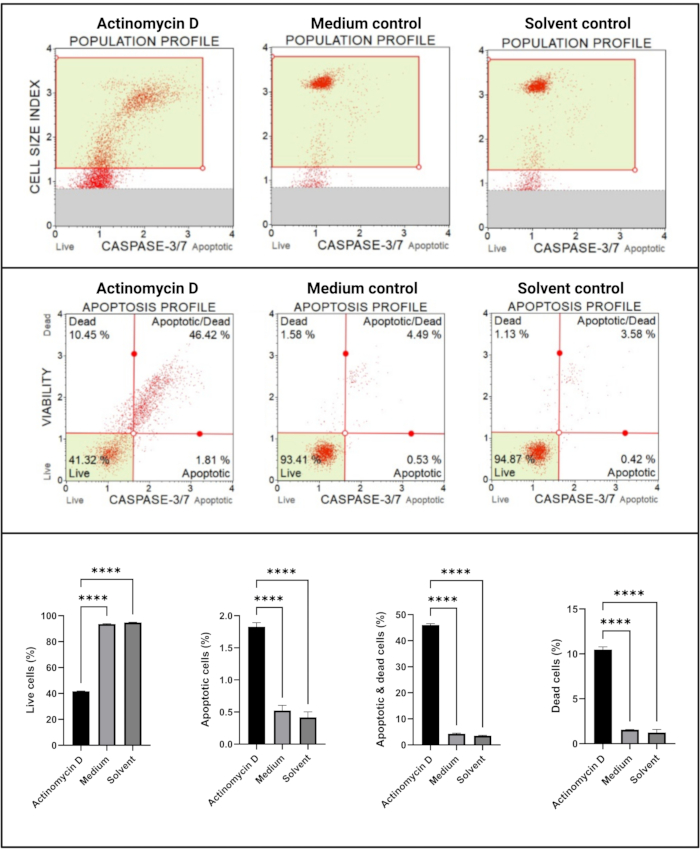
Figure 6 : Dosage de détection de la caspase 3/7. Tous les échantillons présentent des paramètres de déclenchement identiques, et l’analyse statistique de chaque sous-population révèle une augmentation significative de l’activité de la caspase 3/7 dans les cellules traitées à l’actinomycine D. Tous les essais ont été effectués en trois expériences indépendantes, et chaque expérience a été dosée en trois exemplaires. Les données sont présentées sous forme de moyenne ± écart-type, et p < 0,05 a été considéré comme statistiquement significatif. p < 0,0001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
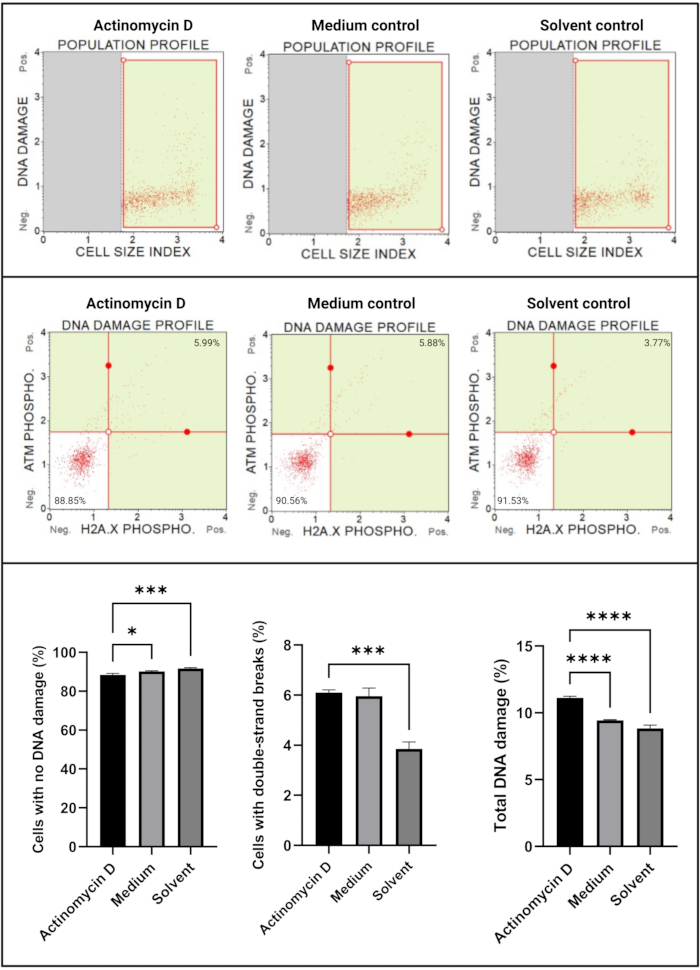
Figure 7 : Essai des dommages à l’ADN. Tous les échantillons présentent des paramètres de déclenchement identiques, et l’analyse statistique de chaque sous-population révèle une augmentation significative des dommages à l’ADN double brin et des dommages totaux à l’ADN dans les cellules traitées avec de l’actinomycine D. Tous les essais ont été effectués sur trois expériences indépendantes, et chaque expérience a été testée en trois exemplaires. Les données sont présentées sous forme de moyenne ± écart-type, et p < 0,05 a été considéré comme statistiquement significatif. * p < 0,05; p < 0,001; p < 0,0001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
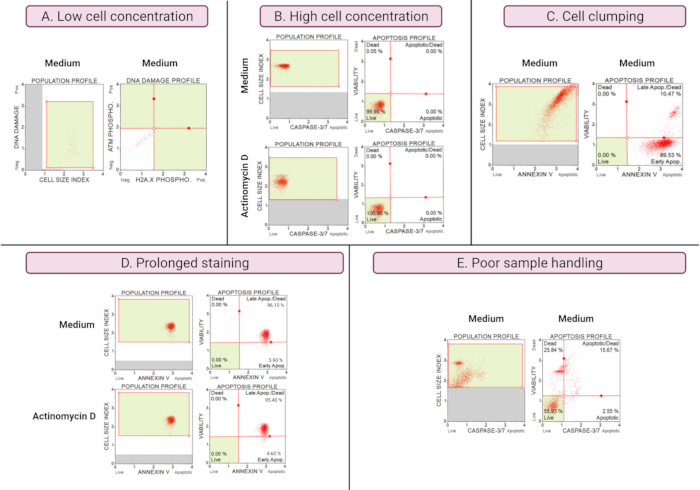
Figure 8 : Les conditions expérimentales sous-optimales donnent de mauvais résultats. (A) Faible concentration de cellules, (B) forte concentration de cellules, (C) agglutination et agrégation cellulaires évidentes par un indice de taille cellulaire élevé, (D) coloration prolongée des échantillons cellulaires évidente par une coloration positive accrue dans les deux échantillons, et (E) mauvaise manipulation des échantillons évidente par une augmentation des débris cellulaires (indice de taille des cellules < 2,2). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Dans cette étude, les cellules SiHa traitées à l’actinomycine D analysées par FC ont révélé des biomarqueurs précoces et tardifs significatifs de l’apoptose. Les conditions sous-optimales pour la préparation, le dénombrement et la coloration des cellules ont permis d’identifier des résultats inexacts, soulignant la nécessité de respecter scrupuleusement les instructions du fabricant lors de l’exécution de la FC.
Cette étude de l’apoptose par identification précoce et tardive des biomarqueurs est conforme aux lignes directrices du NCCD1 pour l’étude de l’apoptose. Les cultures de SiHa traitées à l’actinomycine D ont démontré des biomarqueurs positifs pour les stades apoptotiques précoces et tardifs. Le test Annexin V/PI et le test de perméabilité mitochondriale ont montré que l’actinomycine D induisait respectivement un schéma PS-flip et une dissipation de la transition de la membrane mitochondriale. Une fois que les cellules apoptotiques atteignent le point de non-retour induit par la perturbation mitochondriale, les caspases terminales sont activées3,7. L’activation des caspases terminales 3 et 7 observée dans cette étude indique une apoptose à un stade avancé. De plus, l’activation terminale des caspases provoque un clivage internucléosomique de l’ADN et une fragmentation étendue de l’ADN, ce qui a été classiquement rapporté comme un modèle d’escabeau observé par électrophorèsesur gel 28,38.
Les dégâts nucléaires avec l’ATM et H2A. L’analyse des dommages à l’ADN X FC a montré des cassures double brin dans l’ADN et des dommages totaux à l’ADN. Ces résultats ont confirmé les dommages nucléaires apoptotiques classiques induits par la caspase en aval (caryorrhexis et karyorrlyse) dans des cultures expérimentales. L’utilisation de multiples biomarqueurs cytométriques en flux a ainsi détecté les événements séquentiels à plusieurs stades dans l’apoptose et identifié avec précision et reproductibilité les populations cellulaires aux stades apoptotiques précoces et tardifs. Ces résultats sont cohérents avec les caractéristiques pro-apoptotiques connues de l’actinomycine D dans le traitement du cancer chez les humains 37,39,40,41 et soutiennent davantage l’utilisation de l’actinomycine D comme témoin positif dans les expériences de culture cellulaire FC sur l’apoptose.
Le contrôle des populations cellulaires dans cette étude a été éclairé par des contrôles négatifs de milieu et de solvant, qui ont séparé les cellules apoptotiques des cellules saines. Alternativement, un mélange de populations de témoins positifs et négatifs peut également être utilisé pour définir les populations de cellules vivantes et apoptotiques afin de définir les portes de population cellulaire 7,9. Une fois que les états cellulaires malades et sains sont définis et fermés, les paramètres du modèle peuvent être appliqués à toutes les cultures expérimentales et témoins ultérieures.
Le strict respect du protocole FC est essentiel pour éviter les faux résultats. Au cours de l’optimisation du protocole, les problèmes suivants ont été observés: (1) faible concentration cellulaire, (2) concentration cellulaire élevée, (3) agglutination cellulaire, (4) coloration prolongée et (5) mauvaise manipulation des échantillons. Ces problèmes peuvent être évités par le strict respect des exigences du protocole optimisé. Cela souligne la nature cruciale des étapes préanalytiques et analytiques pour que FC obtienne des données exactes. Pendant la préparation des cellules, la trypsinisation, le pipetage, la centrifugation et les dilutions doivent être effectués avec soin. La sur-trypsinisation et le pipetage vigoureux peuvent entraîner un cisaillement chimique et mécanique des cellules, respectivement. Une centrifugation prolongée et à grande vitesse peut entraîner une dégradation cellulaire et un nombre élevé de débris cellulaires. Une concentration cellulaire optimale est nécessaire pour minimiser l’acquisition incorrecte d’événements cellulaires. Par conséquent, les suspensions de cellules primaires doivent être diluées pour obtenir une concentration cellulaire optimale.
De plus, lors de la manipulation des échantillons, il faut prendre soin d’éviter l’agglutination et la fragmentation cellulaires et de s’assurer que les cellules restent en suspension pendant l’analyse. La manipulation des échantillons pour éviter l’agglutination des cellules permet un flux de cellule laminaire unique, empêche le blocage mécanique du tube capillaire de l’instrument et freine les indices de grande taille de cellule parasites. Une autre mise en garde consiste à protéger les cultures contre la lumière pour éviter la photo-oxydation et la trempe des fluorophores dans les tests afin d’éviter les résultats faussement négatifs. Des précautions doivent être prises pour assurer une exposition minimale à la lumière à l’étape de coloration des cellules et aux étapes de traitement ultérieures. De plus, des temps d’immunomarquage prolongés peuvent entraîner des résultats faussement positifs, car les protéines ne sont pas spécifiquement colorées. Par conséquent, le respect des périodes de coloration d’incubation prescrites par le fabricant est important.
En résumé, FC peut détecter avec précision l’apoptose et faire la distinction entre les biomarqueurs de l’apoptose précoce et tardive en culture cellulaire. En outre, les progrès technologiques ont conduit à la fabrication de cytomètres de flux de paillasse pour les scientifiques non experts afin d’étudier la santé cellulaire et les voies de signalisation intracellulaires complexes.
Déclarations de divulgation
Luminex® Corporation a aimablement fourni les frais de traitement des articles.
Remerciements
L’étude a été financée par la National Research Foundation (NRF) et le South African Medical Research Council (SAMRC). Nous tenons à remercier le National Health Laboratory Service (NHLS) pour l’achat de l’analyseur de cellules de goyave Muse. Toutes les figures de cette publication ont été créées avec Biorender.com.
matériels
| Name | Company | Catalog Number | Comments |
| 6-well plates | Lasec | P1PLA044C-000006 | |
| Dimethyl Sulfoxide | Sigma-Aldrich | D8418 | |
| DMEM | ThermoFisher | 41966052 | |
| Glutamine | Sigma-Aldrich | P10-040500 | |
| Guava Muse Cell Analyzer | Luminex | 0500-3115 | |
| Microcentrifuge tubes/Eppendorf | Merck | EP0030122208-200EA | |
| Muse Annexin V kit | Merck | MCH100105 | |
| Muse Caspase-3/7 kit | Merck | MCH100108 | |
| Muse Count and Viability kit | Merck | MCH600103 | |
| Muse DNA Damage kit | Merck | MCH200107 | |
| Muse MitoPotential kit | Merck | MCH100110 | |
| PBS Buffer | ThermoFisher | 70013065 | |
| Pen-strep | Sigma-Aldrich | P4333 | |
| SiHa cells | ATCC | CRL-1550 | |
| T25 culture flasks | Sigma-Aldrich | C6231 | |
| Trypsin | Pan Biotech | P10-040500 |
Références
- Galluzzi, L., et al. Molecular mechanisms of cell death: Recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death and Differentiation. 25 (3), 486-541 (2018).
- Kerr, J. F., Wyllie, A. H., Currie, A. R. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. British journal of cancer. 26 (4), 239-257 (1972).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Edinger, A. L., Thompson, C. B. Death by design: apoptosis, necrosis and autophagy. Current Opinion in Cell Biology. 16 (6), 663-669 (2004).
- Arends, M. J., Morris, R. G., Wyllie, A. H. Apoptosis. The role of the endonuclease. The American journal of pathology. 136 (3), 593-608 (1990).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Darzynkiewicz, Z., Traganos, F., Al-Rubeai, M. . Apoptosis. , 33-73 (1998).
- Wlodkowic, D., Skommer, J., Darzynkiewicz, Z. Flow cytometry-based apoptosis detection. Methods in molecular biology. 559, 19-32 (2009).
- . Introduction to Flow Cytometry Basics Available from: https://www.bio-rad-antibodies.com/introduction-to-flow-cytometry.html (2021)
- Telford, W. G., Komoriya, A., Packard, B. Z. Detection of localized caspase activity in early apoptotic cells by laser scanning cytometry. Cytometry. 47 (2), 81-88 (2002).
- Castedo, M., et al. Quantitation of mitochondrial alterations associated with apoptosis. J Immunol Methods. 265 (1-2), 39-47 (2002).
- McKinnon, K. M. Flow Cytometry: An Overview. Current protocols in immunology. 120, 1-11 (2018).
- Macey, M. G. Flow cytometry: principles and clinical applications. Med Lab Sci. 45 (2), 165-173 (1988).
- Darzynkiewicz, Z., et al. Features of apoptotic cells measured by flow cytometry. Cytometry. 13 (8), 795-808 (1992).
- Darzynkiewicz, Z., et al. Cytometry in cell necrobiology: Analysis of apoptosis and accidental cell death (necrosis). Cytometry. 27 (1), 1-20 (1997).
- Ormerod, M. G. The study of apoptotic cells by flow cytometry. Leukemia. 12 (7), 1013-1025 (1998).
- van Engeland, M., Nieland, L. J., Ramaekers, F. C., Schutte, B., Reutelingsperger, C. P. Annexin V-affinity assay: a review on an apoptosis detection system based on phosphatidylserine exposure. Cytometry. 31 (1), 1-9 (1998).
- Vermes, I., Haanen, C., Reutelingsperger, C. Flow cytometry of apoptotic cell death. Journal of Immunological Methods. 243 (1), 167-190 (2000).
- Jahan-Tigh, R. R., Ryan, C., Obermoser, G., Schwarzenberger, K. Flow cytometry. J Invest Dermatol. 132 (10), 1-6 (2012).
- Lövborg, H., Gullbo, J., Larsson, R. Screening for apoptosis-classical and emerging techniques. Anti-cancer drugs. 16 (6), 593-599 (2005).
- Vorobjev, I. A., Barteneva, N. S. Multi-parametric imaging of cell heterogeneity in apoptosis analysis. Methods. 112, 105-123 (2017).
- Telford, W. G., Komoriya, A., Packard, B. Z. Multiparametric analysis of apoptosis by flow and image cytometry. Methods in molecular biology. 263, 141-160 (2004).
- Kagami, S., Rizzo, H. L., Lee, J. J., Koguchi, Y., Blauvelt, A. Circulating Th17, Th22, and Th1 cells are increased in psoriasis. J Invest Dermatol. 130 (5), 1373-1383 (2010).
- . Muse® Annexin V & Dead Cell Kit Available from: https://www.luminexcorp.com/muse-annexin-v-dead-cell-kit/ (2019)
- Roederer, M. Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats. Cytometry. 45 (3), 194-205 (2001).
- Kroemer, G., et al. Classification of cell death: recommendations of the Nomenclature Committee on Cell Death. Cell Death and Differentiation. 12 (2), 1463-1467 (2005).
- Apoptosis assays and markers guide. Abcam Available from: https://www.abcam.com/kits/apoptosis-assays (2021)
- Vermes, I., Haanen, C., Steffens-Nakken, H., Reutelingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. Journal of Immunological Methods. 184 (1), 39-51 (1995).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicologic Pathology. 35 (4), 495-516 (2007).
- Saelens, X., et al. Toxic proteins released from mitochondria in cell death. Oncogene. 23 (16), 2861-2874 (2004).
- Muse™ MitoPotential Kit User's Guide. Luminex Corporation Available from: https://www.luminexcorp.com/muse-mitopotential-kit (2013)
- McIlwain, D. R., Berger, T., Mak, T. W. Caspase functions in cell death and disease. Cold Spring Harbor Perspectives in Biology. 5 (4), 008656 (2013).
- Wigdal, S. S., Kirkland, R. A., Franklin, J. L., Haak-Frendscho, M. Cytochrome c release precedes mitochondrial membrane potential loss in cerebellar granule neuron apoptosis: lack of mitochondrial swelling. Journal of Neurochemistry. 82 (5), 1029-1038 (2002).
- Muse® Caspase-3/7 Kit. Luminex Corporation Available from: https://www.luminexcorp.com/muse-caspase-3-7-kit/#overview (2019)
- Häcker, G. The morphology of apoptosis. Cell and Tissue Research. 301 (1), 5-17 (2000).
- Muse® Multi-Color DNA Damage Kit User's Guide. Luminex Corporation Available from: https://www.luminexcorp.com/muse-multi-color-dna-damage-kit/#overview (2020)
- Kleeff, J., Kornmann, M., Sawhney, H., Korc, M. Actinomycin D induces apoptosis and inhibits growth of pancreatic cancer cells. International journal of cancer. 86 (3), 399-407 (2000).
- Wlodkowic, D., Skommer, J., Darzynkiewicz, Z. Cytometry of apoptosis. Historical perspective and new advances. Experimental oncology. 34 (3), 255-262 (2012).
- Szeberenyi, J. The effect of actinomycin D on RNA metabolism in human cells. Biochem Mol Biol Educ. 34 (1), 50-51 (2006).
- Ginell, S., Lessinger, L., Berman, H. M. The crystal and molecular structure of the anticancer drug actinomycin D--some explanations for its unusual properties. Biopolymers. 27 (5), 843-864 (1988).
- Hou, M. H., Robinson, H., Gao, Y. G., Wang, A. H. Crystal structure of actinomycin D bound to the CTG triplet repeat sequences linked to neurological diseases. Nucleic Acids Res. 30 (22), 4910-4917 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon