Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Entwicklung eines Lateral Flow Immunochromatographic Strip für den schnellen und quantitativen Nachweis niedermolekularer Verbindungen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Membranbasierte Lateral-Flow-Immunchromatographiestreifen (ICSs) sind nützliche Werkzeuge für die kostengünstige Selbstdiagnose und wurden effizient auf die Erkennung von Toxinen, physiologischen Indizes und klinischen Biomarkern angewendet. In diesem Protokoll beschreiben wir detailliert die Schritte zur Entwicklung eines schnellen, empfindlichen und quantitativen Lateral-Flow-Immunoassays (mit AuNPs als Marker und mAbs als Sonde). Das Verfahren beschreibt die Herstellung und Charakterisierung von kolloidalem Gold, die Synthese des AuNP-mAb-Konjugats, den Aufbau des immunchromatographischen Streifens und die methodische Untersuchung des Assays. Die Ergebnisse zeigten, dass die endgültigen Streifen weiter für die schnelle und bequeme Selbstdiagnose eines kleinen Moleküls verwendet werden können, was ein alternatives Werkzeug bei der schnellen und präzisen Analyse physiologischer und biologischer Indizes sein kann.
Einleitung
Membranbasierte Lateral Flow Immunochromatographic Strips (ICSs) sind nützliche Werkzeuge für eine kostengünstige und schnelle Erkennung. Die Nitrocellulosemembran als Träger und kolloidales Gold als Marker für schnelldiagnostische Reagenzien der Immunchromatographie sind die am häufigsten verwendete POCT-Methode (Point of Care Testing), und der Testumfang des Projekts ist breiter. Von ihrer ursprünglichen Anwendung bei der Überwachung während der Schwangerschaft wurde ihre Verwendung erweitert, um Blutgerinnungszustand1,2, Myokardverletzung3, Veterinärmedizin4, Pestizidrückstände5, Infektionskrankheiten6 und Arzneimittelkonzentrationen zu überwachen. Weitere Arten von Proben können beurteilt werden, einschließlich Urin, Speichel, Vollblut, Serum und andere Körperflüssigkeiten7,8,9.
In den letzten Jahren wurden zahlreiche neuartige Assays zum Nachweis von Biomarkern bei der Diagnose von Erkrankungen entwickelt, darunter HPLC, UPLC, LC-MS und ELISA, die sensibel und genau, glaubwürdig und spezifisch sind. Diese Methoden erfordern jedoch eine ausgeklügelte Instrumentierung, eine komplexe Vorverarbeitung und zeitaufwändige Behandlungen9. Daher ist die Entwicklung einer schnelleren und bequemeren Point-of-Care-Diagnosestrategie für den Selbst- und Echtzeitnachweis von medizinischen Wirkstoffen dringend10,11.
Die Popularität von ICS, insbesondere für gängige Tests, wird durch ihre Benutzerfreundlichkeit angetrieben, da sie keine Profis oder aufwendige instrumentenaufwändige Setups erfordern12. Mit anderen Worten, Menschen, die keine spezielle Ausbildung haben, können Streifen oder Selbsttestsbedienen 13. Die Ergebnisse des Tests können in 5 Minuten erhalten werden, was bedeutet, dass es für Standortinspektionen verwendet werden kann14. Darüber hinaus könnten nach unseren Berechnungen die Kosten für Streifen niedriger als 1 RMB15sein, was bedeutet, dass die Tests kostengünstig sind, um16zu fördern. Daher ist das ICS ein relativ genaues, einfaches und kostengünstiges Einweggerät. ICSs auf Basis von kolloidalem Gold17,18 werden auch bei der schnellen COVID-19-Erkennung eingesetzt.
Das Prinzip des ICS kann in Sandwich-ICS und wettbewerbsfähige ICS unterteilt werden. Abbildung 1A ist ein schematisches Diagramm des Sandwich-ICS, das hauptsächlich zum Nachweis makromolekularer Substanzen wie Proteine, einschließlich Tumormarker, Entzündungsfaktoren und humanes Chorion-Gonadotropin (HCG, Early Pregnancy Antigen) verwendet wird. Bei dieser Methode werden gepaarte Antikörper verwendet, die auf verschiedene Epitope des Antigens abzielen, und der Capture-Antikörper wird auf der NC-Membran als Testlinie getrocknet. Markierte Antikörper werden auf dem Konjugatpad getrocknet, und sekundäre Antikörper werden als Kontrolllinie verwendet.
Abbildung 1B ist ein schematisches Diagramm des kompetitiven ICS, das hauptsächlich zum Nachweis niedermolekularer Substanzen verwendet wird (MWCO < 2000 Da). Das Beschichtungsantigen wird als Testlinie auf der NC-Membran fixiert und der markierte Antikörper auf dem Konjugatpad getrocknet. Während des Nachweises fließen die Probe und der markierte Antikörper unter Kapillarwirkung durch die Nachweislinie, und das beschichtete Antigen bindet kompetitiv freies Antigen in der Probe und entwickelt eine rote Farbe auf der Nachweislinie.
Kürzlich haben wir das Verfahren der monoklonalen Antikörperbildung gegen Naturprodukte beschrieben19. In dieser Arbeit entwickelten wir einen neuartigen Lateral-Flow-Immunoassay auf Basis des vorbereiteten Anti-SSD mA20 für eine schnelle Vor-Ort-Erkennung. Die Ergebnisse zeigen, dass der Immunchromatographie-Assay ein unverzichtbares und bequemes Werkzeug zum Nachweis von aus Naturprodukten gewonnenen Verbindungen ist.
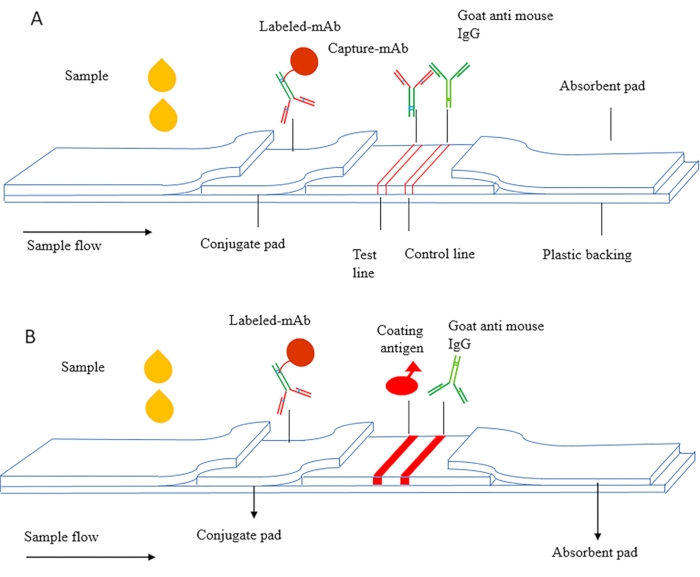
Abbildung 1 Schematische Darstellung des Immunchromatographie-Assays (A) Sandwich-immunchromatographische Teststreifen. (B) Indirekte kompetitive immunchromatographische Teststreifen. Diese Zahl wurde modifiziert von Zhang et al.,201821. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
Alle in dieser Studie durchgeführten Verfahren wurden vom Ethics Review Committee der Beijing University of Chinese Medicine genehmigt (Zulassungsnummer 2017BZYYL00120).
1. Herstellung und Charakterisierung von kolloidalem Gold
HINWEIS: Da kolloidales Gold leicht an der Innenwand des Gefäßes adsorbiert wird und anfällig für Ausfällung durch Verunreinigungen ist, sollte das Gefäß für die Synthese und Lagerung von kolloidalem Gold gründlich gereinigt und in Säure getränkt werden (40 ml destilliertes Wasser, 360 ml konzentrierte Schwefelsäure, 20 g Kaliumdichromat) oder einer Oberflächenpassivierungsbehandlung unterzogen werden. Eine Zitronensäurereduktionsmethode wurde verwendet, um kolloidales Gold zu synthetisieren.
- Schalten Sie den Magnetrührer ein und legen Sie den Kolben (250 ml) auf den Mischer.
- Bereiten Sie 4% ige Goldchloridsäurelösung bzw. 1% ige Natriumcitratlösung vor.
- 120 ml destilliertes Wasser in einen runden Bodenkolben geben und auf einem thermostatischen Magnetrührer zum Kochen erhitzen.
- Kochen Sie weiter und fügen Sie schnell 0,5 ml 4% Chloraurinsäure und 5 ml 1% Natriumcitrat hinzu.
- Beobachten Sie die Farbe der Lösung. Die blassgelbe Chloraurinsäurelösung färbt Wein innerhalb weniger Minuten rot.
- 10 Minuten weiter erhitzen, bis die Lösung von farblosem zu transparentem Weinrot wechselt.
- Schalten Sie den thermostatischen Magnetmischer aus, kühlen Sie ihn auf Raumtemperatur ab und bewegen Sie die Mischung in eine saubere Flasche. Bei 4 °C lagern.
- Bestimmen Sie die Größe und Morphologie der AuNPs durch Ultraviolettspektroskopie und TEM-Bildgebung.
HINWEIS: Unterschiedliche Größen von kolloidalen Goldpartikeln für verschiedene Anwendungen können durch Änderung des Anteils von Citratnatrium und Chlorauursäure erhalten werden.
2. Synthese des AuNPs-mAb-Konjugats
HINWEIS: Da Antikörper durch elektrostatische Adsorption an kolloidales Gold binden, beeinflussen Ladungen auf der Oberfläche von Proteinen und kolloidalem Gold direkt die Bindungsintensität; Daher ist der Puffer-pH-Wert ein wichtiger Faktor, der die Stabilität des Antikörper-kolloidalen Goldkonjugats beeinflusst. SSD und Anti-SSD mAbs werden als Beispiele in diesem Protokoll verwendet.
- Bewertung des Kopplungs-pH-Werts
- 100 μL NaCl-Lösung (10% m/v) werden in acht Röhrchen geben.
- Stellen Sie die AuNP-Lösungen bei pH 5, 6, 7, 8, 9, 10, 11 und 12 mit 0,1 MK2CO3ein.
- 100 μL kolloidale Goldlösung (pH-eingestellt 5-12) werden in acht Röhrchen mit NaCl gegeben.
- Lassen Sie die Lösungen nach dem Mischen einige Minuten stehen. Beobachten Sie die Farbänderung jeder Röhrchenlösung und notieren Sie die Röhrchen, die rot bleibt.
- Wählen Sie den pH-Wert mit der geringsten Zugabe vonK2CO3 und stabiler Lösungsfarbe als optimalen pH-Wert für die Herstellung von AuNP-mAb-Konjugaten.
HINWEIS: Verwenden Sie kein pH-Messgerät, da die Sonde durch AuNPs zerstört werden kann.
- Bewertung der Antikörpermenge
- 100 μL NaCl-Lösung (10% m/v) in acht Röhrchen geben.
- Fügen Sie 100 μL kolloidale Goldlösung mit optimalem pH-Wert in jedes Röhrchen hinzu.
- Die monoklonalen Antikörperlösungen (Proteinkonzentration 0,1 mg/ml-3,2 mg/ml) werden in die oben genannten acht Röhrchen geben.
- Lassen Sie die Lösungen nach dem Mischen einige Minuten stehen. Beobachten Sie die Farbänderung jeder Röhrchenlösung und notieren Sie die Röhrchen, die rot bleibt.
- Wählen Sie die Antikörpermenge mit der niedrigsten Konzentration an mAb und stabiler Lösungsfarbe als optimale mAb-Menge für die Herstellung von AuNP-mAb-Konjugaten.
- Bereiten Sie den Resuspensionspuffer vor: Fügen Sie 1 M Tris-HCl (pH 8,8), 1% (w/v) BSA, 0,5% (v/v) Tween 20 und 1% (v/v) PEG 20000 hinzu und mischen Sie gut.
- Synthese des AuNP-mAb-Konjugats
- Nehmen Sie 10 ml kolloidale Goldlösung und verwenden Sie 0,1 MK2CO3, um die Lösung auf den optimalen pH-Wert einzustellen.
- Fügen Sie ssd mAbs langsam in geeigneten Konzentrationen hinzu und schütteln Sie sie bei Raumtemperatur für 30 Minuten.
- Zentrifugieren Sie das Gemisch bei 83 x g (1.000 U/min) für 10 min bei 4 °C. Entfernen Sie den Niederschlag, der Verunreinigungen oder gefälltes kolloidales Gold enthält.
- Zentrifugieren Sie das Gemisch bei 8.330 x g (10.000 U/min) für 30 min bei 4 °C. Verwerfen Sie den Überstand, und der Niederschlag ist das kolloidale Gold-mAb-Konjugat.
- Fügen Sie den Resuspensionspuffer hinzu, um den Niederschlag zu dissoziieren.
3. Montage des Streifens
HINWEIS: Bei späteren Flow-Immunoassays wirkt sich die Auswahl und Vorbehandlung des Membranmaterials direkt auf den Test aus, der untersucht werden sollte. Der immunchromatographische Streifen besteht aus einem Probenpad, einem Konjugatpad, einer Nitrocellulosemembran (NC), einem absorbierenden Pad und einer PVC-Platte (Abbildung 1). Das Membranmaterial sollte durch Stereomikroskopie überprüft und bewertet werden, um Inhomogenität zu beseitigen.
- Fügen Sie die NC-Membran auf eine PVC-Platte ein, die 2 cm vom Rand des Saugendes der Platte entfernt ist.
- SSD-BSA (2 mg/ml) tropfenweise auf die NC-Membran (2 cm vom oberen Rand entfernt) als Testlinie (1 mm breit) geben und Ziegen-Anti-Maus-IgG (1,5 mg/ml) tropfenweise auf der NC-Membran (2 cm vom unteren Rand entfernt) als Steuerleitung (1 mm breit) hinzufügen. Kontrollieren Sie die Menge des hinzugefügten Proteins.
- Befestigen Sie das saugfähige Pad an der PVC-Platte über der NC-Membran und überlappen Sie es mit der NC-Membran um 2 mm.
- Tauchen Sie die Glasfasermembran in die AuNPs-mAb-Konjugatlösung. Trocknen Sie die nasse Membran in einem Inkubator bei 37 °C.
- Schneiden Sie die Glasfasermembran auf 5 cm lang und 2 cm breit und verwenden Sie sie als Konjugatpad.
- Fügen Sie das vorbehandelte Konjugatpad unter die NC-Membran ein. Die Länge der Überlappung mit der NC-Membran sollte 0,1 cm beträgen.
HINWEIS: Die Glasfasermembran hat eine starke Fähigkeit, Proteine zu binden und freizusetzen. - Schneiden Sie die Fusion 3-Membran auf 1,8 cm Länge und 3,5 cm Breite und verwenden Sie sie als Probenpad.
- Fügen Sie das Probenpad auf die PVC-Platte ein und überlappen Sie es mit dem konjugierten Pad um 2 mm.
- Schneiden Sie den bestückten Karton mit einer Schneidemaschine in 3,5 mm breite Streifen und verdichten Sie ihn mit einem Chargenkaschierungssystem.
- Legen Sie die Teststreifen schließlich in die Schale, verschließen Sie sie in einem Aluminiumfolienbeutel, der Trockenmittel enthält, und lagern Sie sie lichtgefäss. Die IKS sind nun montiert.
HINWEIS: Das obige ist das Laborverfahren. In der Produktion werden Goldsprühgeräte und Kreuzmembraninstrumente verwendet, um Gold zu versprühen und die T- und C-Linien herzustellen.
4. Quantitative Detektion
- Geben Sie 50 μL Probenlösung auf das Probenloch, um den Chromatographieprozess zu beobachten.
HINWEIS: Infolge der Kapillarwirkung, die vom absorbierenden Pad angetrieben wird, wandert die Probenlösung zum anderen Ende des Streifens. Wenn die Probenlösung das konjugierte Pad erreicht, reagiert die SSD (Antigen) in der Probe mit dem auf dem Pad vorinstallierten AuNPs-mAb. Wenn die Lösung migriert und die T-Linie erreicht, kann der AuNPs-mAb ohne SSD selektiv von SSD-BSA (Antigen-Carrier-Protein-Konjugat) erfasst werden, was sich als rote Farbe auf der T-Linie zeigt. Dann wandert die Lösung zur C-Linie, wo die AuNPs-mAb von Ziegen-Anti-Maus-IgG in der Region erfasst werden und so als rote Farbe auf der C-Linie angezeigt werden. - Analysieren Sie die Streifen mit einem tragbaren Streifenleser. Die Maschine kann das Verhältnis der Prüflinie zur Steuerleitung (T/C) bereitstellen.
- Bewerten Sie die Spezifität, Sensitivität, Wiederholbarkeit und Stabilität des ICS-Tests.
HINWEIS: Bei qualitativer Erkennung zeigt eine rote Linie ein positives Ergebnis an (Kontrolllinie). Zwei rote Linien zeigen ein negatives Ergebnis an (Test- und Kontrolllinien). Wenn die Steuerleitung nicht vorhanden ist, wird der Test als ungültig betrachtet.
Ergebnisse
Charakterisierung von kolloidalem Gold
Die vorbereiteten kolloidalen Goldlösungen waren claretrot. TEM-Analysen wurden verwendet, um die Morphologie und Form von AuNPs zu bestimmen (Abbildung 2A-D). Abbildung 2A und Abbildung 2B zeigen, dass die Partikel polyedrisch geformt und gleichmäßig verteilt sind. Der durchschnittliche Durchmesser von AuNPs betrug etwa 14 nm (Abbild...
Diskussion
In dieser Arbeit stellen wir ein Protokoll zur Herstellung von mAbs gegen aus Naturprodukten gewonnene kleine Moleküle vor. Die wesentlichen Schritte und die Angelegenheiten, die in der Prozedur beachtet werden müssen, wurden skizziert, und wir haben den Nutzen dieses Protokolls am Beispiel der niedermolekularen SSD demonstriert. Beispielspektren, TEM-Bilder, quantitative Ergebnisse und methodische Untersuchungen werden in repräsentativen Daten gezeigt. Daher haben wir gezeigt, dass die hier vorgestellte kolloidale Go...
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Diese Arbeit wurde durch die Sonderfonds für Grundlagenforschungsfonds der mit zentralen Abteilungen verbundenen Hochschulen unterstützt. Wir schätzen die Unterstützung des Classical Prescription Basic Research Teams der Beijing University of Chinese Medicine.
Materialien
| Name | Company | Catalog Number | Comments |
| Chloroauric acid solution (HAuCl4) | Tianjin Fu Chen Chemical Reagents Factory | JY-SJ102 | |
| bovine serum albumin | AMRESCO | 332 | |
| centrifuge tube 15 mL | Corning | 430645 | |
| centrifuge tube 50 mL | Corning | 430828 | |
| ELISA plates, 96 well | NUNC | 655101 | |
| Filter paper | Sinopharm | H5072 | |
| Glass fibre membranes | Jieyi | XQ-Y6 | |
| goat-anti-mouse IgG antibody | applygen | C1308 | |
| Nitrocellulose membranes | Millipore | millipore 180 | |
| ovalbumin | Beijing BIODEE | 5008-25g | |
| PEG20000 | Sigma Aldrich | RNBC6325 | |
| Pipette 10mL | COSTAR | 4488 | |
| Pipette 25mL | FALCON | 357525 | |
| semi-rigid PVC sheets | Jieyi | JY-C104 | |
| Sodium citrate | Beijing Chemical Works | C1034 | |
| sodium periodate | Sinopharm Chemical | BW-G0008 | |
| Sulfo-GMBS | Perbio Science Germany | 22324 | |
| TipOne Tips 1,000 µL | Starlab | S1111-2021 | |
| Tris-HCl | Solarbio | 77-86-1 | |
| TWEEN 20 | Solarbio | 9005-64-5 |
Referenzen
- Huang, X., et al. Membrane-based lateral flow immunochromatographic strip with nanoparticles as reporters for detection: A review. Biosensors and Bioelectronics. 75, 166-180 (2016).
- Chang, H. -. F., Wang, J. -. Q., Wang, B., Deng, A. -. P. An immune chromatographic assay for rapid and simultaneous detection of levonorgestrel and methylprednisolone in water samples. Chinese Chemical Letters. 24 (10), 937-940 (2013).
- Lai, J. J., Stayton, P. S. Improving lateral-flow immunoassay (LFIA) diagnostics via biomarker enrichment for mHealth. Methods in Molecular Biology. 1256, 71-84 (2015).
- Zhang, M. Z., et al. Development of a colloidal gold-based lateral-flow immunoassay for the rapid simultaneous detection of clenbuterol and ractopamine in swine urine. Analytical & Bioanalytical Chemistry. 395 (8), 2591-2599 (2009).
- Kranthi, K. R., et al. Development of a colloidal-gold based lateral-flow immunoassay kit for 'quality-control' assessment of pyrethroid and endosulfan formulations in a novel single strip format. Crop Protection. 28 (5), 428-434 (2009).
- Qian, K., et al. Development and evaluation of an immunochromatographic strip for rapid detection of capsid protein antigen p27 of avian leukosis virus. Journal of Virological Methods. (221), 115-118 (2015).
- Guo, H., et al. Lateral flow immunoassay devices for testing saliva and other liquid samples and methods of use of same. US Patent. , (2003).
- Miočević, O., et al. Quantitative Lateral Flow Assays for Salivary Biomarker Assessment: A Review. Frontiers in Public Health. 5, 1-13 (2017).
- Lisa, M., et al. Gold nanoparticles based dipstick immunoassay for the rapid detection of dichlorodiphenyltrichloroethane: an organochlorine pesticide. Biosensors and Bioelectronics. 25 (1), 224-227 (2009).
- Zhang, Z., et al. Monoclonal Antibody-Europium Conjugate-Based Lateral Flow Time-Resolved Fluoroimmunoassay for Quantitative Determination of T-2 Toxin in Cereals and Feed. Analytical Methods. 7 (6), 2822-2829 (2015).
- Shen, H., et al. Facile synthesis of high-quality CuInZnxS2+x core/shell nanocrystals and their application for detection of C-reactive protein. Journal of Materials Chemistry. 22 (35), 18623-18630 (2012).
- Xiang, T., et al. A novel double antibody sandwich-lateral flow immunoassay for the rapid and simple detection of hepatitis C virus. International Journal of Molecular Medicine. 30 (5), 1041-1047 (2012).
- Yang, Q., et al. Quantum dot-based immunochromatography test strip for rapid, quantitative and sensitive detection of alpha fetoprotein. Biosensors & Bioelectronics. 30 (1), 145 (2011).
- Song, L. W., et al. Rapid fluorescent lateral-flow immunoassay for hepatitis B virus genotyping. Analytical Chemistry. 87, 5173-5180 (2015).
- Zhang, Y., et al. Quantum dot-based lateral-flow immunoassay for rapid detection of rhein using specific egg yolk antibodies. Artificial Cells, Nanomedicine, and Biotechnology. 1, (2017).
- Qu, H., et al. Rapid Lateral-Flow Immunoassay for the Quantum Dot-based Detection of GsRerarin. Biosensors and Bioelectronics. 81, 358-362 (2016).
- Li, Z., et al. Development and Clinical Application of a Rapid IgM-IgG Combined Antibody Test for SARS-CoV-2 Infection Diagnosis. Journal of Medical Virology. 92 (9), (2020).
- Xiaomei, L., Jing, W., Ya, Z. The clinical application value analysis of the 2019-coronary virus disease was analyzed by the whole blood Sars-COV 2 specific antibody detection. Natural Science Edition. 42, (2020).
- Zhang, Y., et al. Generation of Monoclonal Antibodies Against Natural Products. Journal of Visualized Experiments. , e57116 (2019).
- Sai, J., et al. Development of an Enzyme-Linked Immunosorbent Assay and Immunoaffinity Column Chromatography for Saikosaponin d Using an Anti-Saikosaponin d Monoclonal Antibody. Planta Medica. 82, 432-439 (2016).
- Yue, Z., et al. A Highly Sensitive Immunochromatographic Strip Test for Rapid and Quantitative Detection of Saikosaponin d. Molecules. 23 (2), 338 (2018).
- Qu, H., et al. Rapid Lateral-Flow Immunoassay for the Quantum Dot-based Detection of Puerarin. Biosensors and Bioelectronics. 81, 358-362 (2016).
- Zhang, Y., et al. Quantum dot-based lateral-flow immunoassay for rapid detection of rhein using specific egg yolk antibodies. Artificial Cells, Nanomedicine, and Biotechnology. 1, (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten