Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Modelo de perforación endovascular para hemorragia subaracnoidea combinada con resonancia magnética (IRM)
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí presentamos un modelo estandarizado de ratón SAH, inducido por perforación de filamento endovascular, combinado con imágenes de resonancia magnética (MRI) 24 h después de la operación para asegurar el sitio de sangrado correcto y excluir otras patologías intracraneales relevantes.
Resumen
El modelo de perforación de filamento endovascular para imitar la hemorragia subaracnoidea (HSA) es un modelo de uso común, sin embargo, la técnica puede causar una alta tasa de mortalidad, así como un volumen incontrolable de HSA y otras complicaciones intracraneales como accidente cerebrovascular o hemorragia intracraneal. En este protocolo, se presenta un modelo estandarizado de ratón SAH, inducido por perforación de filamento endovascular, combinado con imágenes de resonancia magnética (MRI) 24 h después de la operación para asegurar el sitio de sangrado correcto y excluir otras patologías intracraneales relevantes. Brevemente, los ratones C57BL/6J son anestesiados con una inyección intraperitoneal de ketamina/xilazina (70 mg/16 mg/kg de peso corporal) y colocados en posición supina. Después de la incisión del cuello en la línea media, se exponen la arteria carótida común (CCA) y la bifurcación carotídea, y se inserta una sutura de polipropileno monofilamento no absorbible 5-0 de manera retrógrada en la arteria carótida externa (ECA) y se avanza hacia la arteria carótida común. Luego, el filamento se invagina en la arteria carótida interna (ICA) y se empuja hacia adelante para perforar la arteria cerebral anterior (ACA). Después de la recuperación de la cirugía, los ratones se someten a una resonancia magnética de 7.0 T 24 h más tarde. El volumen de sangrado se puede cuantificar y clasificar a través de una resonancia magnética postoperatoria, lo que permite un grupo experimental robusto de HSA con la opción de realizar análisis de subgrupos adicionales basados en la cantidad de sangre.
Introducción
La hemorragia subaracnoidea (HSA) es causada por la ruptura de un aneurisma intracraneal y plantea una emergencia potencialmente mortal, asociada con una morbilidad y mortalidad sustanciales, que representan aproximadamente el 5% de los accidentes cerebrovasculares 1,2. Los pacientes con HSA presentan cefaleas severas, disfunción neurológica y alteración progresiva de la conciencia3. Alrededor del 30% de los pacientes con HSA mueren dentro de los primeros 30 días después del evento hemorrágico inicial4. Clínicamente, el 50% de los pacientes experimentan lesión cerebral retardada (DBI) después de una lesión cerebral temprana. La DBI se caracteriza por isquemia cerebral retardada y déficits neurológicos retardados. Los estudios actuales han demostrado que los efectos sinérgicos de varios factores diferentes conducen a la pérdida de la función neurológica, incluida la destrucción de la barrera hematoencefálica, la contracción de arterias pequeñas, la disfunción microcirculatoria y la trombosis 5,6.
Un aspecto único de la HSA es que la patogénesis se origina en una ubicación extraparenquimatosa, pero luego conduce a cascadas perjudiciales dentro del parénquima: la patología comienza con la acumulación de sangre en el espacio subaracnoideo, desencadenando una multitud de efectos intraparenquimatosos, como neuroinflamación, apoptosis de células neuronales y endoteliales, despolarización de propagación cortical y formación de edema cerebral7, 8.
La investigación clínica está limitada por varios factores, lo que hace que el modelo animal sea un elemento crítico para imitar de manera consistente y precisa los cambios pathomecanicistas de la enfermedad. Se han propuesto diferentes protocolos modelo de HSA, por ejemplo, inyección de sangre autóloga en la cisterna magna (ACM). También, un método modificado con una doble inyección de sangre autóloga en la cisterna magna y cisterna de quiasma óptico (APC) respectivamente 9,10. Si bien la inyección autóloga en sangre es una forma sencilla de simular el proceso patológico del vasoespasmo y las reacciones inflamatorias después de la hemorragia subaracnoidea, el siguiente aumento de la presión intracraneal (PIC) es relativamente lento, y no se inducen cambios notables en la permeabilidad de la barrera hematoencefálica11,12. Otro método, la colocación de sangre periarterial, generalmente utilizada en modelos grandes de HSA (por ejemplo, monos y perros), consiste en colocar sangre autóloga anticoagulada o productos sanguíneos comparables alrededor del vaso. Los cambios de diámetro de la arteria se pueden observar con un microscopio, que sirve como indicador de vasoespasmo cerebral después de laHSA 13.
Barry et al. describieron por primera vez un modelo de perforación endovascular en 1979 en el que la arteria basilar se expone después de extirpar el cráneo; luego se perfora la arteria con microelectrodos de tungsteno, utilizando una técnica estereotáctica microscópica14. En 1995, Bederson y Veelken modificaron el modelo Zea-Longa de isquemia cerebral y establecieron la perforación endovascular, que se ha mejorado continuamente desdeel año 15,16. Este método se basa en el hecho de que ratones y humanos comparten una red vascular intracraneal similar, conocida como el círculo de Willis.
Para la evaluación postoperatoria y la calificación de la HSA en el modelo de ratón, se han propuesto diferentes enfoques. Sugawara et al. desarrollaron una escala de clasificación que ha sido ampliamente utilizada desde 200817. Este método evalúa la gravedad de la HSA en función de los cambios morfológicos. Sin embargo, para este método, la morfología del tejido cerebral del ratón debe examinarse bajo visión directa y, por lo tanto, el ratón debe sacrificarse para su evaluación. Además, se han establecido varios métodos para determinar la gravedad de la HSA in vivo. Los enfoques van desde la puntuación neurológica simple hasta el monitoreo de la presión intracraneal (PIC) y varias técnicas de imagen radiológica. Además, la clasificación por resonancia magnética se ha demostrado como una nueva herramienta no invasiva para calificar la gravedad de la HSA, correlacionándose con la puntuación neurológica18,19.
Aquí, se presenta un protocolo para un modelo de HSA causado por perforación endovascular, combinado con resonancia magnética postoperatoria. En un intento de establecer un sistema para objetivar la cantidad de sangrado en un entorno in vivo , también desarrollamos un sistema para la clasificación de la HSA y la cuantificación del volumen sanguíneo total basado en la resonancia magnética ponderada en T2 de alta resolución de 7.0 T. Este enfoque asegura la correcta inducción de la HSA y la exclusión de otras patologías como el ictus, la hidrocefalia o la hemorragia intracerebral (ICH) y complicaciones.
Protocolo
Los experimentos se realizaron de acuerdo con las directrices y regulaciones establecidas por Landesamt fuer Gesundheit und Soziales (LaGeSo), Berlín, Alemania (G0063/18). En este estudio, se utilizaron ratones machos C57Bl / 6J (8-12 semanas de edad) con un peso de 25 ± 0.286 g (promedio de ± s.e.m.).
1. Preparación animal
- Inducir la anestesia inyectando ketamina (70 mg/kg) y xilazina (16 mg/kg) por vía intraperitoneal. Mantener la temperatura corporal normal, contribuyendo a la rápida inducción de la anestesia profunda. Pruebe la sedación adecuada con un estímulo de dolor, como un pellizco en el dedo del pie, y verifique la ausencia de una reacción.
- Afeite cuidadosamente el pelo del cuello del ratón con una maquinilla de afeitar, límpielo con etanol al 70% seguido de betadina / clorhexidina y aplique lidocaína al 1% en la superficie de la piel para el control local del dolor.
- Coloque el ratón en posición supina. Use cinta adhesiva para fijar las extremidades y la cola, estirando suavemente la piel del cuello hacia el lado opuesto de la cirugía. Simultáneamente, eleve el cuello ligeramente.
- Use ungüento oftálmico (por ejemplo, dexpantenol al 5%) para prevenir la deshidratación de los ojos durante la operación.
2. Inducción de HSA
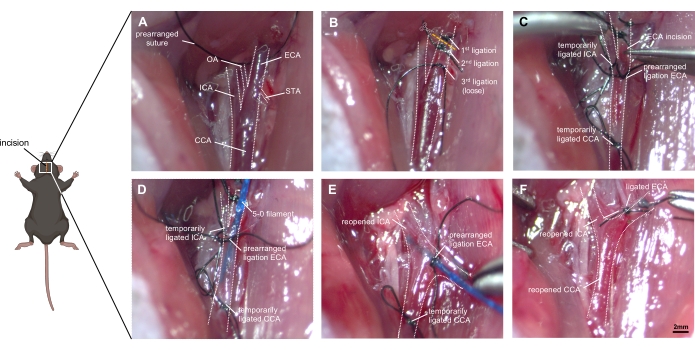
Figura 1: Imágenes paso a paso de la técnica quirúrgica. (A) Representación de la anatomía de la arteria carótida derecha expuesta: se identifican el CCA y su bifurcación en ICA y ECA, así como las pequeñas ramas del ECA (OA y STA). (B) El ECA se moviliza desde el tejido circundante y se liga con dos suturas antes de cortarlo. Una tercera ligadura debe colocarse libremente cerca de la bifurcación sin ocluirla. (C) El ICA y el CCA se ocluyen temporalmente (con ligadura o clips) para evitar un sangrado excesivo cuando el ECA se incide cuidadosamente. D) El filamento se inserta en el ACE y se avanza en el CCA. La ligadura preestablecida debe apretarse cuidadosamente para que no se produzca derrame de sangre, pero sigue siendo posible avanzar por el filamento. E) Se reabren el ICA y el CCA, y el muñón del ECA debe ajustarse a una dirección craneal. Al empujar el filamento ~ 9 mm hacia adelante en el ICA, se alcanzará la bifurcación ACA-MCA, y el recipiente se perfora empujando el filamento ~ 3 mm más. (F) El filamento se retira después de asegurar una re-ligadura temporal del CCA. La ligadura preestablecida de la ECA se ocluye rápidamente y la CCA se reabre para permitir la reperfusión. Abreviaturas: ACA = arteria cerebral anterior, CCA = arteria carótida común, ECA = arteria carótida externa, MCA = arteria cerebral media, ICA = arteria carótida interna, OA = arteria occipital, PPA = arteria pterigopalatina, STA = arteria tiroidea superior. Barra de escala = 2 mm. Haga clic aquí para ver una versión más grande de esta figura.
- Abra la piel del cuello con un bisturí estéril, desde la barbilla hasta el borde superior del esternón (1,5 cm), y separe sin rodeos las glándulas salivales de su tejido conectivo circundante.
- Separe el grupo muscular a lo largo de un lado [en este caso, el lado derecho] de la tráquea, exponiendo la vaina de la arteria carótida común (CCA) cubierta con vasos sanguíneos y vénulas nutritivas. El CCA y el nervio vago se encuentran muy cerca el uno del otro.
- Disociar el CCA y dejar un 8-0 libre sutura de seda alrededor del CCA sin ligarlo de antemano. Preste atención a la protección del nervio vago, ya que se daña fácilmente (Figura 1A).
- Una triple bifurcación del CCA, el ICA y el ECA es visible a lo largo del tercio inferior posterior de la diástasis. Diseccionar el extremo distal de la ECA y ligar el vaso dos veces más lejos posible.
- Desconecte el ECA en el punto medio del segmento dos veces ligado, creando un muñón de vaso.
- Prearorganice un ligamento para el filamento alrededor del muñón ECA, no lo cierre hasta la inserción exitosa del filamento.
- Utilice una sutura o microclip para ocluir el ICA y el CCA temporalmente (Figura 1B).
- Haga una pequeña incisión (aproximadamente la mitad del diámetro de la ECA) en la ECA usando tijeras microvasculares. Inserte un filamento de proleno 5-0 (alternativamente 4-0) en el ECA y avance hacia el CCA.
- Cierre ligeramente la ligadura en el ECA mientras afloja el micro clip en el ICA y el CCA (Figura 1C).
- Tire suavemente hacia atrás del filamento y ajuste el muñón ECA en la dirección craneal, invaginando el filamento a través de la bifurcación en el ICA (Figura 1D).
- Apunte la punta del filamento medialmente en un ángulo de ~30° a la línea media traqueal y ~30° al plano horizontal. Empuje el filamento hacia adelante dentro del ICA. Después de alcanzar la bifurcación ACA-MCA, se encuentra resistencia (~ 9 mm).
- Avanza el filamento 3 mm más, perforando el ACA derecho. Retire rápidamente el filamento al muñón ECA, permitiendo el flujo sanguíneo hacia el espacio subaracnoideo.
- Mantenga el filamento en esta posición durante unos 10 s (Figura 1E). La presencia de temblores musculares, miosis ipsilateral, jadeo por respirar, ritmo cardíaco alterado e incontinencia urinaria pueden ser evidencia de apoyo de una cirugía exitosa.
- Cierre temporalmente el CCA para evitar la pérdida excesiva de sangre. Extraiga el filamento instantáneamente y ligate el ECA con la sutura preestablecida. Vuelva a abrir el CCA y permita la reperfusión y una mayor efusión de sangre en el espacio subaracnoideo (Figura 1F).
- Después de verificar si hay fugas de sangrado, desinfecte la piel que rodea la herida para prevenir infecciones cutáneas postoperatorias y suture la herida con una sutura de fibra de poliéster 4-0 no absorbible.
- Coloque el ratón en una caja térmica hasta que se recupere la conciencia. Espere hasta que el animal esté completamente despierto y asegúrese de que haya recuperado la conciencia suficiente para mantener la reclinación esternal. No devuelva a los animales a la compañía de otros ratones hasta que se recuperen por completo.
- Administrar 200-300 mg/kg de paracetamol de peso corporal para el alivio del dolor postoperatorio.
- Revise a los ratones diariamente después de la cirugía.
3. Medición por resonancia magnética
- 24 h después de la cirugía, realice una resonancia magnética utilizando un escáner de roedores (Tabla de materiales) y un resonador de cabeza de ratón dedicado: aquí, se utilizó un resonador de volumen de cuadratura de transmisión / recepción de 20 mm.
- Coloque el ratón sobre una manta de agua circulante calentada para garantizar una temperatura corporal constante de ~ 37 ° C. Inducir anestesia con isoflurano al 2,5 % en una mezcla de O2/N2O (30%/70%) y mantener con isoflurano al 1,5-2 % mediante mascarilla bajo monitorización continua de ventilación.
- Primero realice un escaneo de referencia rápido adquiriendo 3 paquetes de corte ortogonales (Tri-Pilot-Multi, FLASH con tiempo de repetición TR / tiempo de eco TE = 200 ms / 3 ms, 1 promedio, ángulo de giro FA = 30 °, campo de visión FOV = 28 mm x 28 mm, matriz MTX = 256 x 256, grosor de corte 1 mm, tiempo total de adquisición TA = 30 s).
- A continuación, utilice una secuencia de eco de espín turbo 2D ponderada en T2 de alta resolución para la obtención de imágenes (parámetros de imagen TR/TE = 5505 ms/36 ms, factor RARE 8, 6 promedios, 46 rodajas axiales contiguas con un grosor de rebanada de 0,35 mm para cubrir todo el cerebro, FOV = 25,6 mm x 25,6 mm, MTX = 256 x 256, TA = 13 min).
- Si el resultado no está claro, utilice una secuencia de eco de gradiente ponderado T2* desencadenada por respiración adicional con la misma isodistancia que la exploración T2w (2D FLASH, TR/TE = 600 ms/6,3 ms, FA = 30°, 1 promedio, 20 rodajas axiales con 0,35 mm de espesor, FOV y MTX idénticos a T2w, TA = 5-10 min dependiendo de la frecuencia respiratoria).
- Transfiera los datos al formato de imagen DICOM y utilice el software ImageJ para la clasificación SAH y la volumetría de coágulos sanguíneos. Los detalles sobre la cuantificación se enumeran como una guía paso a paso en el material complementario (Figura suplementaria 1).
Resultados
Mortalidad
Para este estudio, un total de 92 ratones machos C57Bl/6J de entre 8 y 12 semanas de edad fueron sometidos a una operación de HSA; en estos, observamos una tasa de mortalidad global del 11,9% (n = 12). La mortalidad ocurrió exclusivamente dentro de las primeras 6-24 h después de la cirugía, lo que sugiere la mortalidad perioperatoria, así como el sangrado de HSA en sí mismo como los factores contribuyentes más probables.
Grado de sangrado de HSA
Discusión
En resumen, un modelo estandarizado de ratón de HSA inducido por operación de perforación de filamento endovascular se presenta con invasión menor, tiempo quirúrgico corto y tasas de mortalidad aceptables. La resonancia magnética se realiza 24 h después de la operación para asegurar el sitio de sangrado correcto y la exclusión de otras patologías intracraneales relevantes. Además, se clasificaron diferentes grados de sangrado de HSA y se midieron los volúmenes de sangrado, lo que permitió realizar análisis ...
Divulgaciones
Sin conflictos de intereses
Agradecimientos
SL fue apoyado por el Consejo chino de Becas. KT fue apoyado por la beca BIH-MD del Instituto de Salud de Berlín y la Sonnenfeld-Stiftung. RX cuenta con el apoyo del Programa de Científicos Clínicos de BIH-Charité, financiado por la Charité -Universitätsmedizin Berlin y el Instituto de Salud de Berlín. Agradecemos el apoyo de la Fundación Alemana de Investigación (DFG) y el Fondo de Publicación de Acceso Abierto de Charité - Universitätsmedizin Berlin.
Materiales
| Name | Company | Catalog Number | Comments |
| Eye cream | Bayer | 815529836 | Bepanthen |
| Images analysis software | ImageJ | Bundled with Java 1.8.0_172 | |
| Ligation suture (5-0) | SMI | Silk black USP | |
| Light source for microscope | Zeiss | CL 6000 LED | |
| Ketamine | CP-pharma | 797-037 | 100 mg/mL |
| MRI | Bruker | Pharmascan 70/16 | 7 Tesla |
| MRI images acquired software | Bruker | Bruker Paravision 5.1 | |
| Paracetamol (40 mg/mL) | bene Arzneimittel | 4993736 | |
| Prolene filament (5-0) | Erhicon | EH7255 | |
| Razor | Wella | HS61 | |
| Surgical instrument (Fine Scissors) | FST | 14060-09 | |
| Surgical instrument (forceps#1) | AESCULAP | FM001R | |
| Surgical instrument (forceps#2) | AESCULAP | FD2855R | |
| Surgical instrument (forceps#3) | Hammacher | HCS 082-12 | |
| Surgical instrument (Needle holder) | FST | 91201-13 | |
| Surgical instrument (Vannas Spring Scissors) | FST | 15000-08 | |
| Surgical microscope | Zeiss | Stemi 2000 C | |
| Ventilation monitoring | Stony Brook | Small Animal Monitoring & Gating System | |
| Wounding suture(4-0) | Erhicon | CB84D | |
| Xylavet | CP-pharma | 797-062 | 20 mg/mL |
Referencias
- Macdonald, R. L., Schweizer, T. A. Spontaneous subarachnoid haemorrhage. The Lancet. 389 (10069), 655-666 (2017).
- van Gijn, J., Kerr, R. S., Rinkel, G. J. Subarachnoid haemorrhage. The Lancet. 369 (9558), 306-318 (2007).
- Abraham, M. K., Chang, W. -. T. W. Subarachnoid hemorrhage. Emergency Medicine Clinics of North America. 34 (4), 901-916 (2016).
- Schertz, M., Mehdaoui, H., Hamlat, A., Piotin, M., Banydeen, R., Mejdoubi, M. Incidence and mortality of spontaneous subarachnoid hemorrhage in martinique. PLOS ONE. 11 (5), 0155945 (2016).
- Okazaki, T., Kuroda, Y. Aneurysmal subarachnoid hemorrhage: intensive care for improving neurological outcome. Journal of Intensive Care. 6 (1), 28 (2018).
- Kilbourn, K. J., Levy, S., Staff, I., Kureshi, I., McCullough, L. Clinical characteristics and outcomes of neurogenic stress cadiomyopathy in aneurysmal subarachnoid hemorrhage. Clinical Neurology and Neurosurgery. 115 (7), 909-914 (2013).
- de Oliveira Manoel, A. L., et al. The critical care management of spontaneous intracranial hemorrhage: a contemporary review. Critical Care. 20 (1), 272 (2016).
- Schneider, U. C., et al. Microglia inflict delayed brain injury after subarachnoid hemorrhage. Acta Neuropathologica. 130 (2), 215-231 (2015).
- Delgado, T. J., Brismar, J., Svendgaard, N. A. Subarachnoid haemorrhage in the rat: angiography and fluorescence microscopy of the major cerebral arteries. Stroke. 16 (4), 595-602 (1985).
- Piepgras, A., Thomé, C., Schmiedek, P. Characterization of an anterior circulation rat subarachnoid hemorrhage model. Stroke. 26 (12), 2347-2352 (1995).
- Suzuki, H., et al. Heme oxygenase-1 gene induction as an intrinsic regulation against delayed cerebral vasospasm in rats. Journal of Clinical Investigation. 104 (1), 59-66 (1999).
- Dudhani, R. V., Kyle, M., Dedeo, C., Riordan, M., Deshaies, E. M. A Low mortality rat model to assess delayed cerebral vasospasm after experimental subarachnoid hemorrhage. Journal of Visualized Experiments: JoVE. (71), e4157 (2013).
- Iuliano, B. A., Pluta, R. M., Jung, C., Oldfield, E. H. Endothelial dysfunction in a primate model of cerebral vasospasm. Journal of Neurosurgery. 100 (2), 287-294 (2004).
- Barry, K. J., Gogjian, M. A., Stein, B. M. Small animal model for investigation of subarachnoid hemorrhage and cerebral vasospasm. Stroke. 10 (5), 538-541 (1979).
- Bederson, J. B., Germano, I. M., Guarino, L. Cortical blood flow and cerebral perfusion pressure in a new noncraniotomy model of subarachnoid hemorrhage in the rat. Stroke. 26 (6), 1086-1092 (1995).
- Veelken, J. A., Laing, R. J. C., Jakubowski, J. The Sheffield model of subarachnoid hemorrhage in rats. Stroke. 26 (7), 1279-1284 (1995).
- Sugawara, T., Ayer, R., Jadhav, V., Zhang, J. H. A new grading system evaluating bleeding scale in filament perforation subarachnoid hemorrhage rat model. Journal of Neuroscience Methods. 167 (2), 327-334 (2008).
- Egashira, Y., Shishido, H., Hua, Y., Keep, R. F., Xi, G. New grading system based on magnetic resonance imaging in a mouse model of subarachnoid hemorrhage. Stroke. 46 (2), 582-584 (2015).
- Mutoh, T., Mutoh, T., Sasaki, K., Nakamura, K., Taki, Y., Ishikawa, T. Value of three-dimensional maximum intensity projection display to assist in magnetic resonance imaging (MRI)-based grading in a mouse model of subarachnoid hemorrhage. Medical Science Monitor. 22, 2050-2055 (2016).
- Kothari, R. U., et al. The ABCs of measuring intracerebral hemorrhage volumes. Stroke. 27 (8), 1304-1305 (1996).
- Leclerc, J. L., et al. A comparison of pathophysiology in humans and rodent models of subarachnoid hemorrhage. Frontiers in Molecular Neuroscience. 11, 71 (2018).
- Titova, E., Ostrowski, R. P., Zhang, J. H., Tang, J. Experimental models of subarachnoid hemorrhage for studies of cerebral vasospasm. Neurological Research. 31 (6), 568-581 (2009).
- Marbacher, S., et al. Systematic review of in vivo animal models of subarachnoid hemorrhage: Species, standard parameters, and outcomes. Translational Stroke Research. 10 (3), 250-258 (2019).
- Marbacher, S., Fandino, J., Kitchen, N. D. Standard intracranial in vivo animal models of delayed cerebral vasospasm. British Journal of Neurosurgery. 24 (4), 415-434 (2010).
- Thompson, J. W., et al. In vivo cerebral aneurysm models. Neurosurgical Focus. 47 (1), 1-8 (2019).
- Frontera, J. A., et al. Prediction of symptomatic vasospasm after subarachnoid hemorrhage: The modified fisher scale. Neurosurgery. 59 (1), 21-26 (2006).
- Fisher, C. M., Kistler, J. P., Davis, J. M. Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computerized tomographic scanning. Neurosurgery. 6 (1), 1-9 (1980).
- Wilson, D. A., et al. A simple and quantitative method to predict symptomatic vasospasm after subarachnoid hemorrhage based on computed tomography: Beyond the fisher scale. Neurosurgery. 71 (4), 869-875 (2012).
- Schüller, K., Bühler, D., Plesnila, N. A murine model of subarachnoid hemorrhage. Journal of Visualized Experiments: JoVE. (81), e50845 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados