Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Микрофлюидные инструменты для зондирования грибковых и микробных взаимодействий на клеточном уровне
В этой статье
Резюме
Из-за непрозрачности почвы взаимодействия между составляющими ее микробами не могут быть легко визуализированы с клеточным разрешением. Здесь представлены два микрофлюидных инструмента, которые открывают новые возможности для исследования грибково-микробных взаимодействий. Устройства универсальны и просты в использовании, обеспечивая высокий пространственно-временный контроль и визуализацию с высоким разрешением на клеточном уровне.
Аннотация
Нитевидные грибы являются успешными обитателями почвы и играют важную роль в почвенных экосистемах, таких как разложение органических и неорганических веществ, а также регулирование уровня питательных веществ. Там они также находят многочисленные возможности для взаимодействия с множеством других микробов, таких как бактерии или другие грибы. Однако изучение грибковых взаимодействий на клеточном уровне может быть сложной задачей из-за черной коробчатой природы почвы. Разрабатываются новые микрофлюидные инструменты для изучения грибковых взаимодействий; выделены две платформы, предназначенные для изучения бактериально-грибковых и грибково-грибковых взаимодействий. В этих микроканалах грибковые и микробные взаимодействия могут контролироваться в контролируемых физико-химических средах с более высоким временным и пространственным разрешением, чем это было возможно ранее. Применение этих инструментов дало многочисленные новые биологические идеи, такие как наблюдение бактериальной полярной привязанности к гифам или выявление нехарактеризованных грибково-грибковых антагонизмов. Ключевой особенностью этих методологий является простота использования этого инструмента неспециалистами, что дает высокопереводимые технологии для использования в микробиологических лабораториях.
Введение
Почва представляет собой исключительно разнообразную среду, содержащую обилие микроорганизмов, которые играют важную роль в углеродных и фосфорных циклах 1,2. Нитевидные грибы являются основным компонентом многочисленных экосистем в качестве разлагателей органического и неорганического вещества и могут усиливать питание растений путем формирования симбиотических отношений 3,4. В почве грибы динамически взаимодействуют с множеством микробов, таких как другие грибы5, бактерии6, вирусы7 и нематоды8. Эти взаимодействия имеют значительные последствия для здоровья почвы и растений. Тем не менее, из-за отсутствия соответствующих экспериментальных систем, способных визуализировать взаимодействующие микроорганизмы с высоким разрешением, многие из них остаются неопределенными.
Исследования, касающиеся бактериально-грибковых взаимодействий (BFI) и грибково-грибковых взаимодействий (FFI), имеют ценное применение в целом ряде областей, включая противомикробные препараты в медицине и агенты биологического контроля в сельском хозяйстве. Например, гриб Coprinopsis cinerea продуцирует пептид копсин, который, как было показано, проявляет антибактериальную активность против патогена человека Listeria monocytogenes9. Аналогичным образом, грибковое соединение, гризеофульвин, широко используется в качестве лечения грибковых инфекций человека и дополнительно способно ингибировать рост растительного патогенного гриба Alternaria solani10,11. Было также продемонстрировано, что несколько штаммов почвенной бактерии Bacillus subtilis являются эффективными агентами биоконтроля грибкового патогена растений Rhizoctonia solani12,13. Тем не менее, из-за ограничений, связанных с традиционными методологиями, BFI и FFI плохо понимаются на уровне одиночных клеток.
Обычные исследования обычно исследуют BFI и FFI на макроуровне с использованием агаровых пластин с двумя или более видами в противостоянии. Их взаимодействие оценивается путем измерения темпов роста и выработки метаболитов противостоящих видов 14,15,16; однако эта методология распространяется только на колониальный уровень. Для изучения взаимодействий на клеточном уровне бактериальные и грибковые инокулянты могут культивироваться на предметных стеклах микроскопа, покрытых агаром, которые затем визуализируются под микроскопом17. Тем не менее, может быть трудно проследить за одной гифой с помощью слайдов микроскопа из-за отсутствия удержания, что означает, что покадровые изображения труднее получить. Кроме того, возможность пространственно ограничивать другие микроорганизмы в пределах определенных областей грибкового мицелия или создавать определенные химические среды, которые могут быть нарушены, например, невозможна в таких установках. Характер почвы «черного ящика» также усложняет изучение грибково-микробных взаимодействий на уровне одиночных клеток18. Наблюдая за взаимодействующими видами вдали от невероятного разнообразия почвенного микробиома, можно оценить точный способ взаимодействия отдельных членов. Таким образом, сохраняется потребность в универсальных платформах, которые обеспечивают одноклеточную визуализацию BFI и FFI с высоким разрешением.
Микрофлюидные технологии, так называемые системы lab-on-a-chip, обеспечивают идеальную платформу для изучения BFI и FFI на уровне одиночных клеток. Область микрофлюидики, происходящая из технологий, разработанных для химического анализа и микроэлектроники, была принята биологическими науками19. Микрофлюидные технологии регулируют небольшие объемы жидкостей в специальной сети миниатюрных каналов, имеющих по меньшей мере одно измерение в микрометровом масштабе, и их использование в биологических исследованиях расширяется20. В частности, разработаны микрофлюидные устройства для изучения роста нитевидных грибов 21,22,23,24,25,26,27,28,29,30. Одним из преимуществ использования этой технологии является то, что ограничение гиф и распределение питательных веществ в микроканалах более близко напоминает структуру почвенной среды, чем обычные агаровые методы31. В последнее время микрофлюидные платформы используются для исследования взаимодействий между нейтрофилами человека и грибковыми патогенами32, бактериями и корнями растений33, а также грибами и нематодами34,35.
Одним из многих преимуществ использования микрофлюидики для изучения микробных взаимодействий является специфический контроль микроканальной среды. Например, ламинарные режимы потока могут быть использованы для генерации определенных градиентов концентрации, что особенно полезно при исследовании бактериального хемотаксиса36. Другим преимуществом является то, что прозрачная природа поли(диметилсилоксана) (PDMS), недорогого, биосовместимого эластомерного полимера, обычно используемого при изготовлении микрофлюидных устройств, облегчает визуализацию одиночных клеток с высоким разрешением с использованием ярко-полевой и флуоресцентной микроскопии37. Аналогичным образом, ограничение микробов в микроканалах означает, что могут быть проведены покадровые эксперименты, отслеживающие отдельные клетки, позволяющие регистрировать и количественно оценивать отдельные клеточные ответы37. Наконец, поскольку микрофлюидные устройства могут быть спроектированы так, чтобы быть удобными для пользователя, они могут быть легко использованы неспециалистами38.
Углубление знаний о взаимодействии между почвенными микроорганизмами имеет важное значение для совершенствования практики устойчивого управления экосистемами, которая поддерживает биоразнообразие и смягчает воздействие изменения климата на наземную среду39. Таким образом, разработка новых микрофлюидных инструментов имеет основополагающее значение для расширения понимания грибов и их взаимодействий на клеточном уровне. Протокол здесь будет сосредоточен на двух микрофлюидных устройствах, произведенных для изучения BFI40 и FFI41, как показано на рисунке 1.

Рисунок 1: Визуальное и схематическое представление устройств бактериально-грибкового взаимодействия (BFI) и грибково-грибкового взаимодействия (FFI). (A) Изображение устройства BFI. Мицелиальная пробка размещается на входе в один конец микроканалов, чтобы обеспечить рост гифы в устройстве. Бактериальное входное отверстие находится на противоположном конце. Шкала = 5 мм. (B) Схематический обзор устройства BFI, изображающий позиционирование бактериальных входов и направление роста гифаля через микроканал взаимодействия. Каналы имеют глубину 10 мкм, ширину 100 мкм и длину 7 мм, всего 28 каналов наблюдения. (C) Анализ противостояния на агаровой пластине между Coprinopsis cinerea и Bacillus subtilis NCIB 3610, шкала бар = 20 мм (слева). Микроскопические изображения, показывающие взаимодействие между C. cinerea и B. subtilis NCIB 3610 в пределах микроканала (средний и правый), т. е. полярное прикрепление бактерий к грибковым гифам. Шкала стержня = 25 мкм (посередине) и 10 мкм (справа). (D) Изображение устройства FFI, прикрепленного к чашке Петри со стеклянным дном, двойной инокулированной мицелиальными пробками. Шкала = 1 см. (E) Схематический обзор устройства FFI. Две заглушки грибкового инокулянта вводятся во входные отверстия на обоих концах устройства, что позволяет гифальное исследование микроканалов. Контрольные каналы соединены только с одним грибковым входом и имеют тупиковый канал, предотвращая взаимодействие между тестовыми грибами. Каналы взаимодействия соединяют оба грибковых входа и позволяют гифальные взаимодействия между испытуемыми в микроканале. Каждый канал взаимодействия состоит из 18 алмазообразных секций, общей длиной 8,8 мм (490 x 430 мкм на алмаз), глубиной 10 мкм и имеющих соединительную область между каждым алмазом 20 мкм. Типы каналов дублируются, шкала баров = 1 мм. (F) Зона взаимодействия между двумя приближающимися гифальными фронтами, растущая с противоположных концов взаимосвязанного канала взаимодействия. Изображение фазово-контрастной микроскопии, шкала = 250 мкм. Панели на этом рисунке были изменены из Stanley et al., 2014 (A-C)40 и Gimeno et al., 2021 (D-F)41. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
ПРИМЕЧАНИЕ: Краткое изложение процедур, описанных в этом протоколе, визуально показано на рисунке 2.
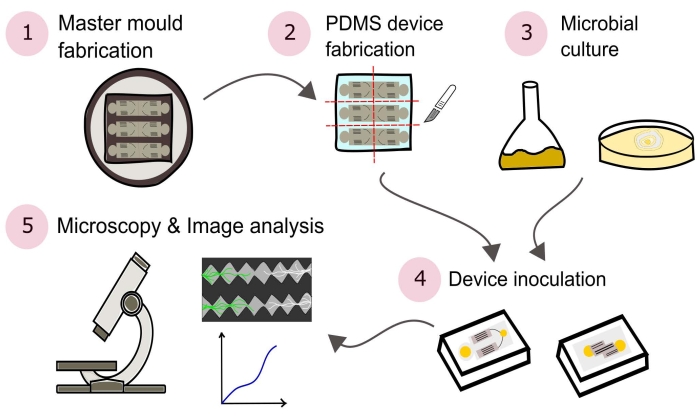
Рисунок 2: Схематическое представление представленной методологии, состоящей из пяти основных разделов, подробно описанных в настоящем протоколе. Конструкции устройств создаются с использованием программного обеспечения автоматизированного проектирования (CAD) и мастер-формы, изготовленной с использованием фотолитографии (1). Это используется для литья поли(диметилсилоксана) (PDMS), который затем нарезается кубиками в плиты и связывается со стеклянными чашками Петри для формирования микрофлюидных устройств (2). Микробы, подлежащие включению в исследование, культивируют (3) и используют для прививки устройств (4). Взаимодействия изучаются с помощью микроскопии и количественно оцениваются с использованием методов анализа изображений (5). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Мастер изготовления пресс-форм
- Производство фотомаск
- Создавайте микрофлюидные конструкции устройств с помощью программного обеспечения автоматизированного проектирования (CAD). Размеры представленных устройств приведены на рисунке 1, а более подробно о конкретных конструктивных особенностях подробно перечислены в соответствующих публикациях40,41.
- Экспортируйте файл проекта САПР в соответствующем формате (например, .dwg, .dxf). Распечатайте пленочную фотолитографическую маску, отправив экспортированный файл дизайна САПР коммерческому поставщику для печати.
- Фотолитография
ПРИМЕЧАНИЕ: Следующие шаги должны выполняться в свободной от пыли и контролируемой светом среде, такой как ламинарная вытяжка или помещение для чистой комнаты. Экспериментальные условия, представленные здесь, приведены в качестве руководства и должны быть оптимизированы внутри компании. Авторы рекомендуют искать конкретную подготовку и консультироваться с установленными протоколами42.- Приготовьте 100 мм кремниевой, выпекая в духовке при 200 °C в течение 2 ч. Покройте кремниевую пластину фоторезистом SU-8 2010, стремясь к целевой толщине 10 мкм, используя следующие условия: 500 об/мин в течение 10 с (ускорение 100 об/мин) и 3000 об/мин в течение 45 с (ускорение 300 об/с).
ВНИМАНИЕ: Фоторезист SU-8 опасен, будьте осторожны при обращении и предотвращайте вдыхание и контакт с кожей. Он легковоспламеняется, потенциально канцерогенен и токсичен для окружающей среды. - Выпекать силиконовую пластину с покрытием при 95 °C в течение 2,5 мин (мягкая выпечка). Подвергайте фоторезист воздействию ультрафиолетового (УФ) света, используя пленочную фотолитографическую маску и энергетическую дозу 140 мДж/см2 на длине волны 365 нм с помощью элайнера маски.
- Выпекать силиконовую пластину с покрытием при 95 °C в течение 3,5 мин (выпекать после воздействия). Погружайте и перемешивайте кремниевую пластину в раствор разработчика в течение 3 минут, чтобы выявить микрофабрикованные структуры, удалив неэкспонированный фоторезист.
ВНИМАНИЕ: Решение разработчика может быть легковоспламеняющимся, принимайте соответствующие меры предосторожности при обращении и хранении. - Промывайте свежим решением разработчика в течение 10 с. Промыть изопропиловым спиртом на 10 с и высушить на воздухе. Используйте фильтрованный, сжатый воздух, чтобы убедиться, что конструкции полностью высохли. Измерьте высоту конструкций Су-8, например, с помощью профилометра.
- Силанизуйте каждую главную форму 50 мкл хлортриметилсилана, применяя вакуумное давление 50 мбар в течение 2 ч. Авторы отмечают, что повторная силанизация мастер-формы не была признана необходимой.
ВНИМАНИЕ: Хлортриметилсилан является опасным веществом. Носите соответствующие средства индивидуальной защиты (СИЗ) и обращайтесь с ними с осторожностью. Избегайте контакта с кожей и глазами и предотвращайте вдыхание. Хранить вдали от источников возгорания и использовать в хорошо проветриваемом помещении.
- Приготовьте 100 мм кремниевой, выпекая в духовке при 200 °C в течение 2 ч. Покройте кремниевую пластину фоторезистом SU-8 2010, стремясь к целевой толщине 10 мкм, используя следующие условия: 500 об/мин в течение 10 с (ускорение 100 об/мин) и 3000 об/мин в течение 45 с (ускорение 300 об/с).
2. Изготовление устройств
ПРИМЕЧАНИЕ: Следующие шаги должны выполняться в свободной от пыли среде, такой как ламинарный вытяжка.
- Приготовление плит поли(диметилсилоксан) (PDMS)
- Приготовьте приблизительно 40 г PDMS, тщательно перемешав основу и отверждающий агент в соотношении 10:1 с помощью шпателя в чистом пластиковом стаканчике. Дегазация смеси для удаления всех пузырьков воздуха путем помещения пластикового стаканчика, содержащего PDMS, в вакуумную камеру (вакуумное давление = 50 мбар) на 1 ч.
- Закрепите основную форму в пластиковом креплении с помощью прозрачной ленты. Очистка с помощью сжатого фильтрованного воздуха для удаления частиц пыли.
ПРИМЕЧАНИЕ: Альтернативно, алюминиевая фольга может быть сформирована вокруг стеклянной чашки Петри, а затем использована для размещения мастер-формы и содержать PDMS43. - Вылейте смесь PDMS на центр основной формы, убедившись, что она находится на ровной поверхности, и дайте осесть.
ПРИМЕЧАНИЕ: Смесь PDMS следует заливать как можно ближе к поверхности главной формы и поддерживать непрерывный поток, чтобы свести к минимуму введение пузырьков воздуха. Пузырьки воздуха можно удалить, направив сжатый воздух над пузырьком или вычерпывая их с помощью тонкой иглы. - Накройте основную форму свободно пластиковой крышкой, чтобы предотвратить оседание частиц пыли на поверхности PDMS. Переложите основную форму в духовку и отверждайте в течение ночи при 70 °C.
- Снимите основную форму из духовки и дайте остыть. Отклейте отвержденный PDMS от основной формы и пластиковой рамы, позаботившись о том, чтобы не повредить основную форму / PDMS.
- Поместите прозрачную ленту на микроканалы, выбитые в PDMS, чтобы сохранить поверхность без пыли. Убедитесь, что лента снята перед склеиванием.
- Нарежьте PDMS на плиты (т. Е. Если в конструкцию на главной пресс-форме включено несколько устройств, многие из них могут быть изготовлены из одной отливки), как указано в конструкции, с использованием навесной гильотины или лезвия бритвы. При резке бокового отверстия плиты BFI PDMS убедитесь, что микроканалы полностью открыты (рисунок 1A). Для плиты FFI PDMS убедитесь, что каждый угол обрезан, чтобы он мог поместиться в чашку Петри со стеклянным дном, показанную на рисунке 1D.
- Пробивайте желаемые входные/выпускные отверстия в соответствии с конструкцией устройства. Используйте прецизионный резак для пробивки входных отверстий диаметром 3,18 мм и 4,75 мм для образцовых устройств BFI и FFI соответственно.
- Склеивание плит PDMS для создания устройств
ПРИМЕЧАНИЕ: На следующих этапах стирки (2.2.1-2.2.2) используется ультразвуковой очиститель, заполненный очищенной водой (ddH2O) на частоте 37 кГц. Промывка плит PDMS помогает улучшить успешное склеивание44 и снизить риск загрязнения. Для манипулирования плитами PDMS используйте чистые щипцы и поднимайте с помощью входных отверстий, чтобы избежать повреждения микроканалов или поверхности устройства.- Погружайте плиты PDMS в 0,5 М NaOH и обжаивайте ультразвуком в течение 5 мин. Промыть стерильным ddH2O. Переложить плиты PDMS в 70% раствор этанола и ультразвуком в течение 5 мин. Промыть стерильным ddH20.
- Погружайте плиты PDMS в стерильный ddH2Oи храните ультразвуком в течение 5 мин. Извлеките плиты PDMS из стерильного ddH2O, высушите с помощью фильтрованного сжатого воздуха и поместите в стерильную квадратную чашку Петри.
- Поместите квадратную чашку Петри, содержащую плиты PDMS, в духовку при 70 °C в течение 1 часа для высыхания. Достаньте из духовки и дайте остыть в беспыльной среде. Удалите пыль с поверхности плит PDMS с помощью ленты и/или отфильтрованного сжатого воздуха.
- Активируйте поверхности плит PDMS и тарелок Петри со стеклянным дном для склеивания с помощью плазменного очистителя со следующими настройками: вакуумное давление 0,75 мбар, мощность 50%, время покрытия 1 мин. Поместите поверхности, которые должны быть активированы (и впоследствии склеены) обращены вверх в плазмоочиститель.
- Извлеките плиты PDMS и чашки Петри со стеклянным дном из плазмоочистителя и соедините, осторожно поместив активированные поверхности в конформный контакт друг с другом. Прикрепите плиты BFI и FFI PDMS к стеклянным чашкам Петри диаметром 35 мм и 50 мм (толщина стекла 0,17 мм) соответственно.
ПРИМЕЧАНИЕ: Следите за тем, чтобы не оказывать слишком большого давления при склеивании, так как это может привести к коллапсу микроканалов. - Проверьте успешность склеивания, просто попытавшись вытащить плиту PDMS со стеклянного дна чашки Петри пинцетом. Визуализируйте устройства на глаз или с помощью общей микроскопии, чтобы обеспечить отсутствие коллапса входных отверстий или микроканалов прививки.
ПРИМЕЧАНИЕ: Для насыщенных условий (т.е. условий, насыщенных водой и/или богатых питательными веществами) включите этап 2.2.7 протокола. Если требуются ненасыщенные водой условия, перейдите к этапу 2.2.8. Устройства могут быть заполнены водой или средой. - Заполняют устройства сразу после склеивания путем пипетирования 100 мкл желаемого раствора для устройства BFI (бактериальное входное и боковое отверстие) или 30 мкл среды в каждое входное отверстие (всего 60 мкл) для устройства FFI. Если присутствуют пузырьки воздуха, они рассеиваются примерно через 10 минут после заполнения, поскольку PDMS пористый.
- Добавьте стерильный ddH2O(~100-200 мкл) в чашку Петри для поддержания влажности.
3. Микробная культура
ПРИМЕЧАНИЕ: Следующие этапы обеспечивают общую микробиологическую процедуру для грибковой и бактериальной культуры и должны проводиться в стерильных условиях (т.е. с использованием шкафа для пламени или микробиологической безопасности), соответствующего уровню локализации, требуемому для желаемых микробов. Конкретные примеры приведены в конце каждого раздела для вида, представляющего интерес.
- Грибковая культура
- Приготовьте желаемую питательную среду, дополненную агаром. Автоклав среды при 121 °C в течение 15 мин. Дайте среде остыть до 50 °C и перелейте в чашки Петри диаметром 9 см, сохраняя стерильные условия.
- Используйте пробковый бур, чтобы удалить пробку агара, содержащего мицелий диаметром 4 мм, из колонии холодильника желаемого грибкового штамма, чтобы активировать изолят. Это проводится для обеспечения стандартизированного и энергичного роста грибка до инокуляции устройства.
ПРИМЕЧАНИЕ: Микробы также могут быть активированы из запаса глицерина, т.е. грибковых изолятов, хранящихся на агаровых пробках в 50% растворе глицерина при -70 °C41. - Поместите боковую часть пробки с мицелием в контакт с поверхностью агара в центре неинокализованной чашки Петри. Замените крышку поверх чашки Петри и запечатайте перед инкубацией при соответствующей температуре для желаемого штамма в течение необходимого количества времени, как правило, около 3-4 дней.
ПРИМЕЧАНИЕ: Пример условий культивирования Trichoderma rossicum: Солодовый экстракт агара, инкубированный при 25 °C в темноте в течение 48 ч.
- Бактериальная культура
- Распределите желаемый бактериальный изолят из исходного запаса (например, глицеринового запаса или одной колонии из агаровой пластины) на агаровую пластину, чтобы достичь одиночных бактериальных колоний и обеспечить отсутствие загрязнения45. Запечатайте пластину пленкой.
- Инкубировать при температуре и продолжительности, специфичных для интересующего изолята, пока не будут наблюдаться отдельные колонии.
- Подготовьте нужный культуральный отвар. Например, добавьте 10 г триптона, 10 г NaCl и 5 г дрожжевого экстракта на 1 л ddH2O, чтобы подготовить среду LB для культуры B. subtilis. Автоклав среды при 121 °C в течение 15 мин.
- Дайте среде остыть до комнатной температуры. Добавьте среду в стерильную колбу для культивирования внутри стерильной среды.
- Прикоснитесь к одной бактериальной колонии из агаровой пластины с помощью стерильной петли прививки. Переложите инокулированную петлю в стерильную питательную среду, ненадолго коснувшись петлей жидкости.
- Запечатайте колбу стерильной крышкой или фольгой и поместите внутрь встряхивающегося инкубатора на ночь, используя настройки, соответствующие выбранному виду.
ПРИМЕЧАНИЕ: Примеры условий культивирования для B. subtilis: i) жидкая культура - аэробный рост при 37 °C при 200 об/мин в среде LB и ii) пластинчатая культура - комнатная температура на агаровой пластине LB. Обратитесь к документам FFI/BFI 40,41 для получения более подробной информации о культивировании различных штаммов грибов.
4. Прививка устройства
ПРИМЕЧАНИЕ: Следующие шаги должны выполняться внутри ламинарной вытяжки с использованием стерильного оборудования.
- Грибковая прививка
- Используйте стерилизованный пробковый бур (ø = 4 мм), чтобы удалить агаровую пробку из колонии на периферии 3-дневной культуры (шаг 3.1). Убедитесь, что растущий гифальный фронт остается нетронутым.
- Введите пробку в грибковое отверстие, мицелий стороной вниз, с направлением роста гифального фронта, ориентированного на микроканальные отверстия, чтобы стимулировать гифальную инфильтрацию каналов.
- Повторите шаги 4.1.1-4.1.2 для второго вида грибов (если используется устройство FFI), введя вилку в противоположное входное отверстие. При использовании устройства BFI пропустите этот шаг и перейдите к шагу 4.1.4.
- Запечатайте чашку Петри прозрачной пленкой и инкубируйте при 25-28 °C в темноте до начала визуализации. Определите время инкубации до визуализации в зависимости от предполагаемого биологического события, которое будет наблюдаться, например, грибково-грибковых столкновений и скорости роста включенных видов в устройство.
- Бактериальная прививка
- Разбавляют бактерии из ночной культуры (стадия 3.2) в соотношении 1:25, используя ту же культуральную среду, что и в шаге 3.2.3. Культивировать в течение 3 ч при 37 °C.
- Промыть бактерии гранулированной культурой с помощью центрифуги при 2000 х г в течение 10 мин. Откажитесь от супернатанта и повторно суспендируйте клетки в желаемом объеме 0,9% мас./об.раствора натрия хлорида.
- Центрифуга снова для получения гранулы. Выбросьте супернатант и повторно суспендируйте клетки в жидкой среде (например, C. cinerea минимальной среде до OD600 из 1). Оптимизируйте значение OD600 для рассматриваемого бактериального штамма.
- Извлеките устройство BFI из инкубатора и откройте его в стерильной среде. Пипетка 10 мкл суспензии в бактериальный вход.
ПРИМЕЧАНИЕ: Оптимизируйте точное время прививки для бактериально-грибковых взаимодействий, о которых идет речь. Например, вводят бактерии в устройство BFI через 18 ч после грибковой инокуляции при использовании C. cinerea. - Запечатайте чашку Петри прозрачной пленкой и инкубируйте при 25 °C в темноте до начала визуализации. Храните устройство в вертикальном положении.
5. Микроскопия и анализ изображений
- Микроскопия
ПРИМЕЧАНИЕ: Исследователь должен выбрать соответствующий метод визуализации, соответствующий характеру проводимого эксперимента, например, инвертированную широкопольную эпифлуоресценцию или конфокальную микроскопию. Общий обзор был представлен здесь, так как конкретные детали будут зависеть от атрибутов выбранной настройки микроскопии.- Включите компьютер микроскопа, основной корпус микроскопа (если применимо), камеру, инкубатор с контролируемой температурой и источник (источники) света. Убедитесь, что микроскоп настроен правильно, например, подсветка Köhler была правильно применена для равномерного освещения образца. Запустите пакет программного обеспечения для создания образов.
ПРИМЕЧАНИЕ: При использовании инкубатора с контролируемой температурой важно дать температуре микроскопа уравновеситься в течение нескольких часов перед началом эксперимента. - Установите микрофлюидное устройство в сценическую вставку. Убедитесь, что устройство хорошо закреплено, т.е. лентой, чтобы предотвратить смещение устройства во время активного движения ступени.
- Получение изображений привитых устройств, например, одноточечных или покадровых экспериментов. Исчерпывающие спецификации изображений, относящиеся к экспериментам, проведенным с устройствами BFI и FFI, приведены в соответствующих вышеупомянутых публикациях40,41.
ПРИМЕЧАНИЕ: Изображения Brightfield были получены с помощью фазово-контрастной микроскопии для визуализации гифальной пролиферации через каналы роста с использованием программного обеспечения автофокусировки и либо 10-кратного увеличения, 0,30 NA (числовая диафрагма), либо 20-кратного увеличения, объективов 0,45 NA. Возбуждение флуоресцентных репортерных белков достигалось с помощью мощного светодиодного двигателя с длинами волн, специфичными для флуорофора. - Экспортируйте изображения в подходящий формат для последующей обработки изображений. Например, .tiff.
- Включите компьютер микроскопа, основной корпус микроскопа (если применимо), камеру, инкубатор с контролируемой температурой и источник (источники) света. Убедитесь, что микроскоп настроен правильно, например, подсветка Köhler была правильно применена для равномерного освещения образца. Запустите пакет программного обеспечения для создания образов.
- Анализ изображений
ПРИМЕЧАНИЕ: Авторы рекомендуют Фиджи46 в качестве инструмента для анализа изображений, но доступны и другие программные пакеты. Ниже приводятся примеры анализа изображений, проведенных с использованием Фиджи, из представленных публикаций BFI и FFI об устройствах. Эти шаги специфичны для Mac и могут немного отличаться при использовании ПК.- Измерения скорости роста гифального нерва
ПРИМЕЧАНИЕ: Этот метод был использован в рукописи BFI40 для измерения темпов роста отдельных гиф.- Загрузите, установите и запустите Fiji. Импортируйте последовательность изображений из эксперимента с замедленной съемкой, выбрав Файл > Импорт > Последовательность изображений. Найдите папку, в которой хранятся данные, и нажмите кнопку Открыть. В окне Параметры последовательности выберите Настройки, а затем ОК.
- Выберите значок «Прямая линия » на главной панели инструментов. Поместите начало прямой линии на кончик растущего гифального наконечника, щелкнув и одновременно перетащив курсор в другую точку в окне. Появится желтая линия с тремя полями, указывающими начало, середину и конец линии.
- Перейдите к следующему кадру в последовательности изображений, нажав и удерживая клавиши CTRL и >. Расположите конец прямой линии на кончике растущей гифы, выбрав и перетащив квадратную рамку в правильное положение.
- Нажмите и удерживайте клавиши CTRL и M , чтобы измерить длину линии в пикселях. Появится окно Результаты с измеренными данными. Определите данные, отображаемые в окне Результаты, следующим образом: щелкните окно Результаты , а затем выберите Результаты > Задать измерения.
- Перейдите к следующему кадру в последовательности изображений, нажав и удерживая клавишу CTRL , а затем >. Расположите начало прямой линии на кончике растущей гифы, выбрав и перетащив квадратную рамку в правильное положение.
- Нажмите и удерживайте клавишу CTRL , а затем M , чтобы измерить длину линии в пикселях. Появится окно Результаты с измеренными данными.
- Повторяйте шаги 5.2.1.5-5.2.1.6 до тех пор, пока не закончите измерение роста гифы в пикселях.
- Выберите все данные в окне Результаты . Скопируйте и вставьте в другую программу, например, электронную таблицу, для обработки данных. Постройте график гифального роста (в пикселях или микрометрах) как функцию времени и рассчитайте средние темпы роста. Выполняйте не менее трех биологических реплик за эксперимент.
- Измерения интенсивности флуоресценции
ПРИМЕЧАНИЕ: Этот метод был использован в публикацииFFI 41 для оценки изменения интенсивности флуоресценции в гифах Fusarium graminearum 8/1-wt-GFP при контакте с Clonostachys rosea 016 в зависимости от времени.- Загрузите, установите и запустите Fiji. Импорт последовательности изображений из эксперимента с замедленной съемкой, выбрав Файл > Импорт > Последовательность изображений. Найдите папку, в которой хранятся данные, и нажмите кнопку Открыть. В окне Параметры последовательности выберите Настройки , а затем ОК.
- Укажите интересующую область (ROI) для измерения абсолютной интенсивности флуоресценции гифы с помощью прямоугольного инструмента, расположенного на основной панели инструментов. Размер квадрата можно определить точно следующим образом: Редактировать > Выделение > Указать; окупаемость инвестиций также может быть сохранена для дальнейшего использования в менеджере ROI, выбрав Изменить > Выбор > Добавить в Менеджер.
- Измерьте абсолютную интенсивность флуоресценции (среднее значение серого) в пределах определенной рентабельности инвестиций для каждого изображения во всей последовательности изображений или стеке следующим образом: Стеки > изображения > Стек мер. Окно Результаты откроется автоматически после обработки всех изображений в стеке.
ПРИМЕЧАНИЕ: Данные, отображаемые в окне Результаты, могут быть определены следующим образом: нажмите на окно Результаты , а затем выберите Результаты > Установить измерения. Убедитесь, что выбран параметр Среднее серое значение . - Выберите все данные в окне Результаты . Скопируйте и вставьте в другую программу, например, в электронную таблицу, чтобы построить абсолютную интенсивность флуоресценции указанной рентабельности инвестиций в зависимости от времени.
- Повторите шаги 5.2.2.2-5.2.2.4 для сбора измерений абсолютной интенсивности флуоресценции для каждого ROI, т.е. на интересующей гифе, рядом с интересующей гифой или в пределах соответствующего контрольного канала.
- Рассчитайте соответствующие относительные интенсивности флуоресценции в произвольных единицах (AU), например, разделив абсолютную интенсивность флуоресценции ROI [интересующая гифа] на абсолютную интенсивность флуоресценции ROI [контрольного канала]. Обратитесь к публикации FFI41 для получения более подробной информации.
- Выполните по крайней мере три биологические реплики за эксперимент и постройте график относительной интенсивности флуоресценции в зависимости от времени.
- Измерения скорости роста гифального нерва
Результаты
Репрезентативные результаты представлены из примерных устройств BFI40 и FFI41. Измерения скорости роста гифрагмы могут быть легко получены с помощью этих устройств в сочетании с основными методами микроскопии. Рисунок 3A-B иллюст?...
Обсуждение
В данной статье представлен протокол исследования грибково-микробных взаимодействий с использованием канальной микрофлюидики. Авторы стремятся продемонстрировать универсальность этих устройств и поощрять адаптацию в соответствии с интересами исследователя. Используя примерные у?...
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Мы признаем финансовую поддержку со стороны Департамента биоинженерии Имперского колледжа Лондона и The Leverhulme Trust (ссылка на исследовательский грант: RPG-2020-352).
Материалы
| Name | Company | Catalog Number | Comments |
| Agar | Difco Laboratories | 214010 | Used to solidify culture medium for bacterial and fungal cultivation within Petri dishes |
| Aluminum foil | Fisher Scientific Ltd | 11759408 | |
| AutoCAD 2021 | Autodesk, USA | ||
| Autoclave (VX-75) | Systec | ||
| Centrifuge (5810R) | Eppendorf | ||
| Chlorotrimethysilane | Merck Life Sciences | 386529 | CAUTION: Chlorotrimethylsilane is a hazardous substance. Wear appropriate PPE and handle with care. Avoid contact with skin and eyes and prevent inhalation. Keep away from sources of ignition and use in a well-ventilated area. |
| Cork borer | SLS | COR1000 | |
| Developer solution (mr-Dev 600) | Microresist Technologies | CAUTION: mr-Dev 600 developer solution is flammable | |
| Erlenmeyer flasks | VWR | 214-1108 | e.g. 200 mL; choose size to suit your exact needs |
| Ethanol (70% v/v) | Fisher Scientific Ltd | E/0650DF/15 | Diluted from 99.8% (Analytical Reagent Grade) |
| Fiji | ImageJ | Exemplar software package for imaging processing | |
| Filtered, compressed air | Available as standard in most labs. Altervatively, an oil-free compressor with air regulator can be used. | ||
| Flat-headed wafer tweezers | SLS | INS5026 | |
| Forceps | Fisher Scientific Ltd | 10008051 | Bent, sharp |
| Glass bottom petri dish | World Precision Instruments | FD35-100 | 35 mm |
| Glass bottom petri dish | World Precision Instruments | FD5040-100 | 50 mm |
| Glass crystallisation dishes | VWR | 216-1865 | Used for washing of PDMS slabs |
| Glass crystallisation dishes | VWR | 216-1866 | Used in the development of master moulds |
| Glass media bottles | Fisher Scientific Ltd | 15456113 | e.g. 250 mL; choose size to suit your exact needs |
| Glass syringe (Hamilton) | Fisher Scientific Ltd | 10625251 | Used for dispensing chlorotrimethylsilane |
| Hot plate (HP 160 III BM) | SAWATEC | ||
| Inoculation loop | VWR | COPA175CS01 | |
| Isopropyl alcohol | Sigma-Aldrich | W292907 | |
| Laminar flow hood | Air Science (PCR) | Exemplar laminar flow hood used for device fabrication | |
| LB medium | Fisher Scientific Ltd | BP9723-500 | Exemplar nutrient broth for bacterial overnight culture |
| Light emitting diode light engine (LedHUB) | Omicron-Laserage Laserprodukte GmbH | Exemplar light source that can be used for imaging fungal-microbial interactions (fluorescence) | |
| MA6 Ultraviolet mask aligner | Suss Microtec | ||
| Malt extract | VWR | 84618 | Used to make exemplar fungal culture medium (Malt extract agar) |
| Mask Writer | Applied Materials | 4700DP | Example of a mask writer which can be used to print photo-mask for photolithography |
| Master mould plastic mount | 3D-printed bespoke holder manufactured in-house | ||
| Microbiological safety cabinet (BioMat2) | Contained Air Solutions | Exemplar MSC used for microbial culture and device inoculation | |
| Milli-Q purified water | Available as standard in biology labs. | ||
| NaOH | Fisher Scientific Ltd | BP359-500 | |
| NIS-Elements Advanced Research imaging software | Nikon | Exemplar software package for image acquisition | |
| NIS-Elements Free Viewer | Nikon | Exemplar software package for viewing acquired images | |
| Oven (Binder BD115) | Fisher Scientific Ltd | 15602126 | Used for curing poly(dimethylsiloxane)(PDMS) |
| Oven (CLO-2AH-S) | KOYO | Used for preparing silicon wafers | |
| Parafilm | Bemis | HS234526B | transparent film |
| Petri dishes, square sterile | Fisher Scientific Ltd | 11708573 | 120.5 mm |
| Petri dishes, sterile | Fisher Scientific Ltd | 15370366 | 90 mm |
| Photolithography mask | Micro Lithography Services Ltd. UK | ||
| Plasma cleaner (Zepto) | Diener Electronic | 100012601 | |
| Plastic cup | Semadeni | 8323 | |
| Plastic spatula | Semadeni | 3340 | |
| Portable precision balance (OHAUS Scout) | Fisher Scientific Ltd | 15519631 | Used for weighing PDMS, media components etc. |
| Precision cutter | Syneo | HS1251135P1183 | Cutting edge diameter: 3.18 mm |
| Precision cutter | Syneo | HS1871730P1183S | Cutting edge diameter: 4.75 mm |
| Profilometer | Bruker | Dektak XT-stylus | |
| Razor blades | Häberle Labortechnik | 9156110 | |
| Refridgerator | Haden | 4-6 °C | |
| Retiga R1 CCD camera | Qimaging | Exemplar camera that can be used for imaging fungal-microbial interactions | |
| Scotch magic tape | Office Depot | 3969954 | 19 mm invisible tape; clear tape |
| Shaking incubator (Cole-Parmer SI500) | Fisher Scientific Ltd | 10257954 | |
| Silicon wafer | Inseto | 100 mm | |
| Soda lime glass plate | Inseto | 125 mm x 125 mm x 2 mm. Used to hold photolithography mask in mask aligner | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Spincoater | SAWATEC | SM-180-BM | |
| SU-8 2010 photoresist | MicroChem | CAUTION: SU-8 photoresist is hazardous, take care when handling and prevent inhalation and contact with skin. Flammable, potentially carcinogenic and toxic to the environment. | |
| Sylgard 184 elastomer kit | VWR | 634165S | Used for the preparation of poly(dimethylsiloxane)(PDMS) devices |
| Temperature controlled incubator | Okolab | Exemplar incubator that can be used for imaging fungal-microbial interactions | |
| Ti2-E inverted epifluorescence microscope | Nikon | MEA54000 | Exemplar microscope that can be used for imaging fungal-microbial interactions |
| Ultrasonic cleaner S-Line | Fisher Scientific Ltd | FB15050 | |
| Vacuum desiccator | Fisher Scientific Ltd | 10528861 | Silianisation and PDMS degassing should be conducted in separate desiccators |
| x10/0.3 NA CFI Plan Fluor DL objective lens | Nikon | MRH20105 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
| x20/0.45 NA CFI Plan Fluor DL objective lens | Nikon | MRH48230 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
Ссылки
- Zhu, Y. -. G., Miller, R. M. Carbon cycling by arbuscular mycorrhizal fungi in soil-plant systems. Trends in Plant Science. 8 (9), 407-409 (2003).
- Dai, Z., et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems. The ISME Journal. 14 (3), 757-770 (2020).
- Op De Beeck, M., et al. Regulation of fungal decomposition at single-cell level. The ISME Journal. 14 (4), 896-905 (2020).
- Bender, S. F., et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil. The ISME Journal. 8 (6), 1336-1345 (2014).
- Dullah, S., et al. Melanin production and laccase mediated oxidative stress alleviation during fungal-fungal interaction among basidiomycete fungi. IMA Fungus. 12 (1), 33 (2021).
- Deveau, A., et al. Bacterial-fungal interactions: ecology, mechanisms and challenges. FEMS Microbiology Reviews. 42 (3), 335-352 (2018).
- Bian, R., et al. Facilitative and synergistic interactions between fungal and plant viruses. Proceedings of the National Academy of Sciences of the United States of America. 117 (7), 3779-3788 (2020).
- Jiang, X., Xiang, M., Liu, X. Nematode-trapping fungi. Microbiology Spectrum. 5 (1), (2017).
- Essig, A., et al. a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis. Journal of Biological Chemistry. 289 (50), 34953-34964 (2014).
- Tang, H. -. Y., Zhang, Q., Li, H., Gao, J. -. M. Antimicrobial and allelopathic metabolites produced by Penicillium brasilianum. Natural Product Research. 29 (4), 345-348 (2015).
- Bai, Y. -. B., et al. Antifungal activity of griseofulvin derivatives against phytopathogenic fungi In vitro and In vivo and three-dimensional quantitative structure-activity relationship analysis. Journal of Agricultural and Food Chemistry. 67 (22), 6125-6132 (2019).
- Solanki, M. K., et al. Characterization of antagonistic-potential of two Bacillus strains and their biocontrol activity against Rhizoctonia solani in tomato. Journal of Basic Microbiology. 55 (1), 82-90 (2015).
- Jamali, H., Sharma, A., Srivastava, A. K. Biocontrol potential of Bacillus subtilis RH5 against sheath blight of rice caused by Rhizoctonia solani. Journal of Basic Microbiology. 60 (3), 268-280 (2020).
- Válková, H., Novotný, &. #. 2. 6. 8. ;., Malachová, K., Šlosarčíková, P., Fojtík, J. Effect of bacteria on the degradation ability of Pleurotus ostreatus. Science of The Total Environment. 584-585, 1114-1120 (2017).
- Leyva-Rojas, J. A., Coy-Barrera, E., Hampp, R. Interaction with soil bacteria affects the growth and amino acid content of Piriformospora indica. Molecules. 25 (3), 572 (2020).
- Dullah, S., et al. Fungal interactions induce changes in hyphal morphology and enzyme production. Mycology. 12 (4), 279-295 (2021).
- Marfetán, J. A., Romero, A. I., Folgarait, P. J. Pathogenic interaction between Escovopsis weberi and Leucoagaricus sp.: mechanisms involved and virulence levels. Fungal Ecology. 17, 52-61 (2015).
- Cortois, R., De Deyn, G. B. The curse of the black box. Plant and Soil. 350 (1), 27-33 (2012).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Sackmann, E. K., Fulton, A. L., Beebe, D. J. The present and future role of microfluidics in biomedical research. Nature. 507 (7491), 181-189 (2014).
- Hanson, K. L., et al. Fungi use efficient algorithms for the exploration of microfluidic networks. Small. 2 (10), 1212-1220 (2006).
- Held, M., Edwards, C., Nicolau, D. V. Probing the growth dynamics of Neurospora crassa with microfluidic structures. Fungal Biology. 115 (6), 493-505 (2011).
- Thomson, D. D., et al. Contact-induced apical asymmetry drives the thigmotropic responses of Candida albicans hyphae. Cellular Microbiology. 17 (3), 342-354 (2015).
- Lee, K. K., Labiscsak, L., Ahn, C. H., Hong, C. I. Spiral-based microfluidic device for long-term time course imaging of Neurospora crassa with single nucleus resolution. Fungal Genetics and Biology. 94, 11-14 (2016).
- Asenova, E., Lin, H. Y., Fu, E., Nicolau, D. V., Nicolau, D. V. Optimal fungal space searching algorithms. IEEE Transactions on NanoBioscience. 15 (7), 613-618 (2016).
- Soufan, R., et al. Pore-scale monitoring of the effect of microarchitecture on fungal growth in a two-dimensional soil-like micromodel. Frontiers in Environmental Science. 6, (2018).
- Uehling, J. K., et al. Microfluidics and metabolomics reveal symbiotic bacterial-fungal interactions between Mortierella elongata and Burkholderia include metabolite exchange. Frontiers in Microbiology. 10, 2163 (2019).
- Millet, L. J., et al. Increasing access to microfluidics for studying fungi and other branched biological structures. Fungal Biology and Biotechnology. 6 (8), 1-14 (2019).
- Baranger, C., Fayeulle, A., Le Goff, A. Microfluidic monitoring of the growth of individual hyphae in confined environments. Royal Society Open Science. 7 (8), 191535 (2020).
- Aleklett, K., Ohlsson, P., Bengtsson, M., Hammer, E. C. Fungal foraging behaviour and hyphal space exploration in micro-structured Soil Chips. The ISME Journal. 15 (6), 1782-1793 (2021).
- Aleklett, K., et al. Build your own soil: exploring microfluidics to create microbial habitat structures. The ISME Journal. 12 (2), 312-319 (2018).
- Ellett, F., Jorgensen, J., Frydman, G. H., Jones, C. N., Irimia, D. Neutrophil interactions stimulate evasive hyphal branching by Aspergillus fumigatus. PLOS Pathogens. 13 (1), 1006154 (2017).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Schmieder, S. S., et al. Bidirectional propagation of signals and nutrients in fungal networks via specialized hyphae. Current Biology. 29 (2), 217-228 (2019).
- Tayyrov, A., Stanley, C. E., Azevedo, S., Künzler, M. Combining microfluidics and RNA-sequencing to assess the inducible defensome of a mushroom against nematodes. BMC Genomics. 20 (1), 243 (2019).
- Stanley, C. E., Grossmann, G., Casadevall i Solvas, X., deMello, A. J. Soil-on-a-Chip: microfluidic platforms for environmental organismal studies. Lab on a Chip. 16 (2), 228-241 (2016).
- Stanley, C. E., vander Heijden, M. G. A. Microbiome-on-a-Chip: new frontiers in plant-microbiota research. Trends in Microbiology. 25 (8), 610-613 (2017).
- Ortseifen, V., Viefhues, M., Wobbe, L., Grünberger, A. Microfluidics for biotechnology: bridging gaps to foster microfluidic applications. Frontiers in Bioengineering & Biotechnology. 8, 589074 (2020).
- Jansson, J. K., Hofmockel, K. S. The soil microbiome-from metagenomics to metaphenomics. Current Opinion in Microbiology. 43, 162-168 (2018).
- Stanley, C. E., et al. Probing bacterial-fungal interactions at the single cell level. Integrative Biology (Camb). 6 (10), 935-945 (2014).
- Gimeno, A., et al. A versatile microfluidic platform measures hyphal interactions between Fusarium graminearum and Clonostachys rosea in real-time. Communications Biology. 4 (1), 262 (2021).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Stanley, C. E., et al. Fabrication and use of the dual-flow-RootChip for the imaging of Arabidopsis roots in asymmetric microenvironments. Bio-protocol. 8 (18), 3010 (2018).
- Choi, C. -. H., Lee, H., Weitz, D. A. Rapid patterning of PDMS microfluidic device wettability using syringe-vacuum-induced segmented flow in nonplanar geometry. ACS Applied Materials & Interfaces. 10 (4), 3170-3174 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. (63), e3064 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Harting, R., et al. Pseudomonas strains induce transcriptional and morphological changes and reduce root colonization of Verticillium spp. Frontiers in Microbiology. 12, 652468 (2021).
- Boenisch, M. J. . Structural and molecular characterisation of the penetration process of Fusarium graminearum during Fusarium head blight infection. , (2013).
- Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., von Tiedemann, A. Differential interactions of Verticillium longisporum and V. dahliae with Brassica napus detected with molecular and histological techniques. European Journal of Plant Pathology. 118 (3), 259-274 (2007).
- Ghanem, N., Stanley, C. E., Harms, H., Chatzinotas, A., Wick, L. Y. Mycelial effects on phage retention during transport in a microfluidic platform. Environmental Science & Technology. 53 (20), 11755-11763 (2019).
- Alrifaiy, A., Lindahl, O. A., Ramser, K. Polymer-based microfluidic devices for pharmacy, biology and tissue engineering. Polymers. 4 (3), 1349-1398 (2012).
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nature Reviews Molecular Cell Biology. 16 (9), 554-567 (2015).
- Hoelzle, D., et al. Microfluidic device design, fabrication, and testing protocols. Protocol Exchange. , (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены