Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Ürokinaz tipi Plazminojen Aktivatörü ile İndüklenen Fare Sırt Ağrısı Modeli
Bu Makalede
Özet
Farelerde sırt ağrısı modelinin basit, hızlı indüksiyonu için yöntemler burada idrar plazminojen aktivatörünün intraligament enjeksiyonu kullanılarak sağlanmaktadır.
Özet
Burada açıklanan basit metodoloji ile farelerde kalıcı bel ağrısı modeli indüklenebilir. Farelerde kalıcı bir sırt ağrısı modelinin basit, hızlı bir şekilde indüksiyonu için adım adım yöntemler, burada insanlarda ve diğer hayvanlarda bulunan bir serin proteaz olan ürokinaz tipi plazminojen aktivatörü (ürokinaz) enjeksiyonu kullanılarak sağlanmaktadır. Farelerde devam eden bel ağrısının indüksiyonu için metodoloji, lomber omurganın ligamentöz yerleştirme bölgesi boyunca basit bir ürokinaz enjeksiyonunu içerir. Ürokinaz inflamatuar ajanı, plazminojeni plazminle aktive eder. Tipik olarak, model 10 dakika içinde indüklenebilir ve aşırı duyarlılık en az 8 hafta devam eder.
Aşırı duyarlılık, yürüme bozukluğu ve diğer standart anksiyete ve depresyon benzeri önlemler kalıcı modelde test edilebilir. Sırt ağrısı en sık görülen ağrı türüdür. Sırt ağrısı farkındalığını artırmak için Uluslararası Ağrı Araştırmaları Derneği (IASP), 2021'i "Sırt Ağrısı Hakkında Küresel Yıl" ve 2022'yi "Ağrı Bilgisini Pratiğe Dönüştürmek için Küresel Yıl" olarak adlandırdı. Ağrı terapötiklerinin terapötik ilerlemesinin bir sınırlaması, kalıcı ve kronik ağrıyı test etmek için uygun modellerin olmamasıdır. Bu modelin özellikleri, sırt ağrısının ve yardımcı özelliklerinin azaltılmasını amaçlayan potansiyel terapötikleri test etmek için uygundur ve IASP'nin 2022'yi Ağrı Bilgisini Uygulamaya Dönüştürmek için Küresel Yıl olarak adlandırmasına katkıda bulunur.
Giriş
Bel ağrısı, dünya çapında her 5 kişiden 1'inin acı çektiği en yaygın sakatlık nedenlerinden biridir1. Bu çabalara rağmen, sırt ağrısının az sayıda güvenilir hayvan modeli, ağrı alanındaki hayvan araştırmalarında, özellikle farelerde yaygın olarak kullanılmaktadır. Önceki modeller, lomber faset eklemine (uPA) idrar plazminojen aktivatörü (uPA) enjeksiyonu, sinir büyüme faktörünün (NGF) gövde kas sistemine enjeksiyonu (NGF) veya monosodyum iyodoasetat (MIA)5 veya interlökin-1beta6 intravertebral diske enjeksiyon. Tabii ki, sıçanlar bu modeller için esas olarak daha büyük boyutları ve enflamatuar ajanların enjeksiyonu için erişim kolaylığı nedeniyle tercih edilir.
Açık olmak gerekirse, uzun yıllar boyunca kullanılan SPARC-null fare intervertebral disk dejenerasyonu modeli gibi sırt ağrısının fare modelleri mevcuttur7, ancak bunların oluşturulması enjeksiyon tabanlı modellerden daha maliyetli ve zaman alıcıdır. Yakın zamanda yapılan bir fare çalışması, bel kaslarına NGF enjeksiyonunu dikey kronik kısıtlama stresi ile birleştirerek bir bel ağrısı modeli oluşturdu8. Aşağıdaki protokolde, uPA kaynaklı CBP modelini fareler2 için sıçanlardan uyarladık. Aşırı duyarlılık 1 hafta içinde kurulur ve 6-8 haftaya kadar devam eder. Ek olarak, farelerin anksiyete ve depresyon benzeri davranışlar geliştirdiğini tespit ettik. Sırt ağrısının prevalansı ve moleküler ağrı araştırmalarında farelerin daha yaygın kullanımı göz önüne alındığında, bu dayanıklı model, sırt ağrısının giderilmesi için yeni tedavi stratejilerinin geliştirilmesinde kullanılmak üzere kolayca oluşturulmuştur.
Protokol
Açıklanan tüm hayvan prosedürleri, NIH Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu ile uyumludur. Çalışmalar, New Mexico Üniversitesi Sağlık Bilimleri Merkezi'nin yerel Kurumsal Bakım ve Kullanım Komitesi (IACUC #23-201364-HSC) tarafından onaylandı. Tüm çalışmalar, Bölüm III'te açıklandığı gibi, araştırmada hayvanların kullanımına ilişkin bir OLAW Uygunluk Güvencesi (A3002-01) himayesindeki politikalara uygundur. II. Güvenceler ve Sertifikalar. Hayvanlar, laboratuvar personeli ve Laboratuvar ve Hayvan Kaynakları Bölümü (DLAR) personeli tarafından sürdürülen Hayvan Kaynakları Merkezi (ARC) barınma tesisinde barındırılmaktadır. Ötenazi yöntemi (100 μL 59 mg / mL pentobarbital enjeksiyon) hızlı ve güvenilirdir ve daha fazla araştırma için çeşitli dokuların diseksiyonuna ve toplanmasına izin verir.
1. Hayvanlar
- Ev yetişkini (~ 3-4 haftalık) erkek ve dişi BALB/c fareleri (20-25 g) ters 12 saat:12 saat aydınlık:karanlık döngüsünde, bu nedenle karanlıkta aktif süreleri laboratuvar çalışma saatlerinde gerçekleşir.
NOT: Bu, kemirgenler doğal olarak gece hayvanları olduğundan, hayvanların doğal aktif süresi boyunca tüm parametrelerin değerlendirilmesine izin verecektir. Bu, sirkadiyen saatteki değişikliklerin katkısını azaltır, böylece hayvanlar artık gündüz olan aktif zamanlarında test edilebilir. - Hayvanları günde iki kez izleyin.
- Fareleri, ağrı ile ilgili davranışlar üzerindeki ilaç etkilerini değerlendirirken, standart kemirgen yemine (aşırı duyarlılığı değiştirdiği bilinen) kıyasla soya proteini içeriğinde daha düşük olan normal fare damızlık yemi üzerinde tutun.
- Sağlıklı kilo alımının korunmasını sağlamak için hayvanları haftada bir kez tartın.
NOT: 8-10 haftalık çalışmalar boyunca ağırlıkta hiçbir grup farkı görülmemiştir, bu da çalışma körlemesine izin vermiştir.
2. Model indüksiyonu
- Fareyi yerinde tutmak için stabilizasyon kısıtlamaları takmak için bir araçla donatılmış sıcak, steril düz bir yüzey üzerinde model indüksiyonu gerçekleştirin (Şekil 1A). Ameliyatı sterilize edilmiş bir yüzeyde diseksiyon mikroskobu ile gerçekleştirin.
NOT: Anestezi yakalama mevcut değilse kimyasal dereceli bir çeker ocak kullanın. - Malzeme Tablosunda önerilen taban plakasını kullanıyorsanız, kısıtlama olarak plakanın nervürlü kenarlarına asılan iplerin ucunda düğümlenmiş lastik bantlı cerrahi ipek veya hatta iplik kullanın.
- Enjeksiyondan hemen sonra farelerin istasyona aktarılması için ameliyat kurulumunun bitişiğindeki bir yüzeye bir ısıtma yastığı geri kazanım istasyonu yerleştirin (Şekil 1B).
NOT: Kafesin rahat bir sıcaklığa (10 °C) kadar ısınmasını sağlamak için enjeksiyondan en az 37 dakika önce ısıtma yastığının üzerine boş bir muhafaza kafesi yerleştirin. Uyanık farenin toparlanma sıcaklıklarını tercih etmesine izin vermek için kafesi pedin yarısına yerleştirin. - Ürokinazı steril suyla seyrelterek hazırlayın. Alkol: Hamilton şırıngasını temizleyin ve steril suyla durulayın. Çözeltiyi önceden hazırlayın, böylece fare mümkün olduğunca kısa bir süre anestezi altında kalır. Model için 5 μL 2 mg/mL idrar plazminojen aktivatörü kullanın; şems için 5 μL steril salin kullanın.
- Bu kısa prosedür için izofluran anestezi istasyonunu %4 veya daha düşük bir seviyede ayarlayın. Fareyi indüksiyon odasına yerleştirin; Tipik olarak, farenin hızlı nefes alma hızı 1-2 dakika içinde yavaşlar ve üst göğüs hareketinden alt göğse doğru hareket eder.
- Hayvan cerrahına maruz kalmaktan kaçınmak için izofluranı fırçalamak için 1.5 L/dk'lık bir oksijen seviyesi ve aktif kömür F bidonu kullanın veya biyolojik akış veya baş üstü tahliye başlığı altında çalışın. Mevcut değilse, prosedürü bir kimyasal güvenlik başlığında gerçekleştirin.
- Anestezik seviyeyi korumak için farenin burnunu nosekona yerleştirerek, fareyi ve anestezik akışı 37 ° C'lik bir ısıtma pedi üzerinde cerrahi alana hızla değiştirin (Şekil 1C, D). Farenin ayak parmaklarını sıkıştırmak ve ardından fareyi taban plakasında tutmak için refleksif bir hareketi olmadığından emin olun.
NOT: Herhangi bir hareket varsa, fareyi indüksiyon odasına geri yerleştirin ve bunu tekrarlayın. - Arka cilt bölgesini alkollü bir bezle temizleyin. Anestezi uygulanmış farenin arkasını net bir şekilde görebilmek için LED aydınlatmayı gerektiği gibi ayarlayın.
NOT: Gerekirse, farenin sırtındaki tüyleri almak için elektrikli bir tıraş makinesi kullanın, böylece derinin altındaki omurga çıkıntılarının engelsiz bir görünümü olur. Deney fareleri traş edilirse, çalışma körlemesi için saf ve sahte farelerin arkasını da tıraş edin. - Fareyi tamamen uyuşturulmuş ve hareketsizken enjekte edin (düzeltme refleksi ve ayak parmağı sıkışma geri çekilmesi yok). Farenin göğüs kafesinin alt kısmının omurga ile birleştiği yeri nazikçe hissetmek için iki parmağınızı kullanın (Şekil 2A). Bu noktanın altında kereste omurga segmentleri bulunur; enjeksiyonu burada L2-L3'te hedefleyin.
- Hamilton şırıngasının ucunu omurganın yanına yerleştirin (Şekil 2B,C). Şırıngayı ~45° açıyla kemiğe hemen bitişik interspinöz bağa doğrultun.
NOT: Farenin derisinin sertliğine bağlı olarak, bazen aktif basınç ve 90° açı yerine yerçekimine güvenmek daha iyi sonuç verebilir. - İğnenin ucunu nazikçe ama sıkıca interspinöz bağa sokun (Şekil 3B,C).
NOT: Amaç karın boşluğunu kırmak değil, bağı enjekte etmektir. - İğnenin içindekileri yavaşça boşaltın. Herhangi bir noktada uçta sıvı varsa, iğne deriden geçmez. 5 μL'nin tamamı enjekte edilene kadar devam edin.
- Enjeksiyondan geri akışı önlemek için iğneyi ~5 saniye yerinde tutun. Terminal veya akut pilot çalışmalarda mavi boya kullanılması önerilir.
NOT: Doğru yapılırsa, sıvı gösterildiği gibi bağa yayılmalıdır (Şekil 3A). - İğneyi nazikçe ve yavaşça çıkarın. Kan veya akıntı olmadığından emin olun.
- Fareyi, ev kafesine geri döndürmeden önce uyanana ve hareket edene kadar kafes üstü bir ısı geri kazanım istasyonuna yerleştirin.
NOT: İşlemin hızlı bir şekilde gerçekleştirildiğini varsayarsak, farenin uyanması bir dakikadan fazla sürmemelidir. - Önlem olarak tüm normal motor fonksiyonlarının devam ettiğinden emin olmak için ameliyattan 1 saat sonra fareleri kontrol edin.
NOT: Doğru yapılırsa, bu prosedürden herhangi bir komplikasyon olmamalıdır. - Herhangi bir enfeksiyon veya komplikasyon meydana gelmediğinden emin olmak için kilo değerlendirmesi ve enjeksiyon yeri muayenesi de dahil olmak üzere ameliyattan sonraki hafta boyunca fareleri günlük olarak kontrol edin. Kilo kaybı ve uyuşukluk gibi davranışlarda bir değişiklik varsa, fareyi daha fazla deney yapmak için kullanmayın.

Şekil 1: Ürokinaz CBP indüksiyonu için kurulum. (A) Fare ameliyatları için önerilen Güzel Bilim Araçları taban plakası. Nervürlü kenarlar, fareyi yerinde tutmak için üzerlerinde kancalı ipe sahip olabilir. (B) Kurtarma istasyonu. Yarısı ısıtma yastığında, yarısı kapalı olmak üzere boş bir muhafaza kafesi önerilir. Fareye rahat bir dinlenme alanı sağlamak için tabana temiz bir bez yerleştirilir. (C) Anestezi makinesi kurulum önerisi. İki kanallı bir dağıtım sistemi kullanarak, bir hortumu indüksiyon odasına, diğerini ameliyat istasyonuna kurun. (D) Fare kısıtlamalarının görünümü. Taban plakasının nervürlü kenarlarına iki ip düğümlenir, ardından sırasıyla farenin boynu ve arkası boyunca nazikçe çekilir. Normal nefes almaya devam edebilmesi için fareyi çok sıkı tutmadığınızdan emin olun. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: CBP'nin ürokinaz enjeksiyon indüksiyonu. (A) Enjeksiyon bölgesi yerleşiminin bir görünümü. Gösterildiği gibi, L4-L5 için bir referans noktası olarak farenin göğüs kafesinin altını bulmak için parmaklarınızla hissedin. (B) Uygun enjeksiyon açısını gösteren enjeksiyon işleminin bir görünümü. (C) Burada 45°'lik bir açı tercih edilir, ancak iğnenin ihtiyaç duyduğu yere ulaştığından emin olmak için gerektiği gibi ayarlayın. Gerekirse, daha iyi görselleştirme için enjeksiyon bölgesini tıraş edin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Enjeksiyon bölgesinin şeması. (A) Enjeksiyon bölgesinin yerinin bir fotoğrafı. Burada mürekkep, sıvının L2 ve L3 omurları arasındaki interspinöz bağa nereden gireceğini belirtmek için kullanılır. (B) İğnenin doğru konumlandırılmasını ve enjeksiyon bölgesinin yerini gösteren, yandan görünümde gösterilen bir diyagram. (C) Omurların yukarıdan aşağıya görünümünü ve interspinöz bağlar için enjeksiyon bölgelerini gösteren bir diyagram. Enjeksiyonlar tipik olarak omurganın yanındaki interspinöz bağlar üzerinde olacaktır, ancak iğne intertransvers omurlar arasındaki boşluğa da yerleştirilebilir. Pilot denemelerde mavi boya kullanımı (A)'da gösterildiği gibi tavsiye edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Davranışsal tahliller
- von Frey mekanik refleks tepki eşiği testi
NOT: Mekanik geri çekilme eşiği, çapı ~0,2 g'lık artışlarla derecelendirilmiş bir dizi 8 von Frey monofilament ile zamanın %50'sinde bir yanıt ortaya çıkarmak için gereken minimum kuvvettir ve mekanik kuvvette kütük adım değişiklikleri sağlar (Malzeme Tablosu).- Lumbosakral sinirlerin innervasyon bölgesi olan arka pençeye uygulanan von Frey lifleri ile mekanik stimülasyonu test edin. Ameliyattan önce temel pati çekilme değerlerini belirleyin. Ameliyattan sonra, kronik deney sırasında haftada bir kez mekanik eşiği belirleyin.
- Hayvanları barınak odasından çıkarın ve testten önce 30 dakika boyunca ev kafeslerinde test odasında alıştırın. Oradan, hayvanları, aktivite seviyelerine bağlı olarak 15-20 dakika boyunca ekranın üstündeki test masasındaki küçük şeffaf kabinlerde ayrı ayrı dizginlemek için hareket ettirin.
NOT: Test, fareler dinlenme pozisyonuna geçtikten ve haznede dönüp hareket etmedikten sonra başlayabilir. Emniyet kabinine alışma, stres kaynaklı etkileri en aza indirir. Fareler ters ışık döngüsünde tutulmuşsa, test kırmızı ışık koşullarında yapılmalıdır. - Aşağıda ve Chaplan ve ark.9'da açıklandığı gibi derecelendirilmiş von Frey lif serilerini kullanarak teste devam edin.
- Büküldüğünde 3.61 g kuvvet ortaya çıkaran 0.4 von Frey filamentini kullanarak ayak tabanını her hayvan üzerinde tutarlı bir noktada araştırın (Malzeme Tablosu). 1.0 g kuvvet ortaya çıkaran 4.08 von Frey filamenti ile stimülasyon ile takip edin.
NOT: Bu liflerin hiçbiri saf, alışmış hayvanlarda tepki göstermez. - Her bir filamenti 5x 5x'i ayak pedine dik olarak >5 s aralıklarla uygulayın, bir kıvrıma/yarığa veya saça dokunmamaya dikkat edin. Olumlu bir tepki, beş uyarandan üçüne ayak çekilmesidir. Hayvan mekanik stimülasyona yanıt vermeyene kadar serideki bir sonraki zayıf filamenti uygulayın; Bu noktada, bir sonraki yüksek filamenti kullanın. Bir yanıt ortaya çıkarırsa, ayak pedinin mekanik stimülasyonuna yanıt değişikliğinden sonra dört deneme uygulanana kadar alt filamenti tekrar kullanın.
- Bir eğri uydurma algoritması9 kullanarak, zamanın %50'sinde bir yanıt ortaya çıkarmak için gereken minimum kuvvet miktarı olan mekanik geri çekilme eşiğini hesaplamak için ortaya çıkan yanıt modelini kullanın. Saf farelere veya hayvanın kendi taban çizgisine kıyasla bir ayak geri çekilme tepkisi ortaya çıkarmak için gereken kuvvetteki bir azalma, hayvanın duyarlılığının arttığını gösterir.
- Büküldüğünde 3.61 g kuvvet ortaya çıkaran 0.4 von Frey filamentini kullanarak ayak tabanını her hayvan üzerinde tutarlı bir noktada araştırın (Malzeme Tablosu). 1.0 g kuvvet ortaya çıkaran 4.08 von Frey filamenti ile stimülasyon ile takip edin.
- Termal refleks tepki eşiği testi
NOT: Sıcak ve soğuk tepki eşikleri, sırasıyla Hargreaves ve soğuk plaka testleri ile belirlenir.- Hargreaves testi
- Fareleri, aşağıdan kızılötesi bir yayıcı ile ısıtılan bir cam yüzey üzerindeki kabinlere yerleştirin. Ayağı geri çekmek için gecikme süresini, aparat tarafından sağlanan kızılötesi ışık (50 °C) uyaranının farenin arka pençesine uygulanmasından stimülasyondan çekilene kadar geçen süreyi saniye cinsinden kaydedin.
- Soğuk plaka testi
- Fareleri -9 °C'ye soğutulmuş soğuk plaka aparatına yerleştirin. Ayağı geri çekmek için gecikmeyi, farenin aparat üzerine yerleştirilmesinden fare ayağını kaldırmaya başlayana kadar geçen süreyi saniye cinsinden kaydedin.
- Alternatif olarak, fare bir tel örgü üzerinde kafesliyken farenin arka pençesinin altına -9 °C'ye soğutulmuş soğuk bir prob yerleştirin. Geri çekilme gecikmesini, aparatın arka pençenin altına yerleştirilmesinden fare ayak kaldırmaya, yalamaya veya sallamaya başlayana kadar geçen süreyi saniye cinsinden kaydedin. Nosiseptif bir tepki uyandırmaktan kaçınmak için, fareyi oda sıcaklığında prob tarafından dokunulmaya alıştırın.
- Hargreaves testi
- Biliş ve duyguya bağlı davranışsal tahliller
NOT: Hayvanlarda uzun süreli aşırı duyarlılık, duygusal ve bilişe bağlı işlev bozukluğuna neden olur. Bunlar, uygulama etkilerinden kaçınmak için tipik olarak ağrı modeli indüksiyonundan sonra 6. haftada yalnızca bir kez ölçülür.- Anksiyete testleri
NOT: Anksiyete ve depresyon, modelin etkinliğini belirlemek için güvenilir bir şekilde test edilebilir. Komorbiditelerin gelişmesine izin vermek için indüksiyon enjeksiyonundan sonra en az 4-6 haftaya kadar beklemek en iyisidir. Işık odasından ziyade karanlığı tercih etmek, nosisepsiyonla ilgili kaygının bir ölçüsüdür. Sıfır veya artı labirent testinde, ağrı modeli fareler açık kadranlarda saf kontrol hayvanlarına göre daha az zaman harcarlar, bu da kaygı benzeri davranışların bir göstergesidir10,11.- Açık/koyu yer tercihi testi: Her hayvanı iki oda (10 x 10 x 10 cm3) arasında bir geçit olacak şekilde yer tercihi test kutusuna yerleştirin. Aparatın bir odası parlak bir şekilde aydınlatılırken, karşı taraf karanlık kalır. Her 10 dakikalık test sırasında, aydınlık ve karanlık doluluk sürelerini ve geçiş sayısını belirlemek için hayvanın konumunu bilgisayarla izleyin.
NOT: Alternatif olarak, test odasının üzerine bir video kamera monte edin ve her odada geçirilen süreyi manuel olarak kaydedin. - Yükseltilmiş artı veya sıfır labirentler: model kemirgenleri veya saf hayvanları labirente yerleştirin ve labirentin kapalı bölümlerinde harcanan zamanı değerlendirmek için bir kronometre kullanın. İki duvarlı "güvenli" alanda ve iki açık "güvenli olmayan" alanda geçirilen zamanı belirleyin. Ağrısı olan hayvanlar kapalı güvenli alanları tercih eder.
NOT: Anksiyete benzeri davranışlar sıfır veya artı labirentte (10 dk) test edilebilir. Sıfır labirenti, "artı işareti şeklinde" olan artı labirentin aksine dairesel bir yoldur. Her ikisinde de sürekli keşif davranışına izin veren iki açık ve iki kapalı kadran vardır. Her ikisi de yerden 1 m yükseltilir, dört eşit büyüklükte çeyreğe bölünmüş dairesel veya artı şeklinde bir yürüyüş yolu.
- Açık/koyu yer tercihi testi: Her hayvanı iki oda (10 x 10 x 10 cm3) arasında bir geçit olacak şekilde yer tercihi test kutusuna yerleştirin. Aparatın bir odası parlak bir şekilde aydınlatılırken, karşı taraf karanlık kalır. Her 10 dakikalık test sırasında, aydınlık ve karanlık doluluk sürelerini ve geçiş sayısını belirlemek için hayvanın konumunu bilgisayarla izleyin.
- Sükroz sıçrama depresyon testi
NOT: Sükroz sıçrama testi, depresyon benzeri davranışı belirlemek için kullanılır. Sıçrama testi, kronik ağrıdan kaynaklanan bir depresyon belirtisi olarak normal tımar davranışının yokluğunun ölçülmesini sağlar.- Sırt kaplamasına (kuyruğun tabanına yakın ~250 μL) %10-30 sükroz çözeltisi püskürttükten sonra 10 dakika boyunca tımarlamanın sıklığını, süresini ve gecikmesini puanlayın. Kör gözlemcilere video kaset kayıtlarından tımar manevralarının sayısını saydırın12.
NOT: Bu indeksin, kronik hafif stres gibi duygudurum bozukluklarının kemirgen modellerinde etkilendiği ve kronik antidepresan tedavisi ile düzeltildiği bildirilmiştir13.
- Sırt kaplamasına (kuyruğun tabanına yakın ~250 μL) %10-30 sükroz çözeltisi püskürttükten sonra 10 dakika boyunca tımarlamanın sıklığını, süresini ve gecikmesini puanlayın. Kör gözlemcilere video kaset kayıtlarından tımar manevralarının sayısını saydırın12.
- Yeni nesne testi
NOT: Bilişsel işlev bozukluğu yeni nesne testi ile ölçülebilir.- Fareleri ayrı ayrı 1 saat boyunca üstü açık (56 x 30 x 20 cm) şeffaf plastik bir kafese alıştırın. 5 dakika boyunca kafesin zıt köşelerine birbirinin aynısı iki oyuncak minifigür yerleştirin.
- Test gününde, iki özdeş mini figürü ev kafesine geri koymadan önce 5 dakika boyunca kafesin aynı konumlarına yerleştirmeden önce hayvanları tekrar 1 saat boyunca şeffaf kafese alıştırın.
- Orijinal figürlerden birini belirgin bir şekilde farklı bir yeni nesneyle değiştirin, fareleri 4 saat sonra test kafesine geri koyun ve nesneleri keşfetmek için harcanan zamanı kaydedin.
- Rapor edilen Tanıma İndeksini (RI), toplam nesne keşif süresi14'ün yeni nesneyi keşfetmek için harcanan sürenin yüzdesi olarak hesaplayın.
- Motor fonksiyon değerlendirmesi
NOT: Mürekkep lekesi hareketliliği ve yürüme bozukluğu testi15 , sırt ağrısı modelindeki motor fonksiyonu değerlendirir.- Bir kenarı uzunlamasına kesilmiş bir kağıt havlu tüpünden bir tünel oluşturun. Tüneli temiz bir yazıcı kağıdına yayın.
- Fareleri sakinleşene kadar nazikçe bir havluya sarın. Pençeleri mürekkeple kaplamak için toksik olmayan Hindistan mürekkebi ile ıslatılmış bir damga pedine yerleştirin veya bir pamuklu çubuk kullanarak farenin ayaklarının altındaki mürekkebi boyayın. Fareleri tünel girişinde serbest bırakın ve tünelden geçmelerine izin verin, sonunda onları yakalayın.
- Pati izlerini üç parametreye göre puanlayın: adım uzunluğu (bir baskının arka ucundan diğerine dikey mesafe), adım genişliği (baskılar arasındaki yatay mesafe) ve parmak açıklığı (patinin karşı taraflarındaki ayak parmakları arasındaki mesafe).
NOT: Onaylanmış ikramlar, fareyi tünelden geçmeye teşvik etmek için de kullanılabilir. Pati izleri lekeliyse veya net değilse, deney tekrarlanmalıdır.
- Anksiyete testleri
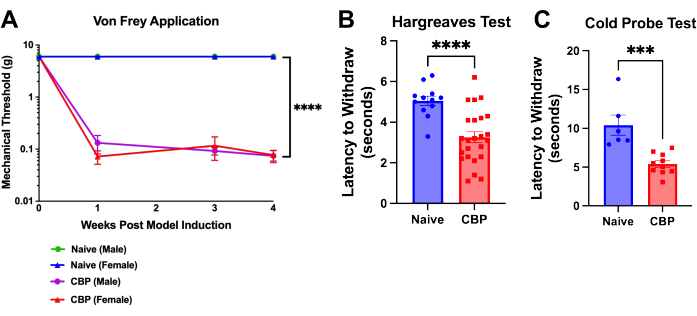
Şekil 4: CBP indüksiyonunu takiben mekanik ve termal aşırı duyarlılık. Ağrı, model indüksiyonundan bir hafta sonra ölçülebilir ve 8 hafta boyunca devam eder. (A) von Frey testi. Mekanik eşik testi, 4 hafta boyunca burada gösterildiği gibi yukarı-aşağı yöntemiyle bir ağ üst tabla aracılığıyla ayak tabanına uygulanan von Frey filamentleri ile gerçekleştirilir. Saf erkek eşiği (yeşil), saf dişi fareler için mavi çizginin altına gizlenmiştir. CBP fareleri (n = 4 erkek, 4 dişi), saf kontrollere (n = 2 erkek, 2 dişi) kıyasla önemli ölçüde artmış mekanik duyarlılık gösterdi. Bu veriler üzerinde iki yönlü ANOVA (Dunnett'in çoklu karşılaştırma testi) yapıldı: grup başına n = 4. Post-hoc analizlerde, CBP ile Naïve'nin haftalık karşılaştırmaları için tüm P değerlerine Bonferroni ayarlaması, 11 değerlerinin tümünü 0.0011'< verdi. p < 0.0001. (B) Hargreaves testi. Isı eşiği, Hargreaves testi (50 °C) ile ayak tabanında test edilmiştir. CBP fareleri (n = 12 erkek, 12 dişi), saf kontrollere (n = 6 erkek, 6 dişi) kıyasla önemli ölçüde artmış ısı duyarlılığı gösterdi. Anlamlılığı test etmek için Mann-Whitney iki kuyruklu t-testi yapıldı (p < 0.0001). (C) Soğuk hassasiyeti. Soğuk prob testi, farelerin -9 °C'ye soğutulmuş soğuk plaka aparatına yerleştirilmesiyle gerçekleştirildi. Geri çekilme gecikmesi, farenin aparat üzerine yerleştirilmesinden farenin ayağını kaldırmaya, yalamaya veya sallamaya başlamasına kadar geçen saniye cinsinden süre olarak kaydedildi. Gösterilen verilerde, fare bir tel örgü üzerine kafesliyken, farenin arka pençesinin altına -9 °C'ye soğutulmuş bir soğuk prob yerleştirildi. Tüm fareler enjeksiyondan 1-3 hafta sonra test edildi. CBP fareleri (n = 4 erkek, 6 dişi), saf kontrollere (n = 2 erkek, 4 dişi) kıyasla önemli ölçüde artmış soğuk duyarlılığı gösterdi. Anlamlılığı test etmek için Mann-Whitney iki kuyruklu t-testi yapıldı (p =0.0002). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Nosiseptif ile ilgili davranış testleri ve veri analizi
Uyarılmış önlemler
Ayak tabanında aşırı duyarlılık, ürokinaz enjeksiyonundan sonraki bir gün içinde gelişir. 1 hafta içinde, geri çekilme eşiği önemli ölçüde azalır ve ötenaziye kadar devam eder; bu, ameliyat sonrası 4. haftada gösterilir (Şekil 4A). Pençe çekme gecikmesi, von Frey yukarı-aşağı yöntemi9 ve Hargreaves testi kullanılarak a...
Tartışmalar
Bu kronik sırt ağrısı modelinin indüklenmesi kolaydır ve 1 hafta içinde kurulan aşırı duyarlılık 8 haftaya kadar (ve muhtemelen daha fazla) sürebilir. Bu, sadece bir veya iki hafta süren diğer akut modellerin aksine, kronik ağrı durumunun doğru bir şekilde incelenmesini sağlar. Modeli farelerde gösterirken, uPA kaynaklı CBP modeli sıçanlarda da kurulabilir2. Modelin bir avantajı, uzun süreli seyrin, kronik bel ağrısı olan hastalarda gözlenen anksiyete ve depresyon ben...
Açıklamalar
Yazarlar hiçbir rakip mali çıkar beyan etmemektedir. KNW, NeuroChronix, Bessor Pharma ve USA Elixeria BioPharm, Inc. ile ücretsiz danışmanlık hizmeti verdiğini kabul eder.
Teşekkürler
Hibe finansmanı NIH HEAL UG3 NS123958 tarafından sağlandı. Barınma tesisleri AAALAC tarafından denetlendi ve akredite edildi. Hayvanlar, laboratuvar personeli ve Laboratuvar ve Hayvan Kaynakları Bölümü (DLAR) personeli tarafından sürdürülen Hayvan Kaynakları Merkezi (ARC) barınma tesisinde barındırıldı. Davranışsal test prosedürleri, Amerikan Ağrı Derneği ve Uluslararası Ağrı Araştırmaları Derneği tarafından onaylanan standart yöntemlerdir. Ötenazi yöntemi, Amerikan Veteriner Hekimler Birliği Ötenazi Paneli'nin tavsiyeleri ile tutarlıdır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Animals and Consumables | |||
| 70% ethanol | Local Source | ||
| BALB/c mice | Envigo | 20-25 g | |
| Cotton balls | Fisher Scientific | 19-090-702 | |
| Cotton-tipped applicators | Fisher Scientific | 19-062-616 | |
| Isoflurane inhalant anesthetic | MedVet | RXISO-250 | |
| Labeling tape | Fisher Scientific | NGFP7002 | |
| Nitrile exam gloves | Fisher Scientific | ||
| Oxygen tank | Local Source | ||
| Surgical drape, Steri-Drape Utility Sheet, Absorbent Prevention | VWR | 76246-788 | cut into 15 x 15 cm pieces |
| Tygon tubing with 3 mm inner diameter | Grainger | 22XH87 | |
| Equipment | |||
| #11 carbon steel scalpel blades | VWR | 21909-612 | |
| Anesthesia induction chamber | Summit Medical Equipment Company | AS-01-0530-LG | |
| Autoclave | Local Unit | ||
| Biology Dumont #5 forceps | Fine Science Tools | 11252-30 | |
| Glass bead sterilizer Germinator 500 | VWR | 102095-946 | |
| IITC Life Sciences Series 8 Model PE34 Hot/Cold Plate Analgesia Meter | IITC | PE34 | |
| Integra Miltex cotton & dressing pliers | Safco Dental Supply | 66-317 | |
| OPTIKA CL31 double arm LED illuminator | New York Microscope Company | OPCL-31 | |
| Plantar Test System with InfraRed Emitter, i. e. Hargreaves Apparatus | Ugo Basile | 37370-001 and 37370-002 | |
| Scalpel Handle No. 3 | VWR | 25607-947 | |
| Small animal heating pad | Valley Vet Supply | 47375 | |
| Student Vannas spring scissors, straight blade | Fine Science Tools | 91500-09 | |
| Table top animal research portable anesthesia workstation “PAM” | Patterson Scientific | AS-01-0007 | |
| Von Frey Filaments | Ugo Basile | 37450-275 |
Referanslar
- O'Sullivan, P. B., et al. Back to basics: 10 facts every person should know about back pain. British Journal of Sports Medicine. 54 (12), 698-699 (2020).
- Nauta, H. J., McIlwrath, S. L., Westlund, K. N. Punctate midline myelotomy reduces pain responses in a rat model of lumbar spine pain: evidence that the postsynaptic dorsal column pathway conveys pain from the axial spine. Cureus. 10 (3), 2371 (2018).
- Shuang, F., et al. Establishment of a rat model of lumbar facet joint osteoarthritis using intraarticular injection of urinary plasminogen activator. Scientific Reports. 5 (1), 9828 (2015).
- Reed, N. R., et al. Somatosensory behavioral alterations in a NGF-induced persistent low back pain model. Behavioural Brain Research. 418, 113617 (2022).
- Suh, H. R., Cho, H. -. Y., Han, H. C. Development of a novel model of intervertebral disc degeneration by the intradiscal application of monosodium iodoacetate (MIA) in rat. The Spine Journal. 22 (1), 183-192 (2022).
- Kim, H., Hong, J. Y., Lee, J., Jeon, W. -. J., Ha, I. -. H. IL-1β promotes disc degeneration and inflammation through direct injection of intervertebral disc in a rat lumbar disc herniation model. The Spine Journal. 21 (6), 1031-1041 (2021).
- Millecamps, M., Tajerian, M., Sage, E. H., Stone, L. S. Behavioral signs of chronic back pain in the SPARC-null mouse. Spine. 36 (2), 95-102 (2011).
- La Porta, C., Tappe-Theodor, A. Differential impact of psychological and psychophysical stress on low back pain in mice. Pain. 161 (7), 1442-1458 (2020).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. Journal of Neuroscience Methods. 53 (1), 55-63 (1994).
- Takao, K., Miyakawa, T. Light/dark transition test for mice. Journal of Visualized Experiments JoVE. (1), e104 (2006).
- Deuis, J. R., Dvorakova, L. S., Vetter, I. Methods used to evaluate pain behaviors in rodents. Frontiers in Molecular Neuroscience. 10, 284 (2017).
- David, D. J., et al. Neurogenesis-dependent and -independent effects of fluoxetine in an animal model of anxiety/depression. Neuron. 62 (4), 479-493 (2009).
- Yalcin, I., et al. A time-dependent history of mood disorders in a murine model of neuropathic pain. Biological Psychiatry. 70 (10), 946-953 (2011).
- Madathil, S. K., et al. Astrocyte-specific overexpression of insulin-like growth factor-1 protects hippocampal neurons and reduces behavioral deficits following traumatic brain injury in mice. PloS One. 8 (6), e67204 (2013).
- Sugimoto, H., Kawakami, K. Low-cost protocol of footprint analysis and hanging box test for mice applied the chronic restraint stress. Journal of Visualized Experiments: JoVE. (143), e59027 (2019).
- Hassan, S., et al. Identifying chronic low back pain phenotypic domains and characteristics accounting for individual variation: a systematic review. Pain. , (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır