Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Tomografía por emisión de positrones cardíacos de alta resolución/tomografía computarizada para animales pequeños
En este artículo
Resumen
Aquí, presentamos un protocolo experimental de imagen para la cuantificación de la función cardíaca y la morfología utilizando tomografía por emisión de positrones de alta resolución / tomografía computarizada para animales pequeños. Se consideran tanto ratones como ratas, discutiendo los diferentes requisitos de los agentes de contraste de tomografía computarizada para las dos especies.
Resumen
La tomografía por emisión de positrones (PET) y la tomografía computarizada (TC) se encuentran entre las técnicas de diagnóstico por imágenes más empleadas, y ambas sirven para comprender la función cardíaca y el metabolismo. En la investigación preclínica, se emplean escáneres dedicados con alta sensibilidad y alta resolución espacio-temporal, diseñados para hacer frente a los exigentes requisitos tecnológicos planteados por el pequeño tamaño del corazón y las frecuencias cardíacas muy altas de ratones y ratas. En este artículo, se describe un protocolo bimodal de imágenes PET / CT cardíaco para modelos experimentales de ratón y / o rata de enfermedades cardíacas, desde la preparación animal y la adquisición y reconstrucción de imágenes hasta el procesamiento y visualización de imágenes.
En particular, la exploración PET de fluorodesoxiglucosa ([18 F]FDG) marcada con 18F permite la medición y visualización del metabolismo de la glucosa en los diferentes segmentos del ventrículo izquierdo (VI). Los mapas polares son herramientas convenientes para mostrar esta información. La parte de TC consiste en una reconstrucción 3D resuelta en el tiempo de todo el corazón (4D-CT) mediante gating retrospectivo sin electrocardiografía (ECG), lo que permite la evaluación morfofuncional del VI y la posterior cuantificación de los parámetros de función cardíaca más importantes, como la fracción de eyección (FE) y el volumen sistólico (SV). Utilizando un escáner PET/CT integrado, este protocolo se puede ejecutar dentro de la misma inducción de anestesia sin necesidad de reposicionar al animal entre diferentes escáneres. Por lo tanto, la PET/CT puede verse como una herramienta integral para la evaluación morfofuncional y metabólica del corazón en varios modelos animales pequeños de enfermedades cardíacas.
Introducción
Los modelos animales pequeños son extremadamente importantes para el avance de la comprensión de las enfermedades cardiovasculares 1,2. Las herramientas de diagnóstico por imágenes no invasivas han revolucionado la forma en que vemos la función cardíaca en las últimas décadas, tanto en entornos clínicos como preclínicos. En lo que respecta a los modelos animales pequeños de enfermedades cardíacas, se han desarrollado herramientas de imagen específicas con una resolución espaciotemporal muy alta. Por lo tanto, tales instrumentos pueden satisfacer la necesidad de cuantificación precisa de los parámetros metabólicos y cinéticos de miocardio relevantes en los corazones muy pequeños y de movimiento muy rápido de ratones y ratas en modelos de enfermedades específicas, como la insuficiencia cardíaca (IC)3 o el infarto de miocardio (IM)4. Hay varias modalidades disponibles para este propósito, cada una con sus propias fortalezas y debilidades. La imagen por ultrasonido (US) es la modalidad más utilizada debido a su gran flexibilidad, resolución temporal muy alta y costo relativamente bajo. La adopción de imágenes cardíacas estadounidenses en animales pequeños ha aumentado considerablemente desde el advenimiento de los sistemas que utilizan sondas con frecuencia ultra alta5,6, con resoluciones espaciales inferiores a 50 μm.
Entre las principales desventajas de la ecografía para imágenes cardíacas totalmente 3D está la necesidad de exploraciones lineales a lo largo del eje cardíaco montando la sonda en una etapa de traducción motorizada para crear una pila completa de imágenes dinámicas en modo B de todo el corazón7. Eventualmente, este procedimiento da lugar (después de un registro espacial y temporal preciso de las imágenes adquiridas en cada posición de la sonda) a una imagen 4D con diferentes resoluciones espaciales entre las direcciones dentro y fuera del plano. El mismo problema de resolución espacial no uniforme ocurre en la RM cardíaca (RMC)8 , que todavía representa el estándar de oro en la imagen funcional del corazón. En cambio, se pueden obtener imágenes 3D isotrópicas reales utilizando tanto la tomografía computarizada (TC) como la tomografía por emisión de positrones (PET)9. El PET proporciona una herramienta muy sensible en términos de señal de imagen por cantidad de sonda inyectada (en el rango nanomolar), a pesar de que sufre de una resolución espacial reducida en comparación con CT, MR o US. La principal ventaja del PET es su capacidad para mostrar los mecanismos celulares y moleculares subyacentes a la fisiopatología del órgano. Por ejemplo, una exploración PET después de la inyección de [18F]FDG permite la reconstrucción de un mapa 3D del metabolismo de la glucosa en el cuerpo. Al combinar esto con la adquisición de datos dinámicos (es decir, resueltos en el tiempo), el modelado cinético del trazador se puede utilizar para calcular mapas paramétricos de las tasas metabólicas de captación de glucosa (MRGlu), que proporcionarán información importante sobre la viabilidad miocárdica10.
La TC requiere volúmenes significativos de agentes de contraste externos (AC) a altas concentraciones (hasta 400 mg de yodo por ml) para proporcionar una mejora medible de los componentes tisulares relevantes (por ejemplo, sangre frente a músculo), pero sobresale en resolución espacial y temporal, especialmente cuando se utilizan escáneres micro-CT de última generación diseñados para imágenes de animales pequeños. 11 Un modelo típico de enfermedad en el que se puede aplicar la PET/TC cardíaca es la evaluación experimental del infarto de miocardio y la insuficiencia cardíaca y la respuesta relacionada con la terapia. Una forma común de inducir IM en animales pequeños es mediante la ligadura quirúrgica de la arteria coronaria descendente anterior izquierda (LAD)12,13 y luego evaluando longitudinalmente la progresión de la enfermedad y la remodelación cardíaca en los días posteriores4. Sin embargo, la evaluación morfofuncional cuantitativa del corazón en animales pequeños es ampliamente aplicable también para otros modelos de enfermedad, como la evaluación del efecto del envejecimiento sobre la función cardíaca14 o la expresión alterada del receptor en modelos de obesidad15. El protocolo de imagen presentado no se limita a ningún modelo de enfermedad dado y, por lo tanto, podría ser del más amplio interés en varios contextos de investigación preclínica con roedores pequeños.
En este artículo, presentamos un protocolo experimental de principio a fin para imágenes cardíacas utilizando PET / CT integrado en animales pequeños. Aunque el protocolo presentado está diseñado para un escáner integrado bimodal específico, las partes PET y CT del procedimiento descrito podrían realizarse de forma independiente en escáneres separados de diferentes fabricantes. En el escáner PET/CT en uso, la secuencia de operaciones se organiza en un flujo de trabajo preprogramado. Las ramas principales de cada flujo de trabajo son uno o más protocolos de adquisición; Cada protocolo de adquisición puede tener una o más ramas para protocolos de preprocesamiento específicos y, a su vez, cada protocolo de preprocesamiento puede tener una o más ramas para protocolos de reconstrucción específicos. Se describen tanto la preparación del animal en el lecho de imagen como la preparación de los agentes externos que se inyectarán durante los procedimientos de imagen. Después de completar el procedimiento de adquisición de imágenes, se proporcionan procedimientos de ejemplo para el análisis cuantitativo de imágenes basado en herramientas de software comúnmente disponibles. El protocolo principal está diseñado específicamente para modelos de ratón; A pesar de que el ratón sigue siendo la especie más utilizada en este campo, también mostramos una adaptación del protocolo para imágenes de ratas al final del protocolo principal. Se muestran resultados representativos tanto para ratones como para ratas, lo que demuestra el tipo de resultado que podría esperarse con los procedimientos descritos. Se realiza una discusión exhaustiva al final de este documento para enfatizar los pros y los contras de la técnica, los puntos críticos, así como la forma en que se podrían usar diferentes radiotrazadores PET casi sin modificación en los pasos preparatorios y de adquisición / reconstrucción.
Protocolo
Los experimentos con animales se realizaron de acuerdo con las recomendaciones de la Guía para el cuidado y uso de animales de laboratorio de las Directrices internacionales sobre el manejo de animales de laboratorio, exigidas por la Directiva Europea (Directiva 86/609 / CEE de 1986 y Directiva 2010/63 / UE) y las leyes italianas (D.Lgs. 26/2014).
1. Configuración de los protocolos de imágenes PET/CT y flujo de trabajo
NOTA: El protocolo presentado aquí está diseñado específicamente para imágenes cardíacas de modelos de ratón. Trabajar con ratas puede implicar algunas modificaciones al protocolo real, principalmente debido al mayor tamaño del animal (aproximadamente 10 veces más pesado). Las modificaciones para las imágenes de ratas se mencionan específicamente en los pasos; Si no se mencionan modificaciones, entonces los mismos pasos para las imágenes de ratón se pueden utilizar para ratas.
- Abra la interfaz gráfica de usuario (GUI) del escáner PET/CT (consulte Tabla de materiales) y crear un conjunto de nuevos protocolos (incluidos los parámetros para la adquisición de datos, el preprocesamiento y la reconstrucción de imágenes): i) a exploración PET dinámica, ii) a tomografía computarizada de baja dosis para la corrección de atenuación (CTAC) sin agente de contraste, y iii) a Cine-TC con contraste mejorado.
NOTA: La creación de nuevos protocolos (es decir, instrucciones de software específicas para el tomógrafo) para las fases de adquisición, preprocesamiento y reconstrucción es un proceso sencillo; en caso de problemas, el usuario puede encontrar información más detallada en el manual del usuario de la GUI.- Para la exploración PET, abra la ficha Protocolo del escáner (GUI) y cree tres nuevos protocolos (para adquisición, preprocesamiento y reconstrucción) con los siguientes parámetros:
- Para el protocolo de adquisición : ajuste el tiempo total de escaneo de 3.600 s y la posición de la cama individual. Guarde este protocolo con un nombre adecuado para su posterior importación en el flujo de trabajo. Haga lo mismo también para todos los siguientes protocolos en los siguientes puntos.
- Para el protocolo de preprocesamiento para ratón: seleccione una ventana de energía (EW) de 250-750 keV y habilite las siguientes correcciones: desintegración radiactiva, coincidencias aleatorias y tiempo muerto. Establezca el protocolo de encuadre (es decir, división dinámica de los datos sin procesar) de la siguiente manera: 8 x 5 s, 8 x 10 s, 3 x 40 s, 2 x 60 s, 2 x 120 s, 10 x 300 s (= 3.600 s). Para rata, seleccione una ventana de energía (EW) de 350-750 keV, utilizando el mismo encuadre que para el protocolo del ratón.
- Para el protocolo de reconstrucción: seleccione el algoritmo de maximización de expectativas de subconjuntos ordenados 3D (3D-OSEM-MC) basado en Monte Carlo de alta calidad, con 8 subconjuntos y 8 iteraciones, con normalización, corrección cuantitativa y corrección de atenuación CT habilitadas.
- Para la tomografía computarizada de dosis baja para la corrección de atenuación (CTAC), use los siguientes parámetros:
- Para el protocolo de adquisición : bastidor individual, posición de cama individual, escaneo completo; ajustes del tubo: 80 kV, baja corriente (dosis baja); 576 vistas a más de 360°, con 34 ms de tiempo de exposición por vista (tiempo de escaneo de 20 s); Tipo de rotación: Continuo, Modo de sensibilidad: Alta sensibilidad.
- Para el protocolo de preprocesamiento: tamaño de vóxel de 240 μm, FOV transversal: Rata, VFO axial: 100%.
- Para el protocolo de reconstrucción : ventana de filtro: suave, tamaño de vóxel: estándar , habilitar el endurecimiento del haz y la precorrección del anillo, deshabilitar la corrección posterior del artefacto del anillo.
- Para la tomografía computarizada cerrada con contraste mejorado, cree tres nuevos protocolos (para adquisición, preprocesamiento y reconstrucción) con la siguiente configuración:
- Para el protocolo de adquisición para ratón: ajuste de marco único, posición de cama individual, escaneo completo; ajustes de tubo: 65 kV, corriente completa (bajo ruido); 8.000 vistas a más de 360°, con 15 ms de tiempo de exposición por vista (tiempo de escaneo de 120 s); tipo de rotación: continuo, modo de sensibilidad: alta sensibilidad. Para rata, establezca los parámetros del protocolo de adquisición de la siguiente manera: voltaje del tubo de 80 kV, 16,000 vistas sobre 360 °, con un tiempo de exposición de 12 ms por vista (tiempo de escaneo de 192 s).
- Para el protocolo de preprocesamiento para ratón: seleccione un tamaño de vóxel de 120 μm; campo de visión transversal (FOV): ratón; VFO axial: 50%. Para rata, seleccione un tamaño de vóxel de 240 μm; campo de visión transversal (FOV): rata; VFO axial: 50%.
- Para el protocolo de reconstrucción : ventanas de filtro: liso, tamaño de vóxel: estándar; Habilite el endurecimiento del haz y la precorrección del anillo, deshabilite la corrección posterior del artefacto del anillo.
- Abra la pestaña Flujo de trabajo en la GUI y cree un nuevo flujo de trabajo , agregando los protocolos recién creados: pasos 1.1.1.1-1.1.1.3 para PET, pasos 1.1.2.1. -1.1.2.3. para CTAC, y pasos 1.1.3.1. -1.1.3.3. para CT cerrada, en el orden dado. En ambos casos, asegúrese de que los protocolos estén anidados con el siguiente orden: Adquisición | Preprocesamiento | Reconstrucción.
NOTA: Los fotogramas PET dinámicos con duraciones <5 s para capturar mejor el pico de la función de entrada arterial al comienzo de la exploración PET son posibles, pero no se recomiendan, ya que esto puede conducir a imágenes ruidosas con una precisión cuantitativa reducida. En el paso 1.1.2.2, hemos utilizado el tamaño "Rata" para el VOV transversal. Esto se usa comúnmente tanto para ratas como para ratones en CTAC.
- Para la exploración PET, abra la ficha Protocolo del escáner (GUI) y cree tres nuevos protocolos (para adquisición, preprocesamiento y reconstrucción) con los siguientes parámetros:
2. Preparación animal para imágenes PET/CT
NOTA: Para el presente protocolo, todos los animales fueron ayunados durante la noche.
- Anestesiar al ratón con isoflurano al 3% -4% (v / v) en una cámara de inducción inicialmente, y luego mantener con isoflurano al 1% -2% (v / v).
- Pesar el ratón y medir la glucemia basal para controlar la condición del animal. Para tomar la muestra de sangre requerida, use tijeras afiladas y haga un pequeño corte en la punta de la cola, luego masajee suavemente la cola para recolectar una gota de sangre (~ 1 μL) directamente en la tira reactiva.
- Proceder con la inserción de un acceso venoso a nivel de la vena caudal utilizando una mariposa 29 G para ratón y 24 G para rata.
- Para realizar la técnica de canulación se utiliza calentamiento simultáneo (normalmente, bajo una lámpara de calentamiento) y la desinfección del punto donde se inserta la aguja para la vasodilatación de la vena. Después de la canulación fije la mariposa con una cinta de seda a la cola para mantenerla en su lugar durante el procedimiento.
NOTA: Se requiere ayuno para los estudios de [18F]FDG. Diferentes trazadores pueden implicar diferentes preparaciones animales, pero un debate exhaustivo sobre este tema queda fuera del alcance del presente protocolo. En lo que respecta a [18F]FDG, evitar el ayuno conduce a una biodistribución de trazadores muy diferente16.
- Para realizar la técnica de canulación se utiliza calentamiento simultáneo (normalmente, bajo una lámpara de calentamiento) y la desinfección del punto donde se inserta la aguja para la vasodilatación de la vena. Después de la canulación fije la mariposa con una cinta de seda a la cola para mantenerla en su lugar durante el procedimiento.
- Encienda el sistema de anestesia (isoflurano 1%-2%, 0.8 L/minO2 para ratón y 1-1.2 L/min para rata) conectado al escáner PET-CT y transfiera el ratón a la cama.
- Coloque el ratón en posición supina, con la cabeza primero, en la cama del escáner del tomógrafo PET-CT, poniendo su nariz en la máscara nasal para la anestesia y bloqueando suavemente la cabeza del ratón a la máscara con cinta adhesiva.
- Fije las extremidades superiores e inferiores del ratón en la cama del escáner para evitar cualquier movimiento involuntario durante los procedimientos de imagen, lo que puede provocar artefactos de movimiento.
- Controle la temperatura corporal y la frecuencia respiratoria utilizando una sonda rectal y una almohada de respiración, respectivamente.
3. Preparación de la dosis del trazador de PET
- Para ratones, extraer 10 MBq de [18F]FDG en un volumen de 100-150 μL con una jeringa de insulina (1 ml). Para ratas, extraiga una dosis más alta de 15 MBq en 0.20-0.25 ml.
NOTA: Evite una mayor actividad ya que el escáner PET discutido en este protocolo tiene una sensibilidad muy alta y solo requiere una cantidad modesta de actividad para obtener imágenes de alta calidad. - Si la concentración original del marcador en el vial es demasiado alta, utilice solución fisiológica (0,9% p/v NaCl) para diluir la dosis del marcador a una concentración de 50-100 MBq/ml.
- Utilice el calibrador de dosis de PET para medir la actividad real en la jeringa. Anote la actividad previa a la inyección y el tiempo de medición, ya que estos valores se utilizarán más adelante utilizando módulos de entrada específicos de la GUI del escáner PET.
4. Preparación del agente de contraste por TC
- Extraiga 0,2 ml por 20 g de peso de ratón de agente de contraste de emulsión lipídica yodada en una jeringa de 1 ml. Limite el volumen de inyección a 0,5 ml de CA para ratones más pesados. Si usa iomeprol, ajuste la velocidad de inyección para ratones a 10 ml / h (~ 0.17 ml / min) y limite el volumen de inyección a 0.5 ml.
- Para ratas, extraiga 2.3-3 ml de iomeprol, diluido a una concentración de 200 mg / ml, en una jeringa de 5 ml.
NOTA: Si la emulsión lipídica de animales pequeños CA no está disponible, se puede usar iomeprol con inyección continua por medio de una bomba de jeringa, como se explica a continuación. - Conecte la jeringa a la bomba de la jeringa y ajuste la bomba para el tamaño y diámetro reales de la jeringa.
- Conecte la jeringa al tubo de CA y la aguja, y rellene previamente el tubo con el CA.
- Ajuste la velocidad de inyección a 24 ml/h (= 0,4 ml/min), limitando la inyección a un volumen máximo de 2 ml.
NOTA: El uso de CA de grupo sanguíneo basado en emulsión lipídica yodada también es posible en ratas, a pesar del costo relativamente alto de este procedimiento debido al mayor volumen de una sola inyección. Si se prefiere esta opción (por ejemplo, para simplificar el protocolo evitando la bomba de jeringa), se puede emplear el siguiente procedimiento:
- Para ratas, extraiga 2.3-3 ml de iomeprol, diluido a una concentración de 200 mg / ml, en una jeringa de 5 ml.
- Extraiga 7,5 ml por kg de peso corporal de agente de contraste de emulsión lipídica yodada en una jeringa de 5 ml. Limite el volumen de inyección a 2 ml de AC también para ratas más pesadas.
5. Alineación del animal y operaciones preliminares antes de la obtención de imágenes
- Tras la inmovilización del animal en el lecho de imágenes, cree un nuevo estudio sobre la GUI del tomógrafo. Agregue un identificador de nombre de estudio en el módulo Nombre de estudio y seleccione el flujo de trabajo de imágenes guardado previamente en el menú desplegable.
- Seleccione la parte anatómica adecuada con información de animales/especímenes | Parte anatómica | Información sobre el posicionamiento cardíaco y animal por animal/espécimen | Posicionamiento | Supino/Cabeza primero. Anote el peso del animal en gramos para el módulo correspondiente: Información sobre animales/especímenes | Peso del animal.
NOTA: El resto de la información de esta sección es opcional, pero es útil proporcionar la mayor cantidad posible de la información solicitada para encontrarla en la cabecera DICOM de las imágenes de reconstrucción, facilitando así la consulta posterior de datos. - Seleccione el radionúclido en la información de la TEP | F18 para [18 estudios F]FDG y otros 18compuestos marcados con F; modificar si se utilizan otros trazadores (por ejemplo, [13N]NH3). Escriba también el nombre del trazador en la información de la TEP | Módulo de nombre de trazador como este nombre se informará en el encabezado DICOM al finalizar la reconstrucción de la imagen.
NOTA: La información sobre el tiempo, la actividad y el volumen de inyección del trazador es obligatoria, pero podría proporcionarse más adelante durante la adquisición del PET. - En la información de la tomografía computarizada, escriba toda la información disponible sobre el agente de contraste.
NOTA: Toda esta información es opcional, pero podría facilitar la consulta posterior de datos si se proporciona. - Presione Realizar escaneo y espere a que se abra otra pestaña de la GUI, lo que permite el posicionamiento del animal y la especificación de otras opciones de escaneo.
- Seleccione el tipo de calibración por TC en la calibración por TC | Utilice la calibración CT predeterminada.
- En la sección Preparación del estudio , seleccione cada protocolo de escaneo en el menú desplegable y marque la casilla de verificación Esperar la confirmación del usuario antes de este escaneo .
NOTA: Este paso es muy importante, ya que pondrá el escáner en modo de espera esperando la entrada del usuario antes de comenzar la fase de adquisición correspondiente. Para la exploración PET, esto permitirá la sincronización de la inyección del trazador y el inicio real de la exploración PET; para la exploración CTAC, permitirá al usuario cerrar la tapa (blindaje) antes de la emisión de rayos X durante la tomografía computarizada (el estudio se abortará automáticamente si la tapa está abierta antes de que comience la tomografía computarizada); para la exploración Cine-CT, esta pausa permitirá al usuario iniciar el protocolo de infusión de CA y la exploración de datos de TC con el retraso requerido. - Para el posicionamiento de animales, encienda el módulo de control del motor utilizando el interruptor en el panel izquierdo de la GUI.
NOTA: Esto encenderá los láseres de centrado en la cama del animal y habilitará los botones de alineación manual de la cama colocados en el costado del escáner. - Utilice los botones manuales de alineación de la cama para mover el pecho del animal sobre las marcas láser. Revise cuidadosamente la alineación longitudinal y vertical del animal.
- Una vez que el animal se coloca en la posición correcta de acuerdo con el láser de centrado, presione Apagar el láser para guardar la posición actual marcada con láser, que se moverá al centro de los escáneres PET y CT durante las fases de adquisición correspondientes. Después, apague el módulo de control del motor.
6. Escaneo PET
- Presione Iniciar adquisición para mover el animal al FOV del escáner PET. La cola y la cánula permanecerán fuera del campo de visión para permitir la inyección del marcador. El escáner permanecerá inactivo hasta que el usuario pulse el botón Continuar .
- Prepare la jeringa con la dosis calibrada del trazador de PET.
- Inicie la adquisición presionando el botón Continuar y comience a inyectar el trazador en la cánula dentro de los 5 s posteriores al inicio del escaneo (Figura 1).
NOTA: La duración de la inyección será ~20-25 s. - Coloque la jeringa en el calibrador de dosis de PET para medir la actividad residual en la jeringa. Anote la actividad real y el tiempo de medición.
- En la ficha Monitor de hardware de la GUI del escáner, utilice el botón Actualizar información del trazador de PET para insertar el tiempo, la actividad y el volumen reales de inyección.
- Durante la exploración, verifique los parámetros fisiológicos del animal periódicamente.
- Durante la exploración, mida la glucemia como se explica en el paso 2.2 en los siguientes puntos temporales: 5 min, 20 min, 40 min y 60 min después del comienzo de la TEP.
- Después de la medición de la glucemia, coloque la tira reactiva en el contador gamma y realice la medición de actividad durante 60 s. Registrar el momento real en que se ha llevado a cabo la medición de la actividad y corregir la desintegración radiactiva, tomando como referencia el tiempo de inyección del marcador. Convierta los valores de actividad registrados en concentración de actividad (Bq/ml) considerando un volumen sanguíneo promedio de 1 μL en la tira reactiva de glucosa (es decir, utilizando la ecuación [1]):
C sangre(t) = Asangre(t)/0,001 ml [Bq/ml] (1)
donde A sangre(t) es la actividad medida corregida de caries de la muestra desangre en la tira reactiva, expresada en Bq.
NOTA: El mismo operador puede realizar el inicio de la exploración PET y la inyección del trazador utilizando el dispositivo de control móvil del tomógrafo colocado en la mesa lateral del escáner cerca del sitio del operador durante la inyección. Se permiten retrasos más largos entre el inicio de la exploración y el comienzo de la inyección, pero algunos fotogramas reconstruidos al comienzo de la secuencia dinámica permanecerán en blanco. Se recomienda evitar retrasos superiores a 10 s (es decir, que den lugar a dos marcos en blanco con el protocolo actual).

Figura 1: Inyección del marcador PET. Esta operación se realiza inmediatamente después del inicio de la exploración PET. El animal está dentro del campo de visión del PET (cabeza primero, con su cola visible en el lado del operador). Abreviatura: PET = tomografía por emisión de positrones. Haga clic aquí para ver una versión más grande de esta figura.
7. Tomografías computarizadas
- Antes de inyectar el agente de contraste CT, inicie la exploración CTAC justo después de cerrar la tapa del escáner y presionar el botón Continue (Continuar) en la GUI. Al final de esta adquisición muy corta, emplee los siguientes procedimientos para garantizar la mejora adecuada de la reserva de sangre inyectando el CA antes de la adquisición utilizando el mismo acceso vascular empleado para la inyección del marcador PET.
- Emulsión lipídica yodada CA:
- Después de completar la exploración CTAC, inyecte la emulsión lipídica yodada CA utilizando la cánula ya conectada a la vena de la cola del ratón. La duración típica de la inyección es del orden de 30-60 s.
- Comience la toma de imágenes inmediatamente después de completar la inyección. Pulse Continue (Continuar) en la GUI del escáner para iniciar la adquisición de Cine-CT.
- Bomba de iomeprol/jeringa:
- Si se utiliza una CA de rayos X normal, como iomeprol, use una bomba de jeringa que permita una inyección lenta a una velocidad constante.
- Para ratones, establezca la velocidad de inyección del CA a 10 ml / h (~ 0.17 ml / min) limitando el volumen de inyección a 0.5 ml. Con este ajuste, detenga la inyección después de ~3 min. Para ratas, ajuste la bomba a una velocidad de 24 ml / h (= 0.4 ml / min) y limite el volumen de inyección a 2 ml. Con este ajuste, detenga la inyección después de 5 minutos.
- Conecte la aguja conectada al tubo de CA a la cánula de la vena de la cola, asegurándose de que tanto el tubo como la aguja estén precargados con CA.
- Inicie la inyección. Cierre la tapa del escáner y prepárese para la exploración Cine-CT.
- Presione el botón Continuar en la GUI del tomógrafo después de 60 s desde el comienzo de la inyección para ratones y después de 90 s desde el comienzo de la inyección para ratas, de modo que se inicie la adquisición de Cine-CT. La inyección de AC se detendrá aproximadamente al mismo tiempo que la finalización de la exploración Cine-CT para ratones y al finalizar para ratas.
- Emulsión lipídica yodada CA:
- Al finalizar la exploración Cine-CT, desconecte al animal del sistema de monitoreo fisiológico y retire la cánula de la vena de la cola. Dependiendo del protocolo real, los animales son recuperados o sacrificados después del procedimiento de imagen descrito. En el primer caso, los animales se despiertan en sus jaulas en un ambiente cálido bajo una lámpara infrarroja. Se monitorean hasta el despertar completo, tomando 15/30 min después de la anestesia gaseosa. En el caso de protocolos que requieran, por ejemplo, la recolección de tejidos al final del procedimiento de imagen, los animales son sacrificados usando una sobredosis anestésica en una cámara de inducción (isoflurano al 5%), según el Anexo VI del D.Lgs. 26/2014.
NOTA: En el caso de los radionucleidos basados en 18F, como se analiza en este protocolo, 24 h después de la inyección del trazador son suficientes para alcanzar un nivel de radiactividad residual en el cuerpo del animal que sea seguro para todos los fines prácticos.
8. Reconstrucción de las imágenes 4DCT cardíacas mediante gating cardiorrespiratorio intrínseco
NOTA: Al finalizar el estudio por imágenes, la reconstrucción estándar de PET y CT se realiza automáticamente. Sin embargo, la reconstrucción de la secuencia de TC cardio 4D (Cine) debe realizarse manualmente y requiere cierta interacción del usuario. Este tipo especial de reconstrucción, obligatorio para el posterior análisis de TC cardíaca morfofuncional, se discute en esta sección.
- Abra el módulo de activación cardíaca de la GUI del tomogragh y seleccione el estudio de imagen a analizar.
- Seleccione una región de interés (ROI) en las radiografías del animal mostrado (Figura 2) para construir una curva de movimiento cardíaco dependiente del tiempo, que represente la señal de acceso: el quimograma. Mueva verticalmente el ROI rectangular predibujado de tal manera que se seleccionen tanto el ápice cardíaco como el diafragma. A continuación, seleccione Análisis de señal de acceso. La interfaz de usuario ahora mostrará la señal de acceso tanto en el dominio del tiempo como en el dominio de la frecuencia.
- En el primer gráfico del dominio de frecuencia, seleccione la banda de frecuencia respiratoria resaltando el primer grupo de picos del espectro de frecuencias (consulte la figura 3 para ver un ejemplo de espectro).
- En el segundo gráfico de dominio de frecuencia, seleccione la banda de frecuencia de movimiento cardíaco, destacando el segundo pico más agudo.
- En la siguiente fase, observe la señal de activación en el dominio del tiempo con marcadores de color (puntos) superpuestos, mostrando los picos de respiración identificados y los picos de contracción cardíaca. Si las posiciones de los marcadores encajan bien con los picos respiratorios y cardíacos de la señal de activación original, pase a la siguiente fase. De otra manera:
- Si la forma de la señal de activación es demasiado diferente de la que se muestra en la Figura 3, vuelva al paso 8.2 y seleccione otro ROI.
- Si la forma de la señal de activación es razonablemente similar a la que se muestra en la Figura 3, vuelva a los pasos 8.3 y 8.4 y seleccione diferentes bandas de frecuencia en el espectro de la señal de compuerta.
- En la siguiente fase, seleccione un mínimo de cuatro puertas cardíacas.
NOTA: La reconstrucción típica de Cine-TC consiste en 8-12 puertas cardíacas. - Seleccione la ventana respiratoria adecuada utilizando el menú desplegable: Ventana respiratoria | 20%-80%.
NOTA: Esto retendrá el 60% de los datos adquiridos en la reconstrucción, excluyendo la fase de inspiración máxima y, por lo tanto, mejorando la nitidez de las paredes miocárdicas reconstruidas en cada fase cardíaca. - Realice la reconstrucción para convertir las imágenes Cine-CT cerradas retrospectivamente en formato DICOM, listas para ser importadas al software para su posterior análisis funcional.
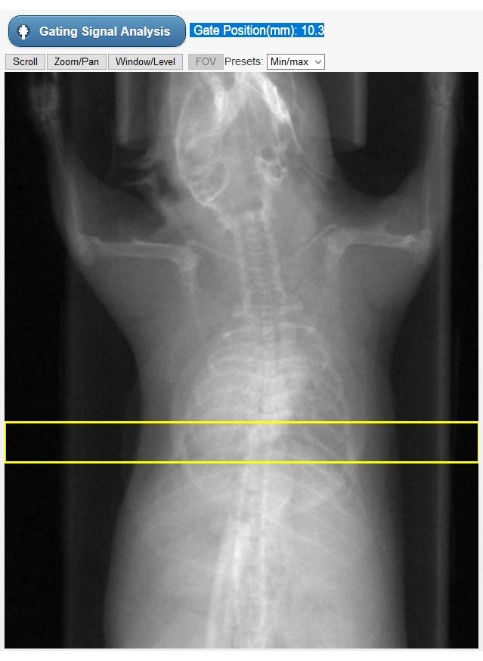
Figura 2: Herramienta de selección de ROI para gating intrínseco. Esta imagen se muestra en la GUI del tomógrafo durante la fase de reconstrucción Cine-CT. El usuario debe seleccionar la posición del ROI (rectángulo amarillo) en el que se obtiene la señal de compuerta intrínseca (kymogram) de las proyecciones de TC sin procesar. El objeto de forma circular superpuesto al pecho del animal es la almohada respiratoria utilizada solo para el monitoreo fisiológico durante el estudio. Abreviaturas: ROI = región de interés; TC = tomografía computarizada; GUI = interfaz gráfica de usuario. Haga clic aquí para ver una versión más grande de esta figura.
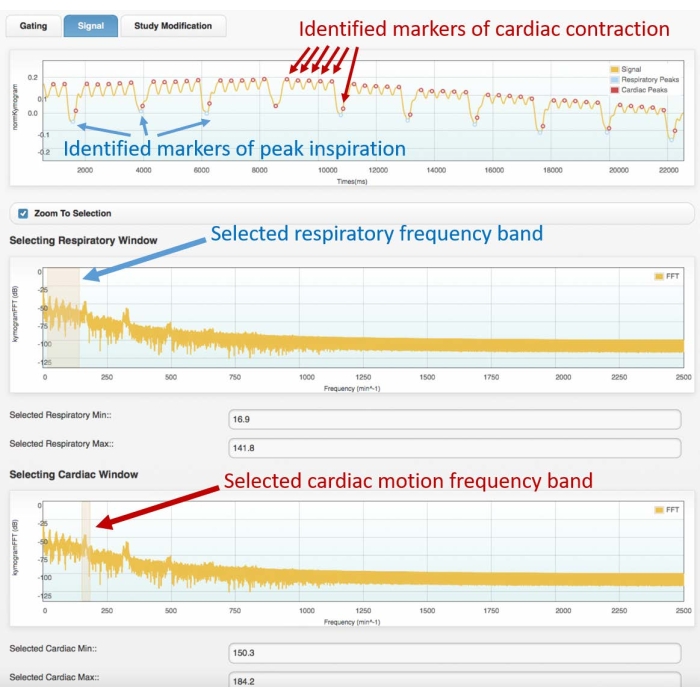
Figura 3: Ejemplo de señal de acceso (fotograma superior) y espectro de frecuencia correspondiente (centro e inferior). Imágenes obtenidas con el módulo de compuerta cardíaca del software Atrium. El usuario debe seleccionar las bandas de frecuencia adecuadas para el movimiento respiratorio (marco central) y cardíaco (marco inferior). Esto permitirá la identificación de los marcadores respiratorios y cardíacos en la señal de acceso, que deben ser verificados por el usuario antes de proceder con la reconstrucción 4D. La mala identificación de los picos o la asignación incorrecta (por ejemplo, respiratoria a cardíaca, o viceversa) conducirá a una reconstrucción incorrecta. Los datos mostrados se obtuvieron del análisis de una exploración 4D Cine-CT de una rata Wistar macho adulta sana (507 g) inyectada con 2 ml de iomeprol, 200 mg / ml, a una velocidad de 0,4 ml / min durante 5 min (el gráfico en la parte superior se amplía en los primeros 22 s de adquisición para permitir una mejor visualización del movimiento cardíaco y respiratorio identificado). Abreviatura: CT = tomografía computarizada. Haga clic aquí para ver una versión más grande de esta figura.
9. Análisis cardíaco PET
NOTA: Esta sección muestra cómo realizar un análisis cinético de los datos dinámicos de [18F]FDG del ventrículo izquierdo de animales pequeños. El análisis se basa en el software Carimas. Las instrucciones a continuación no pretenden reemplazar el manual de usuario del software17. El procedimiento que se presenta a continuación se basa en el análisis gráfico Patlak de datos dinámicos de PET18. Consulte la sección Discusión para obtener detalles sobre este análisis.
- Abra las imágenes DICOM del escaneo PET dinámico.
- Seleccione el módulo HeartPlugin .
- Haga zoom en la imagen en el corazón del ratón / rata, y seleccione el último marco de tiempo (o equivalentemente, la suma de los últimos tres a cinco marcos de tiempo) para el cual la mayor parte de la actividad de la acumulación de sangre ya se ha eliminado.
- Siga las instrucciones en pantalla para reorientar la imagen a lo largo del eje principal del corazón del animal (eje corto, eje largo vertical y horizontal). Haga esto de forma interactiva moviendo los marcadores mostrados para la base y el ápice del corazón (Figura 4).
- Seleccione la herramienta Segmentación .
NOTA: De forma predeterminada, la segmentación automática está habilitada, lo que produce resultados confiables en la mayoría de los casos. - Si el resultado de la segmentación automática no es aceptable, refine la forma del miocardio segmentado y/o la cavidad del VI activando el modo manual (ROI Search Disabled).
- En la Herramienta de modelado , seleccione el modelo cinético adecuado que se utilizará para el análisis dinámico de PET. En este caso, seleccione Gráfico | Patlak para permitir el análisis de la gráfica de Patlak para el cálculo de la tasa metabólica de captación de glucosa (MRGlu) para cada sector cardíaco.
- En la herramienta polarmap , seleccione el número correcto de segmentos cardíacos mostrados. En este caso, seleccione 17 segmentos.
- Ahora, presione el botón Ajustar para realizar el procedimiento de ajuste del análisis Patlak.
- Al final del procedimiento de ajuste, observe el mapa polar mostrado de los valores Ki (es decir, la pendiente de la regresión lineal expresada en ml / [ml × min]).
- Usando los valores Ki para cada sector mostrado en una tabla, calcule el MRGlu usando la ecuación (2):
MRGlu = (Ki × PGlu)/LC (2)
donde PGlu es un valor derivado de la muestra de sangre de la concentración plasmática de glucosa (mmol/L), y la constante agrupada (LC) es un coeficiente empírico utilizado para compensar la diferencia de absorción entre la glucosa normal y la FDG. Véase, por ejemplo, Ng et al.22 para los valores típicos de la constante agrupada en diversas condiciones experimentales.
NOTA: Antes de comenzar el análisis de PET, es una buena práctica inspeccionar visualmente la secuencia dinámica de volúmenes de PET dentro de la herramienta de software de análisis de PET. Esto es necesario para excluir el movimiento macroscópico de los animales entre marcos de tiempo durante el estudio. Si hay movimiento, se debe realizar un registro adecuado de la imagen (fuera del alcance de este protocolo) antes del análisis, si es posible.
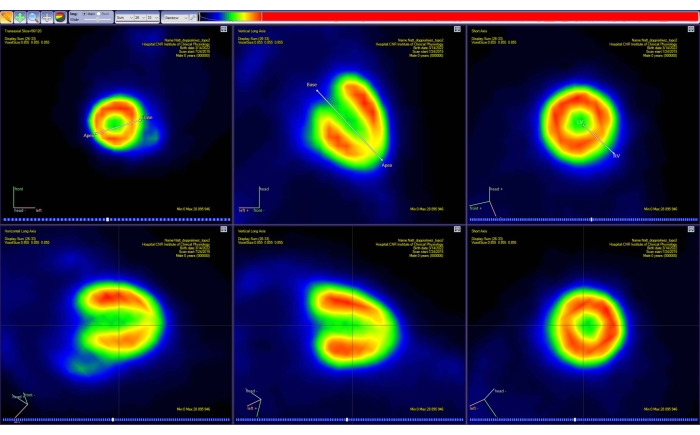
Figura 4: Herramienta de reorientación del software de análisis PET. La proyección de dos segmentos de línea simples en el espacio 3D se muestra en cada uno de los tres planos estándar (transaxial, coronal y sagital). El primer segmento permite al usuario seleccionar la base del corazón y el ápice, mientras que el segundo permite seleccionar los lados izquierdo y derecho del corazón. Este paso da como resultado una nueva imagen PET (interpolada) (fila inferior), con el corazón reorientado a lo largo de la representación estándar de AHA. Las imágenes se obtuvieron con Carimas de un ratón CD-1 macho adulto sano que pesaba 51 g y se inyectó 10 MBq de [18F]FDG. Abreviaturas: PET = tomografía por emisión de positrones; AHA = Asociación Americana del Corazón; FDG = fluorodesoxiglucosa. Haga clic aquí para ver una versión más grande de esta figura.
10. Análisis cardíaco Cine-CT
NOTA: Esta sección muestra cómo realizar un análisis cuantitativo de la imagen cardíaca Cine-CT para recopilar datos cuantitativos globales de la función cardíaca. El análisis se basa en el software Osirix MD. Las instrucciones a continuación no pretenden ser un reemplazo para el manual de usuario de Osirix24.
- Cargue las imágenes DICOM de la exploración Cine-CT en el software.
- Abra el conjunto de datos dinámico con el visor 4D integrado.
- Con la herramienta de Reforma Multiplanar 3D (MPR), reoriente los datos de imagen a lo largo del eje corto (Figura 5).
- Exporte los datos reorientados a DICOM, asegurando que se exporten todos los datos 4D, con un grosor de corte preservado (igual que el original) y una profundidad de bits de imagen (16 bits por vóxel)
- Abra las imágenes 4D MPR exportadas utilizando el visor 4D.
- Seleccione un marco de tiempo correspondiente a la diástole final. Navegue por todos los marcos de tiempo con el control deslizante de tiempo en la barra de herramientas principal para asegurarse de que se selecciona la fase cardíaca correcta.
- En este período de tiempo, elija la herramienta de anotación de polígonos cerrados y delinee manualmente la pared endocárdica del VI.
- Haga lo mismo para 10-20 cortes desde la base hasta el ápice, asegurándose de que todos los ROI tengan el mismo nombre (por ejemplo, LVENDO).
- En el menú ROI, seleccione ROI Volume | Genere ROI faltantes para generar los ROI en todos los segmentos de eje corto mediante interpolación de los ROI dibujados manualmente.
- En el menú ROI, seleccione ROI Volume | Calcular volumen para calcular el volumen del grupo de ROI con el mismo nombre de ROI.
- Navegue a través de los marcos de tiempo y seleccione una fase correspondiente a la sístole final (volumen de VI más pequeño) y repita los pasos 10.7-10.10 anteriores.
- Calcule el volumen sistólico (SV) y la fracción de eyección utilizando las ecuaciones (3) y (4):
SV = EDV - ESV[mL] (3)
FE = 100 × SV/EDV [%] (4)
donde EDV es el volumen diastólico final y ESV es el volumen sistólico final.
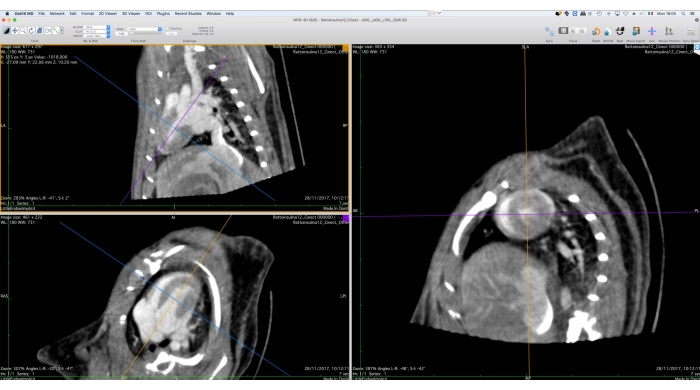
Figura 5: Interfaz gráfica de la herramienta de reforma multiplanar. Esta herramienta se utiliza para la reorientación de los datos de Cine-CT para su posterior análisis funcional. El usuario girará y trasladará los ejes de referencia del lado izquierdo de la pantalla de tal manera que la vista de eje corto del corazón se muestre a la derecha. Al final de este procedimiento, el usuario puede exportar las imágenes reorientadas como un conjunto de archivos DICOM. Las imágenes se obtuvieron con Osirix MD y se refieren a una rata Wistar macho adulta sana (507 g) inyectada con 2 mL de iomeprol, 200 mg/mL, a una velocidad de 0,4 mL/min durante 5 min, reconstruida con Filtered BackProjection con un tamaño de vóxel de 0,24 mm3. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
En esta sección, se muestran los resultados típicos para el análisis de PET y CT siguiendo los procedimientos descritos hasta ahora. La figura 6 muestra los resultados de la segmentación automática del miocardio y de la cavidad del VI de la TEP [18F]FDG de un ratón control (sano) CD-1. Aunque el ventrículo derecho no siempre es visible en las imágenes reconstruidas, los ejes de orientación basados en el encabezado DICOM pueden ser utilizados para discriminar correctamente...
Discusión
El protocolo presentado en este documento se centra en un procedimiento experimental típico para la investigación cardiovascular traslacional en modelos animales pequeños de lesión cardíaca mediante el uso de imágenes PET / CT de alta resolución. Los resultados presentados son indicativos del alto valor cuantitativo y cualitativo de las imágenes PET y Cine-CT, proporcionando información funcional y estructural de todo el corazón con respecto a su metabolismo de la glucosa, la forma y la dinámica de su contracc...
Divulgaciones
Daniele Panetta recibió subvenciones para la investigación y el desarrollo de instrumentación micro-CT de Inviscan Sas.
Agradecimientos
Esta investigación fue apoyada en parte por el proyecto JPI-HDHL-INTIMIC "GUTMOM": Obesidad materna y disfunción cognitiva en la descendencia: papel causa-efecto del GUT MicrobiOMe y prevención dietética temprana (proyecto no. INTIMIC-085, Ministerio de Educación de Italia, Universidad y Decreto de Investigación no. 946/2019).
Materiales
| Name | Company | Catalog Number | Comments |
| 0.9% sterile saline | Fresenius Kabi | 0.9% sodium chloride for injection | |
| 1025L Physiological Monitoring | Small Animal Instruments | Physiological monitoring system for small animal imaging | |
| 5 mL syringes | Artsana | Syringes with needle for injection of PET tracer | |
| Atomlab 500 | Else Nuclear | PET Dose calibrator | |
| Atrium software | Inviscan | Version 1.5.5 | PET/CT operating software |
| Butterfly catheters | Delta Med | 27.5 G needle | |
| Carimas software | Turku PET Center | Version 2.10 | Image analysis software |
| Fenestra VC | Medilumine | Lipid emulsion iodinated contrast agent for small animals | |
| Heat lamp | Heat lamp with clamp and switch | ||
| Insulin syringes | Artsana | Syringes with needle for injection of CT CA | |
| Iomeron 400 mgI/mL | Bracco | Iomeprol, vascular contrast agent | |
| IRIS PET/CT | Inviscan | PET/CT scanner for small animals | |
| Isoflurane | Zoetis | Inhalation anesthetic, 250 mL | |
| OneTouch Glucometer | Johnson&Johnson Medical | Glucose meter kit | |
| Osirix MD software | Pixmeo | Version 11 | Image analysis software |
| Oxygen | Air liquide | Compressed gas | |
| Rectal probe for 1025L | Small Animal Instruments | Rectal probe with cable for SAII 1025L systems | |
| Respiratory sensor for 1025L | Small Animal Instruments | Respiratory pillow with tubings for SAII 1025L systems | |
| TJ-3A syringe pump | Longer | Motorized syringe pump for CT CA injection |
Referencias
- Zaragoza, C. Animal models of cardiovascular diseases. Journal of Biomedicine and Biotechnology. 2011, 497841 (2011).
- Russell, J. C., Proctor, S. D. Small animal models of cardiovascular disease: Tools for the study of the roles of metabolic syndrome, dyslipidemia, and atherosclerosis. Cardiovascular Pathology. 15 (6), 318-330 (2006).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Menichetti, L., et al. MicroPET/CT imaging of αvß3 integrin via a novel 68Ga-NOTA-RGD peptidomimetic conjugate in rat myocardial infarction. European Journal of Nuclear Medicine and Molecular Imaging. 40 (8), 1265-1274 (2013).
- Zhou, H., et al. Development of a micro-computed tomography-based image-guided conformal radiotherapy system for small animals. International Journal of Radiation Oncology, Biology, Physics. 78 (1), 297-305 (2010).
- Di Lascio, N., Kusmic, C., Stea, F., Faita, F. Ultrasound-based pulse wave velocity evaluation in mice. Journal of Visualized Experiments. (120), e54362 (2017).
- Dann, M. M., et al. Quantification of murine myocardial infarct size using 2-D and 4-D high-frequency ultrasound. American Journal of Physiology-Heart and Circulatory Physiology. 322 (3), 359-372 (2022).
- Espe, E. K. Novel insight into the detailed myocardial motion and deformation of the rodent heart using high-resolution phase contrast cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 15 (1), 82 (2013).
- Vanhove, C., et al. Accurate molecular imaging of small animals taking into account animal models, handling, anaesthesia, quality control and imaging system performance. EJNMMI Physics. 2 (1), 31 (2015).
- Garcia, M. J., et al. State of the art: Imaging for myocardial viability: A scientific statement from the American Heart Association. Circulation: Cardiovascular Imaging. 13 (7), 000053 (2020).
- Panetta, D., et al. Cardiac computed tomography perfusion: Contrast agents, challenges and emerging methodologies from preclinical research to the clinics. Academic Radiology. 28 (1), 1-18 (2020).
- Kusmic, C. Up-regulation of heme oxygenase-1 after infarct initiation reduces mortality, infarct size and left ventricular remodeling: experimental evidence and proof of concept. Journal of Translational Medicine. 12 (1), 89 (2014).
- Muthuramu, I., Lox, M., Jacobs, F., De Geest, B. Permanent ligation of the left anterior descending coronary artery in mice: A model of post-myocardial infarction remodelling and heart failure. Journal of Visualized Experiments. (94), e52206 (2014).
- Fischer, M., et al. Comparison of metabolic and functional parameters using cardiac 18F-FDG-PET in early to mid-adulthood male and female mice. EJNMMI Research. 11 (1), 7 (2021).
- Valenta, I., et al. Feasibility evaluation of myocardial cannabinoid type 1 receptor imaging in obesity: A translational approach. JACC: Cardiovascular Imaging. 11 (2), 320-332 (2018).
- Fueger, B. J., et al. Impact of animal handling on the results of 18F-FDG PET studies in mice. Journal of Nuclear Medicine. 47 (6), 999-1006 (2006).
- . Carimas User Manual Available from: https://turkupetcentre.fl/carimas/files/archive/Html/a1.html (2022)
- Peters, A. M. Graphical analysis of dynamic data: The Patlak-Rutland plot. Nuclear Medicine Communications. 15 (9), 669-672 (1994).
- Choi, Y., et al. Parametric images of myocardial metabolic rate of glucose generated from dynamic cardiac PET and 2-[18F]fluoro-2-deoxy-d-glucose studies. Journal of Nuclear Medicine. 32 (4), 733-738 (1991).
- Laffon, E., Marthan, R. Is Patlak y-intercept a relevant metrics. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1287-1290 (2021).
- Flores, J. E., McFarland, L. M., Vanderbilt, A., Ogasawara, A. K., Williams, S. -. P. The effects of anesthetic agent and carrier gas on blood glucose and tissue uptake in mice undergoing dynamic FDG-PET imaging: Sevoflurane and isoflurane compared in air and in oxygen. Molecular Imaging and Biology. 10 (4), 192-200 (2008).
- Ng, C. K. Sensitivity of myocardial fluorodeoxyglucose lumped constant to glucose and insulin. American Journal of Physiology-Heart and Circulatory Physiology. 260 (2), 593-603 (1991).
- Shoghi, K. I., Welch, M. J. Hybrid image and blood sampling input function for quantification of small animal dynamic PET data. Nuclear Medicine and Biology. 34 (8), 989-994 (2007).
- Heuberger, J., Pixmeo, S., Rosset, A. OsiriX User Manual. Blurb. , (2017).
- Cerqueira, M. D., et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. A statement for healthcare professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association. Circulation. 105 (4), 539-542 (2002).
- Kolanowski, T. J., et al. Multiparametric evaluation of post-MI small animal models using metabolic ([18F]FDG) and perfusion-based (SYN1) heart viability tracers. International Journal of Molecular Sciences. 22 (22), 12591 (2021).
- Guiducci, L., et al. Contribution of organ blood flow, intrinsic tissue clearance and glycaemia to the regulation of glucose use in obese and type 2 diabetic rats: A PET study. Nutrition Metabolism and Cardiovascular Diseases. 21 (9), 726-732 (2011).
- Tadinada, S. M., et al. Functional resilience of C57BL/6J mouse heart to dietary fat overload. American Journal of Physiology-Heart and Circulatory Physiology. 321 (5), 850-864 (2021).
- Dreyfuss, A. D., et al. A novel mouse model of radiation-induced cardiac injury reveals biological and radiological biomarkers of cardiac dysfunction with potential clinical relevance. Clinical Cancer Research. 27 (8), 2266-2276 (2021).
- Hsu, B. PET tracers and techniques for measuring myocardial blood flow in patients with coronary artery disease. Journal of Biomedical Research. 27 (6), 452-459 (2013).
- Dinkel, J., et al. Intrinsic gating for small-animal computed tomography. Circulation: Cardiovascular Imaging. 1 (3), 235-243 (2008).
- Kuntz, J., et al. Fully automated intrinsic respiratory and cardiac gating for small animal CT. Physics in Medicine and Biology. 55 (7), 2069-2085 (2010).
- Li, Y., Zhang, W., Wu, H., Liu, G. Advanced tracers in PET imaging of cardiovascular disease. BioMed Research International. 2014, 504532 (2014).
- Kim, D. -. Y., Cho, S. -. G., Bom, H. -. S. Emerging tracers for nuclear cardiac PET imaging. Nuclear Medicine and Molecular Imaging. 52 (4), 266-278 (2018).
- Maddahi, J., Packard, R. R. S. Cardiac PET perfusion tracers: Current status and future directions. Seminars in Nuclear Medicine. 44 (5), 333-343 (2014).
- Bentourkia, M. Kinetic modeling of PET data without blood sampling. IEEE Transactions on Nuclear Science. 52 (3), 697-702 (2005).
- Lammertsma, A. A. Forward to the past: The case for quantitative PET imaging. Journal of Nuclear Medicine. 58 (7), 1019-1024 (2017).
- Nahrendorf, M., et al. High-resolution imaging of murine myocardial infarction with delayed-enhancement cine micro-CT. American Journal of Physiology-Heart and Circulatory Physiology. 292 (6), 3172-3178 (2007).
- Badea, C. T., Fubara, B., Hedlund, L. W., Johnson, G. A. 4-D micro-CT of the mouse heart. Molecular Imaging. 4 (2), 110-116 (2005).
- Technical Resources. MediLumine Available from: https://www.medilumine.com/technical-resources (2019)
- Nebuloni, L., Kuhn, G. A., Müller, R. A Comparative analysis of water-soluble and blood-pool contrast agents for in vivo vascular imaging with micro-CT. Academic Radiology. 20 (10), 1247-1255 (2013).
- Panetta, D., et al. Performance evaluation of the CT component of the IRIS PET/CT preclinical tomograph. Nuclear Instruments & Methods in Physics Research Section A: Accelerators Spectrometers Detectors and Associated Equipment. 805, 135-144 (2016).
- Gu, J., et al. At what dose can total body and whole abdominal irradiation cause lethal intestinal injury among C57BL/6J mice. Dose-Response. 18 (3), 1559325820956783 (2020).
- Amirrashedi, M., Zaidi, H., Ay, M. R. Advances in preclinical PET instrumentation. PET Clinics. 15 (4), 403-426 (2020).
- Clark, D. P., Badea, C. T. Advances in micro-CT imaging of small animals. Physica Medica. 88, 175-192 (2021).
- Belcari, N., Del Guerra, A., Panetta, D., Grupen, C., Buvat, I. High-Resolution and Animal Imaging Instrumentation and Techniques. Handbook of Particle Detection and Imaging. , 1497-1535 (2021).
- Wang, G., Rahmim, A., Gunn, R. N. PET Parametric imaging: Past, present, and future. IEEE Transactions on Radiation and Plasma Medical Sciences. 4 (6), 663-675 (2020).
- Befera, N. T., Badea, C. T., Johnson, G. A. Comparison of 4D-microSPECT and microCT for murine cardiac function. Molecular Imaging and Biology. 16 (2), 235-245 (2014).
- van Deel, E., Ridwan, Y., van Vliet, J. N., Belenkov, S., Essers, J. In vivo quantitative assessment of myocardial structure, function, perfusion and viability using cardiac micro-computed tomography. Journal of Visualized Experiments. (108), e53603 (2016).
- Lee, C. -. L., et al. Assessing cardiac injury in mice with dual energy-microCT, 4D-microCT and microSPECT imaging following partial-heart irradiation. International Journal of Radiation Oncology, Biology, Physics. 88 (3), 686-693 (2014).
- Harms, H., et al. Comparison of clinical non-commercial tools for automated quantification of myocardial blood flow using oxygen-15-labelled water PET/CT. European Heart Journal - Cardiovascular Imaging. 15 (4), 431-441 (2013).
- Nesterov, S. V., et al. Myocardial perfusion quantitation with 15O-labelled water PET: High reproducibility of the new cardiac analysis software (CarimasTM). European Journal of Nuclear Medicine and Molecular Imaging. 36 (10), 1594-1602 (2009).
- Nesterov, S. V., et al. Myocardial perfusion quantification with Rb-82 PET: Good interobserver agreement of Carimas software on global, regional, and segmental levels. Annals of Nuclear Medicine. 36, 507-514 (2022).
- Nesterov, S. V., et al. One-tissue compartment model for myocardial perfusion quantification with N-13 ammonia PET provides matching results: A cross-comparison between Carimas, FlowQuant, and PMOD. Journal of Nuclear Cardiology. , (2021).
- Thackeray, J. T., Kuntner-Hannes, C., Haemisch, Y. Preclinical Multimodality Imaging and Image Fusion in Cardiovascular Disease. Image Fusion in Preclinical Applications. , 161-181 (2019).
- Vohra, R., Batra, A., Forbes, S. C., Vandenborne, K., Walter, G. A. Magnetic resonance monitoring of disease progression in mdx mice on different genetic backgrounds. The American Journal of Pathology. 187 (9), 2060-2070 (2017).
- Baehr, A., et al. Agrin promotes coordinated therapeutic processes leading to improved cardiac repair in pigs. Circulation. 142 (9), 868-881 (2020).
- Lalwani, K., et al. Contrast agents for quantitative microCT of lung tumors in mice. Comparative Medicine. 63 (6), 482-490 (2013).
- Bertoldo, A., et al. Evaluation of compartmental and spectral analysis models of [18F]FDG kinetics for heart and brain studies with PET. IEEE Transactions on Bio-medical Engineering. 45 (12), 1429-1448 (1998).
- Li, Y., Kundu, B. K. An improved optimization algorithm of the three-compartment model with spillover and partial volume corrections for dynamic FDG PET images of small animal hearts in vivo. Physics in Medicine and Biology. 63 (5), 055003 (2018).
- Mabrouk, R., Dubeau, F., Bentourkia, M., Bentabet, L. Extraction of time activity curves from gated FDG-PET images for small animals' heart studies. Computerized Medical Imaging and Graphics. 36 (6), 484-491 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados