È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Risonanza magnetica cardiaca sensibile all'ossigenazione con manovre di respirazione vasoattiva per la valutazione non invasiva della disfunzione microvascolare coronarica
In questo articolo
Erratum Notice
Riepilogo
La valutazione della funzione microvascolare mediante risonanza magnetica cardiaca sensibile all'ossigenazione in combinazione con manovre di respirazione vasoattiva è unica nella sua capacità di valutare rapidi cambiamenti dinamici nell'ossigenazione miocardica in vivo e, quindi, può servire come tecnica diagnostica di fondamentale importanza per la funzione vascolare coronarica.
Abstract
La risonanza magnetica cardiaca sensibile all'ossigenazione (OS-CMR) è una tecnica diagnostica che utilizza le proprietà paramagnetiche intrinseche della deossiemoglobina come fonte endogena di contrasto tissutale. Utilizzato in combinazione con manovre di respirazione vasoattiva standardizzate (iperventilazione e apnea) come potente stimolo vasomotorio non farmacologico, OS-CMR può monitorare i cambiamenti nell'ossigenazione miocardica. La quantificazione di tali cambiamenti durante il ciclo cardiaco e durante le manovre vasoattive può fornire marcatori per la funzione macro e microvascolare coronarica e quindi aggirare la necessità di agenti di contrasto estrinseci, per via endovenosa o farmacologici.
L'OS-CMR utilizza la ben nota sensibilità delle immagini pesate in T2* all'ossigenazione del sangue. Le immagini sensibili all'ossigenazione possono essere acquisite su qualsiasi scanner per risonanza magnetica cardiaca utilizzando una sequenza cine di precessione libera allo stato stazionario (SSFP) standard modificata, rendendo questa tecnica indipendente dal fornitore e facilmente implementabile. Come manovra di respirazione vasoattiva, applichiamo un protocollo di respirazione di 4 minuti di 120 s di respirazione libera, 60 s di iperventilazione a ritmo sostenuto, seguiti da una apnea espiratoria di almeno 30 s. La risposta regionale e globale dell'ossigenazione del tessuto miocardico a questa manovra può essere valutata monitorando la variazione dell'intensità del segnale. La variazione nei primi 30 secondi della apnea post-iperventilazione, denominata riserva di ossigenazione miocardica indotta dalla respirazione (B-MORE) è stata studiata in persone sane e in varie patologie. Viene fornito un protocollo dettagliato per l'esecuzione di scansioni CMR sensibili all'ossigeno con manovre vasoattive.
Come dimostrato in pazienti con disfunzione microvascolare in condizioni ancora non completamente comprese, come l'ischemia inducibile senza stenosi coronarica ostruttiva (INOCA), l'insufficienza cardiaca con frazione di eiezione conservata (HFpEF) o la disfunzione microvascolare dopo trapianto di cuore, questo approccio fornisce informazioni uniche, clinicamente importanti e complementari sulla funzione vascolare coronarica.
Introduzione
La risonanza magnetica cardiaca sensibile all'ossigenazione (OS-CMR) utilizza le proprietà paramagnetiche intrinseche della deossiemoglobina come fonte endogena di contrasto RM 1,2,3. Utilizzato in combinazione con manovre di respirazione vasoattiva standardizzate (iperventilazione e apnea) come potente stimolo vasomotorio non farmacologico, l'OS-CMR può monitorare i cambiamenti nell'ossigenazione miocardica come marcatore della funzione vascolare, aggirando così la necessità di agenti estrinseci, di contrasto per via endovenosa o di stress farmacologico 4,5,6.
Le manovre respiratorie, comprese le apnee e l'iperventilazione, sono misure vasoattive altamente efficaci per alterare la vasomozione e, grazie alla loro sicurezza e semplicità, sono ideali per la vasomozione endoteliale dipendente controllata come parte di una procedura diagnostica. Gli studi hanno dimostrato una maggiore efficacia quando si combina l'iperventilazione con una successiva apnea4,7, in quanto durante tale protocollo, la vasocostrizione (attraverso la diminuzione associata dell'anidride carbonica nel sangue) è seguita dalla vasodilatazione (aumento dell'anidride carbonica nel sangue); pertanto, un sistema vascolare sano passa attraverso l'intera gamma dalla vasocostrizione alla vasodilatazione con un forte aumento del flusso sanguigno miocardico, che a sua volta aumenta l'ossigenazione miocardica e, quindi, l'intensità del segnale osservabile nelle immagini OS-CMR. L'uso di immagini cine per l'acquisizione consente inoltre di ottenere risultati cardiaci risolti in fase con un migliore rapporto segnale/rumore rispetto all'infusione di adenosina8.
Le manovre respiratorie possono sostituire gli agenti di stress farmacologico per indurre cambiamenti vasoattivi che possono essere utilizzati per valutare la funzione vascolare coronarica. Ciò non solo riduce il rischio per il paziente, gli sforzi logistici e i costi associati, ma aiuta anche a fornire risultati clinicamente più significativi. Gli agenti di stress farmacologici come l'adenosina innescano una risposta endotelio-dipendente e, quindi, riflettono la funzione endoteliale stessa. Tale valutazione specifica della funzione endoteliale finora è stata possibile solo con una somministrazione intracoronarica di acetilcolina come vasodilatatore endoteliale dipendente. Questa procedura, tuttavia, è altamente invasiva2,9 e, quindi, raramente eseguita.
In mancanza di accesso a biomarcatori diretti, diverse tecniche diagnostiche hanno utilizzato marcatori surrogati come l'assorbimento tissutale di un mezzo di contrasto esogeno. Sono limitati dalla necessità di una o due linee di accesso endovenoso, da controindicazioni come grave malattia renale o blocco atrioventricolare e dalla necessità della presenza fisica di personale addestrato alla gestione di effetti collaterali potenzialmente gravi10,11. Il limite più significativo dell'attuale imaging della funzione coronarica, tuttavia, rimane che la perfusione miocardica come marcatore surrogato non riflette l'ossigenazione del tessuto miocardico come la più importante conseguenza a valle della disfunzione vascolare2.
L'OS-CMR con manovre di respirazione vasoattiva è stato utilizzato per valutare la funzione vascolare in numerosi scenari, tra cui individui sani, malattia macrovascolare in pazienti con malattia coronarica (CAD), nonché disfunzione microvascolare in pazienti con apnea ostruttiva del sonno (OSA), ischemia senza stenosi coronarica ostruttiva (INOCA), dopo trapianto di cuore e insufficienza cardiaca con frazione di eiezione conservata (HFpEF)4, 7,12,13,14,15,16. In una popolazione CAD, il protocollo per la riserva di ossigenazione miocardica indotta dalla respirazione (B-MORE) derivato da OS-CMR si è dimostrato sicuro, fattibile e sensibile nell'identificare una risposta di ossigenazione alterata nei territori miocardici perfusi da un'arteria coronaria con una stenosi significativa13.
Nella disfunzione microvascolare, l'OS-CMR ha dimostrato una risposta ritardata all'ossigenazione miocardica nei pazienti con apnea ostruttiva del sonno e un B-MORE attenuato è stato riscontrato nei pazienti con HFpEF e dopo trapianto di cuore12,14,16. Nelle donne con INOCA, la manovra respiratoria ha portato a una risposta di ossigenazione miocardica anormalmente eterogenea, evidenziando il vantaggio dell'alta risoluzione spaziale di OS-CMR15. Questo documento esamina il razionale e la metodologia per l'esecuzione di OS-CMR con manovre di respirazione vasoattiva e discute la sua utilità clinica nella valutazione della fisiopatologia vascolare nelle popolazioni di pazienti con disfunzione microvascolare, in particolare in relazione alla disfunzione endoteliale.
Il contesto fisiologico della risonanza magnetica sensibile all'ossigenazione potenziata dalla respirazione
In condizioni fisiologiche normali, un aumento della domanda di ossigeno è accompagnato da un aumento equivalente dell'apporto di ossigeno attraverso l'aumento del flusso sanguigno, con conseguente assenza di cambiamenti nella concentrazione locale di deossiemoglobina. Al contrario, la vasodilatazione indotta porta a un afflusso "eccessivo" di sangue ossigenato senza un cambiamento nella domanda di ossigeno. Di conseguenza, una maggiore quantità di emoglobina tissutale viene ossigenata e, quindi, c'è meno deossiemoglobina, portando a un aumento relativo dell'intensità del segnale OS-CMR 4,17. Se la funzione vascolare è compromessa, non può rispondere correttamente a una richiesta metabolica alterata o a uno stimolo per aumentare il flusso sanguigno miocardico.
Nel contesto di uno stimolo per suscitare vasomozione, come l'iperventilazione stimolata che provoca vasocostrizione o una lunga apnea che provoca vasodilatazione mediata dall'anidride carbonica, la compromissione dell'attività vasomotoria comporterebbe un aumento relativo della concentrazione locale di deossiemoglobina rispetto ad altre regioni e, successivamente, una riduzione dell'intensità del segnale OS-CMR. Nel contesto dell'ischemia inducibile, la compromissione della funzione vascolare comporterebbe un aumento della domanda locale non soddisfatta da un aumento locale del flusso sanguigno miocardico anche in assenza di stenosi dell'arteria coronaria epicardica. Nelle immagini OS-CMR, l'aumento locale netto della concentrazione di deossiemoglobina porta a una diminuzione dell'intensità del segnale locale 2,18,19,20.
In pazienti con disfunzione microvascolare coronarica 21,22,24,25,26,27 è stato dimostrato un attenuato rilassamento della muscolatura liscia vascolare in risposta ai vasodilatatori endotelio-dipendenti e -indipendenti (inclusa l'adenosina). Si ritiene che la disfunzione endoteliale indipendente sia dovuta ad anomalie strutturali dovute all'ipertrofia microvascolare o alla patologia miocardica circostante. Al contrario, la disfunzione endoteliale provoca sia un'inadeguata vasocostrizione che un compromesso vasorilassamento (endotelio-dipendente), tipicamente causato da una perdita di bioattività dell'ossido nitrico nella parete del vaso21,28. La disfunzione endoteliale è stata implicata nella patogenesi di una serie di malattie cardiovascolari, tra cui ipercolesterolemia, ipertensione, diabete, CAD, apnea ostruttiva del sonno, INOCA e HF 23,24,28,29,30,31,32. Infatti, la disfunzione endoteliale è la prima manifestazione dell'aterosclerosi coronarica33. L'imaging della funzione endoteliale ha un potenziale molto forte, dato il suo ruolo di predittore significativo di eventi cardiovascolari avversi e di esiti a lungo termine, con profonde implicazioni prognostiche negli stati di malattia cardiovascolare 23,29,30,31,34,35.
A differenza dell'imaging di perfusione, la riserva di ossigenazione miocardica indotta dalla respirazione (B-MORE), definita come l'aumento relativo dell'ossigenazione miocardica durante una apnea post-iperventilazione, consente di visualizzare le conseguenze di tale innesco vasoattivo sull'ossigenazione globale o regionalestessa 2,36. Come accurato marcatore a valle della funzione vascolare, B-MORE può, quindi, non solo identificare la disfunzione vascolare ma anche l'ischemia inducibile effettiva, indicando un problema di perfusione locale o di ossigenazione più grave18,19,37. Ciò si ottiene attraverso la capacità dell'OS-CMR di visualizzare la diminuzione relativa dell'emoglobina deossigenata, che è abbondante nel sistema capillare del miocardio, che a sua volta rappresenta una percentuale significativa del tessuto miocardico24.
Sequenza OS-CMR
La sequenza di risonanza magnetica per immagini (MRI) utilizzata per l'imaging OS-CMR è una sequenza prospetticamente gated, modificata, bilanciata, stazionaria, di precessione libera (bSSFP) acquisita in due sezioni ad asse corto. Questa sequenza bSSFP è una sequenza clinica standard disponibile (e modificabile) su tutti gli scanner MRI che eseguono la risonanza magnetica cardiaca, rendendo questa tecnica indipendente dal fornitore e facilmente implementabile. In una normale sequenza cinematografica bSSFP, il tempo di eco, il tempo di ripetizione e l'angolo di capovolgimento vengono modificati per sensibilizzare l'intensità del segnale risultante all'effetto BOLD e, quindi, creare una sequenza sensibile all'ossigenazione. Questo approccio, una lettura bSSFP preparata per T2, si è precedentemente dimostrato adatto per l'acquisizione di immagini sensibili all'ossigenazione con un rapporto segnale/rumore più elevato, una qualità dell'immagine superiore e tempi di scansione più rapidi rispetto alle precedenti tecniche di eco a gradiente utilizzate per l'imaging BOLD38. L'esecuzione di OS-CMR potenziata dalla respirazione con questo approccio può essere applicata con pochissimi effetti collaterali lievi (Tabella 1). Da notare che oltre il 90% dei partecipanti completa questo protocollo con tempi di apnea sufficientemente lunghi 4,12,13,16.
Protocollo
Tutte le scansioni MRI che utilizzano OS-CMR con manovre di respirazione vasoattiva devono essere eseguite in conformità con le linee guida istituzionali locali. Il protocollo descritto di seguito è stato utilizzato in studi approvati da diversi comitati etici istituzionali per la ricerca umana. È stato ottenuto il consenso scritto per tutti i dati e i risultati dei partecipanti umani descritti in questo protocollo e manoscritto.
1. Ampia panoramica
- Variare i criteri di inclusione ed esclusione a seconda della popolazione di studio di interesse. Utilizzare i seguenti criteri di esclusione generali e comuni per un protocollo OS-CMR con manovre di respirazione vasoattiva: controindicazioni generali alla risonanza magnetica (ad es. dispositivi incompatibili con la risonanza magnetica come pacemaker o defibrillatori, materiale impiantato o corpi estranei), consumo di caffeina o farmaci vasoattivi nelle 12 ore precedenti la risonanza magnetica ed età <18 anni.
- Innanzitutto, acquisire lo scout del localizzatore clinico standard e le immagini della struttura e della funzione ventricolare prima di acquisire le acquisizioni del sistema operativo. Utilizzare le immagini cinematografiche ad asse lungo bSSFP per pianificare il posizionamento delle sezioni delle acquisizioni del sistema operativo.
NOTA: Una revisione dei protocolli clinici standardizzati CMR è descritta altrove39. - Apnea di base
- Acquisisci la prima serie OS-CMR come breve acquisizione di base in apnea per valutare la qualità dell'immagine e la posizione della sezione, verificare la presenza di artefatti e fungere da linea di base per l'intensità del segnale.
- Eseguire una breve (~10 s) acquisizione di un singolo ciclo cardiaco dopo che il partecipante ha respirato normalmente. Assicurarsi che l'apnea venga eseguita alla fine dell'espirazione.
- Acquisizione continua con manovra di respirazione vasoattiva
- Acquisire la seconda serie OS-CMR come un'acquisizione continua di 4 minuti composta da 2 minuti di respirazione libera e 1 minuto di iperventilazione accelerata, seguita da una apnea volontaria e massima (~1 minuto). Poiché l'acquisizione continua ottiene più cicli cardiaci nell'arco di 4 minuti, modificare un parametro aggiuntivo (il numero di cicli cardiaci acquisiti dall'acquisizione) per rendere questa serie un'acquisizione a misure ripetute
NOTA: La durata minima richiesta per l'apnea è di 30 s, anche se una trattenuta di 60 s è considerata lo standard. - Trasmettere le istruzioni per la manovra di respirazione vasoattiva ai partecipanti nello scanner MRI dirigendo manualmente il partecipante durante la manovra di respirazione attraverso un microfono collegato al sistema di altoparlanti MRI o attraverso un file .mp3 preregistrato (File supplementare 1) che può essere riprodotto per il partecipante attraverso il sistema di altoparlanti MRI.
- Iniziare la manovra di respirazione vasoattiva con respirazione libera (dopo 120 s di respirazione libera, inizia l'iperventilazione). Guidare il partecipante attraverso la respirazione ritmica con l'uso di segnali acustici da un metronomo a una frequenza di 30 respiri/min (un segnale acustico indica l'inspirazione, un segnale acustico indica l'espirazione). Al segno di iperventilazione di 55 s, dare un comando vocale finale per "inspirare profondamente e poi espirare e trattenere il respiro" per assicurarsi che l'apnea venga eseguita a un livello di fine espirazione.
NOTA: La variazione di CO 2 nel sangue è molto più pronunciata con l'apnea alla fine dell'espirazione (la superficie polmonare è più piccola, riducendo al minimo la diffusione residua di CO2 negli alveoli).
- Acquisire la seconda serie OS-CMR come un'acquisizione continua di 4 minuti composta da 2 minuti di respirazione libera e 1 minuto di iperventilazione accelerata, seguita da una apnea volontaria e massima (~1 minuto). Poiché l'acquisizione continua ottiene più cicli cardiaci nell'arco di 4 minuti, modificare un parametro aggiuntivo (il numero di cicli cardiaci acquisiti dall'acquisizione) per rendere questa serie un'acquisizione a misure ripetute
- Analisi dell'immagine
- Per misurare il B-MORE, considerare la prima immagine telesistolica durante l'apnea come tempo 0 s. Confrontare i valori di intensità del segnale globale o regionale dell'immagine telesistolica acquisita più vicino al punto temporale di 30 s dell'apnea con l'intensità del segnale dell'immagine al punto di tempo di 0 s. Riportare BMORE come variazione percentuale dell'intensità del segnale a 30 s rispetto al tempo 0 s della trattenuta del respiro.
2. Procedura di pre-scansione
- Assicurarsi che ogni partecipante superi il questionario sulla sicurezza e la compatibilità della risonanza magnetica dell'istituzione locale (modulo di controindicazione generale alla risonanza magnetica), che dovrebbe includere domande sull'anamnesi medica e chirurgica pregressa e identificare la presenza di qualsiasi impianto, dispositivo o corpo estraneo metallico all'interno o nel sito chirurgico del partecipante40.
- Procurati un test di gravidanza, se applicabile.
- Verificare che il paziente si sia astenuto dai farmaci vasoattivi e dalla caffeina nelle 12 ore precedenti la risonanza magnetica.
- Mostra al partecipante il video didattico della manovra di respirazione (Video supplementare S1).
- Eseguire una sessione pratica di 60 secondi di iperventilazione a ritmo seguito da una massima apnea volontaria con ogni partecipante al di fuori della sala di scansione MRI e fornire un feedback sulle prestazioni dell'iperventilazione.
- Istruisci i partecipanti che possono semplicemente riprendere a respirare quando hanno un forte bisogno di farlo.
NOTA: Vedere la discussione per i punti da notare e fornire feedback ai partecipanti.
3. Acquisizione RM di sequenze sensibili all'ossigenazione
- Modificare tre parametri dalla sequenza bSSFP standard sulla console MRI: aumentare il tempo di ripetizione (TR), aumentare il tempo di eco (TE), diminuire l'angolo di inversione (FA).
NOTA: I valori modificati dipendono dall'intensità di campo dello scanner MRI (Tabella 2). L'aumento di TR e TE e la diminuzione di FA si traducono in un aumento di T2* o sensibilità all'ossigenazione della sequenza MRI. Queste modifiche si tradurranno quindi in un aumento della larghezza di banda e della risoluzione di base della sequenza. - Creare due serie di OS, una linea di base (etichettata: OS_base) e l'acquisizione continua durante la quale viene eseguita la manovra di respirazione (etichettata: OS_cont_acq). Lasciare invariata la sequenza del sistema operativo di base. Nell'acquisizione continua del sistema operativo, aumentare le misure ripetute da 1 a ~25-40 (a seconda del tipo di scanner). Aumentare il numero di cicli cardiaci (misure) fino a quando il tempo di acquisizione è di ~4,5 min.
NOTA: Sono necessarie due sequenze OS-CMR: l'acquisizione della linea di base dell'OS e l'acquisizione continua dell'OS con manovre di respirazione vasoattiva. Nelle sezioni seguenti vengono descritti questi passaggi.
4. Acquisizione della linea di base del sistema operativo
- Per la prescrizione della fetta, pianificare in un fermo immagine telesistolico di una vista ad asse lungo (immagine a due o quattro camere). Prescrivere due fette dell'asse corto, una a livello ventricolare medio-basale e l'altra a livello ventricolare medio-apicale. Vedere la discussione per i punti da considerare relativi alla posizione della sezione.
- Regolazioni dei parametri di sequenza
- Regolare i parametri della sequenza in base alle esigenze di un determinato partecipante. Vedere la Tabella 3 per i parametri di sequenza che possono o non possono essere modificati.
- Regolare lo spazio/spaziatura media tra le fette in base alle dimensioni del cuore del partecipante e assicurarsi che la posizione corretta delle fette.
- Regolare il campo visivo per evitare artefatti di avvolgimento, se necessario. Fare ogni sforzo per mantenere il campo visivo tra 360 mm e 400 mm.
- Volume spessore
- Regolare il volume dello spessore in modo che sia stretto attorno al ventricolo sinistro sia nella vista dell'asse lungo che in quella dell'asse corto.
- Acquisizione di sequenze
- Approvare la sequenza ed eseguirla durante l'apnea di fine espirazione. Assicurarsi che questa sequenza di base del sistema operativo duri ~10 s, in base alla frequenza cardiaca e allo scanner MRI.
- Controllo della qualità dell'immagine
- Controllare entrambe le sezioni della serie acquisita, verificare la presenza di movimenti respiratori, una cattiva posizione della fetta o la presenza di artefatti. Ripetere la sequenza OS di base fino a ottenere una qualità dell'immagine adeguata.
- Per la risoluzione dei problemi, se la posizione della fetta è troppo basale o troppo apicale, regolare la posizione della fetta prescritta in modo che sia più vicina al livello ventricolare medio. Se è presente un artefatto, procedi nel seguente modo:
- Controllare la direzione di codifica delle fasi.
- Ingrandisci il campo visivo.
- Regolare il volume dello spessore intorno al ventricolo sinistro.
5. Acquisizione continua OS con manovre di respirazione vasoattiva
NOTA: Assicurarsi che ogni partecipante sia stato istruito sulla corretta esecuzione della manovra di respirazione prima di essere nello scanner MRI (vedere la sezione 2).
- Pianificazione delle sequenze
- Se possibile, copiare la posizione della sezione e regolare il volume dall'immagine di base del sistema operativo o duplicare la sequenza del sistema operativo di base e, in caso di misurazioni ripetute, aumentare da 1 a ~25-40 (o quasi 4,5 minuti di tempo di acquisizione).
- Verificare il posizionamento dell'immagine e della sezione, quindi eseguire il ciclo di acquisizione.
- Se possibile, apri la finestra del live streaming.
- Nella sala di controllo, collegare un dispositivo con il file .mp3 delle istruzioni per la manovra respiratoria nell'ingresso ausiliario o prepararsi a tenerlo sopra il microfono proiettato nello scanner MRI. In alternativa, guidare manualmente il partecipante attraverso la manovra di respirazione utilizzando un cronometro per il cronometraggio e fornire istruzioni verbalmente attraverso il microfono collegato al sistema di altoparlanti MRI.
- Acquisizione di sequenze
- Premere contemporaneamente play per la sequenza di acquisizione continua OS sullo scanner MRI e riprodurre per il file di istruzioni di respirazione .mp3 o avviare il cronometro se il partecipante viene istruito manualmente.
- Se guidi manualmente il partecipante attraverso le manovre di respirazione, istruiscilo a inspirare ed espirare, quindi trattieni il respiro per 10 secondi e inizia a iperventilare non appena sente il segnale acustico del metronomo.
- Avvisare il partecipante al segno di iperventilazione di 40 s (2:40 sul cronometro).
- Al punto di tempo di 55 s di iperventilazione (2:55 sul cronometro), istruire il partecipante a "inspirare profondamente, espirare e trattenere il respiro".
NOTA: Le immagini di respirazione libera e iperventilazione presenteranno artefatti di movimento. Questo è previsto. Tuttavia, non dovrebbero esserci artefatti di movimento durante l'apnea. È di fondamentale importanza che le immagini trattenute dal respiro vengano acquisite dopo l'espirazione (posizione di fine espirazione confortevole). Solo un'apnea dopo l'espirazione porta al rapido aumento di CO2 nel sangue durante i primi 30 secondi della successiva apnea, con la conseguente variazione del flusso sanguigno coronarico e dell'ossigenazione miocardica. - Monitorare le prestazioni del partecipante dell'iperventilazione stimolata attraverso la finestra della sala di controllo o la telecamera dello scanner MRI per garantire un'adeguata esecuzione della respirazione profonda. Se si utilizzano soffietti, monitorare i picchi di ampiezza sul visore di gating respiratorio. Se l'iperventilazione non viene eseguita in modo adeguato dopo la guida iniziale, interrompere l'acquisizione e ripetere la sequenza di acquisizione continua del sistema operativo.
- Monitora eventuali piccoli respiri effettuati dai partecipanti durante l'apnea. A tale scopo, è necessario monitorare il tracciamento di una cintura respiratoria sulla console di risonanza magnetica o visivamente attraverso la finestra/telecamera.
- Una volta che il partecipante inizia a respirare alla fine dell'apnea, interrompere l'acquisizione.
- Dopo la fine dell'acquisizione, chiedere al partecipante se ha avuto effetti avversi e lasciare che il partecipante respiri normalmente per 3 minuti.
- Risoluzione dei problemi: ripetere l'acquisizione
- Se le manovre respiratorie devono essere ripetute, ripetere la sequenza OS di base.
NOTA: È necessario un periodo di 2-3 minuti prima di ripetere l'acquisizione per consentire alla fisiologia di tornare al basale. Dati precedenti hanno dimostrato che la fisiologia non ritorna al basale dopo 1 minutoe 41. - Se la qualità dell'immagine della sequenza di base dell'OS è adeguata, ripetere l'acquisizione continua dell'OS e l'esecuzione delle manovre respiratorie.
- Se le manovre respiratorie devono essere ripetute, ripetere la sequenza OS di base.
6. Analisi dell'immagine
- Importa i set di dati di immagine OS-CMR in un visualizzatore DICOM con funzionalità di contorno dell'immagine, al meglio con la funzionalità per analizzare automaticamente le variazioni di intensità del segnale sensibili all'ossigenazione.
- I marcatori e la loro misurazione
- Acquisire un'immagine di base durante una breve acquisizione di apnea di base prima dell'iperventilazione (riposo). Confronta la prima immagine dell'apnea (che rappresenta la fine dello stimolo di "stress") con l'immagine di base.
NOTA: L'iperventilazione è uno stimolo vasocostrittore che riduce l'ossigenazione miocardica (Sano: %ΔSI ≈-5% a -10%13). - Ottenere molte immagini (e cicli cardiaci) durante l'apnea. Usa la prima immagine dell'apnea come linea di base e confronta tutte le immagini seguenti con questa immagine.
NOTA: L'apnea è uno stimolo vasodilatatore che aumenta l'ossigenazione miocardica (%ΔSI ≈ +5%-15%12,13,14,16). - Contorni miocardici
Per l'analisi manuale: selezione della fase cardiaca- Poiché l'apnea può contenere più di 400 immagini, analizzare solo una singola fase di ogni ciclo cardiaco. Di conseguenza, focalizzare l'analisi sulle immagini telesistoliche di ciascun ciclo cardiaco.
- Identificare le immagini telesistoliche di ciascun ciclo cardiaco.
- Disegna i contorni dell'epicardio e dell'endocardio attorno al miocardio.
- Finestra l'immagine per cercare artefatti, che appariranno come aree scure (suscettibilità) o luminose a causa di uno scarso gating nel miocardio.
NOTA: Evitare di includere pixel con effetti di volume parziali dai pool di sangue ventricolare sinistro e destro. La maggior parte degli errori di contouring si verifica dal contorno endocardico, compresi i pixel con effetti di volume parziale e la conseguente intensità del segnale artificialmente elevata dal pool sanguigno ventricolare sinistro. Per evitare ciò, disegna il contorno endocardico di un pixel intero all'interno del miocardio. Allo stesso modo, assicurarsi che il contorno epicardico sia un pixel intero all'interno del miocardio per evitare effetti di volume parziale dal pool sanguigno ventricolare destro, dal grasso epicardico o dall'interfaccia aria-polmone. - Copia e incolla i contorni endocardici ed epicardici dalla prima immagine telesistolica del ciclo cardiaco all'immagine telesistolica del ciclo cardiaco successivo. Regolare i contorni in base alle esigenze.
Per l'analisi automatizzata:
NOTA: Con le funzionalità di contouring automatizzato, se lo si desidera, tutte le fasi del ciclo cardiaco possono essere modellate e analizzate. - Controllare tutte le immagini per garantire un contorno accurato.
NOTA: alcune funzionalità di contornatura automatizzata disponibili in commercio sono state addestrate su set di dati che sono stati sagomati per l'analisi volumetrica. Questi contorni sono soggetti a effetti di volume parziale in quanto hanno lo scopo di delimitare il pool sanguigno e il miocardio. I contorni OS-CMR devono essere completamente all'interno del miocardio.
- Acquisire un'immagine di base durante una breve acquisizione di apnea di base prima dell'iperventilazione (riposo). Confronta la prima immagine dell'apnea (che rappresenta la fine dello stimolo di "stress") con l'immagine di base.
7. Segmentazione per l'analisi regionale
- Per ottenere informazioni regionali, identificare l'inserzione anterosettale e inferosettale del ventricolo destro per dividere il miocardio nella segmentazione dell'American Heart Association (AHA)42.
8. Calcolo di B-MORE
- Esprimere B-MORE come variazione percentuale dell'intensità del segnale dal basale alla vasodilatazione (vedi equazione 1):
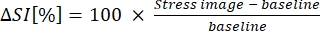 (1)
(1) - Calcolare il B-MORE globale come l'intensità media globale del segnale miocardico delle immagini telesistoliche a 30 s rispetto a 0 s della apnea8 (vedi equazione 2):
 (2)
(2)
Risultati
Interpretariato B-MORE
In studi pubblicati in precedenza che utilizzavano OS-CMR con manovre di respirazione vasoattiva, il B-MORE globale o regionale è stato calcolato confrontando la prima immagine telesistolica della trattenuta con l'immagine telesistolica più vicina a 15 s, 30 s, 45 s, ecc. della apnea. La fase telesistolica del ciclo cardiaco è stata scelta per diversi motivi. L'immagine telesistolica è la fase più consistente identificata tra i lettori: contiene il maggior numero di pixel n...
Discussione
L'aggiunta di un'acquisizione OS-CMR con manovre di respirazione vasoattiva standardizzate a un protocollo di ricerca o di risonanza magnetica clinica già consolidato aggiunge poco tempo alla scansione complessiva. Con questa breve aggiunta, è possibile ottenere informazioni sulla funzione macro e microvascolare sottostante (Figura 2). Un'importante conseguenza della disfunzione endoteliale è l'incapacità del sistema vascolare di rispondere agli stimoli fisiologici, come inizialmente dim...
Divulgazioni
MGF è elencato come titolare del brevetto degli Stati Uniti n. 14/419,877: Inducendo e misurando i cambiamenti di ossigenazione miocardica come indicatore per la malattia cardiaca; Brevetto degli Stati Uniti n. 15/483,712: misurazione dei cambiamenti di ossigenazione nei tessuti come marcatore della funzione vascolare; Brevetto degli Stati Uniti n. 10.653.394: Misurazione dei cambiamenti di ossigenazione nei tessuti come marcatore della funzione vascolare - continuazione; e brevetto canadese CA2020/051776: metodo e apparato per la determinazione di biomarcatori della funzione vascolare utilizzando immagini CMR in grassetto. EH è elencato come titolare del brevetto internazionale CA2020/051776: Metodo e apparato per la determinazione di biomarcatori della funzione vascolare utilizzando immagini CMR in grassetto.
Riconoscimenti
Questo documento e la revisione della metodologia sono stati resi possibili dall'intero team del Courtois CMR Research Group presso il McGill University Health Centre. Un ringraziamento speciale alle nostre tecnologhe di risonanza magnetica Maggie Leo e Sylvie Gelineau per la scansione dei nostri partecipanti e il feedback su questo manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| balanced SSFP MRI sequence | Any | To modify to create the OS-CMR sequence | |
| DICOM/ Imaging Viewer | Any | Best if the viewer has the ability for quantitative measurements (i.e., Area19 prototype software) | |
| Magnetic Resonance Imaging scanner | Any | 3 Tesla or 1.5 Tesla | |
| Metronome | Any | Set to 30 breaths per minute. To use if manually communicating breathing maneuver instructions to participants. | |
| Speaker system | Any | To communicate breathing maneuver instrucitons to participants through | |
| Stopwatch | Any | To use if manually communicating breathing maneuver instructions to participants |
Riferimenti
- Ogawa, S., Lee, T. M., Kay, A. R., Tank, D. W. Brain magnetic resonance imaging with contrast dependent on blood oxygenation. Proceedings of the National Academy of Sciences of the United States of America. 87 (24), 9868-9872 (1990).
- Friedrich, M. G., Karamitsos, T. D. Oxygenation-sensitive cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 15, 43 (2013).
- Guensch, D. P., et al. The blood oxygen level dependent (BOLD) effect of in-vitro myoglobin and hemoglobin. Scientific Reports. 11 (1), 11464 (2021).
- Guensch, D. P., et al. Breathing manoeuvre-dependent changes in myocardial oxygenation in healthy humans. European Heart Journal - Cardiovascular Imaging. 15 (4), 409-414 (2014).
- Fischer, K., Guensch, D. P., Shie, N., Lebel, J., Friedrich, M. G. Breathing maneuvers as a vasoactive stimulus for detecting inducible myocardial ischemia - An experimental cardiovascular magnetic resonance study. PloS One. 11 (10), 0164524 (2016).
- Friedrich, M. G. Tracking myocardial oxygenation over a breath hold with blood oxygen level−dependent MRI: A radically different approach to study ischemia. Radiology. 294 (3), 546-547 (2020).
- Teixeira, T., Nadeshalingam, G., Fischer, K., Marcotte, F., Friedrich, M. G. Breathing maneuvers as a coronary vasodilator for myocardial perfusion imaging. Journal of Magnetic Resonance Imaging. 44 (4), 947-955 (2016).
- Fischer, K., Guensch, D. P., Friedrich, M. G. Response of myocardial oxygenation to breathing manoeuvres and adenosine infusion. European Heart Journal Cardiovascular Imaging. 16 (4), 395-401 (2015).
- Ong, P., Athanasiadis, A., Sechtem, U. Intracoronary acetylcholine provocation testing for assessment of coronary vasomotor disorders. Journal of Visualized Experiments. (114), e54295 (2016).
- Voigtländer, T., et al. The adverse events and hemodynamic effects of adenosine-based cardiac MRI. Korean Journal of Radiology. 12 (4), 424-430 (2011).
- Tsang, K. H., Chan, W. S. W., Shiu, C. K., Chan, M. K. The safety and tolerability of adenosine as a pharmacological stressor in stress perfusion cardiac magnetic resonance imaging in the Chinese population. Hong Kong Medical Journal. 21 (6), 524-527 (2015).
- Roubille, F., Fischer, K., Guensch, D. P., Tardif, J. -. C., Friedrich, M. G. Impact of hyperventilation and apnea on myocardial oxygenation in patients with obstructive sleep apnea - An oxygenation-sensitive CMR study. Journal of Cardiology. 69 (2), 489-494 (2017).
- Fischer, K., et al. Feasibility of cardiovascular magnetic resonance to detect oxygenation deficits in patients with multi-vessel coronary artery disease triggered by breathing maneuvers. Journal of Cardiovascular Magnetic Resonance. 20 (1), 31 (2018).
- Iannino, N., et al. Myocardial vascular function assessed by dynamic oxygenation-sensitive cardiac magnetic resonance imaging long-term following cardiac transplantation. Transplantation. 105 (6), 1347-1355 (2021).
- Elharram, M., et al. Regional heterogeneity in the coronary vascular response in women with chest pain and nonobstructive coronary artery disease. Circulation. 143 (7), 764-766 (2021).
- Fischer, K., et al. Insights into myocardial oxygenation and cardiovascular magnetic resonance tissue biomarkers in heart failure with preserved ejection fraction. Circulation: Heart Failure. 15 (4), 008903 (2022).
- Li, D., Dhawale, P., Rubin, P. J., Haacke, E. M., Gropler, R. J. Myocardial signal response to dipyridamole and dobutamine: demonstration of the BOLD effect using a double-echo gradient-echo sequence. Magnetic Resonance in Medicine. 36 (1), 16-20 (1996).
- Arnold, J. R., et al. Myocardial oxygenation in coronary artery disease: insights from blood oxygen level-dependent magnetic resonance imaging at 3 tesla. Journal of the American College of Cardiology. 59 (22), 1954-1964 (2012).
- Karamitsos, T. D., et al. Relationship between regional myocardial oxygenation and perfusion in patients with coronary artery disease: Insights from cardiovascular magnetic resonance and positron emission tomography. Circulation: Cardiovascular Imaging. 3 (1), 32-40 (2010).
- Friedrich, M. G., Niendorf, T., Schulz-Menger, J., Gross, C. M., Dietz, R. Blood oxygen level-dependent magnetic resonance imaging in patients with stress-induced angina. Circulation. 108 (18), 2219-2223 (2003).
- Cai, H., Harrison, D. G. Endothelial dysfunction in cardiovascular diseases: The role of oxidant stress. Circulation Research. 87 (10), 840-844 (2000).
- Kothawade, K., Bairey Merz, C. N. Microvascular coronary dysfunction in women: Pathophysiology, diagnosis, and management. Current Problems in Cardiology. 36 (8), 291-318 (2011).
- Gimbrone, M. A., García-Cardeña, G. Endothelial cell dysfunction and the pathobiology of atherosclerosis. Circulation Research. 118 (4), 620-636 (2016).
- Vancheri, F., Longo, G., Vancheri, S., Henein, M. Coronary microvascular dysfunction. Journal of Clinical Medicine. 9 (9), 2880 (2020).
- Camici, P. G., Crea, F. Coronary microvascular dysfunction. The New England Journal of Medicine. 356 (8), 830-840 (2007).
- Ford, T. J., et al. Assessment of vascular dysfunction in patients without obstructive coronary artery disease: Why, how, and when. JACC: Cardiovascular Interventions. 13 (16), 1847-1864 (2020).
- Taqueti, V. R., Di Carli, M. F. Coronary microvascular disease pathogenic mechanisms and therapeutic options: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (21), 2625-2641 (2018).
- Budhiraja, R., Parthasarathy, S., Quan, S. F. Endothelial dysfunction in obstructive sleep apnea. Journal of Clinical Sleep Medicine. 3 (4), 409-415 (2007).
- Sena, C. M., Pereira, A. M., Seiça, R. Endothelial dysfunction - A major mediator of diabetic vascular disease. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1832 (12), 2216-2231 (2013).
- Vanhoutte, P. M., Shimokawa, H., Feletou, M., Tang, E. H. C. Endothelial dysfunction and vascular disease - A 30th anniversary update. Acta Physiologica. 219 (1), 22-96 (2017).
- Juni, R. P., Duckers, H. J., Vanhoutte, P. M., Virmani, R., Moens, A. L. Oxidative stress and pathological changes after coronary artery interventions. Journal of the American College of Cardiology. 61 (14), 1471-1481 (2013).
- Simsek, E. C., et al. Endothelial dysfunction in patients with myocardial ischemia or infarction and nonobstructive coronary arteries. Journal of Clinical Ultrasound. 49 (4), 334-340 (2021).
- Stillman, A. E., et al. Imaging the myocardial ischemic cascade. The International Journal of Cardiovascular Imaging. 34 (8), 1249-1263 (2018).
- Fischer, D., et al. Endothelial dysfunction in patients with chronic heart failure is independently associated with increased incidence of hospitalization, cardiac transplantation, or death. European Heart Journal. 26 (1), 65-69 (2005).
- Hurst, T., Olson, T. H., Olson, L. E., Appleton, C. P. Cardiac syndrome X and endothelial dysfunction: New concepts in prognosis and treatment. The American Journal of Medicine. 119 (7), 560-566 (2006).
- Bauer, W. R., et al. Theory of the BOLD effect in the capillary region: An analytical approach for the determination of T*2 in the capillary network of myocardium. Magnetic Resonance in Medicine. 41 (1), 51-62 (1999).
- Manka, R., et al. BOLD cardiovascular magnetic resonance at 3.0 tesla in myocardial ischemia. Journal of Cardiovascular Magnetic Resonance. 12 (1), 54 (2010).
- Dharmakumar, R., Qi, X., Hong, J., Wright, G. A. Detecting microcirculatory changes in blood oxygen state with steady-state free precession imaging. Magnetic Resonance in Medicine. 55 (6), 1372-1380 (2006).
- Kramer, C. M., et al. Standardized cardiovascular magnetic resonance imaging (CMR) protocols: 2020 update. Journal of Cardiovascular Magnetic Resonance. 22 (1), 17 (2020).
- Expert Panel on MR Safety et al. ACR guidance document on MR safe practices: 2013. Journal of Magnetic Resonance Imaging: JMRI. 37 (3), 501-530 (2013).
- Macey, P. M., Kumar, R., Ogren, J. A., Woo, M. A., Harper, R. M. Global brain blood-oxygen level responses to autonomic challenges in obstructive sleep apnea. PLoS One. 9 (8), 105261 (2014).
- Cerqueira, M. D., et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. Circulation. 105 (4), 539-542 (2002).
- Hayoz, D., et al. Flow-mediated arterial dilation is abnormal in congestive heart failure. Circulation. 87 (6), 92-96 (1993).
- Hillier, E., Friedrich, M. G. The potential of oxygenation-sensitive CMR in heart failure. Current Heart Failure Reports. 18 (5), 304-314 (2021).
- Hawkins, S. M., et al. Hyperventilation-induced heart rate response as a potential marker for cardiovascular disease. Scientific Reports. 9 (1), 17887 (2019).
- Dass, S., et al. No evidence of myocardial oxygen deprivation in nonischemic heart failure. Circulation: Heart Failure. 8 (6), 1088-1093 (2015).
- Endemann, D. H., Schiffrin, E. L. Endothelial dysfunction. Journal of the American Society of Nephrology. 15 (8), 1983-1992 (2004).
- Costanzo, M. R., et al. The International Society of Heart and Lung Transplantation Guidelines for the care of heart transplant recipients. The Journal of Heart and Lung Transplantation. 29 (8), 914-956 (2010).
- Lanza, G. A. Cardiac syndrome X: A critical overview and future perspectives. Heart. 93 (2), 159-166 (2007).
- Gould, K. L., Johnson, N. P. Coronary physiology beyond coronary flow reserve in microvascular angina: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (21), 2642-2662 (2018).
- Guensch, D. P., Nadeshalingam, G., Fischer, K., Stalder, A. F., Friedrich, M. G. The impact of hematocrit on oxygenation-sensitive cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 18 (1), 42 (2016).
- Dharmakumar, R., et al. Assessment of regional myocardial oxygenation changes in the presence of coronary artery stenosis with balanced SSFP imaging at 3.0T: Theory and experimental evaluation in canines. Journal of Magnetic Resonance Imaging. 27 (5), 1037-1045 (2008).
- Hillier, E., Benovoy, M., Friedrich, M. A fully automated post-processing tool identifies a reduced global myocardial oxygenation reserve in patients with ischemia and no obstructive coronary artery stenosis when compared to patients with significant CAD. SCMR 25th Annual Scientific Sessions. , (2022).
Erratum
Formal Correction: Erratum: Oxygenation-sensitive Cardiac MRI with Vasoactive Breathing Maneuvers for the Non-invasive Assessment of Coronary Microvascular Dysfunction
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/64149
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon