A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידוד של הפטוציטים מתחדשים לאחר כריתת כבד חלקית בעכברים
In This Article
Summary
הפטוציטים עמוסי שומנים טבועים בהתחדשות הכבד, אך בדרך כלל הולכים לאיבוד עם צנטריפוגה הדרגתית של צפיפות. כאן, אנו מציגים פרוטוקול בידוד תאים אופטימלי השומר על הפטוציטים סטאטוטיים, ומניב אוכלוסיות מייצגות של הפטוציטים מתחדשים לאחר כריתת כבד חלקית בעכברים.
Abstract
כריתת כבד חלקית נמצאת בשימוש נרחב כדי לחקור התחדשות כבד בעכברים, אך הבידוד של יבולים גבוהים של הפטוציטים קיימא עבור יישומים של תאים בודדים במורד הזרם הוא מאתגר. הצטברות ניכרת של שומנים בתוך hepatocytes התחדשות נצפתה במהלך 2 הימים הראשונים של התחדשות כבד נורמלי בעכברים. סטאטוזיס זה המכונה סטאטוזיס הקשור להתחדשות חולפת (TRAS) הוא זמני אך חופף חלקית לשלב ההתרבות העיקרי. טיהור שיפוע צפיפות הוא עמוד השדרה של רוב הפרוטוקולים הקיימים לבידוד של הפטוציטים ראשוניים. מכיוון שטיהור הדרגתי מסתמך על צפיפות התאים וגודלם, הוא מפריד בין אוכלוסיות הפטוציטים שאינם סטאטוטיים לסטאטוטים. לכן, hepatocytes שומן לעתים קרובות הולכים לאיבוד, מניב שברים hepatocyte לא מייצג.
הפרוטוקול המוצג מתאר שיטה קלה ואמינה לבידוד in vivo של הפטוציטים מתחדשים ללא קשר לתכולת השומנים שלהם. הפטוציטים מעכברי C57BL/6 זכרים מבודדים 24-48 שעות לאחר כריתת הכבד בגישה קלאסית של זילוח collagenase דו-שלבי. משאבה פריסטלטית סטנדרטית מניעה את התמיסות המחוממות דרך הווריד הנבוב התחתון הצנתורי אל תוך השארית, תוך שימוש בטכניקת זילוח מדרדר עם זרימה החוצה דרך הווריד הפורטלי. הפטוציטים מנותקים על ידי collagenase לשחרורם מהקפסולה של גליסון. לאחר שטיפה וצנטריפוגה זהירה, ניתן להשתמש בהפטוציטים לכל ניתוח במורד הזרם. לסיכום, מאמר זה מתאר טכניקה פשוטה וניתנת לשחזור לבידוד אוכלוסייה מייצגת של הפטוציטים מתחדשים לאחר כריתת כבד חלקית בעכברים. השיטה עשויה גם לסייע בחקר מחלת הכבד השומני.
Introduction
הכבד יכול לחדש את עצמו גם לאחר אובדן רקמות משמעותי. יכולת התחדשות ייחודית זו מודגמת במפורש על ידי המודל הניסיוני של כריתת כבד חלקית (70%), שתואר לראשונה בחולדות על ידי היגינס ואנדרסון בשנת 19311. במודל זה, 70% מהכבד מוסר בניתוח מבעלי חיים על ידי חיתוך אונות כבד גדולות יותר. האונות הנותרות גדלות באמצעות היפרטרופיה מפצה כדי לשחזר את מסת הכבד המקורית תוך כשבוע לאחר הניתוח, אם כי ללא שחזור של ארכיטקטורת הכבד המקורית 2,3. פותחו כריתות כבד נוספות עם כמויות משתנות של הסרת רקמות, כגון כריתת כבד מורחבת של 86% שבה שארית הכבד קטנה מכדי להתאושש, מה שמוביל בסופו של דבר לאי ספיקת כבד לאחר כריתת הכבד (PHLF) ומוות לאחר מכן אצל 30%-50% מבעלי החיים 4,5,6. מודלים אלה מאפשרים לחקור התחדשות כבד נורמלית ונכשלת, כתלות בכמות הרקמה שנכרתה (איור 1).
למרות מודלים עכבריים של hepatectomies שימשו בהצלחה במשך שנים רבות, רק לאחרונה שיטות אנליטיות מתקדמות יותר אפשרו תובנה עמוקה יותר ברמת התא הבודד. עבור רוב שיטות אלה, עם זאת, נוכחות של hepatocytes בודדים הוא תנאי מוקדם בסיסי. רוב הפרוטוקולים לבידוד של הפטוציטים ראשוניים מבוססים על טכניקת זילוח קולגנאז דו-שלבית וטיהור שיפוע צפיפות לאחר מכן כדי להפריד הפטוציטים קיימא מפסולת ולא פרנכימליים, כמו גם תאים מתים 7,8,9. שיטה זו תוארה לראשונה על ידי ברי ופרנד בשנת 196910 ואומצה על ידי סגלן ועמיתיו בשנת 197211,12. עם זאת, מכיוון שצנטריפוגות הדרגתיות מסתמכות על צפיפות התאים וגודלם, הפטוציטים עמוסי השומנים אובדים לעתים קרובות במהלך טיהור סטנדרטי. בעוד אובדן כזה עשוי להיות זניח עבור שאלות מחקר רבות, זהו היבט מכריע עבור התחדשות הכבד מוקדם. במהלך היומיים הראשונים, הפטוציטים בתוך כבד העכבר המתחדש צוברים שומנים, ובכך גדלים בגודל וטובלים בצפיפות. סטאטוזיס חולף זה הקשור להתחדשות (TRAS) משמש לספק דלק רגנרטיבי והוא זמני, אך חופף חלקית לשלב השגשוג העיקרי ומתפלג באופן לא אחיד בתוך אונות הכבד - היחידות התפקודיות של הכבד13,14. עם זאת, לאחר כריתת כבד ממושכת של 86%, TRAS מתרחש גם הוא אך נמשך, מכיוון שההתחדשות נעצרת והשומנים אינם מחומצנים14. לכן, טיהור הדרגתי של הפטוציטים לאחר כריתת כבד של 70% או 86% יניב שברים לא מייצגים, מכיוון שרוב הפטוציטים עמוסי השומנים אובדים בגלל צפיפותם הנמוכה15.
בפרוטוקול בידוד שונה זה, הפטוציטים מעכברי C57BL/6 מבודדים 24-48 שעות לאחר כריתת הכבד על ידי גישה קלאסית של זילוח collagenase בשני שלבים. בדרך כלל, קנולציה וזילוח של השארית לבידוד תאים נעשים דרך וריד הפורטל. עם זאת, ההתנגדות הפורטו-וסקולרית בשרידים קטנים שנותרו לאחר כריתה גדולה היא גבוהה16, ולכן הזלוף עדין. מכיוון שהווריד קאווה אינו מושפע מכריתת הכבד, ניתן לבצע זילוח בקלות בכיוון הנסיגה באמצעות קנולציה של הווריד הנבוב. משאבה פריסטלטית סטנדרטית מניעה את התמיסות המחוממות דרך הווריד הנבוב התחתון הצנתורי אל שארית הכבד, באמצעות זילוח מדרדר עם זרימה דרך הווריד הפורטלי (איור משלים S1). הפטוציטים מנותקים על ידי collagenases ומשוחררים מהקפסולה של Glisson. לאחר שטיפה ועיבוד זהיר של הפטוציטים קיימא על ידי בידוד הדרגתי באמצעות גישת צנטריפוגה במהירות נמוכה, ניתן להשתמש בהפטוציטים לכל ניתוח במורד הזרם.
Protocol
כל הניסויים בבעלי חיים נעשו בהתאם לתקנות הפדרליות השווייצריות לבעלי חיים ואושרו על ידי המשרד הווטרינרי של ציריך (n° 007/2017, 156/2019) תוך הבטחת טיפול בבני אדם. עכברי C57BL/6 זכרים בגילאי 10-12 שבועות הוחזקו במחזור יום/לילה של 12 שעות עם גישה חופשית למזון ומים. כל קבוצת ניסוי כללה שישה עד שמונה בעלי חיים. עיין בטבלת החומרים לקבלת פרטים הקשורים לכל החומרים, הציוד והריאגנטים המשמשים בפרוטוקול זה.
1. כריתת כבד חלקית בעכברים
- עבור כריתת כבד סטנדרטית (70%), לקשור ולכרות מחדש את האונה הצידית השמאלית, את החלק הימני של האונה החציונית ואת החלק השמאלי של האונה החציונית (איור 1B). לכריתת כבד ממושכת (86%)4, הסירו גם את האונות הקאודטיות ואת האונה הקדמית הימנית (איור 1C).
- הערה: כריתת כבד סטנדרטית היא הליך המשמש במחקר התחדשות הכבד במשך שנים רבות. פרוטוקולים עבור הליך זה זמינים3,17, כולל פרוטוקול בסיוע וידאו של מיטשל ווילנברינג 18. פרטים נוספים על הטכניקות המשמשות כאן לכריתת כבד ניתן למצוא בקובץ משלים 1.
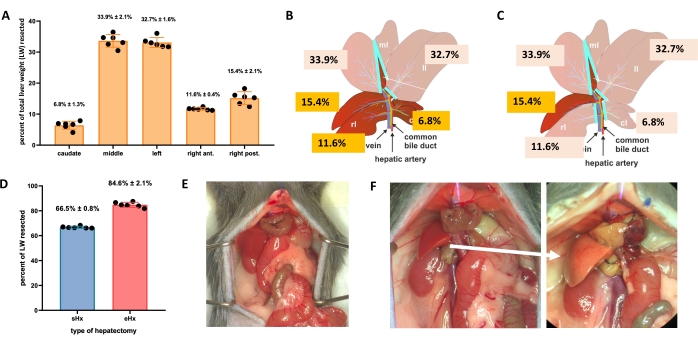
איור 1: כריתת כבד סטנדרטית (70%) ומורחבת (86%) בעכברים . (A) חמש אונות הכבד של העכבר ותרומתן בהתאמה למשקל הכבד הכולל. (B) המחשה סכמטית של 70% כריתת כבד בעכברים. האונות הכהות מייצגות את שארית הכבד העתידית. (C) המחשה סכמטית של 86%-כריתת כבד בעכברים. האונות הכהות מייצגות את שארית הכבד העתידית. (D) נפח מדויק של רקמה שנכרתה לאחר כריתת הכבד ב-70% ו-86%. (ה) בטן עכבר מיד לאחר 70%-כריתת הכבד; (F) בטן העכבר מיד (משמאל) ו-48 שעות (מימין) לאחר 86% כריתת כבד. שימו לב לצבע החיוור של השריד הסטאטוטי (חץ לבן). n = 6-7/קבוצה. קיצורים: sHx = כריתת כבד סטנדרטית; eHx = כריתת כבד מורחבת; LW = משקל הכבד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. הכנת פתרונות הזלוף
- הכינו את מאגרי הזילוח, העיכול והשימור (ראו טבלה 1).
- כוונן את רמת החומציות של כל תמיסות החיץ ב-37°C על-ידי הוספת נתרן הידרוקסידי (NaOH) או מימן כלורי (HCl) לפי הצורך. ה- pH האופטימלי עבור המאגרים הוא 7.4.
- הניחו את מאגר השימור ואת מדיום E של ויליאמס על קרח.
- הכינו את מאגר ציטומטריית הזרימה ואחסנו אותו על קרח.
טבלה 1: תמיסות ומאגרים המשמשים לעיכול וטיהור של הפטוציטים. אנא לחץ כאן כדי להוריד טבלה זו.
3. הכנת ציוד זילוח
- חממו את אמבט המים ל -42 מעלות צלזיוס והניחו את חיץ הזילוח (50 מ"ל) ואת חיץ העיכול (10-20 מ"ל) באמבט המים. עדיין אין להוסיף collagenase למאגר העיכול.
- הכינו את המשאבה הפריסטלטית והכניסו את הצינור. מערך הזילוח המלא מוצג באיור 2.
- חבר צינורית IV 26 G לקצה היציאה של הצינור באמצעות מחבר מנעול Luer. הכנס את קצה הכניסה של הצינור לצינור חיץ הזילוח שחומם מראש באמבט המים. שטפו את הצינור באתנול 70%, ואחריו 50 מ"ל נתרן כלורי סטרילי (NaCl 0.9%). הקפיצו את הצינור עם חיץ זילוח חם (מהירות משאבה של 3 מ"ל/דקה).
- הרגיעו את העכבר באמצעות הרדמה באינהלציה איזופלורנית (800 מ"ל/דקה O 2, 3%-5% איזופלורן לזירוזו-2% לתחזוקה במהלך ההליך). יש לטפל באיזופלורן מתחת למכסה המנוע של המעבדה ולספק אוורור הולם.
- יש לתת בופרנורפין תת עורית 30 דקות לפני הניתוח במינון של 0.1 מ"ג/ק"ג משקל גוף.
- כדי למנוע היפותרמיה, הניחו את העכבר המורדם על כרית חימום והניחו רקמת בד מגולגלת מתחת לבטן העליונה כדי להעלות את הכבד מעל האיברים האחרים ולהקל על הגישה לווריד הנבוב הנחות.
הערה: אין להשתמש ברקמה עבה מדי, שכן קימוט כלי הדם אפשרי ויעילות הזילוח תיפגע. - יש להוסיף משחת עיניים למניעת נזק לקרנית.
- לפני תחילת הניתוח, ודא כי בעל החיים מורדם כראוי על ידי בדיקת רפלקס נסיגה הדוושה (כרית כף רגל צביטה על שתי הרגליים האחוריות). במקרה של תגובה, יש לספק הרדמה נוספת ולבצע בדיקה חוזרת לפני תחילת ההליך.
- נקו את הבטן עם 70% אתנול.
- פתח מחדש את חתך קו האמצע על ידי חיתוך התפר ומשיכה עדינה של קצוות הפצע זה מזה. אם כריתת הכבד מבוגרת מ 24-48 שעות, להסיר את התפר לחתוך את העור עם מספריים.
- תקן תפר פוליפרופילן 5-0 לחזה, משוך אותו באופן גולגולתי וקבע אותו במצב זה. השתמש retractor או קליפסים פשוטים כדי לשמור על הבטן פתוחה. חלל הבטן צריך להיות חשוף ככל האפשר כדי לייעל את הגישה ואת הדמיה.
- הזיזו את המעיים ימינה באמצעות צמר גפן כדי לחשוף את הווריד הפורטלי ואת הווריד הנבוב. השתמש במטלית רטובה כדי לשמור על המעיים.
- הניחו חפץ כבד בגובה של כ-2 ס"מ (למשל, טבעת משקל מצופה סיליקון לצלוחיות נפחיות) בסמוך לרגליים האחוריות של העכבר (איור משלים S2A). הניחו את הצינורית עם צינורית 26 G IV המחוברת על החפץ ומקמו את המחט בזהירות על גבי הווריד הנבוב. התאימו את אורך הצינור.
- הכניסו את תמיסת ה-collagenase המוכנה לצינור חיץ העיכול שחומם מראש. הוסף 250 μL של תמיסת המניות ל 10 מ"ל של מאגר העיכול. להכין 10-20 מ"ל של חיץ העיכול לכל חיה. עבור בעלי חיים גדולים יותר או זילוח של כבדים שלמים, להכין עד 30 מ"ל של חיץ העיכול.
הערה: מומלץ להוסיף את תמיסת מלאי הקולגנאז למאגר העיכול המחומם כ-30 דקות לפני תחילת תהליך העיכול.
איור 2: סקירה כללית על מערך הזילוח. (A) שולחן ניתוחים עם הציוד הדרוש לזילוח. (B) החומרים הדרושים להכנת הכבד, כמו גם מיצוי הפטוציטים ובידודם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. קנולציה וזילוח
- כוונן את מהירות המשאבה ל-3 מ"ל/דקה והפעל את המשאבה. תנו למאגר הזילוח שחומם מראש להגיע למחט. יש להשליך את 2-3 מ"ל הראשונים של חיץ הזלוף.
- בצע קנולציה של הווריד הנבוב הנחות.
- בזמן שהחיץ עובר דרך המחט, הכנס את צינורית 26 G IV בזווית רדודה לתוך הווריד קאווה מתחת לכליה. ודא ששיפוע המחט מצביע כלפי מעלה.
- השתמש בצמר גפן כדי למשוך בעדינות את הווריד קאווה בקאודליות מתחת לאתר הניקוב, כך שהמתח שסופק מאפשר את החדרת הצינורית לווריד. חפש דם בתא הבזק של הצנתר כאשר המחט נכנסת לומן.
- מקדמים את המחט עוד 2-3 מ"מ כדי לוודא שגם קצה קטטר הפלסטיק נכנס לווריד.
- מחליקים את קטטר הפלסטיק מעל המחט ולתוך הווריד קאווה עוד 5 מ"מ. הסר את המחט לאט ובזהירות רבה.
הערה: תיקון הצינורית עם רצועה אינו מומלץ. שלב זה גוזל זמן מכיוון שיש לנתח תחילה את כלי השיט למטרה זו. אם הצינורית ממוקמת באופן רופף ונתמכת עם אובייקט, אין צורך בקיבוע נוסף (ראו הגדרת זילוח באיור משלים S2). כדי לייצב את אתר הקנולציה ולמנוע זרימה חוזרת, ניתן להוסיף טיפה אחת של n-butyl-cyanoacrylate מונומרי לאתר הקנולציה.
- כאשר הדם נושר מהצינורית, מלאו אותה בחיץ זילוח חם באמצעות מזרק.
- חבר מחדש את הצינורית לצינורית, שעדיין פועלת במהירות משאבה של 3 מ"ל/דקה. תנו למאגר הזילוח להיכנס לכבד.
- לאחר 2-3 שניות, חפשו כתמים לבנים הנוצרים בכבד ו/או התרחבות/נפיחות של הווריד הפורטלי, אשר מצביעים על כך שחיץ הזילוח זורם דרך הכבד ונכנס לאונות הכבד מהווריד המרכזי (איור 3).
- המתן עד שווריד הפורטל יתנפח באופן גלוי תוך 1-2 שניות לאחר הופעת כתמים לבנים על פני הכבד. חותכים את וריד השער עם מספריים רחוק ככל האפשר מן הילוס הכבד. השתמשו בתפס מיקרו כלי כדי לתייג (לא להסתיר) את אתר החיתוך (איור 3B).
הערה: זה מפשט את הערכת הזרימה דרך הכבד במהלך תהליך הזלוף. הכבד מתנקה מדם באופן מיידי והופך לצהוב-לבן תוך מספר שניות (איור 3C). חתך נוסף דרך העור בצד ימין של פתח הבטן מקל על יציאת הדם כמו גם על תמיסת הזלוף (איור 3B ואיור משלים S2B,C). - הגדל את הזרימה עד 4-7 מ"ל / דקה בהתאם למשקל החיה, גודל הכבד, ואת היקף כריתת כבד קודמת.
- מהדק את וריד הפורטל עם פינצטה או מהדק כלי הדם במשך 7-10 שניות. יש לוודא שלא עובר נוזל.
הערה: הכבד מתנפח באופן ניכר במהלך הידוק ונרגע עם שחרורו. זה חיוני כדי לשטוף את כל הכבד ולנקות אותו מכל הדם שנותר. - בצע מהדק שני לאחר כ -30 שניות וודא כי הכבד מתנפח ונרגע. ממשיכים עם שטיפת החיה עד שהחיץ הזורם מהווריד הפורטלי ברור, אבל לפחות למשך 3-4 דקות.
הערה: מהירות המשאבה תלויה בצינור וכן בגודל הכבד. זה חייב להיות מוערך בנפרד. - בשלב זה של ההליך, המתת חסד הייתה צריכה להתרחש משנית להמתת חסד. ודא כי זרימת הדם המערכתית נעצרה (ללא דופק או הבהוב של הלב). כדי להבטיח מוות, pneumothorax דו צדדי מבוצע בשלב זה של ההליך כשיטה פיזית משנית של המתת חסד.
הערה: הפחיתו מעט את מהירות המשאבה אם זרימת הדם המערכתית נעצרה (ללא דופק או הבהוב של הלב).
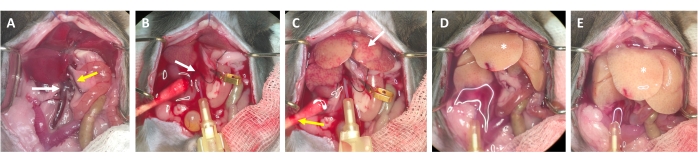
איור 3: תהליך זילוח מקנולציה לעיכול. (A) אנטומיה של כבד העכבר עם הווריד הנבוב התחתון (חץ לבן) ווריד השער (חץ צהוב). (B) קנולציה של הווריד הנבוב הנחות. הצינורית מאובטחת באמצעות ליגטורה (חץ לבן), ומיקום היציאה דרך וריד השער הפתוח מסומן (לא מהודק) במהדק כלי מיקרו. (C) שימו לב להופעתם של מבנים מטושטשים לפני שמאגר הזילוח פינה את הכבד מכל הדם שנותר (חץ לבן). העור חתוך (חץ צהוב) וממקלון צמר גפן מונח כדי להבטיח ניקוז של דם ונוזל זילוח. הידוק לסירוגין יכול להתבצע עם מהדק כלי דם או פינצטה. (D) יש לנקות את הכבד מכל הדם (*). לאחר שמאגר העיכול המכיל collagenase נכנס לכבד, הוא כבר לא יירגע לאחר הידוק ואונות הכבד יגדלו. (E) לאחר זמן מה ניתן להבחין במראה מבעבע על פני הכבד (*). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. עיכול
- השהה את משאבת הזילוח והעבר במהירות את צינור הכניסה ממאגר הזילוח למאגר העיכול המחומם מראש. הפעל מחדש את המשאבה.
- לפני שמאגר העיכול מגיע לכבד, מהדקים את וריד הפורטל פעם נוספת למשך 3-4 שניות. ודא כי הכבד מרגיע עם שחרורו של המהדק ואת נוזל זילוח נשאר צלול.
הערה: מאגר העיכול מכיל פנול אדום וניתן להבחין בו בקלות ממאגר הזילוח השקוף. זה מאפשר מעקב קל בתוך הצינור. - ברגע שמאגר העיכול הגיע לכבד, הדקו שוב את וריד הפורטל עם קליפ כלי מיקרו.
הערה: בעת הידוק הכבד מתנפח אך אינו נרגע עם שחרור המהדק. זה נורמלי. - כדי להקל על תהליך העיכול, סגור את הווריד הנבוב העליון עם מהדק כלי דם ישירות מתחת לסרעפת כדי לאפשר למאגר העיכול לעבור מהווריד הנבוב התחתון לכבד לזרם החוצה דרך וריד הפורטל הפתוח.
הערה: הידוק זה מבטיח עקיפת מחזור הדם המערכתי ומניעת מגע מיותר עם שאריות מרכיבי דם / מעכבים. שלב זה הוא אופציונלי, מכיוון שקשה להתקרב לווריד הנבוב העליון מאחורי רקמת הכבד המוגדלת לאחר ניתוח דמה, אך הגישה הרבה יותר קלה בעכברים שעברו כריתת כבד. - יש לעכל במשך כ-4 דקות בקצב זרימה של 5 מ"ל/דקה. עם התקדמות העיכול, חפשו סימנים לכך שהכבד מתחיל להתנפח וחלקים קטנים ושקופים/שקופים על פני השטח של הכבד. יתר על כן, שימו לב שהכבד מקבל מרקם של פיסת בד רטובה ונראה כמעט רטוב (איור 3E). בדקו את העקביות על ידי נגיעה זהירה עם צמר גפן לח.
- המשך עם זילוח עד הבדל ניכר במרקם פני השטח של הכבד ניתן לראות. שימו לב שהכבד מקבל צבע בהיר מאוד ומראה מבעבע (איור 3E), והקפסולה של הגליסון (כלומר, שק הכבד) נפרדת מהפרנכימה הזו. עצור את תהליך העיכול ברגע שהכבד רכש תכונות אלה, כמו עיכול יתר יכול לפגוע hepatocytes. הסר את המחט לפני שהאוויר נכנס לכבד.
הערה: בדרך כלל יש צורך ב-10-20 מ"ל של חיץ עיכול כדי להגיע לעיכול מספיק. זה תלוי בגודל החיה, היקף כריתת הכבד, הגדרת הצינורות, ואיכות תמיסת הקולגנאז. במידת הצורך, הגדילו את זמן הזילוח במקום את מהירות הזילוח. לחץ רב מדי במערכת כלי הדם עלול לגרום לכבד להתפוצץ ונוזל הזילוח / העיכול עלול ללכת לאיבוד לחלל הרטרופריטוניאלי.
6. הכנת הכבד
- הסר את הכבד בעדינות מחלל הבטן. היזהר מאוד מכיוון שהוא עכשיו דקיק ושברירי מאוד.
- אחזו ברקמת החיבור המרכזית בין האונות באמצעות מלקחיים והרימו אותה מעט כלפי מעלה, תוך שימוש בה כנקודת עיגון.
- חתכו את כל חיבורי הכבד לאיברים אחרים, הסירו את כיס המרה והניחו את הכבד במאגר השימור הקר כקרח.
הערה: באופן אידיאלי, מיצוי hepatocyte ועיבוד נוסף צריך להתרחש באופן מיידי כדי לשמור על הכדאיות של hepatocytes. עם זאת, במידת הצורך, הכבד יכול להיות מאוחסן לזמן קצר ב 4 ° C (למשל, להובלה). עיכוב זה לא יעלה על 30-40 דקות.
7. מיצוי הפטוציטים
- מעבירים את הכבד לצלחת פטרי בקוטר 10 ס"מ ומוסיפים 10 מ"ל מדיום E קר כקרח.
- קרעו את הקפסולה של גליסון עם פינצטה עדינה בכמה מקומות לאורך פני הכבד. אחזו חלק מרכזי (למשל, רקמת חיבור בהילוס הכבד) עם שני זוגות פינצטה ומשכו אותם לאט לאט זה מזה, מה שמאפשר לקפסולה להיקרע מבלי לפגוע בהפטוציטים. שחררו את התאים על-ידי ניעור עדין של הקפסולה (איור משלים S3).
הערה: באופן אידיאלי, הכבד נקרע בקלות ומשחרר את התאים. אין להפעיל כוח. מגרד תאים יכול לעזור להסיר לחלוטין את כל התאים ולהגדיל את תפוקת התא. אין לחתוך את הכבד לחתיכות עם מספריים. - סנן 5 מ"ל של עיסת הכבד דרך מסננת תאים 100 מיקרומטר לתוך צינור 50 מ"ל. שטפו את הפילטר ב-10 מ"ל של מדיום טרי קר כקרח. מסננים את 5 מ"ל הנותרים של עיסת התא דרך מסננת התא.
הערה: השתמשו בפיפט סרולוגי של 25 מ"ל כדי להעביר את מוך הכבד עם הפטוציטים המנותקים (איור 4A). פיפטות קטנות יותר עם פתחים קטנים יותר מגבירות את לחץ הגזירה ופוגעות באופן בלתי הפיך בהפטוציטים. - הוסף סך של 30 מ"ל של מדיום קר כדי לשטוף את צלחת פטרי, לסנן אותו, ולהוסיף את התרחיף לצינור 50 מ"ל עד שהוא מלא. כל התאים המבודדים נמצאים כעת בתרחיף (איור 4B).
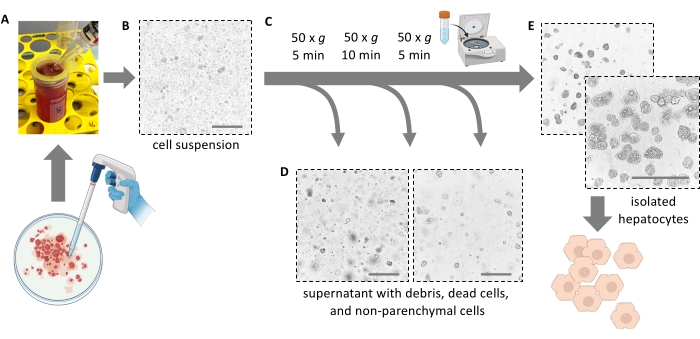
איור 4: טיהור באמצעות צנטריפוגה עדינה . (A) הומוגנט בכבד שנותר לאחר שלב המיצוי. (B) תצוגה מיקרוסקופית (הגדלה של פי 20) של ההומוגנאט; שימו לב לזיהום המסומן בפסולת. (C) שלבי צנטריפוגות טיהור ו-(D) תצוגות מיקרוסקופיות של הסופרנאטנטים שיש להשליך. (E) מבט מיקרוסקופי על מקטע הפטוציטים המטוהרים. פסי קנה מידה = 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
8. בידוד הפטוציטים
- סחרור ב 50 × גרם במשך 5 דקות ב 4 ° C (האצה הנמוכה ביותר והבלם הנמוך ביותר האפשרי).
הערה: הפטוציטים צפופים יותר מתאי כבד שאינם פרנכימליים. בשל כוח הצנטריפוגה הנמוך, רק הפטוציטים הם כדורים, בעוד תאים אחרים (למשל, תאים חיסוניים, אריתרוציטים, ותאים סינוסואידים) נשארים supernatant. - שאפו את רוב הסופרנטנט, והותירו 1 מ"ל כדי להשעות מחדש את התאים על ידי ערבול עדין של הצינור.
- הוסף 40 מ"ל של מדיום E קר של ויליאמס וסחרר שוב ב 50 × גרם במשך 10 דקות ב 4 ° C (האצה נמוכה, בלימה נמוכה) כדי להסיר עוד יותר הפטוציטים מתים פסולת תאים ו pellet קיימא ו hepatocytes קיימא ושומן (איור 4C).
- להשליך את רוב supernatant, משאיר 1 מ"ל כדי להשעות מחדש את התאים על ידי ערבול הצינור.
- הוסף 40 מ"ל של מדיום E קר של ויליאמס וסחרר שוב ב 50 × גרם במשך 5 דקות ב 4 ° C (האצה נמוכה, בלימה נמוכה).
- שאפו את רוב הסופרנטנט, והותירו 1 מ"ל כדי להשעות מחדש את התאים על ידי ערבול עדין של הצינור.
הערה: אל תפסיק תהליך זה עד לתיקון או ניתוח תאים. הפטוציטים שבירים מאוד וכל עיכוב בתהליך הזילוח, העיכול והטיהור עלול לפגוע בתאים. - קבע את ריכוז התא הסופי לאחר הוספת כחול טריפאן, באמצעות תא ספירה משופר של נויבאואר.
הערה: רוב הפסולת והתאים שאינם פרנכימליים הוסרו כעת, וכתוצאה מכך גלולה נקייה של כ 10-15 × 106 hepatocytes שנותרו לאחר 70%-hepatectomy. - בהתאם לריכוז הרצוי, מוסיפים עוד מדיום קר כקרח. השתמש בתרחיף תאי הפטוציטים לכל ניתוח במורד הזרם או התחל תרבית תאים ראשונית.
הערה: בשלב זה, רק מעט תאים חיסוניים ולא פרנכימליים (<5%) נשארים בתרחיף. אם יש צורך בטיהור נוסף, בצע בחירה שלילית של תאי CD31+ ו- CD45+ על ידי מיון תאים המופעלים באמצעות מגנטיות או פלואורסצנטיות (MACS/FACS). עד כה, אין סמן פני שטח אמין וחזק עבור תאים parenchymal הכבד.
9. הכנת הפטוציטים המבודדים לציטומטריית זרימה
- צנטריפוגה את hepatocytes ב 100 × גרם במשך 5 דקות.
- השליכו את הסופרנאטנט והוסיפו את הכמות הרצויה של חיץ ציטומטריית זרימה, בהתאם לריכוז תרחיף התא.
- הוסף 1 מ"ל של תרחיף התא בצינור ציטומטריית זרימה. צנטריפוגה למשך 5 דקות ב 100 × גרם ולהשליך את supernatant.
- הוסיפו 100-200 μL של צבע הכדאיות הירוק המדולל Alexa Fluor 488 Zombie (ריכוז 1:400) לתאים ונערו אותם בעדינות. בזהירות resuspended hepatocytes על ידי ניעור ידני או באמצעות מערבל מערבולת במהירות נמוכה (מקסימום 2-3) במשך 2 שניות.
הערה: אין להשתמש בקצוות פיפטה קטנים כדי להשעות מחדש את התאים. הם שבירים מאוד ומתח הגזירה המופעל גורם נזק ומקטין את יכולת הקיום של התא. אם לא ניתן להימנע מפיפטים, השתמשו בפיפטה של 1,000 מיקרוליטר לאחר חיתוך החלק הקטן ביותר מהקצה כדי להגדיל את הקוטר ופיפטה את התאים לאט מאוד. - הניחו את הצינורות על קרח או אחסנו אותם בטמפרטורת החדר, בהתאם להכתמה הרצויה. לדגור על התאים במשך 20-30 דקות בחושך.
- הוסף 2 מ"ל של חיץ ציטומטריה זרימה ולשטוף את התאים 3x. צנטריפוגה את התאים לאחר כל שלב כביסה ב 100 × גרם במשך 5 דקות.
- הוסף 2 מ"ל של חיץ קיבוע (1:1, 4% PFA ו- PBS). בזהירות resuspended hepatocytes על ידי ניעור ידני או באמצעות מערבל מערבולת במהירות נמוכה (מקסימום 2-3) במשך 2 שניות.
- תקן את התאים למשך 30 דקות.
- צנטריפוגה ב 100 × גרם למשך 5 דקות נוספות, להשליך את supernatant, ולהוסיף חיץ ציטומטריה זרימה.
הערה: ניתן לאחסן תאים במאגר ציטומטריית זרימה לפני ניתוח עד 72 שעות לאחר הבידוד.
10. ניתוח hepatocytes עם cytometry זרימה
- נתח את הפטוציטים באמצעות ממיין תאים המופעל על ידי פלואורסצנטיות.
הערה: שקול את הגודל הגדול יחסית של hepatocytes ולהתאים את המתחים. התחל עם מתח נמוך ואל תעלה על 350 V עבור פיזור קדימה (FSC) ו- 220 V עבור פיזור צדדי (SSC).- התאם את המתחים עבור FSC ו- SSC לגודל הגדול המשוער של התאים. זהו את אוכלוסיית הפטוציטים ותיעדו את כל האירועים באמצעות SSC-A ו-FSC-A (איור 5A).
- שימו לב שפסולת ותאים לא פרנכימליים מוצגים בפינה השמאלית התחתונה של תרשים צפיפות FSC לעומת SSC ואינם נכללים (איור 5A).
- מכיוון שתאים כפולים יכולים להשפיע על הניתוח, בנו תרשים צפיפות של גובה פיזור צדדי (SSC-H) לעומת שטח פיזור צדדי (SSC-A) כדי לא לכלול כפילויות, כפי שמוצג באיור 5B.
- בחרו את אוכלוסיית ההפטוציטים הסופית על-ידי התאמת תאי CD31 ( סמן אנדותל) ו-CD45 ( סמן חיסוני) (איור 5C).
תוצאות
TRAS מגיע לשיאו ב -16 שעות לאחר כריתת הכבד ונעלם בהדרגה 32-48 שעות לאחר כריתת כבד סטנדרטית, אך נמשך מעבר ל -48 שעות לאחר כריתת כבד ממושכת. מבחינה מקרוסקופית, TRAS נראה בקלות כגוון עור חיוור של שאריות הכבד (איור 1F), וניתן לצפות בו בעכברים שעברו כריתת כבד בין 16 שעות ל-48 שעות לאחר ניתוח.
<...Discussion
הפרוטוקול שפורסם מספק שיטה אמינה ופשוטה לבודד תפוקה גבוהה של הפטוציטים מורין רגילים וסטאטוטיים עבור ניתוח חד-תאי במורד הזרם או ניתוח בתפזורת של תאים לאחר מיון FACS. היתרון המובהק על פני טיהור שיפוע צפיפות הוא שלתכולת השומנים התאית אין למעשה השפעה על התפוקה האפקטיבית של הפטוציטים. לפיכך, הח?...
Disclosures
המחברים מצהירים כי אין להם אינטרסים מתחרים.
Acknowledgements
מחקר זה נתמך על ידי הקרן הלאומית השווייצרית (מענק פרויקט 310030_189262).
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Alexa Fluor 488 Zombie green | BioLegend | 423111 | Amine-reactive viability dye |
| Attane Isoflurane ad us. vet. 99.9% | Provet AG | QN01AB06 | CAUTION: needs ventilation |
| EDTA solution | Sigma-Aldrich | E8008-100ML | - |
| Ethanol | Sigma-Aldrich | V001229 | Dilute with water to 70% |
| Fetal bovine serum (FCS) | Gibco | A5256701 | - |
| Hanks' Balanced Salt Solution (HBSS), Ca2+, Mg2+, phenol red | Sigma-Aldrich | H9269-6x600ML | For digestion/preservation |
| Hanks' Balanced Salt solution (HBSS), w/o Ca2+, w/o Mg2+, no phenol red | Sigma-Aldrich | H6648-6x500ML | For perfusion buffer |
| HEPES solution, 1 M | Sigma-Aldrich | 83264-100ML-F | - |
| Histoacryl tissue adhesive (butyl-2-cyanoacrylate) | B. Braun | 1050052 | For stabilization of cannulation site |
| Hoechst 33258 Staining Dye Solution | Abcam | ab228550 | - |
| Liberase Research Grade | Roche | 5401119001 | Lyophilized collagenases I/II |
| NaCl 0.9% 500 mL Ecotainer | B. Braun | 123 | - |
| Paralube Vet Ointment | Dechra | 17033-211-38 | - |
| Phosphate buffered saline (PBS) | Gibco | A1286301 | - |
| Sudan IV – Lipid staining | Sigma-Aldrich | V001423 | - |
| Temgesic (Buprenorphine hydrochloride), Solution for Injection 0.3 mg/mL | Indivior Europe Ltd. | 345928 | Narcotics. Store securely. |
| Trypan blue, 0.4%, sterile-filtered | Sigma-Aldrich | T8154 | For cell counting |
| Williams’ Medium E | Sigma-Aldrich | W4128-500ML | - |
| Materials | |||
| 25 mL serological pipette, Greiner Cellstar | Merck | P7865 | - |
| 50 mL Falcon tubes | TPP | - | - |
| BD Neoflon, Pro IV Catheter 26 G | BD Falcon | 391349 | - |
| Cell scraper, rotating blade width 25 mm | TPP | 99004 | - |
| Falcon Cell Strainer 100 µm Nylon | BD Falcon | 352360 | - |
| Fenestrated sterile surgical drape | - | - | Reusable cloth material |
| Filling nozzle for size 16# tubing (ID 3.1 mm) | Drifton | FILLINGNOZZLE#16 | To go into the tubes |
| Flow cytometry tubes, 5 mL | BD Falcon | 352008 | - |
| Male Luer to Barb, Tubing ID 3.2 mm | Drifton | LM41 | Connection tube to syringe |
| Petri dishes, 96 x 21 mm | TPP | 93100 | - |
| Prolene 5-0 | Ethicon | 8614H | To retract the sternum |
| Prolene 6-0 | Ethicon | 8695H | For skin suture |
| Prolene 8-0 | Ethicon | EH7470E | Ligature gall bladder |
| Tube 16#, WT 1.6 mm, ID 3.2 mm, OD 6.4 mm | Drifton | SC0374T | Perfusion tube |
| Equipment | |||
| BD LSRFortessa Cell Analyzer Flow Cytometer | BD | - | - |
| Isis rodent shaver | Aesculap | GT421 | - |
| Isofluran station | Provet | - | - |
| Low-speed centrifuge – Scanspeed 416 | Labogene | - | - |
| Neubauer-improved counting chamber | Marienfeld | - | - |
| Oxygen concentrator – EverFlo | Philips | 1020007 | 0 – 5 L/min |
| Pipetboy – Pipettor Turbo-Fix | TPP | 94700 | - |
| Shenchen perfusion pump – YZ1515x | Shenchen | YZ1515x | - |
| Surgical microscope – SZX9 | Olympus | - | - |
| ThermoLux warming mat | Thermo Lux | - | - |
| Vortex Genie 2, 2700 UpM | NeoLab | 7-0092 | - |
| Water bath – Precision GP 02 | Thermo scientific | - | Adjust to 42 °C |
References
- Higgins, G., Anderson, R. Experimental pathology of liver. I. Restoration of liver of white rat following partial surgical removal. Archives of Pathology & Laboratory Medicine. 12, 186-202 (1931).
- Taub, R. Liver regeneration: from myth to mechanism. Nature Reviews Molecular Cell Biology. 5 (10), 836-847 (2004).
- Nevzorova, Y. A., Tolba, R., Trautwein, C., Liedtke, C. Partial hepatectomy in mice. Lab Animal. 49, 81-88 (2015).
- Lehmann, K., et al. Liver failure after extended hepatectomy in mice is mediated by a p21-dependent barrier to liver regeneration. Gastroenterology. 143 (6), 1609-1619 (2012).
- Makino, H., et al. A good model of hepatic failure after excessive hepatectomy in mice. Journal of Surgical Research. 127 (2), 171-176 (2005).
- Lizardo Thiebaud, M. J., Cervantes-Alvarez, E., Navarro-Alvarez, N., Gayam, V., Engin, O. . Liver Pathology. , (2019).
- Charni-Natan, M., Goldstein, I. Protocol for primary mouse hepatocyte isolation. STAR Protocols. 1 (2), 100086 (2020).
- Smedsrød, B., Pertoft, H. Preparation of pure hepatocytes and reticuloendothelial cells in high yield from a single rat liver by means of Percoll centrifugation and selective adherence. Journal of Leukocyte Biology. 38 (2), 213-230 (1985).
- Mederacke, I., Dapito, D. H., Affò, S., Uchinami, H., Schwabe, R. F. High-yield and high-purity isolation of hepatic stellate cells from normal and fibrotic mouse livers. Nature Protocols. 10 (2), 305-315 (2015).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. Journal of Cell Biology. 43 (3), 506-520 (1969).
- Seglen, P. O. Preparation of rat liver cells. I. Effect of Ca 2+ on enzymatic dispersion of isolated, perfused liver. Experimental Cell Research. 74 (2), 450-454 (1972).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Trotter, N. L. A fine structure study of lipid in mouse liver regenerating after partial hepatectomy. Journal of Cell Biology. 21 (2), 233-244 (1964).
- Kachaylo, E., et al. PTEN down-regulation promotes β-oxidation to fuel hypertrophic liver growth after hepatectomy in mice. Hepatology. 66 (3), 908-921 (2017).
- Jung, Y., Zhao, M., Svensson, K. J. Isolation, culture, and functional analysis of hepatocytes from mice with fatty liver disease. STAR Protocols. 1 (3), 100222 (2020).
- Dold, S., et al. Portal hyperperfusion after extended hepatectomy does not induce a hepatic arterial buffer response (HABR) but impairs mitochondrial redox state and hepatocellular oxygenation. PLoS One. 10 (11), 0141877 (2015).
- Boyce, S., Harrison, D. A detailed methodology of partial hepatectomy in the mouse. Laboratory Animals. 37 (11), 529-532 (2008).
- Mitchell, C., Willenbring, H. A reproducible and well-tolerated method for 2/3 partial hepatectomy in mice. Nature Protocols. 3 (7), 1167-1170 (2008).
- Chen, T., Oh, S., Gregory, S., Shen, X., Diehl, A. M. Single-cell omics analysis reveals functional diversification of hepatocytes during liver regeneration. JCI Insight. 5 (22), (2020).
- Chembazhi, U. V., Bangru, S., Hernaez, M., Kalsotra, A. Cellular plasticity balances the metabolic and proliferation dynamics of a regenerating liver. Genome Research. 31 (4), 576-591 (2021).
- Fiegel, H. C., Kaufmann, P. M., Kneser, U., Kluth, D., Rogiers, X. Priming of hepatocytes for cell culture by partial hepatectomy prior to cell isolation. Journal of Tissue Engineering. 6 (6), 619-626 (2000).
- Roche, . Liberase TM Research Grade. , (2020).
- Giugliano, S., et al. Hepatitis C virus infection induces autocrine interferon signaling by human liver endothelial cells and release of exosomes, which inhibits viral replication. Gastroenterology. 148 (2), 392-402 (2015).
- Shetty, S., et al. Common lymphatic endothelial and vascular endothelial receptor-1 mediates the transmigration of regulatory T cells across human hepatic sinusoidal endothelium. The Journal of Immunology. 186 (7), 4147-4155 (2011).
- Edwards, S., Lalor, P. F., Nash, G. B., Rainger, G. E., Adams, D. H. Lymphocyte traffic through sinusoidal endothelial cells is regulated by hepatocytes. Hepatology. 41 (3), 451-459 (2005).
- Helling, T. S. Liver failure following partial hepatectomy. HPB. 8 (3), 165-174 (2006).
- Saran, U., Humar, B., Kolly, P., Dufour, J. F. Hepatocellular carcinoma and lifestyles. Journal of Hepatology. 64 (1), 203-214 (2016).
- Park, W. Y., et al. Sugar-sweetened beverage, diet soda, and nonalcoholic fatty liver disease over 6 years: the Framingham Heart Study. Clinical Gastroenteroly and Hepatology. , (2021).
- Pocha, C., Kolly, P., Dufour, J. F. Nonalcoholic fatty liver disease-related hepatocellular carcinoma: a problem of growing magnitude. Seminars in Liver Disease. 35 (3), 304-317 (2015).
- Roeb, E. Excess body weight and metabolic (dysfunction)-associated fatty liver disease (MAFLD). Visceral Medicine. 37 (4), 273-280 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved