Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Blutsenkungsgeschwindigkeit: Eine physikgetriebene Charakterisierung im medizinischen Kontext
In diesem Artikel
Zusammenfassung
Die Blutsenkungsgeschwindigkeit (BSG) ist ein physikalischer Parameter, der häufig bei routinemäßigen Gesundheitsuntersuchungen und medizinischen Diagnosen verwendet wird. Vor kurzem wurde ein theoretisches Modell entwickelt, das es ermöglicht, physikalisch bedeutsame Parameter aus der gesamten Sedimentationskurve zu extrahieren, basierend auf modernen kolloidalen Erkenntnissen. Hier stellen wir ein Protokoll vor, um den ESR im Laufe der Zeit automatisch zu erfassen und die Parameter dieses aktuellen Modells aus dieser automatisierten Datenerfassung zu extrahieren. Diese verfeinerten Parameter dürften auch die medizinische Aussage verbessern.
Zusammenfassung
Die Blutsenkungsgeschwindigkeit (BSG) der Erythrozyten (oder roten Blutkörperchen) ist ein physikalisch abgeleiteter Parameter des Blutes, der häufig bei routinemäßigen Gesundheitsuntersuchungen und medizinischen Diagnosen verwendet wird. So wird beispielsweise bei einer Entzündung aufgrund des damit verbundenen Anstiegs von Fibrinogen und anderen Plasmaproteinen ein höherer BSG beobachtet. Es wurde angenommen, dass dieser Anstieg auf die Bildung größerer Aggregate roter Blutkörperchen (RBCs) zurückzuführen ist, die durch den Anstieg des Fibrinogens verursacht werden. In der Tat ist Fibrinogen eine wirkstofffördernde Aggregation von Erythrozyten und im Stokes-Regime, von der angenommen wird, dass sie in Blut beobachtet wird, sedimentieren größere Aggregate schneller. Alle Modelle von ESR-Messungen, die auf dieser Hypothese basieren, erfordern jedoch weitere spezifische physikalische Annahmen, die in keinem anderen System erforderlich sind. Darüber hinaus haben moderne Studien auf dem Gebiet kolloidaler Suspensionen festgestellt, dass attraktive Partikel perkolierende Aggregate bilden (d.h. Aggregate, die so breit wie der Behälter sind). Auf die Sedimentation dieser Kolloide folgt dann ein sogenannter "kolloidaler Gelkollaps". Kürzlich wurde gezeigt, dass Erythrozyten tatsächlich dem gleichen Verhalten folgen. Diese Hypothese erlaubt es auch, die Sedimentationskurve von Erythrozyten effizient und analytisch zu modellieren, aus denen robuste und physikalisch aussagekräftige Deskriptoren extrahiert werden können. Dieses Manuskript beschreibt, wie eine solche Analyse durchgeführt wird, und diskutiert die Vorteile dieses Ansatzes.
Einleitung
Die Blutsenkungsgeschwindigkeit (BSG) ist ein medizinisches klinisches In-vitro-Instrument, das im zwanzigsten Jahrhundert offiziell in der evidenzbasierten Medizin eingeführt wurde 1,2,3,4. Er wird derzeit weltweit als unspezifischer Entzündungstest oder zur Überwachung der Entwicklung bestimmter Erkrankungen eingesetzt 5,6,7,8. Dies ist vor allem auf einen Anstieg der Fibrinogenkonzentration, aber auch in anderen Plasmabestandteilen wie IgM 1,9,10,11 zurückzuführen. Nach dem aktuellen Westergren-Standardprotokoll werden ESR-Werte als Messung der zellfreien Plasmaschicht zu einem bestimmten Zeitpunkt (30 min oder 1 h) nach dem Verlassen eines vertikalen Röhrchens mit einer typischen Größe von 20 cm vertikal im Ruhezustand angegeben12. Diese Messmethode steht jedoch in der Kritik, da qualitativ unterschiedliche Stadien im Sedimentationsprozess berichtet wurden, einschließlich einer Verzögerung vor Erreichen der maximalen Setzgeschwindigkeit13. Diese Verzögerung dauert bei etwa der Hälfte der gesunden Proben mehr als 1 h14. Die Geschwindigkeit während dieser Phase gehorcht einer anderen Skalierung als während der zweiten, schnelleren Phase der Sedimentation15. Durch die Beschränkung der Ablesung auf die durchschnittliche Absetzgeschwindigkeit während der ersten Stunde wird dann eine unterschiedliche Mischung verschiedener Bluteigenschaften zwischen verschiedenen Individuen verglichen.
Darüber hinaus wurde kürzlich gezeigt, dass die üblichen theoretischen Überlegungen hinter diesem Protokoll falsch waren16,17,18. Bei physiologischem Hämatokrit (über ca. 25%) sedimentieren die roten Blutkörperchen (RBCs) nicht als separate Aggregate, sondern als kontinuierliches, sogenanntes perkolierendes Netzwerk von Erythrozyten 17,18, das einem anderen Satz physikalischer Gleichungen gehorcht als die üblicherweise erwähnte Stokes-Sedimentation 16,17. Es konnte gezeigt werden, dass die Betrachtung einer physikalischen Beschreibung, die auf den zeitaufgelösten Messungen der Sedimentation (ganze Kurve) basiert, in einigen neuen medizinischen Kontexten robuster war19,20. Darüber hinaus könnten diese Messungen verwendet werden, um die physikalischen Mechanismen zu beleuchten, die die BSG bei Pathologien verändern, bei denen die Zellform verändert ist19,20. Darüber hinaus kann eine langsame BSG eine nützliche medizinische Interpretation haben, wie die Messungen einer Kohorte von Patienten mit Neuroacanthozytose-Syndromzeigen 19,20. Dieser Artikel gibt einen Überblick darüber, wie die Messung physikalisch sinnvoller Parameter auf der Grundlage der gesamten ESR-Kinetik praktisch implementiert werden kann. Genauer gesagt extrahiert die hier vorgestellte Methode die maximale Sedimentationsgeschwindigkeit Um, deren Wert korrigiert werden kann, um den Effekt des Hämatokrit des Donorszu berücksichtigen 16,17. Dieser Parameter ist genauer und damit zuverlässiger als die herkömmliche Messung16,17,19,20.
Darüber hinaus ist es in der Grundlagenforschung interessant, den Einfluss des Hämatokrits auf den BSGauszuschließen 21,22,23 oder die Rolle der Erythrozyten bei einem modifizierten BSG zu untersuchen, anstatt den Entzündungszustand eines bestimmten Patienten zu überwachen 19,20,24,25 zwischen verschiedenen Spendern. Es kann sinnvoll sein, Proben zu vergleichen, bei denen es sich nicht direkt um Vollblutproben von Patienten handelt. Daher könnte die Resuspendierung von Erythrozyten mit einem kontrollierten Hämatokrit im autologen Plasma oder in einem Plasmasubstituenten als erster Schritt der BSG-Messung verwendet werden. Beispielsweise erzeugen Lösungen von Dextran 70 kDa mit einer Konzentration von 55 mg/ml in phosphatgepufferter Kochsalzlösung (PBS) einen Sedimentationsbereich innerhalb des Kontrollbereichs für gesunde Zellen19. Dieses Manuskript zeigt auch, wie solche Schritte durchgeführt werden sollten und dass die vorgestellte Analyse auch in diesen Fällen relevant ist.
Protokoll
Die Blutentnahme und die Experimente wurden von der Ärztekammer des Saarlandes, ethics votum 51/18, genehmigt und nach Einholung der Einverständniserklärung von Helsinki durchgeführt. Standardmessungen sollten mit Ethylendiamintetraessigsäure (EDTA)-antikoaguliertem Blut (Standard-EDTA-Konzentration von 1,6 mg/ml Blut, europäische Norm NF EN ISO 6710) in Westergren-Röhrchen durchgeführt werden. Das Volumen, das zum Befüllen der Westergren-Röhre erforderlich ist, hängt vom Hersteller ab (da die unteren Teile manchmal ein breiteres Reservoir enthalten). Das Volumen sollte etwa 1 ml Vollblut und 800 μl für die in der Materialtabelle angegebenen Röhrchen betragen. Die unten beschriebene Methode ist jedoch unabhängig von der spezifischen Suspensions- und Behälterform gültig, solange der Hämatokrit der untersuchten Proben höher als 25 % ist16. Volumina, Behälter, Suspensionsmedium und Additive sollten daher entsprechend den spezifischen Zielen der durchgeführten Forschung ausgewählt werden.
1. Experimente und Messungen
Anmerkungen: Notieren Sie die Sedimentationsgeschwindigkeit der Probe jede Minute.
- Probenvorbereitung (falls erforderlich): Wenn ein Kontrollhämatokrit oder eine Suspensionsflüssigkeit erforderlich ist, beginnen Sie mit dem Waschen der Zellen und der Vorbereitung der Proben (als Beispiel zeigen wir, wie Proben mit unterschiedlichen Fibrinogengehalten durch Mischen von autologem Serum und Plasma hergestellt werden). Serum kann in der Tat als fibrinogenfreies Plasma26,27 angenähert werden und kann verwendet werden, um die Aggregation von Erythrozyten unter ansonsten physiologischen Bedingungen zu verringern. Um mehrere Proben vorzubereiten, wird das Blut in Standard-EDTA-Röhrchen von 9 ml und das Serum in Standard-Serumröhrchen (mit Siliziumdioxidkügelchen als Gerinnungsaktivatoren) von 9 ml gesammelt.
- Zentrifugieren Sie die Blutproben (d. h. 9 ml Standard-EDTA- und Serumröhrchen im ausgewählten Beispiel) bei 3.000 x g für mindestens 7 Minuten, um eine optimale Verdichtung der verpackten Erythrozyten zu gewährleisten. Ersetzen Sie den Überstand durch PBS oder die gewünschte Suspensionsflüssigkeit, wenn eine ausreichende Menge vorhanden ist. Wenn es lediglich erforderlich ist, den Hämatokrit im autologen Plasma zu kontrollieren, fahren Sie direkt mit Schritt 1.1.3 fort. Andernfalls nach Einschluss des Überstands zum Waschen vorsichtig mischen.
- Wiederholen Sie den Vorgang dreimal. Führen Sie die letzte Wäsche in jedem Fall mit der gewünschten Suspensionsflüssigkeit durch.
- Im gewählten Beispiel werden Mischungen aus Eigenplasma und Serum mit bestimmten Anteilen (z. B. 25 %/75 %, 50 %/50 % oder 75 %/25 % des Plasma-Serum-Volumenanteils) hergestellt. Wenn Sie beispielsweise 2,5 ml des 25%/75%igen Plasma-Serum-Gemisches zubereiten, fügen Sie 0,625 ml Plasma zu 1,875 ml Serum hinzu.
- Extrahieren Sie das erforderliche Volumen der gepackten Zellen und suspendieren Sie es in der gewünschten Flüssigkeit. Verarbeiten Sie die gepackten Zellen als hochviskose Flüssigkeit (unter Verwendung von Standard-Vorpipettieren und/oder Rückwärtspipettieren oder einer Verdrängungspipette28). Im gewählten Beispiel werden für eine 4-ml-Probe bei einem Hämatokrit von 45 % 1,8 ml gepackte Zellen innerhalb von 2,2 ml des Plasma-Serum-Gemisches suspendiert.
- Wenn der Hämatokrit der Probe nicht kontrolliert wird, wird er durch Hochgeschwindigkeits-Mikrozentrifugation bestimmt (andere Standardmethoden sind ebenfalls geeignet).
- Extrahieren Sie die erforderliche Probenmenge für die Hämatokritbestimmung: Füllen Sie die Mikrohämatokritkapillaren, indem Sie die untere Spitze in die Flüssigkeit tauchen. Stoppen Sie es, indem Sie die obere Öffnung abdecken, wenn die erforderliche Probenmenge im Röhrchen durch Kapillarabsaugung ansteigt.
- Versiegeln Sie die Kapillaren mit Siegellack. Legen Sie sie in die Mikrohämatokritzentrifuge und lassen Sie sie 5 Minuten lang bei 15.000 x g (12.000 U/min) oder gemäß den Anweisungen des Herstellers laufen.
- Lesen Sie den Hämatokritwert an der Kapillare ab und notieren Sie ihn als Referenz.
- Stellen Sie eine Kamera auf, um die Sedimentation der Proben aufzuzeichnen. Um eine Überlastung des Speichers oder eine Entladung des Akkus zu vermeiden, versorgen Sie das Gerät über das Stromnetz mit Strom und speichern Sie die Bilder direkt auf einem Computer oder einer externen Festplatte.
- Stellen Sie eine stabile Kamera vor der Halterung auf, wo die ESR-Röhrchen ruhen. Verwenden Sie einen weißen, beleuchteten Hintergrund (weiße Blätter im Hintergrund funktionieren perfekt).
- Verwenden Sie leere Westergren-Röhren, vorzugsweise ohne Markierungen, um den Fokus und das Sichtfeld der Kamera so einzustellen, dass die höchste Auflösung an der Stelle erreicht wird, an der die Proben platziert werden. Achten Sie vorzugsweise darauf, dass die Ränder der Bilder in vertikaler und horizontaler Richtung ausgerichtet sind.
- Machen Sie ein Foto einer skalierten Röhre, um die Pixelauflösung zu extrahieren. Die Verwendung von RGB-Bildern wird empfohlen.
- Stellen Sie das Licht und die Belichtungszeit der Kamera so ein, dass sie einen weißen Hintergrund, aber keine Sättigung haben. Das Beispiel in Abbildung 1 wurde mit einer Canon EOS M50 mit einer Belichtungszeit von 1/15 s, einer Blende von F8,0, einem Tungsten-Weißabgleich, im Einzelbildmodus mit manuellem Fokus und einer ISO-Empfindlichkeit von 1.000 aufgenommen.
- Bereiten Sie die ESR-Röhrchen vor und platzieren Sie sie.
- Füllen Sie den unteren Behälter der Westergren-Röhre mit dem Volumen, das den Anweisungen des Herstellers entspricht. Setzen Sie das Westergren-Rohr wie vom Hersteller angegeben in den Bodenbehälter ein.
- Sobald die erste Röhre fertig ist, legen Sie diese in die Halterung und starten Sie die Kameraaufnahme. Die Aufnahme eines Bildes pro Minute ergibt in der Regel eine gute Auflösung der kinetischen ESR-Kurve.
- Bereiten Sie die nächsten Proben vor und platzieren Sie sie. Achten Sie darauf, dass Sie nicht vor einer Probe stehen, wenn ein Bild aufgenommen wird.
- Lassen Sie die Messungen mindestens 2 h laufen, um sie mit den Standardmessungen in 30 min, 1 h und 2 h zu vergleichen. Es ist jedoch auch besser, die Sättigung und den Stillstand der Sedimentation zu sehen. Für gesunde Proben oder im Falle einer Entzündung ist die Aufzeichnung der Proben über Nacht, zwischen 12 h und 24 h, mehr als ausreichend, da die Krümmung der schnellsten Proben innerhalb von 3 h sichtbar ist13,19. Wenn jedoch eine Bedingung die Sedimentationsgeschwindigkeit verringert, wie dies bei einer Abnahme der Fibrinogenkonzentration der Fall ist (d. h. im gewählten Beispiel ein hoher Serumvolumenanteil), können Aufzeichnungen von 50 Stunden oder mehr erforderlich sein, um die genauesten Informationen zu erhalten16,19.
2. Bildanalyse
Anmerkungen: Sobald die Bilder aufgezeichnet sind, extrahieren Sie die ESR-Kurve. Ein Beispiel für Matlab-Code finden Sie als Ergänzungsdatei 1 (MatlabCodeImageAnalysisSampled.m).
- Wählen oder identifizieren Sie eine Region of Interest (ROI), in der nur ein Röhrchen sichtbar ist, wobei sich der untere Rand unter der untersten Position der Grenzfläche des erythrozytzellfreien Plasmas, aber innerhalb der Probe befindet (siehe Abbildung 1A, B). Drehen Sie das Bild bei Bedarf so, dass die vertikale Richtung entlang der ersten Komponente des Bildes ausgerichtet ist.
- Konvertieren Sie den ROI des RGB-Bildes in ein Graustufenbild oder eine Matrix Gr. In der Regel ist die Kombination der dreifarbigen Kanäle (Rot [R], Grün [G] und Blau [B]) als Gr = 2 * R - B - G mit einem klaren Hintergrund sehr effizient (siehe Abbildung 1C und MatlabCodeImageAnalysisSampled.m Zeilen 121-128).
- Binarisieren Sie das Bild. Bei einer fehlerfreien Stichprobe führt die Verwendung des Otsu-Schwellenwerts29 in der Regel zu einem konsistenten Ergebnis (siehe Abbildung 1D und Zeile 133 von MatlabCodeImageAnalysisSampled.m). Für Proben mit einem hohen Hämatokrit oder mit einer gewissen Hämolyse kann es besser sein, ihn manuell anzupassen oder eine andere automatische Methode zu verwenden (wie in den Zeilen 129-131 von MatlabCodeImageAnalysisSampled.m beschrieben), abhängig vom genauen Kontrast, der zwischen den verschiedenen Phasen im Röhrchen erzielt wird.
- Ermitteln Sie den Durchschnitt der Pixel- (oder Element-) Werte von Gr entlang der horizontalen Richtung. Dieser Schritt minimiert das Rauschen und mittelt effizient die möglichen Schnittstellenunregelmäßigkeiten (siehe Abbildung 1E und MatlabCodeImageAnalysisSampled.m Zeile 137).
- Bevor Sie die Variationen berechnen, glätten Sie die Kurve mit einem gleitenden Durchschnitt, insbesondere wenn die Röhren einige horizontale Markierungen enthalten (siehe Abbildung 1F). Für die bereitgestellten Beispiele wurde ein bewegliches Fenster von ~2,5 mm (50 Pixel) für diesen Prozess verwendet (siehe Zeile 138 von MatlabCodeImageAnalysisSampled.m). Identifizieren Sie dann die Grenzflächenposition als den Punkt mit der höchsten Intensitätsvariation (siehe Abbildung 1G).
- Wiederholen Sie dies für jedes Bild und jede Probe. Speichern Sie für jedes Beispiel die Positionen der Schnittstelle entlang der Zeit in einem geeigneten Format, um das physische Modell mit einer geeigneten Software anzupassen.
3. Anpassung des physikalischen Modells
- Unter Verwendung einer geeigneten Software, die den Hämatokrit und die Anfangshöhe der Blutsäule h 0 kennt, finden Sie die Werte der Verzögerungszeit t0, der dimensionslosen Zeit γ und des endgültigen gepackten Volumenanteils Φmder Erythrozyten, der die Summe der quadrierten Restabweichungen für das physikalische Modell17 minimiert. Ein Matlab-Code (ShapeAnalyzerIntegrated.m) wird als Supplementary File 2 als Beispiel für die Durchführung einer solchen Anpassung bereitgestellt. Weitere Anweisungen finden Sie in der Ergänzungsdatei 2. Wie an anderer Stelle16,17 beschrieben, weisen Erythrozyten am physiologischen Hämatokritsediment als weiches Partikelgel auf, wobei die wichtigen physikalischen Parameter der Dichteunterschied zwischen dem Plasma und den Erythrozyten des Donors Δρ, der charakteristische Erythrozytdurchmesser rRBC, die Plasmaviskosität bei Raumtemperatur η und der Hämatokrit Φ des Donors sind . Unter Verwendung dieser Parameter und unter der Annahme, dass die Gravitationsspannung der Hauptantriebsprozess für das Plasma ist, um nach einer Verzögerungszeit t0 durch das von den Erythrozyten gebildete poröse Netzwerk nach oben zu fließen, erhält man die zeitliche Entwicklung16,17:
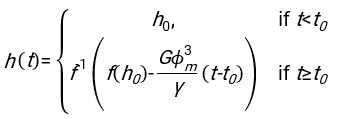
mit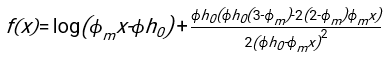 ,
, 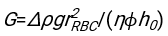 und
und 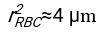 ist der mittlere Bandscheibenradius eines Erythrozyten. Ein Beispiel für einen Matlab-Code, der dies ausführt, wird als Anhang bereitgestellt (ShapeAnalyzerIntegrated.m passt zu der in SedimFit.m [Supplementary File 3] definierten Funktion). Alternativ kann G/γ auch direkt als Anpassungsparameter mit Einheiten von 1/t verwendet werden.
ist der mittlere Bandscheibenradius eines Erythrozyten. Ein Beispiel für einen Matlab-Code, der dies ausführt, wird als Anhang bereitgestellt (ShapeAnalyzerIntegrated.m passt zu der in SedimFit.m [Supplementary File 3] definierten Funktion). Alternativ kann G/γ auch direkt als Anpassungsparameter mit Einheiten von 1/t verwendet werden. - Sobald die quantitative Kurve aus dem Bild extrahiert wurde, speichern Sie die physikalischen Parameter der Probe. Herkömmliche ESR-Werte nach 30 min, 1 h oder 2 h können weiterhin als Referenz aus der Kurve extrahiert werden (siehe ShapeAnalyzerIntegrated.m, Zeilen 123-132).
Ergebnisse
Ein Beispiel für eine korrekt aufgenommene Bildsequenz ist als Supplementary Movie 1 (MovieS1.avi) dargestellt. In Abbildung 2 ist eine Reihe von charakteristischen Anpassungen des Modells für verschiedene Bedingungen dargestellt. Die Fibrinogenkonzentration wurde aus der Fibrinogenkonzentration im Plasma Fib0 bestimmt, unter der Annahme, dass das Serum überhaupt kein Fibrinogen enthält. Daher ist Fib = C Fib0, wobei C der...
Diskussion
Damit das automatisierte Protokoll effizient funktioniert, ist es wichtig, einen klaren Hintergrund und eine gute Beleuchtung zu haben. Ein dunkler Hintergrund kann das Vorhandensein eines effizienten Binarisierungsschwellenwerts verhindern. Bei Proben mit einer gewissen Hämolyse, die in der Regel im Laufe der Zeit auftritt (zunimmt), ist es wichtig, zunächst zu überprüfen, ob die gewählte Binarisierungsschwelle sowohl für das Anfangs- als auch für das Endbild relevant ist.
Wenn es um d...
Offenlegungen
Die Autoren haben keine Interessenkonflikte, die sie für den Inhalt dieses Artikels als relevant erklären müssen.
Danksagungen
Diese Arbeit wurde durch die Forschergruppe FOR 2688 - Wa1336/12 der Deutschen Forschungsgemeinschaft und durch die Marie-Skłodowska-Curie-Fördervereinbarung Nr. 860436-EVIDENCE unterstützt. T. J. und C. W. bedanken sich für die Förderung durch die Deutsch-Französische Hochschule (DFH/UFA). A. D. bedankt sich für die Förderung durch das Young Investigator Grant der Universität des Saarlandes.
Materialien
| Name | Company | Catalog Number | Comments |
| Anticoagulant (EDTA or Heparin) tube (for blood sample) | SARSTEDT | 267001 or 265 | Anticoagulated blood sample to characterize |
| Camera EOS M50 | Canon | Kit EF-M18-150 IS STM | Any camera should work, provided that sector alimentation, connection to computer for automated shooting and adapted objective are available |
| Centrifuge | HERMLE | 302.00 V03 - Z 36 HK | Requirements: at least 3000 x g ofr 7 min. |
| Micro-centrifuge | MLW | TH21 | or any other way to determine the hematocrit |
| Micro-hematocrit capilaries | Fisher scientific | 11884040 | or other capillaries/containers for hematocrit determination |
| Phosphate Buffered Saline (PBS) | ThermoFisher | 10010023 | 1x PBS, pH 7.4, 298 Osm |
| Pipettes (e.g. positive displacement pipette) | Gilson | FD10006 | Pipette required to manipulate blood and/or packed cells.Other models are of course suitable, but be careful to treat blood and pakced cells as highly viscous fluids. |
| Wax sealing plate | Hirschmann | 9120101 | Sealing wax for the micro-hematocrit capillaries |
| Westergren tubes | Praxindo | A9244560 | Any other standard Wetsergren tube should work too |
| White background with illumination | / | / | White sheet(s) of paper behind the samples, with usual room light is perfcetly sufficient. |
Referenzen
- Bedell, S. E., Bush, B. T. Erythrocyte sedimentation rate. From folklore to facts. The American Journal of Medicine. 78, 1001-1009 (1985).
- Grzybowski, A., Sak, J. Edmund Biernacki (1866-1911): Discoverer of the erythrocyte sedimentation rate. On the 100th anniversary of his death. Clinics in Dermatology. 29 (6), 697-703 (2011).
- Kushner, I., Mackiewicz, A. . The Acute Phase Response: An Overview. Acute Phase Proteins. , (1993).
- Tishkowski, K., Gupta, V. Erythrocyte Sedimentation Rate. StatPearls Publishing. , (2022).
- Menees, S. B., Powell, C., Kurlander, J., Goel, A., Chey, W. D. A meta-analysis of the utility of C-reactive protein, erythrocyte sedimentation rate, fecal calprotectin, and fecal lactoferrin to exclude inflammatory bowel disease in adults with IBS. The Americal Journal of Gastroenterology. 110 (3), 444-454 (2015).
- Brigden, M. L. Clinical utility of the erythrocyte sedimentation rate. Americal Family Physician. 60 (5), 1443-1450 (1999).
- Liu, S., et al. Preliminary case-control study to evaluate diagnostic values of C-reactive protein and erythrocyte sedimentation rate in differentiating active Crohn's disease from intestinal lymphoma, intestinal tuberculosis and Behcet's syndrome. The American Journal of the Medical Sciences. 346 (6), 467-472 (2013).
- Greidanus, N. V., et al. Use of erythrocyte sedimentation rate and C-reactive protein level to diagnose infection before revision total knee arthroplasty: A prospective evaluation. The Journal of Bone and Joint Surgery. 89 (7), 1409-1416 (2007).
- Flormann, D., Kuder, E., Lipp, P., Wagner, C., Kaestner, L. Is there a role of C-reactive protein in red blood cell aggregation. International Journal of Laboratory Hematology. 37 (4), 474-482 (2015).
- Brust, M., et al. The plasma protein fibrinogen stabilizes clusters of red blood cells in microcapillary flows. Scientific Reports. 4, 4348 (2014).
- Gray, S. J., Mitchell, E. B., Dick, G. F. Effect of purified protein fractions on sedimentation rate of erythrocytes. Proceedings of the Society for Experimental Biology and Medicine. 51 (3), 403-404 (1942).
- Kratz, A., et al. ICSH recommendations for modified and alternate methods measuring the erythrocyte sedimentation rate. International Journal of Laboratory Hematology. 39 (5), 448-457 (2017).
- Hung, W. T., Collings, A. F., Low, J. Erythrocyte sedimentation rate studies in whole human blood. Physics in Medicine and Biology. 39 (11), 1855-1873 (1994).
- Woodland, N. B., Cordatos, K., Hung, W. T., Reuben, A., Holley, L. Erythrocyte sedimentation in columns and the significance of ESR. Biorheology. 33 (6), 477-488 (1996).
- Holley, L., Woodland, N., Hung, W. T., Cordatos, K., Reuben, A. Influence of fibrinogen and haematocrit on erythrocyte sedimentation kinetics. Biorheology. 36 (4), 287-297 (1999).
- Dasanna, A. K., et al. Erythrocyte sedimentation: Effect of aggregation energy on gel structure during collapse. Physical Review. E. 105 (2-1), 024610 (2022).
- Darras, A., et al. Erythrocyte sedimentation: collapse of a high-volume-fraction soft-particle gel. Physical Review Letters. 128 (8), 088101 (2022).
- Darras, A., et al. Imaging erythrocyte sedimentation in whole blood. Frontiers in Physiology. 12, 729191 (2022).
- Darras, A., et al. Acanthocyte sedimentation rate as a diagnostic biomarker for neuroacanthocytosis syndromes: Experimental evidence and physical justification. Cells. 10 (4), 788 (2021).
- Rabe, A., et al. The erythrocyte sedimentation rate and its relation to cell shape and rigidity of red blood cells from chorea-acanthocytosis patients in an off-label treatment with dasatinib. Biomolecules. 11 (5), 727 (2021).
- Giavarina, D., Capuzzo, S., Pizzolato, U., Soffiati, G. Length of erythrocyte sedimentation rate (ESR) adjusted for the hematocrit: reference values for the TEST 1 method. Clinical Laboratory. 52 (5-6), 241-245 (2006).
- Bull, B. S. Is a standard ESR possible. Laboratory Medicine. 6 (11), 31-39 (1975).
- Bull, B. S., Brecher, G. An evaluation of the relative merits of the Wintrobe and Westergren sedimentation methods, including hematocrit correction. American Journal of Clinical Pathology. 62 (4), 502-510 (1974).
- Reinhart, W. H., Singh, A., Straub, P. W. Red blood cell aggregation and sedimentation: the role of the cell shape. British Journal of Haematology. 73 (4), 551-556 (1989).
- Jan, K., Usami, S., Smith, J. A. Influence of oxygen tension and hematocrit reading on ESRs of sickle cells: Role of RBC aggregation. Archives of Internal Medicine. 141 (13), 1815-1818 (1981).
- Issaq, H. J., Xiao, Z., Veenstra, T. D. Serum and plasma proteomics. Chemical Reviews. 107 (8), 3601-3620 (2007).
- Yu, Z., et al. Differences between human plasma and serum metabolite profiles. PLoS One. 6 (7), 21230 (2011).
- . Proper Pipetting Techniques - DE Available from: https://www.thermofisher.com/de/de/home/life-science/lab-plasticware-supplies/lab-plasticware-supplies-learning-center/lab-plasticware-supplies-resource-library/fundamentals-of-pipetting/proper-pipetting-techniques.html (2023)
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Transaction on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Solomon, C., et al. A comparison of fibrinogen measurement methods with fibrin clot elasticity assessed by thromboelastometry, before and after administration of fibrinogen concentrate in cardiac surgery patients. Transfusion. 51 (8), 1695-1706 (2011).
- Norouzi, N., Bhakta, H. C., Grover, W. H. Sorting cells by their density. PLoS One. 12 (7), 0180520 (2017).
- Trudnowski, R. J., Rico, R. C. Specific gravity of blood and plasma at 4 and 37 degrees C. Clinical Chemistry. 20 (5), 615-616 (1974).
- Késmárky, G., Kenyeres, P., Rábai, M., Tóth, K. Plasma viscosity: A forgotten variable. Clinical Hemorheology and Microcirculation. 39 (1-4), 243-246 (2008).
- Teece, L. J., et al. Gels under stress: The origins of delayed collapse. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 458, 126-133 (2014).
- Lindström, S. B., Kodger, T. E., Sprakel, J., Weitz, D. A. Structures, stresses, and fluctuations in the delayed failure of colloidal gels. Soft Matter. 8 (13), 3657-3664 (2012).
- Bartlett, P., Teece, L. J., Faers, M. A. Sudden collapse of a colloidal gel. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 85, 021404 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten