Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Vitesse de sédimentation des érythrocytes: une caractérisation basée sur la physique dans un contexte médical
Dans cet article
Résumé
La vitesse de sédimentation érythrocytaire (VS) est un paramètre physique, souvent utilisé dans les contrôles de santé de routine et le diagnostic médical. Un modèle théorique permettant d’extraire des paramètres physiquement significatifs de l’ensemble de la courbe de sédimentation, basé sur les connaissances colloïdales modernes, a récemment été développé. Ici, nous présentons un protocole pour collecter automatiquement l’ESR au fil du temps, et extraire les paramètres de ce modèle récent de cette collecte de données automatisée. Ces paramètres affinés sont également susceptibles d’améliorer le témoignage médical.
Résumé
La vitesse de sédimentation des érythrocytes (ou globules rouges) est un paramètre physique dérivé du sang qui est souvent utilisé dans les contrôles de santé de routine et le diagnostic médical. Par exemple, dans le cas de l’inflammation, une VS plus élevée est observée en raison de l’augmentation associée du fibrinogène et d’autres protéines plasmatiques. On croyait que cette augmentation était due à la formation de plus grands agrégats de globules rouges (GR) causée par l’augmentation du fibrinogène. En effet, le fibrinogène est un agent favorisant l’agrégation des globules rouges et, dans le régime de Stokes, supposé être observé plus rapidement dans les sédiments d’agrégats sanguins plus gros. Cependant, tous les modèles de mesures ESR basés sur cette hypothèse nécessitent d’autres hypothèses physiques spécifiques, qui ne sont requises dans aucun autre système. En outre, des études modernes dans le domaine des suspensions colloïdales ont établi que des particules attractives forment des agrégats percolants (c’est-à-dire des agrégats aussi larges que le récipient). La sédimentation de ces colloïdes suit alors un « collapsus de gel colloïdal ». Récemment, il a été démontré que les globules rouges suivent en fait le même comportement. Cette hypothèse permet également de modéliser efficacement et analytiquement la courbe de sédimentation des globules rouges, à partir de laquelle des descripteurs robustes et physiquement significatifs peuvent être extraits. Ce manuscrit décrit comment effectuer une telle analyse et discute des avantages de cette approche.
Introduction
La vitesse de sédimentation érythrocytaire (VS) est un outil clinique médical in vitro, formellement introduit dans la médecine fondée sur les preuves au cours du XXe siècle 1,2,3,4. Il est actuellement utilisé dans le monde entier comme test inflammatoire non spécifique, ou pour surveiller l’évolution de certaines conditions spécifiques 5,6,7,8. Ceci est principalement dû à une augmentation de la concentration en fibrinogène, mais aussi à d’autres composants plasmatiques tels que les IgM 1,9,10,11. Selon le protocole standard actuel de Westergren, les valeurs ESR sont rapportées comme la mesure de la couche de plasma acellulaire à un point de temps donné (30 min ou 1 h) après avoir laissé un tube vertical d’une taille typique de 20 cm verticalement au repos12. Cependant, cette méthode de mesure a été critiquée car qualitativement différentes étapes du processus de sédimentation ont été rapportées, y compris un délai avant d’atteindre la vitesse maximale de décantation13. Ce délai dure plus de 1 h dans environ la moitié des échantillons sains14. La vitesse au cours de cette phase obéit à une échelle différente de celle de la seconde phase, plus rapide, de la sédimentation15. En limitant la lecture à la vitesse moyenne de décantation au cours de la première heure, on compare ensuite un mélange différent de diverses propriétés sanguines entre différents individus.
De plus, il a été récemment démontré que les considérations théoriques habituelles derrière ce protocole étaient erronées16,17,18. À l’hématocrite physiologique (au-dessus d’environ 25%), les globules rouges (GR) ne sédimentent pas sous forme d’agrégats séparés, mais plutôt sous la forme d’un réseau continu, dit percolant, de globules rouges 17,18, obéissant à un ensemble d’équations physiques différent de la sédimentation de Stokes 16,17 habituellement mentionnée. Il a été démontré que la prise en compte d’une description physique basée sur les mesures résolues dans le temps de la sédimentation (courbe entière) était plus robuste dans certains contextes médicaux nouveaux19,20. De plus, ces mesures pourraient être utilisées pour faire la lumière sur les mécanismes physiques altérant la VS dans les pathologies dans lesquelles les formes cellulaires sont altérées19,20. De plus, une VS lente peut avoir une interprétation médicale utile, comme indiqué dans les mesures d’une cohorte de patients atteints du syndrome de neuroacanthocytose19,20. Cet article examine comment implémenter concrètement la mesure de paramètres physiquement significatifs, basée sur l’ensemble de la cinétique ESR. Plus précisément, la méthode présentée ici extrait la vitesse maximale de sédimentation Um, dont la valeur peut être corrigée pour considérer l’effet de l’hématocrite du donneur16,17. Ce paramètre est plus précis et donc plus fiable que la mesure traditionnelle16,17,19,20.
De plus, dans certaines recherches fondamentales, au lieu de surveiller l’état inflammatoire d’un patient donné, il est intéressant d’exclure l’effet de l’hématocrite sur la VS 21,22,23, ou d’étudier le rôle des globules rouges dans une VS modifiée 19,20,24,25 entre différents donateurs. Il peut être utile de comparer les échantillons qui ne sont pas directement des échantillons de sang complets de patients. Par conséquent, la remise en suspension des globules rouges avec un hématocrite contrôlé dans le plasma autologue, ou dans un substituant plasmatique, pourrait être utilisée comme première étape de la mesure de la VS. Par exemple, les solutions de Dextran 70 kDa avec une concentration de 55 mg/mL dans une solution saline tamponnée au phosphate (PBS) produisent une plage de sédimentation dans la plage de contrôle pour les cellules saines19. Ce manuscrit montre également comment de telles étapes devraient être menées, et que l’analyse présentée est également pertinente dans ces cas.
Protocole
Le prélèvement d’échantillons de sang et les expériences ont été approuvés par l’Ärztekammer des Saarlandes, éthique votum 51/18, et effectués après avoir obtenu le consentement éclairé conformément à la Déclaration d’Helsinki. Les mesures standard doivent être effectuées avec du sang anticoagulé à l’acide éthylènediaminetétraacétique (EDTA) (concentration standard d’EDTA de 1,6 mg/mL de sang, norme européenne NF EN ISO 6710), dans des tubes Westergren. Le volume nécessaire pour remplir le tube Westergren dépend du fabricant (car les parties inférieures contiennent parfois un réservoir plus large); Le volume devrait être d’environ 1 mL de sang total et de 800 μL pour les tubes indiqués dans le tableau des matériaux. La méthode décrite ci-dessous est toutefois valable quelle que soit la suspension spécifique et la forme du récipient, tant que l’hématocrite des échantillons sondés est supérieur à 25%16. Les volumes, les contenants, le milieu de suspension et les additifs doivent donc être choisis en fonction des objectifs spécifiques de la recherche effectuée.
1. Expériences et mesures
REMARQUE : Notez la vitesse de sédimentation de l’échantillon toutes les minutes.
- Préparation de l’échantillon (si nécessaire): Si un hématocrite témoin ou un liquide en suspension est nécessaire, commencez par laver les cellules et préparer les échantillons (à titre d’exemple, nous montrons comment préparer des échantillons avec différents niveaux de fibrinogène, en mélangeant du sérum autologue et du plasma). Le sérum peut en effet être approximé sous forme de plasma sans fibrinogène26,27, et peut être utilisé afin de diminuer l’agrégation des globules rouges, dans des conditions physiologiques différentes. Afin de préparer plusieurs échantillons, prélever le sang dans des tubes EDTA standard de 9 mL et le sérum dans des tubes de sérum standard (avec des billes de silice comme activateurs de coagulation) de 9 mL.
- Centrifuger les échantillons de sang (c.-à-d. 9 mL d’EDTA standard et de tubes de sérum dans l’exemple choisi) à 3 000 x g pendant au moins 7 minutes, pour un compactage optimal des érythrocytes emballés. Remplacer le surnageant par du PBS ou le liquide de suspension souhaité, si une quantité suffisante est disponible. S’il est simplement nécessaire de contrôler l’hématocrite dans le plasma autologue, passez directement à l’étape 1.1.3. Sinon, mélanger délicatement après inclusion du surnageant pour le lavage.
- Répétez trois fois. Effectuez le dernier lavage avec le liquide de suspension souhaité dans tous les cas.
- Dans l’exemple choisi, préparer des mélanges de plasma et de sérum autologues avec des proportions déterminées (p. ex., 25 %/75 %, 50 %/50 % ou 75 %/25 % de la fraction volumique plasma-sérum). Par exemple, lors de la préparation de 2,5 mL du mélange plasma-sérum à 25 %/75 %, ajouter 0,625 mL de plasma à 1,875 mL de sérum.
- Extraire le volume requis de cellules emballées et le suspendre dans le liquide désiré. Traiter les cellules emballées comme un liquide très visqueux (à l’aide d’un prépipetage et/ou d’un pipetage inversé standard ou d’une pipette volumétrique28). Dans l’exemple choisi, pour un échantillon de 4 mL à un hématocrite de 45 %, suspendre 1,8 mL de cellules emballées à moins de 2,2 mL du mélange plasma-sérum.
- Si l’hématocrite de l’échantillon n’est pas contrôlé, déterminez-le par microcentrifugation à grande vitesse (d’autres méthodes standard conviennent également).
- Extraire la quantité requise d’échantillon pour la détermination de l’hématocrite : remplir les capillaires micro-hématocrites en immergeant son extrémité inférieure dans le liquide. Arrêtez-le en couvrant l’ouverture supérieure lorsque la quantité requise d’échantillon monte dans le tube par aspiration capillaire.
- Scellez les capillaires avec de la cire à cacheter. Placez-les dans la centrifugeuse micro-hématocrite et faites-la fonctionner à 15 000 x g (12 000 tr/min) pendant 5 min, ou selon les instructions du fabricant.
- Lisez le niveau d’hématocrite sur le capillaire et écrivez-le pour référence.
- Installez une caméra pour enregistrer la sédimentation des échantillons. Pour éviter de surcharger la mémoire ou de vider la batterie, alimentez l’appareil à partir du secteur et enregistrez les images directement sur un ordinateur ou un disque dur externe.
- Installez une caméra stable devant le support où les tubes ESR seront laissés au repos. Utilisez un fond blanc et éclairé (les feuilles de papier blanches en arrière-plan fonctionnent parfaitement).
- À l’aide de tubes Westergren vides, de préférence sans marquages, réglez la mise au point et le champ de vision de la caméra pour obtenir la résolution la plus élevée où les échantillons seront placés. De préférence, assurez-vous que les bordures des images sont alignées dans le sens vertical et horizontal.
- Prenez une photo d’un tube à l’échelle pour extraire la résolution en pixels. L’utilisation d’images RVB est recommandée.
- Réglez la lumière et le temps d’exposition de l’appareil photo pour qu’ils aient un fond blanc, mais pas de saturation. L’exemple de la Figure 1 a été obtenu à l’aide d’un Canon EOS M50, avec un temps d’exposition de 1/15s, une ouverture de F8.0, une balance des blancs au tungstène, en mode prise de vue unique avec mise au point manuelle et une vitesse ISO de 1 000.
- Préparez et placez les tubes ESR.
- Remplissez le récipient inférieur du tube Westergren avec le volume correspondant aux instructions du fabricant. Insérez le tube Westergren dans le récipient inférieur comme indiqué par le fabricant.
- Dès que le premier tube est prêt, placez-le dans le support et démarrez l’enregistrement de la caméra. L’enregistrement d’une image toutes les minutes donne généralement une bonne résolution de la courbe cinétique ESR.
- Préparez et placez les échantillons suivants. Assurez-vous de ne pas vous tenir devant un échantillon lorsqu’une photo est prise.
- Laissez les mesures fonctionner pendant au moins 2 h, afin de comparer avec les mesures standard à 30 min, 1 h et 2 h. Cependant, il est également préférable de voir la saturation et l’arrêt de la sédimentation. Pour les échantillons sains, ou en cas d’inflammation, l’enregistrement des échantillons pendant la nuit, entre 12 h et 24 h, est plus que suffisant puisque la courbure des échantillons les plus rapides est visible dans les 3 h13,19. Toutefois, si une condition diminue la vitesse de sédimentation, comme le fait une diminution de la concentration de fibrinogène (c.-à-d. dans l’exemple choisi, fraction volumique sérique élevée), des enregistrements de 50 heures ou plus peuvent être nécessaires pour obtenir l’information la plus précise16,19.
2. Analyse d’images
REMARQUE: Une fois les images enregistrées, extrayez la courbe ESR. Un exemple de code Matlab est fourni en tant que fichier supplémentaire 1 (MatlabCodeImageAnalysisSampled.m).
- Sélectionner ou identifier une région d’intérêt (ROI) où un seul tube est visible, la bordure inférieure étant située sous la position la plus basse de l’interface plasma acellulaire érythrocytaire, mais à l’intérieur de l’échantillon (voir Figure 1A, B). Si nécessaire, faites pivoter l’image de sorte que la direction verticale soit alignée le long de la première composante de l’image.
- Convertissez le retour sur investissement de l’image RVB en une image en niveaux de gris ou une matrice Gr. Habituellement, la combinaison des canaux tricolores (rouge [R], vert [G] et bleu [B]) comme Gr = 2 * R - B - G est très efficace avec un arrière-plan clair (voir Figure 1C et MatlabCodeImageAnalysisSampled.m lignes 121-128).
- Binariser l’image. Pour un échantillon sain, l’utilisation du seuil Otsu29 donne généralement un résultat cohérent (voir la figure 1D et la ligne 133 de MatlabCodeImageAnalysisSampled.m). Pour les échantillons avec un hématocrite élevé ou avec une certaine hémolyse, il peut être préférable de l’ajuster manuellement ou d’utiliser une autre méthode automatique (comme dans les lignes 129-131 de MatlabCodeImageAnalysisSampled.m), en fonction du contraste exact obtenu entre les différentes phases à l’intérieur du tube.
- Obtenir la moyenne des valeurs de pixels (ou d’éléments) de Gr le long de la direction horizontale. Cette étape minimise le bruit et calcule efficacement la moyenne des irrégularités d’interface possibles (voir Figure 1E et MatlabCodeImageAnalysisSampled.m ligne 137).
- Avant de calculer les variations, lisser la courbe avec une moyenne mobile, surtout si les tubes contiennent des marques horizontales (voir figure 1F). Pour les exemples fournis, une fenêtre mobile de ~2,5 mm (50 pixels) a été utilisée pour ce processus (voir la ligne 138 de MatlabCodeImageAnalysisSampled.m). Ensuite, identifiez la position de l’interface comme le point avec la variation d’intensité la plus élevée (voir Figure 1G).
- Répétez l’opération pour chaque image et chaque échantillon. Pour chaque exemple, enregistrez les positions de l’interface dans un format approprié pour adapter le modèle physique à tout logiciel adapté.
3. Ajustement du modèle physique
- En utilisant n’importe quel logiciel convenablement adapté, connaissant l’hématocrite et la hauteur initiale de la colonne sanguine h 0, trouvez les valeurs du temps de retard t0, du temps sans dimension γ et de la fraction volumique finale emballée Φmdes érythrocytes qui minimise la somme des écarts résiduels au carré pour le modèle physique17. Un code Matlab (ShapeAnalyzerIntegrated.m) est fourni en tant que fichier supplémentaire 2 à titre d’exemple de la façon d’effectuer un tel ajustement. Voir le dossier supplémentaire 2 pour plus d’instructions. Comme décrit ailleurs16,17, les érythrocytes au niveau des sédiments physiologiques de l’hématocrite sous forme de gel de particules molles, où les paramètres physiques importants sont la différence de densité entre le plasma et les globules rouges du donneur Δρ, le diamètre caractéristique des globules rouges rGR, la viscosité plasmatique à température ambiante η et l’hématocrite Φ du donneur . En utilisant ces paramètres, et en supposant que la contrainte gravitationnelle est le principal processus d’entraînement pour que le plasma s’écoule vers le haut à travers le réseau poreux formé par les érythrocytes après un temps de retard t 0, on obtient l’évolution temporelle16,17:
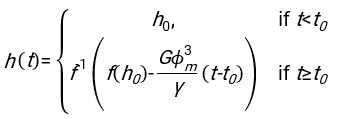
avec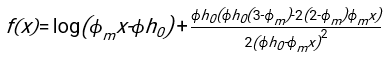 ,
, 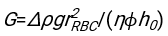 et
et 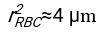 étant le rayon moyen du disque d’un érythrocyte. Un exemple de code Matlab effectuant cette opération est fourni en pièce jointe (ShapeAnalyzerIntegrated.m correspond à la fonction définie dans SedimFit.m [Fichier supplémentaire 3]). Alternativement, G/γ peut également être utilisé directement comme paramètre d’ajustement avec des unités de 1/t.
étant le rayon moyen du disque d’un érythrocyte. Un exemple de code Matlab effectuant cette opération est fourni en pièce jointe (ShapeAnalyzerIntegrated.m correspond à la fonction définie dans SedimFit.m [Fichier supplémentaire 3]). Alternativement, G/γ peut également être utilisé directement comme paramètre d’ajustement avec des unités de 1/t. - Une fois la courbe quantitative extraite de l’image, enregistrez les paramètres physiques de l’échantillon. Les valeurs ESR traditionnelles à 30 min, 1 h ou 2 h peuvent encore être extraites de la courbe pour référence (voir ShapeAnalyzerIntegrated.m lignes 123-132).
Résultats
Un exemple de séquence d’images correctement acquise est fourni en tant que film supplémentaire 1 (MovieS1.avi). Une série d’ajustements caractéristiques du modèle est illustrée pour diverses conditions à la figure 2. La concentration de fibrinogène a été déterminée à partir de la concentration de fibrinogène dans le Fib0 plasmatique, en supposant que le sérum ne contient aucun fibrinogène. Par conséquent, Fib = C Fib0
Discussion
Pour que le protocole automatisé fonctionne efficacement, il est important d’avoir un arrière-plan clair et un éclairage approprié. Un arrière-plan sombre peut empêcher l’existence d’un seuil de binarisation efficace. Pour les échantillons présentant une certaine hémolyse, qui se produit généralement (augmente) avec le temps, il est important de vérifier d’abord que le seuil de binarisation choisi est pertinent pour les images initiales et finales.
En ce qui concerne le pro...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer pertinent pour le contenu de cet article.
Remerciements
Ce travail a été soutenu par l’unité de recherche FOR 2688 - Wa1336/12 de la Fondation allemande pour la recherche et par la convention de subvention Marie Skłodowska-Curie n° 860436-EVIDENCE. T. J. et C. W. reconnaissent le financement de l’Université franco-allemande (DFH/UFA). A. D. reconnaît le financement par le Young Investigator Grant de l’Université de la Sarre.
matériels
| Name | Company | Catalog Number | Comments |
| Anticoagulant (EDTA or Heparin) tube (for blood sample) | SARSTEDT | 267001 or 265 | Anticoagulated blood sample to characterize |
| Camera EOS M50 | Canon | Kit EF-M18-150 IS STM | Any camera should work, provided that sector alimentation, connection to computer for automated shooting and adapted objective are available |
| Centrifuge | HERMLE | 302.00 V03 - Z 36 HK | Requirements: at least 3000 x g ofr 7 min. |
| Micro-centrifuge | MLW | TH21 | or any other way to determine the hematocrit |
| Micro-hematocrit capilaries | Fisher scientific | 11884040 | or other capillaries/containers for hematocrit determination |
| Phosphate Buffered Saline (PBS) | ThermoFisher | 10010023 | 1x PBS, pH 7.4, 298 Osm |
| Pipettes (e.g. positive displacement pipette) | Gilson | FD10006 | Pipette required to manipulate blood and/or packed cells.Other models are of course suitable, but be careful to treat blood and pakced cells as highly viscous fluids. |
| Wax sealing plate | Hirschmann | 9120101 | Sealing wax for the micro-hematocrit capillaries |
| Westergren tubes | Praxindo | A9244560 | Any other standard Wetsergren tube should work too |
| White background with illumination | / | / | White sheet(s) of paper behind the samples, with usual room light is perfcetly sufficient. |
Références
- Bedell, S. E., Bush, B. T. Erythrocyte sedimentation rate. From folklore to facts. The American Journal of Medicine. 78, 1001-1009 (1985).
- Grzybowski, A., Sak, J. Edmund Biernacki (1866-1911): Discoverer of the erythrocyte sedimentation rate. On the 100th anniversary of his death. Clinics in Dermatology. 29 (6), 697-703 (2011).
- Kushner, I., Mackiewicz, A. . The Acute Phase Response: An Overview. Acute Phase Proteins. , (1993).
- Tishkowski, K., Gupta, V. Erythrocyte Sedimentation Rate. StatPearls Publishing. , (2022).
- Menees, S. B., Powell, C., Kurlander, J., Goel, A., Chey, W. D. A meta-analysis of the utility of C-reactive protein, erythrocyte sedimentation rate, fecal calprotectin, and fecal lactoferrin to exclude inflammatory bowel disease in adults with IBS. The Americal Journal of Gastroenterology. 110 (3), 444-454 (2015).
- Brigden, M. L. Clinical utility of the erythrocyte sedimentation rate. Americal Family Physician. 60 (5), 1443-1450 (1999).
- Liu, S., et al. Preliminary case-control study to evaluate diagnostic values of C-reactive protein and erythrocyte sedimentation rate in differentiating active Crohn's disease from intestinal lymphoma, intestinal tuberculosis and Behcet's syndrome. The American Journal of the Medical Sciences. 346 (6), 467-472 (2013).
- Greidanus, N. V., et al. Use of erythrocyte sedimentation rate and C-reactive protein level to diagnose infection before revision total knee arthroplasty: A prospective evaluation. The Journal of Bone and Joint Surgery. 89 (7), 1409-1416 (2007).
- Flormann, D., Kuder, E., Lipp, P., Wagner, C., Kaestner, L. Is there a role of C-reactive protein in red blood cell aggregation. International Journal of Laboratory Hematology. 37 (4), 474-482 (2015).
- Brust, M., et al. The plasma protein fibrinogen stabilizes clusters of red blood cells in microcapillary flows. Scientific Reports. 4, 4348 (2014).
- Gray, S. J., Mitchell, E. B., Dick, G. F. Effect of purified protein fractions on sedimentation rate of erythrocytes. Proceedings of the Society for Experimental Biology and Medicine. 51 (3), 403-404 (1942).
- Kratz, A., et al. ICSH recommendations for modified and alternate methods measuring the erythrocyte sedimentation rate. International Journal of Laboratory Hematology. 39 (5), 448-457 (2017).
- Hung, W. T., Collings, A. F., Low, J. Erythrocyte sedimentation rate studies in whole human blood. Physics in Medicine and Biology. 39 (11), 1855-1873 (1994).
- Woodland, N. B., Cordatos, K., Hung, W. T., Reuben, A., Holley, L. Erythrocyte sedimentation in columns and the significance of ESR. Biorheology. 33 (6), 477-488 (1996).
- Holley, L., Woodland, N., Hung, W. T., Cordatos, K., Reuben, A. Influence of fibrinogen and haematocrit on erythrocyte sedimentation kinetics. Biorheology. 36 (4), 287-297 (1999).
- Dasanna, A. K., et al. Erythrocyte sedimentation: Effect of aggregation energy on gel structure during collapse. Physical Review. E. 105 (2-1), 024610 (2022).
- Darras, A., et al. Erythrocyte sedimentation: collapse of a high-volume-fraction soft-particle gel. Physical Review Letters. 128 (8), 088101 (2022).
- Darras, A., et al. Imaging erythrocyte sedimentation in whole blood. Frontiers in Physiology. 12, 729191 (2022).
- Darras, A., et al. Acanthocyte sedimentation rate as a diagnostic biomarker for neuroacanthocytosis syndromes: Experimental evidence and physical justification. Cells. 10 (4), 788 (2021).
- Rabe, A., et al. The erythrocyte sedimentation rate and its relation to cell shape and rigidity of red blood cells from chorea-acanthocytosis patients in an off-label treatment with dasatinib. Biomolecules. 11 (5), 727 (2021).
- Giavarina, D., Capuzzo, S., Pizzolato, U., Soffiati, G. Length of erythrocyte sedimentation rate (ESR) adjusted for the hematocrit: reference values for the TEST 1 method. Clinical Laboratory. 52 (5-6), 241-245 (2006).
- Bull, B. S. Is a standard ESR possible. Laboratory Medicine. 6 (11), 31-39 (1975).
- Bull, B. S., Brecher, G. An evaluation of the relative merits of the Wintrobe and Westergren sedimentation methods, including hematocrit correction. American Journal of Clinical Pathology. 62 (4), 502-510 (1974).
- Reinhart, W. H., Singh, A., Straub, P. W. Red blood cell aggregation and sedimentation: the role of the cell shape. British Journal of Haematology. 73 (4), 551-556 (1989).
- Jan, K., Usami, S., Smith, J. A. Influence of oxygen tension and hematocrit reading on ESRs of sickle cells: Role of RBC aggregation. Archives of Internal Medicine. 141 (13), 1815-1818 (1981).
- Issaq, H. J., Xiao, Z., Veenstra, T. D. Serum and plasma proteomics. Chemical Reviews. 107 (8), 3601-3620 (2007).
- Yu, Z., et al. Differences between human plasma and serum metabolite profiles. PLoS One. 6 (7), 21230 (2011).
- . Proper Pipetting Techniques - DE Available from: https://www.thermofisher.com/de/de/home/life-science/lab-plasticware-supplies/lab-plasticware-supplies-learning-center/lab-plasticware-supplies-resource-library/fundamentals-of-pipetting/proper-pipetting-techniques.html (2023)
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Transaction on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Solomon, C., et al. A comparison of fibrinogen measurement methods with fibrin clot elasticity assessed by thromboelastometry, before and after administration of fibrinogen concentrate in cardiac surgery patients. Transfusion. 51 (8), 1695-1706 (2011).
- Norouzi, N., Bhakta, H. C., Grover, W. H. Sorting cells by their density. PLoS One. 12 (7), 0180520 (2017).
- Trudnowski, R. J., Rico, R. C. Specific gravity of blood and plasma at 4 and 37 degrees C. Clinical Chemistry. 20 (5), 615-616 (1974).
- Késmárky, G., Kenyeres, P., Rábai, M., Tóth, K. Plasma viscosity: A forgotten variable. Clinical Hemorheology and Microcirculation. 39 (1-4), 243-246 (2008).
- Teece, L. J., et al. Gels under stress: The origins of delayed collapse. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 458, 126-133 (2014).
- Lindström, S. B., Kodger, T. E., Sprakel, J., Weitz, D. A. Structures, stresses, and fluctuations in the delayed failure of colloidal gels. Soft Matter. 8 (13), 3657-3664 (2012).
- Bartlett, P., Teece, L. J., Faers, M. A. Sudden collapse of a colloidal gel. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 85, 021404 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon