S'identifier
Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Methods Article
Caractérisation magnétométrique des intermédiaires dans l’électrochimie à l’état solide de structures métal-organiques rédox-actives
Dans cet article
Résumé
Les levés magnétiques ex situ peuvent fournir directement des informations en vrac et locales sur une électrode magnétique pour révéler son mécanisme de stockage de charge étape par étape. Ici, la résonance de spin électronique (ESR) et la susceptibilité magnétique sont démontrées pour surveiller l’évaluation des espèces paramagnétiques et leur concentration dans un cadre organométallique (MOF) rédox-actif.
Résumé
Le stockage électrochimique de l’énergie a été une application largement discutée des cadres organométalliques (MOF) rédox actifs au cours des 5 dernières années. Bien que les MOF montrent des performances exceptionnelles en termes de capacité gravimétrique ou surfacique et de stabilité cyclique, leurs mécanismes électrochimiques ne sont malheureusement pas bien compris dans la plupart des cas. Les techniques spectroscopiques traditionnelles, telles que la spectroscopie photoélectronique à rayons X (XPS) et la structure fine d’absorption des rayons X (XAFS), n’ont fourni que des informations vagues et qualitatives sur les changements de valence de certains éléments, et les mécanismes proposés sur la base de ces informations sont souvent très discutables. Dans cet article, nous rapportons une série de méthodes standardisées, y compris la fabrication de cellules électrochimiques à l’état solide, les mesures électrochimiques, le désassemblage des cellules, la collecte d’intermédiaires électrochimiques MOF et les mesures physiques des intermédiaires sous la protection des gaz inertes. En utilisant ces méthodes pour clarifier quantitativement l’évolution de l’état électronique et de spin dans une seule étape électrochimique des MOF redox-actifs, on peut fournir un aperçu clair de la nature des mécanismes électrochimiques de stockage d’énergie non seulement pour les MOF, mais aussi pour tous les autres matériaux avec des structures électroniques fortement corrélées.
Introduction
Depuis que le terme cadre organométallique (MOF) a été introduit à la fin des années 1990, et surtout dans les années 2010, les concepts scientifiques les plus représentatifs concernant les MOF sont nés de leur porosité structurelle, y compris l’encapsulation invitée, la séparation, les propriétés catalytiques et la détection de molécules 1,2,3,4 . Pendant ce temps, les scientifiques ont rapidement réalisé qu’il est essentiel pour les MOF de posséder des propriétés électroniques sensibles aux stimuli afin de les intégrer dans les appareils intelligents modernes. Cette idée a déclenché l’apparition et l’épanouissement de la famille MOF bidimensionnelle conductrice (2D) au cours des 10 dernières années, ouvrant ainsi la porte aux MOF pour jouer un rôle clé dans l’électronique5 et, plus attrayant, dans les dispositifs de stockage d’énergie électrochimique6. Ces MOF 2D ont été incorporés comme matériaux actifs dans les piles alcalines métalliques, les batteries aqueuses, les pseudocondensateurs et les supercondensateurs 7,8,9, et ont montré une capacité énorme ainsi qu’une excellente stabilité. Cependant, pour concevoir des MOF 2D plus performants, il est crucial de comprendre en détail leurs mécanismes de stockage de charge. Par conséquent, cet article vise à fournir une compréhension complète des mécanismes électrochimiques des MOF, ce qui peut aider à la conception rationnelle de MOF plus performants pour les applications de stockage d’énergie.
En 2014, nous avons rapporté pour la première fois les mécanismes électrochimiques à l’état solide des MOF avec des sites redox-actifs sur les cations métalliques et les ligands10,11. Ces mécanismes ont été interprétés à l’aide de diverses techniques spectroscopiques in situ et ex situ, telles que la spectroscopie photoélectronique à rayons X (XPS), la structure fine d’absorption des rayons X (XAFS), la diffraction des rayons X (XRD) et la résonance magnétique nucléaire (RMN) à l’état solide. Depuis, ce paradigme de recherche est devenu une tendance dans les études de l’électrochimie à l’état solide des matériaux moléculaires12. Ces méthodes fonctionnent bien pour identifier les événements redox des MOF conventionnels avec des ligands de pontage carboxylate, car les orbitales moléculaires et les niveaux d’énergie des blocs de construction d’amas métalliques et des ligands organiques sont presque indépendants les uns des autres dans ces MOF12,13.
Cependant, en rencontrant les MOF 2D fortement corrélés avec une conjugaison π-d significative, les limites de ces méthodes spectroscopiques ont été exposées. L’une de ces limites est que les niveaux de bande de la plupart des MOF 2D susmentionnés ne peuvent pas être considérés comme une simple combinaison d’amas métalliques et de ligands, mais plutôt comme une hybridation de ceux-ci, alors que la plupart des méthodes spectroscopiques ne fournissent que des informations qualitatives moyennes sur les états d’oxydation14. L’autre limite est que l’interprétation de ces données est toujours basée sur l’hypothèse d’orbitales atomiques localisées. Par conséquent, les états intermédiaires avec hybridation métal-ligand et états électroniques délocalisés sont généralement négligés et décrits de manière incorrecte avec ces seules méthodes spectroscopiques15. Il est nécessaire de développer de nouvelles sondes pour les états électroniques de ces intermédiaires électrochimiques non seulement des MOF 2D, mais aussi d’autres matériaux ayant des structures électroniques conjuguées similaires ou fortement corrélées, tels que les cadres organiques covalents16, les conducteurs moléculaires et les polymères conjugués17.
Les outils les plus courants et les plus puissants pour évaluer les structures électroniques des matériaux sont les mesures de susceptibilité magnétique par résonance de spin électronique (ESR) et par dispositif d’interférence quantique supraconducteur (SQUID)18,19. Comme les deux reposent sur des électrons non appariés dans le système, ces outils peuvent fournir des informations provisoires sur les densités de spin, les distributions de spin et les interactions spin-spin. L’ESR offre une détection sensible des électrons non appariés, tandis que la mesure de susceptibilité magnétique donne plus de signaux quantitatifs pour les propriétés supérieures20. Malheureusement, les deux techniques sont inévitablement confrontées à de grands défis lorsqu’elles sont utilisées pour analyser les intermédiaires électrochimiques. En effet, les échantillons cibles ne sont pas purs, mais plutôt un mélange de matériau cible, d’additif conducteur, de liant et de sous-produit de l’électrolyte, de sorte que les données obtenues21,22 sont la somme des contributions du matériau et des impuretés. Pendant ce temps, la plupart des produits intermédiaires sont sensibles à l’environnement, y compris l’air, l’eau, certains électrolytes ou toute autre perturbation imprévisible; Des précautions supplémentaires sont nécessaires lors de la manipulation et de la mesure des produits intermédiaires. Des essais et des erreurs sont normalement nécessaires lorsqu’il s’agit d’une nouvelle combinaison de matériau d’électrode et d’électrolyte.
Ici, nous présentons un nouveau paradigme, appelé magnétométrie électrochimique, pour analyser les états électroniques ou les états de spin des MOF 2D et des matériaux similaires en utilisant une série de techniques, en utilisant l’électrochimie et la spectroscopie ESR ex situ à température variable ainsi que des mesures de susceptibilité magnétique ex situ 20. Pour démontrer l’efficacité de cette approche, nous utilisons Cu3THQ 2 (THQ = 1,2,4,5-tétrahydroxybenzoquinone; appelé Cu-THQ), un MOF 2D représentatif, à titre d’exemple. Nous expliquons la sélection des additifs conducteurs et des électrolytes, la fabrication des électrodes et des cellules électrochimiques, ainsi que des détails sur la manipulation et la mesure des échantillons, y compris les problèmes possibles lors de la mesure. En comparant avec les caractérisations classiques telles que XRD et XAFS, la magnétométrie électrochimique peut fournir une compréhension complète du mécanisme électrochimique de la plupart des MOF. Cette approche est capable de capturer des états intermédiaires uniques et d’éviter l’attribution incorrecte d’événements redox. L’élucidation des mécanismes de stockage d’énergie à l’aide de la magnétométrie électrochimique peut également contribuer à une meilleure compréhension des relations structure-fonction dans les MOF, conduisant à des stratégies synthétiques plus intelligentes pour les MOF et autres matériaux conjugués.
Protocole
1. Fabrication d’électrodes
- Synthèse de Cu-THQ MOF
NOTE: La poudre polycristalline Cu-THQ MOF a été synthétisée par une méthode hydrothermale suivant les procédures précédemment publiées 14,20,23.- Mettez 60 mg de tétrahydroxyquinone dans une ampoule de 20 mL, puis ajoutez 10 mL d’eau dégazée. Dans un flacon en verre séparé, dissoudre 110 mg de trihydrate de nitrate de cuivre (II) dans 10 mL supplémentaires d’eau dégazée. Ajouter 46 μL du ligand concurrent éthylènediamine à l’aide d’une pipette.
REMARQUE: Pour dégazer l’eau désionisée, faire couler de l’azote gazeux pendant 30 minutes avant utilisation. Si le mélange réactionnel est chauffé trop longtemps, une impureté de Cu peut se former avec un pic de diffraction apparaissant autour de 43° (Cu Kα). - Introduire la solution de cuivre dans l’ampoule contenant la tétrahydroxyquinone. La couleur de la solution passe immédiatement du rouge au marine. Congeler, pomper et décongeler24 fois la solution obtenue trois fois pour éliminer davantage l’oxygène dissous.
- Sceller la flamme de l’ampoule à l’aide d’une torche sous vide. Chauffer la solution à 60 °C pendant 4 h.
- Après la réaction, ouvrez soigneusement l’ampoule et retirez le surnageant. Laver le précipité avec 30 mL d’eau désionisée à température ambiante 3x et 30 mL d’eau désionisée chaude (80 °C) par centrifugation 3x à 10 000 tr/min pendant 5 min.
- Disperser le précipité dans l’acétone en agitant, puis filtrer et laver avec de l’acétone. Chauffer le produit sous vide à 353 K pendant une nuit pour éliminer le solvant résiduel dans le MOF Cu-THQ.
- Mettez 60 mg de tétrahydroxyquinone dans une ampoule de 20 mL, puis ajoutez 10 mL d’eau dégazée. Dans un flacon en verre séparé, dissoudre 110 mg de trihydrate de nitrate de cuivre (II) dans 10 mL supplémentaires d’eau dégazée. Ajouter 46 μL du ligand concurrent éthylènediamine à l’aide d’une pipette.
- Préparation des électrodes CuTHQ
REMARQUE: Pour faire la distinction entre le Cu-THQ MOF et l’électrode, le premier est appelé Cu-THQ, tandis que le mélange de Cu-THQ, de carbone et de liant est simplement appelé CuTHQ.- Pour préparer l’électrode Cu-THQ/CB/PVDF, dissoudre 10 mg de poly(fluorure de vinylidène) (PVDF) dans 1,4 mL de N-méthyl-2-pyrrolidone (NMP). Disperser 50 mg de Cu-THQ MOF et 40 mg de noir de carbone (CB) dans la solution en agitant vigoureusement pendant une nuit. Enduire la boue homogène sur un disque Al d’un diamètre de 15 mm et d’une masse de ~9,7 mg.
- Pour préparer l’électrode Cu-THQ/Gr/SP/SA, suivez la même procédure que l’électrode Cu-THQ/CB/PVDF, mais avec une composition de boue différente : Cu-THQ MOF (80 mg), alginate de sodium (SA, 2 mg) et graphène/Super P (Gr/SP, dilution de 1:1,8 en poids, total de 18 mg) dans l’eau/isopropanol (dilution en volume de 1:1, total de 1,2 mL).
- Sécher les électrodes sous vide à 353 K pendant 12 h. Évacuer l’azote gazeux après séchage et mesurer la charge massique.
2. Assemblage de la batterie et post-traitement
REMARQUE: En raison de la nature sensible à l’air des intermédiaires électrochimiques, l’assemblage et le post-traitement de la batterie doivent être effectués dans une boîte à gants argon avec des manières strictes sans air.
- Assemblage de piles boutons Li/CuTHQ
- Coupez plusieurs morceaux de disques de lithium d’un diamètre de 15,5 mm et des séparateurs Celgard d’un diamètre de 17 mm avant d’assembler la batterie.
- Assemblez les piles boutons Li/CuTHQ (CR2032) de bas en haut dans l’ordre suivant : coque négative, entretoise (hauteur = 0,5 mm), lithium, séparateur, électrode CuTHQ (préparée à l’étape 1.2.1 ou 1.2.2), entretoise, ressort et coque positive (Figure 1A).
- Avant et après l’ajout du séparateur, déposer un total de 0,04 mL d’électrolyte (1,0 M LiBF4 dans carbonate d’éthylène (EC)/carbonate de diéthyle (DEC) à 1:1 en poids). N’utilisez pas de pince à épiler en métal pour maintenir la pile bouton après son assemblage.
- Préparation d’intermédiaires électrochimiques
- Comprimez la pile bouton à l’aide de la vis de serrage (non scellée) à l’aide d’un appareil fait maison (Figure 1B) et connectez l’appareil aux câbles de mesure de la boîte à gants. Connectez l’instrument (à l’extérieur de la boîte à gants) aux ports correspondant à la pile bouton. Effectuer des mesures de voltampérométrie cyclique et de charge/décharge galvanostatique20 pour obtenir les intermédiaires à différents potentiels (Figure 2).
- Après le cycle électrochimique, démontez soigneusement la pile bouton pour éviter tout court-circuit.
- Rincer l’électrode CuTHQ cyclée avec 5 mL de carbonate de diméthyle (DMC) de qualité batterie. Sécher l’électrode naturellement pendant 30 min. Prélever l’échantillon du disque Al sur une feuille d’aluminium à l’aide d’une spatule propre.
- Transférer la poudre d’échantillon dans un tube ESR ou un tube SQUID à travers un entonnoir en verre fait maison (Figure 1C). Scellez hermétiquement le tube d’échantillon avec un bouchon et un film transparent. Vous pouvez également connecter le tube d’échantillon à un tube en caoutchouc et le sceller avec une vanne, puis sceller à la flamme la tête du tube à échantillon sous vide.
- Après les mesures magnétiques20, ouvrir le tube à échantillon et déposer l’échantillon sur une feuille d’aluminium. Mesurer la masse de l’échantillon à l’aide d’une balance analytique avec une résolution de 0,01 mg dans l’air. Estimer la masse de Cu-THQ à partir de la masse totale de l’échantillon.
REMARQUE : La masse du Cu-THQ MOF cyclé est estimée à 50 % ou 80 % de la masse totale, selon le type d’électrodes utilisées; cette estimation ne tient pas compte des ions Li insérés et de l’électrolyte résiduel.
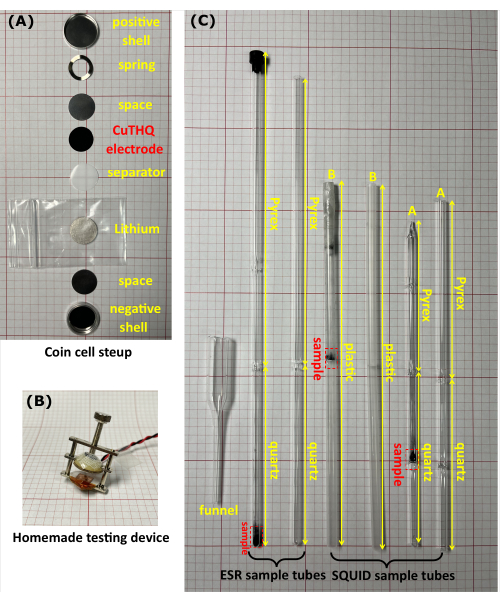
Figure 1 : Équipement utilisé pour les expériences de magnétométrie ex situ. (a) Une photographie d’une pile bouton CR2032. (B) Le dispositif artisanal a été utilisé pour évaluer la pile bouton non scellée dans la boîte à gants. (C) Photographies de tubes d’échantillons ESR et SQUID avec et sans échantillons à l’intérieur. Le tube ESR se compose d’une pointe en quartz de haute pureté de 10 cm (section de mesure) et d’une tête en verre borosilicaté de 17 cm. Il existe deux types de tubes SQUID. Le tube A se compose d’une pointe de quartz de 2 cm x 5 cm avec un diaphragme en quartz au point médian et une tête en verre borosilicaté de 10 cm, et le tube B est un tube en plastique (20 cm de long) avec un diaphragme en plastique au point médian. Tous les tubes d’échantillon ont un diamètre extérieur de 5 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Enregistrement des spectres ESR à des températures variables
- Enregistrement des spectres ESR à température ambiante
- Une fois que le spectromètre ESR est prêt, insérez le tube d’échantillon préparé dans la cavité micro-ondes et centrez l’échantillon. Réglez automatiquement la phase micro-ondes, le couplage et la fréquence pour atteindre l’état de résonance de la cavité. Vérifiez le Q-dip au centre de l’écran pour une forme symétrique et une profondeur maximale.
REMARQUE: Si l’échantillon contient trop de carbone conducteur, tel que le noir de carbone, le processus de réglage automatique peut échouer ou entraîner un petit facteur de qualité (valeur Q) de la cavité. La masse typique de l’échantillon est de 3 mg. - Choisissez les paramètres optimaux, tels que: micro-ondes: puissance; champ magnétique: temps de balayage; champ central: largeur du balayage; modulation: fréquence, largeur; Canal: amplitude, constante de temps. Ensuite, balayez le champ magnétique et enregistrez le spectre ESR. Les valeurs typiques des paramètres de mesure sont indiquées à la figure 3 et à la figure 4.
- Ajustez la quantité d’insertion du marqueur Mn à 800. Répétez les étapes 3.1.1 et 3.1.2 pour enregistrer un spectre ESR avec le marqueur Mn. Calibrer le champ magnétique en utilisant six lignes hyperfines pour les ions Mn(II).
- Une fois que le spectromètre ESR est prêt, insérez le tube d’échantillon préparé dans la cavité micro-ondes et centrez l’échantillon. Réglez automatiquement la phase micro-ondes, le couplage et la fréquence pour atteindre l’état de résonance de la cavité. Vérifiez le Q-dip au centre de l’écran pour une forme symétrique et une profondeur maximale.
- Analyse de la forme des lignes de Cu-THQ
- Importez le jeu de données ESR dans Python (version 3.9.7). Normalisez le spectre ESR en divisant l’intensité par la masse de l’échantillon, la racine carrée de la puissance micro-ondes, la largeur de modulation et l’amplitude.
- Ajuster le spectre ESR étalonné et normalisé du Cu-THQ MOF tel que préparé à la fonction lorentzienneaxiale symétrique 25:
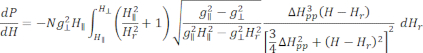
Où N est un facteur d’échelle qui inclut les paramètres de l’instrument g llet les constantes H II, ( et ) sont la composante parallèle (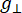 perpendiculaire) du facteur g Lander et le champ magnétique de résonance correspondant, Δ Hpp est la largeur de la ligne crête à crête et
perpendiculaire) du facteur g Lander et le champ magnétique de résonance correspondant, Δ Hpp est la largeur de la ligne crête à crête et 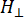 Hrest une variable intégrale.
Hrest une variable intégrale.
Remarque : Les codes Python pour la fonction Lorentzian sont disponibles dans le fichier de codage supplémentaire 1 (qui est nommé comme AxialLorentz). - Obtenez la valeur g anisotrope et la largeur de ligne crête à crête pour les ions Cu(II) axialement symétriques.
- Ajuster le spectre ESR calibré et normalisé avec la fonction lorentzienne pour les échantillons radicaux. Obtenez la valeur g isotrope et la largeur de la ligne crête à crête pour les radicaux.
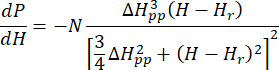
Il est nommé SymLorentz dans le fichier de codage supplémentaire 1.
- Quantifier la concentration radicalaire
- Broyer 3,45 mg de 4-hydroxy-2,2,6,6-tétraméthylpipéridine-1-oxyle (TEMPOL) et 96,55 mg de KBr ensemble dans un mortier d’agate jusqu’à obtention d’un mélange homogène. Placez 1 mg (0,2 μmol), 2 mg (0,4 μmol) et 4 mg (0,8 μmol) de mélanges TEMPOL/KBr dans trois tubes d’échantillon ESR, respectivement.
- Suivez les étapes 3.1.1 et 3.1.2 pour enregistrer les spectres ESR pour les normes TEMPOL/KBr.
- Effectuer un ajustement linéaire de base entre la double intégration des spectres ESR et le nombre de spins dans les normes TEMPOL/KBr. Déterminez le nombre de spins dans le Cu-THQ cyclé en utilisant la ligne de base linéaire des normes TEMPOL/KBr26.
- Enregistrement des spectres ESR à basse température
REMARQUE: Utilisez de l’hélium liquide pour atteindre une température cryogénique. Il est nécessaire de porter des gants cryogéniques lorsque vous travaillez avec de l’hélium liquide.- Vérifiez d’abord le spectre ESR à température ambiante en suivant l’étape 3.1.
- Évacuez le bouclier thermique à un niveau de vide élevé. Purgez la cavité micro-ondes à l’aide d’azote gazeux pour éviter la condensation.
- Introduire de l’hélium liquide du récipient dans le cryostat. Refroidir progressivement l’échantillon à la température la plus basse (environ 10 K). Attendez 30 minutes pour atteindre l’équilibre thermique.
- Enregistrez les spectres ESR dépendants de la température pendant le réchauffement. Confirmer que le spectre ESR ne souffre pas de l’effet de saturation de puissance à basse température et que le rapport entre l’intensité du signal (hauteur crête à crête) et la racine carrée de la puissance micro-ondes reste constant en l’absence de saturation de puissance.
REMARQUE: Lorsque la puissance est saturée, l’intensité du signal augmente plus lentement que la racine carrée de la puissance micro-ondes. La densité d’échantillonnage pourrait diminuer progressivement à mesure que la température augmente.
4. Mesures de susceptibilité magnétique
- Fixez le tube à échantillon au fond de la tige d’échantillonnage. Assurez-vous que la surface du tube à échantillon est propre.
- Purgez la chambre d’échantillonnage et insérez le tube à échantillon dans le SQUID. Appliquez un champ magnétique et centrez l’échantillon dans la bobine de détection. Retirez le champ magnétique externe après le centrage.
REMARQUE: Si la concentration de spin est trop faible pour être détectée, envisagez d’augmenter le champ magnétique ou de le centrer après refroidissement à 2 K. La masse typique de l’échantillon pour les mesures SQUID est d’environ 6 mg. - Refroidir le système à 20 K à une vitesse de 10 K/min. Arrêter le refroidissement pendant 30 min, puis refroidir à 2 K pendant 1 h.
- Mesurer la susceptibilité magnétique de l’électrode CuTHQ cyclée sous un champ magnétique de 1 000 Oe tout en se réchauffant à 300 K; c’est ce qu’on appelle le processus de refroidissement à champ zéro (ZFC). Ensuite, refroidissez à nouveau à 2 K et enregistrez la susceptibilité magnétique dans le processus refroidi par champ (FC).
- Répétez les étapes 4.1 à 4.4 avec des électrodes CuTHQ cyclées à différents degrés de réduction.
- Mesurer la susceptibilité magnétique des matériaux carbonés (Gr/SP) dans les mêmes conditions. Utilisez ce résultat pour compenser la susceptibilité magnétique des électrodes CuTHQ.
- Adapter la dépendance de la susceptibilité magnétique à la température de la loi de Curie-Weiss modifiée:
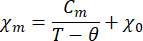
Où χ m est la susceptibilité magnétique molaire, Cmest la constante de Curie molaire, θ est la température de Weiss et χ0est un terme indépendant de la température.
Résultats
Nos travaux précédents comprenaient une discussion détaillée de la spectroscopie ESR ex situ et des mesures de susceptibilité magnétique ex situ pour le CuTHQ20 à cycle électrochimique. Nous présentons ici les résultats les plus représentatifs et détaillés qui peuvent être obtenus en suivant le protocole décrit dans cet article.
Discussion
Pour produire des cathodes, il est nécessaire de mélanger le matériau actif avec du carbone conducteur pour obtenir une faible polarisation pendant le processus électrochimique. L’additif carbone est le premier point critique pour la magnétométrie ex situ ; si le carbone présente des défauts radicalaires, l’émergence du radical organique induit électrochimiquement ne peut pas être observée dans le spectre ESR. Il est donc difficile de déterminer avec précision la concentration de spin ou la con...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Cette étude a été financée par une subvention KAKENHI (JP20H05621) de la Société japonaise pour la promotion de la science (JSPS). Z. Zhang remercie également la Fondation Tatematsu et la bourse Toyota Riken pour leur soutien financier.
matériels
| Name | Company | Catalog Number | Comments |
| 1-Methyl-2-pyrrolidone | FUJIFILM Wako Chemicals | 139-17611 | Super Dehydrated |
| 1mol/L LiBF4 EC:DEC (1:1 v/v%) | Kishida | LBG-96533 | electrolyte |
| 4-Hydroxy-2,2,6,6-tetramethylpiperidine-1-oxyl | FUJIFILM Wako Chemicals | 089-04191 | TEMPOL, for Spin Labeling |
| Ampule tube | Maruemu Corporation | 5-124-05 | 20mL |
| Carbon black, Super P Conductive | Alfa Aesar | H30253 | |
| Conductive Carbon Black | Mitsubishi Chemical | ||
| Copper (II) Nitrate Trihydrate | FUJIFILM Wako Chemicals | 033-12502 | deleterious substances |
| Dimethyl Carbonate | FUJIFILM Wako Chemicals | 046-31935 | battery grade |
| Ethylenediamine | FUJIFILM Wako Chemicals | 053-00936 | deleterious substances |
| Graphene Nanoplatelets | Tokyo Chemical Industry | G0442 | 6-8nm(thick), 15µm(wide) |
| Poly(vinylidene fluoride) | Sigma Aldrich | 182702 | |
| Potassium Bromide | FUJIFILM Wako Chemicals | 165-17111 | for Infrared Spectrophotometry |
| Sodium Alginate | FUJIFILM Wako Chemicals | 199-09961 | 500-600 cP |
| SQUID Magnetometer | Quantum Design | MPMS-XL 5 | |
| Tetrahydroxy-1,4-benzoquinone Hydrate | Tokyo Chemical Industry | T1090 | |
| X-Band ESR | JEOL | JES-F A200 |
Références
- Lee, J., et al. Metal-organic framework materials as catalysts. Chemical Society Reviews. 38 (5), 1450-1459 (2009).
- Dolgopolova, E. A., Rice, A. M., Martin, C. R., Shustova, N. B. Photochemistry and photophysics of MOFs: steps towards MOF-based sensing enhancements. Chemical Society Reviews. 47 (13), 4710-4728 (2018).
- Qian, Q., et al. MOF-based membranes for gas separations. Chemical Reviews. 120 (16), 8161-8266 (2020).
- Wang, Q., Astruc, D. State of the art and prospects in metal-organic framework (MOF)-based and MOF-derived nanocatalysis. Chemical Reviews. 120 (2), 1438-1511 (2020).
- Wang, M., Dong, R., Feng, X. Two-dimensional conjugated metal-organic frameworks (2D c-MOFs): chemistry and function for MOFtronics. Chemical Society Reviews. 50 (4), 2764-2793 (2021).
- Baumann, A. E., Burns, D. A., Liu, B., Thoi, V. S. Metal-organic framework functionalization and design strategies for advanced electrochemical energy storage devices. Communications Chemistry. 2 (1), 86 (2019).
- Nam, K. W., et al. Conductive 2D metal-organic framework for high-performance cathodes in aqueous rechargeable zinc batteries. Nature Communications. 10 (1), 4948 (2019).
- Sheberla, D., et al. Conductive MOF electrodes for stable supercapacitors with high areal capacitance. Nature Materials. 16 (2), 220-224 (2017).
- Wang, Z., et al. Ultrathin two-dimensional conjugated metal-organic framework single-crystalline nanosheets enabled by surfactant-assisted synthesis. Chemical Science. 11 (29), 7665-7671 (2020).
- Zhang, Z., Yoshikawa, H., Awaga, K. Monitoring the solid-state electrochemistry of Cu(2,7-AQDC) (AQDC = anthraquinone dicarboxylate) in a lithium battery: Coexistence of metal and ligand redox activities in a metal-organic framework. Journal of the American Chemical Society. 136 (46), 16112-16115 (2014).
- Zhang, Z., Yoshikawa, H., Awaga, K. Discovery of a "bipolar charging" mechanism in the solid-state electrochemical process of a flexible metal-organic framework. Chemistry of Materials. 28 (5), 1298-1303 (2016).
- Li, C., Hu, X., Hu, B. Cobalt(II) dicarboxylate-based metal-organic framework for long-cycling and high-rate potassium-ion battery anode. Electrochimica Acta. 253, 439-444 (2017).
- Liu, J., et al. Reversible formation of coordination bonds in Sn-based metal-organic frameworks for high-performance lithium storage. Nature Communications. 12 (1), 3131 (2021).
- Jiang, Q., et al. A redox-active 2D metal-organic framework for efficient lithium storage with extraordinary high capacity. Angewandte Chemie. 59 (13), 5273-5277 (2020).
- Sakaushi, K., Nishihara, H. Two-dimensional π-conjugated frameworks as a model system to unveil a multielectron-transfer-based energy storage mechanism. Accounts of Chemical Research. 54 (15), 3003-3015 (2021).
- Li, H., et al. 2D organic radical conjugated skeletons with paramagnetic behaviors. Advanced Materials Interfaces. 8 (18), 2100943 (2021).
- Peeks, M. D., et al. Electronic delocalization in the radical cations of porphyrin oligomer molecular wires. Journal of the American Chemical Society. 139 (30), 10461-10471 (2017).
- Krug von Nidda, H. A., et al. Anisotropic exchange in LiCuVO4 probed by ESR. Physical Review B. 65 (13), 134445 (2002).
- Zeng, Z., et al. Pro-aromatic and anti-aromatic π-conjugated molecules: An irresistible wish to be diradicals. Chemical Society Reviews. 44 (18), 6578-6596 (2015).
- Chen, Q., Adeniran, O., Liu, Z. F., Zhang, Z., Awaga, K. Graphite-like charge storage mechanism in a 2D π-d conjugated metal-organic framework revealed by stepwise magnetic monitoring. Journal of the American Chemical Society. 145 (2), 1062-1071 (2023).
- Julien, C. M., Mauger, A., Groult, H., Zhang, X., Gendron, F. LiCo1-yByO2 as cathode materials for rechargeable lithium batteries. Chemistry of Materials. 23 (2), 208-218 (2011).
- Niemöller, A., Jakes, P., Eichel, R. A., Granwehr, J. In operando EPR investigation of redox mechanisms in LiCoO2. Chemical Physics Letters. 716, 231-236 (2019).
- Park, J., et al. Synthetic routes for a 2D semiconductive copper hexahydroxybenzene metal-organic framework. Journal of the American Chemical Society. 140 (44), 14533-14537 (2018).
- Rondeau, R. E. A technique for degassing liquid samples. Journal of Chemical Education. 44 (9), 530 (1967).
- Flores-Llamas, H. Inhomogeneously broadened EPR lineshape of axial powder. Applied Magnetic Resonance. 9 (2), 289-298 (1995).
- Sun, L., et al. Room-temperature quantitative quantum sensing of lithium ions with a radical-embedded metal-organic framework. Journal of the American Chemical Society. 144 (41), 19008-19016 (2022).
- Chen, Y., et al. Successive storage of cations and anions by ligands of π-d-conjugated coordination polymers enabling robust sodium-ion batteries. Angewandte Chemie. 60 (34), 18769-18776 (2021).
- Roessler, M. M., Salvadori, E. Principles and applications of EPR spectroscopy in the chemical sciences. Chemical Society Reviews. 47 (8), 2534-2553 (2018).
- Ji, X., et al. Pauli paramagnetism of stable analogues of pernigraniline salt featuring ladder-type constitution. Journal of the American Chemical Society. 142 (1), 641-648 (2020).
- Noel, M., Santhanam, R. Electrochemistry of graphite intercalation compounds. Journal of Power Sources. 72 (1), 53-65 (1998).
- Wu, K. H., Ting, T. H., Wang, G. P., Ho, W. D., Shih, C. C. Effect of carbon black content on electrical and microwave absorbing properties of polyaniline/carbon black nanocomposites. Polymer Degradation and Stability. 93 (2), 483-488 (2008).
- Yao, M., Taguchi, N., Ando, H., Takeichi, N., Kiyobayashi, T. Improved gravimetric energy density and cycle life in organic lithium-ion batteries with naphthazarin-based electrode materials. Communications Materials. 1 (1), 70 (2020).
- Krzystek, J., et al. EPR spectra from "EPR-silent" species: High-frequency and high-field EPR spectroscopy of pseudotetrahedral complexes of nickel(II). Inorganic Chemistry. 41 (17), 4478-4487 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon
Nous utilisons des cookies afin d'améliorer votre expérience sur notre site web.
En continuant à utiliser notre site ou en cliquant sur le bouton ''continuer'', vous acceptez l'utilisation de cookies.