Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Küçük oligomer oluşturan Membran Protein Sedimantasyon Denge: pentameric İstikrar Histidine Protonasyon Etkisi
Bu Makalede
Özet
Sedimentation equilibrium (SE) can be used to study protein-protein interactions in a physiological environment. This manuscript describes the use of this technique to determine the effect of pH on the stability of a homo-pentamer formed by the small hydrophobic (SH) protein encoded by the human syncytial respiratory virus (hRSV).
Özet
Analitik ultrasantrifügasyon, (EAA) etkileşim kuvvetleri geniş bir aralıkta ve fizyolojik koşullar altında, makro moleküller arasındaki tersine çevrilebilir etkileşimler üzerinde çalışmak için de kullanılabilir. Bu AUC'sini nicel stoikiyometri ve homo ve biyokimyasal süreçlerde geçici ve geri dönüşümlüdür hetero-Dernek termodinamik değerlendirmek için bir seçim yöntemi yapar. Sedimantasyon denge yöntemi (SE) 'de, difüzyon ve çökelme arasında bir denge, belirli bir ilişki modeline bağlıdır radyal mesafenin bir fonksiyonu olarak, bir profil sağlar. Burada detaylı bir GD protokolü bir analitik ultrasantrifüj kullanarak küçük bir zar proteini oligomerin boyut ve monomer ilişki enerjisini tespit etmek üzere tarif edilmiştir. AUC-ES sadece fiziksel ilkelere dayalı, etiket-ücretsiz, ve hem suda çözünür ve membran proteinleri kullanılabilir. Bir örnek ikincisinin gösterilir, insan solunum sinsisyal virüsü küçük hidrofobik (SH) proteini (hRSV), Pentamerik iyon kanallarını oluşturan tek bir α-sarmal transmembran (TM) etki alanı ile 65-amino asit polipeptit. NMR tabanlı yapısal veriler SH proteini kanalının lümen bakan yönlendirilmiş olan zar ötesi etki protonlaştırılabilir iki His kalıntılarını sahip olduğunu göstermektedir. SE deneyleri pH dernek sabiti ve SH protein oligomerik boyutunu nasıl etkilediğini belirlemek için tasarlanmıştır. Pentamerik bir şekilde her durumda muhafaza ederken, bunun birleşme sabiti düşük pH değerinde indirgendi. Bu veriler, SH proteinde iki His tortularının bir lümene ilişkin yönlendirme ile tutarlı SH kanal aktivitesi için gözlenen benzer bir pH bağımlılığı ile uyum içindedir. ikincisi, düşük pH elektrostatik itme ve düşük oligomer istikrarı karşılaşabilirsiniz. Fizyolojik koşullarda ince, protein-protein ilişki değişiklikler hakkında niceliksel bilgi olarak ölçülmesi için her Özetle, bu yöntem uygulanabilir.
Giriş
Analitik Ultrasantrifügasyon 1-5, fizyolojik koşullar altında makromoleküllerin etkileşimleri incelemek zayıf ve güçlü etkileşimler hem erişilebilir olmasının en önemli yöntemlerden biridir. yöntem etiketi içermez ve ışık emiliminin veya girişim kullanır ve hatta floresan optik sistemler büyüklüğü 6 birkaç düzeyleri üzerinde konsantrasyon aralıkları ulaşmak için kullanılabilir.
En biyokimyasal işlemler tersine etkileşimine bağlıdır, bu yöntem özellikle faydalıdır. Bu etkileşimlerin stoikiometri ve gücü kantitatif biyolojik süreçleri anlamak için karakterize lazım, ve bir dizi yöntem, bu amaçla 7, 8 için var. Bununla birlikte, geçici etkileşimler 9 çalışma zordur.
makromoleküler etkileşimleri tanımlamak için bir yöntem seçimi statik veya dinamik doğasına bağlıdır. İlk durumda, Sedim yönelimi hızı (SV) radyal ulaşım oranı ölçülür ve kompleksleri yüzer kütle ve şekil farklılıkları esasında kesirleştirilmiştir yerlerde kullanılır.
Buna karşılık, deney zaman ölçeği üzerinde ters çevrilebilir dinamik dernekler fiziksel ayrılamaz. Bu durumda, kendi kendine ya da kovalent olmayan etkileşimlerin neden hetero etkileşimleri toplam protein konsantrasyonuna bağlı olan bir denge içindedir. Bu dinamik etkileşimler sedimantasyon denge (SE) ve sedimantasyon hızı (SV) 10 hem ele alınabilir. Bununla birlikte, birinci yöntem gerçekleştirmek için basit ve burada tarif edilmiştir. Bir denge difüzyon ve çökelme ile ulaşılır, böylece SE olarak, santrifüj, yeterince düşük bir hızda gerçekleştirilir. Bu noktada her iki radyal mesafenin bir fonksiyonu olarak, bir optik işaret (UV-VIS) denge profili, dernekler 11 için önceden belirlenmiş bir termodinamik modeller kullanılarak analiz edilebilir.
ve_content "> Bu yazıda, bir sedimentasyon dengeleme çalışması nedeniyle hidrofobisite. iyon kanallarını oluşturur viral zar proteininin kendi kendine birleşmeme özelliği sunulmuştur deney deterjan varlığında gerçekleştirilir, ve bu durumda yoğunluk olduğu Çözücü deterjan edilene uyumlu olması gerekir. Bununla birlikte, protokol solvent yoğunluk eşleme gerekli olacaktır, bunun dışında, suda çözünür protein halinde olur aynı tanımladı.kullanılan protein, insan solunum sinsisyal virüsü (hRSV), alt solunum yolu bebeklerde hastalığı, yaşlılar ve bağışıklık popülasyonları Dünya çapında 12 neden Paramyxoviridae ailesinden bir zarflı Pneumovirus kodlanmıştır. HRSV enfeksiyonu kadar 64 milyon bildirilen vaka ve ölüm 160,000 her yıl meydana gelir.
hRSV genom üç membran proteinleri, F, G ve küçük hidrofobik (SH) dahil olmak üzere 11 proteinleri transkripsiyonunu yapar. SH proteini katılırRSV enfeksiyonu patogenezinde. SH gen (RSVΔSH) eksik RSV mümkün olduğunu sinsitiyumların oluşmasına neden ve vahşi tip (WT) virüsü 13-16 kadar büyüdü. Bununla birlikte, RSVΔSH virüsü üst solunum yolu 15, 16 WT daha az verimli bir şekilde 10-kat çoğaltılır. Ayrıca, RSVΔSH virüs in vivo fare ve şempanze modelleri 13, 17 in zayıflatılmış oldu.
SH proteini 64 (RSV alt grup A) veya 65 (RSV alt grup B) amino asitler, uzun türü Golgi 18 zarlarına çoğunlukla birikir II integral membran proteinidir. SH proteini, tek bir yüksek 20,21 korunmuş bir sarmal transmembran (TM) etki 19 tahmin vardır. C- ve N-terminal extramembrane etki lumenally / hücre dışı ve sitoplazmik sırasıyla yönlendirilir.
Hem sentetik TM domeni (kalıntılar 18-43) Ve tam uzunlukta SH proteini deterjanların çeşitli homopentamers oluşturmak için gösterilmiştir. homopentameric bir şekilde düzlemsel bir lipid çift tabakaları 22,23 kanal aktivitesi için sorumludur. Lipit TM monomerlerin doğru yönlendirme ilk His-22, bir lümene ilişkin olması yakın yönde arası sarmal için gösterdi alana özel kızılötesi dikroizma 23 kullanılarak belirlenmiştir. Aynı TM domeni yönü (DPC) dodesilfosfokolin olarak pentamerik proteinin tam uzunluğunun bir sarmal demeti yeniden 22 miseller NMR çalışmaları ile teyit edilmiştir. Bu 'misel' modelinde, tek bir a-helis TM domeni bir genişletilmiş B-hairpin C-terminal a-helisin göre N-terminal olarak sınırlanan ve edilmiştir. SH proteininin iki protonize kalıntıları, His-22 ve His-51, TM domeni (lumenally yönelimli) bulunur ve extramembrane C-terminali β firketenin ucunda sırasıyla (kadar kanal gözeneğinden). Bir bicellar Çevreyinment, ancak TM α-heliks His-51 kadar uzanır ve her ikisi de His artığı kanalı 24 lümenine erişilebilir. 22 hidrofobik yan zincirler (Ile-32, Ile-36, Ile-40 ve Leu-44), ve kaplı olan kanal yapısı, bir huni benzeri bir mimari 22 dar bölümün benimser (Cys-45, Ser-29) Ile-36 kanal lümen dar noktasını tanımlar. His-51 küçük açıklığın ucunda ise His-22, bu huni büyük açıklık yer almaktadır.
Bu yazıda, bir sedimantasyon denge modunda analitik santrifüj O'nun protonlanma SH, protein pentamerin istikrar etkiler olmadığını belirlemek için kullanılmıştır. Bu durumda, SH protein, literatürde bu SH protein yapılarını pentamerik oligomerler 22 göstermek için daha önce kullanılmış olan C14-betain deterjan içinde çözünmüştür.
Protokol
Bu protokol daha fazla ayrıntı ve özel hususlar 3, 25-28 sevk edilecek olan aşağıdaki kaynaklara dayanmaktadır.
2, H2O ile deterjan miseller 1. Yoğunluk eşleştirme
Not: tampon çözeltisi yoğunluklu deterjan miseller yoğunluğuna uyumlu olması gerekir. Ortak yoğunluk ayarlayıcı maddeler 2 H2O, H2 18 O, 2H 2 18 O, gliserol ve sakaroz 29 içerir. 'H 2 18 O 2 H2O ile aynı yoğunluğa sahiptir ve protein değiştirilebilir protonlar dötertumlanma istenmiyorsa, daha iyi bir seçim olabilir. Bu prosedürde, 50 mM Tris, pH 7.3, 3- (N, N-dimethylmyristylammonio) -propanesulfonate (C14SB) deterjan yoğunluğu, 100 mM NaCI 2 H2O ile uyumlu olacak Bir ilk tahmin olarak, aşağıdaki konsantrasyonlar2 H2O kullanılacaktır: 10, 30, ve% 50 hac / hac.
1.1. Örnek hazırlanması
- Aşağıdaki stok çözeltileri ve filtre bir 0.2 mikron bir şırınga filtreden geçirilmiştir sterilize hazırlanması: 50 ml, 500 mM Tris pH 7.3, 1 M NaCI (10 X tampon çözeltisi); 1 mi, 250 mM C14SB (50X deterjan çözeltisi).
- 20 ul 10X tampon çözeltisi, 4 ul 50X deterjan çözeltisi, 20 ul 2 H2O (% 99.9) ve 156 ul karıştırılarak numune çözeltisinin 200 ul hazırlayın H 2 O deiyonize 20 ul 2 H2O (% 99.9) ve 160 ul, 20 ul 10X tampon çözeltisi karıştırılarak bir referans çözeltisi, 200 ul hazırlayın H 2 O deiyonize
- Diğer 2 H2O konsantrasyonları için yineleyin 1.1.2, uygun 2 H2O ve H2O miktarlarını ayarlamaya,% 30 ve% 50, yani.
1.2. 6-kanal A MeclisiHücre içine UC hücreleri ve örnek yükleme.
Not: Örnek yükleme yöntemine bağlı olarak EAA hücrenin iki türü vardır. Hücreler mühürlü sonra hücreler yüklenebilir dış dolgu ise dış dolgu olmadan Hücreler, hücre sızdırmazlık önce yüklenecek olan. Harici-dolgu AUC hücre Meclis, daha önce 3 tarif edilmiştir. Bu protokolde, dış dolgu olmadan 6-kanal EAA hücre montajı anlatılmıştır. Ana fark, ayrıca sıkılır her iki tarafta vida halkalar olmasıdır, ve (Şek. 1) muhafaza fişleri gerek yoktur. montaj aşamalarında fark aşağıda belirtilmiştir.
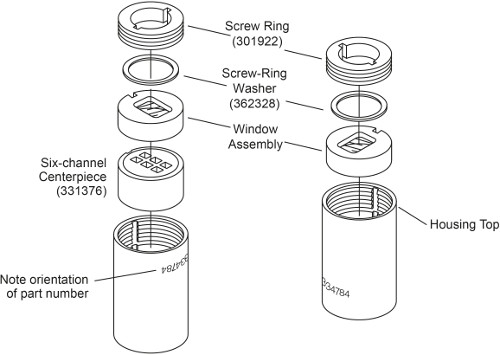
Şekil 1. Harici dolgu olmadan 6-kanal EAA hücre görünümü patladı. Bu rakam Beckman Coulter An-50 Ti modifiye ve An-60 Ti Analyti olmuşturcal Rotor, Hücreler ve karşı ağırlıklar kullanım kılavuzu.
- Safir penceresinin yerine kuvars penceresinde (Şekil. 2) Her EAA hücre için iki pencere meclisleri hazırlayın. Pencere tutucu içine pencere conta yerleştirin. Biraz pencere astarı viraj ve boşluk pencere tutucu şafta karşısında oluşturacak şekilde pencere tutucu içine yerleştirin. Pencere tutucu yivli işareti hizalayarak, pencere liner içine safir penceresini yerleştirin.
. Not: Bu tür bu yoğunluk eşleştirme deneyde olduğu gibi 30000 rpm üzerinde parazit ölçümleri, Bu nedenle yüksek hızda 28, 30 daha fazla ışık kırılma üretecek ve böylece kuvars cam sıkıştırılabilir ve safir camlar kullanılmaktadır. Bir safir cam kuvars penceresinden daha ağırdır ve yüzüne kazınmış bir "X" vardır.
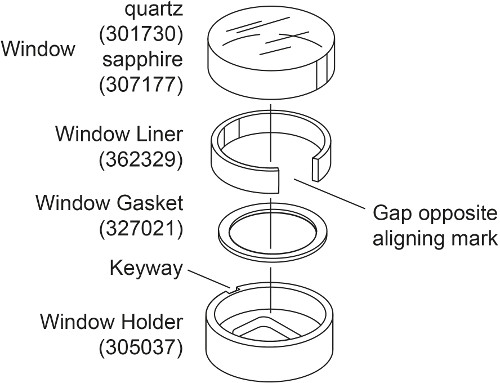
Şekil 2. patlamış görünümü of pencere montajı. Bu rakam Beckman Coulter An-50 Ti ve An-60 Ti Analitik Rotor, Hücreleri ve karşı ağırlıklar kılavuzdaki modifiye edilmiş
- Parça numarası baş aşağı hücre gövdesini yerleştirin. Konut tuşu ile uyumlu kama yatakları ile, (sol, Şek. 1) aşağı bakan pencere ile bir pencere montajı ardından, öncelikle hücre konut aşağı eğimli tarafı 6-sektör merkezinde içine kaydırın.
- Hafifçe kat spinkote vida halka konuları ve vida halkası yıkama. Pencere montaj üstüne bir vida halka pulu yerleştirin. Dışında bakan kelime "OUT" pencere gövde içine vida halkası takın. Hücre hizalama aracını kullanarak vida halkası elle sıkın.
- Tork anahtarı kullanarak, sadece 60 inç-pound vida halka sıkın.
- Parça numarası dik ve 12-öğle saatlerinde konumlandırılmış olan hücreyi yerleştirin. LSol satır içine OAD 120 ul referans ve sağ satır içine 110 ul örnek. Her numune ve referans doğru eşleştirilmiş emin olun.
Not: Tam numune hacmi kritik öneme sahip değildir, ancak örnek menisküs farklı olacak şekilde bir referans numunesi (5-10 ul) biraz daha fazla hacme sahip olması gerekir. - Dikkatle pencere (Şekil. 1, sağ) aşağı bakacak şekilde hücre gövdesi, bir pencere montaj içine kaydırın. Aşırı hücre rahatsız ve içeriğini dökmek için değil dikkat edin.
- Adımı yineleyin 1.2. 3 ve 1.2. 4, 120 inç-pound ikinci vida sıkma halkasını. Hücreyi ters çevirin ve 120 inç-pound ilk vidalı halka yeniden sıkın.
- , Rotor içine hücreleri yükleyin santrifüj içine rotor yüklemek ve üreticinin talimatlarına göre 28 monokromatörü yükleyin.
Not: Bu st AyrıntılarAP, bu referansta 3 bulunabilir.
1.3. Girişim ölçümü kurma
- Kısaca şu aşamada özetlenebilir olacak üreticinin talimatlarına göre, EAA enstrüman için kullanıcı arabirimi yazılımını başlatın ve 3000 rpm'de her hücre için lazer kurulum ve radyal kalibrasyonu yapın.
- Yeterli bir vakum sonra 1.3.1.1 (<100 mikron), 3000 rpm'de santrifüj çalıştırmak ulaşıldı. Kullanıcı arayüzü yazılımı girişim deseni önizlemesini ve yüksek kontrast elde etmek için lazer parametrelerini ayarlamak.
- "Denge" ve "Girişim" ölçüm belirterek | (Yeni Dosya Dosya) Yeni kurmak dosyası oluşturun. Bir sedimantasyon denge yöntemi ("Yöntem" düğmesi) 20 ° C'de çalışma sıcaklığı, 45000 rpm veya daha yüksek hangisi protein örnekleri için beklenen en yüksek hızında çalışacak ve 1 tarama toplamak için her 15 dakikada ayarlayın. MonitoHeteroAnalysis veri dosyaları açma ve en az 12 saat sonra "Maç" fonksiyonunu seçerek r denge ilerleme (yaklaşık gecede Şekil. 3).
Not: Benzer bir fonksiyonu da SEDFIT (Seçenekler | Yükleme Seçenekleri | Denge Test Yaklaşımı) mevcuttur.

Şekil HeteroAnalysis Maç işlevi 3. Sonuç. Maç işlevi ardışık tarama ve son tarama arasındaki RMSD karşılaştırarak denge ilerlemesini izlemek için kullanılabilir. X ekseni asimptotik RMSD değerleri ile gösterildiği gibi bu örneğin 8 saat sonra denge elde edilmesini gösterir.
1.4. Veri analizi
- Numunelerin her bir grubu için, 2 H2O konsantrasyonuna karşı radyal dağılım profili eğimini çizilir.
Not: Dağıtım çok sığ üstel o ap olacakyaklaşımlar çok doğrusallık. X ekseni ile kesişme noktasını eşleşen 2 H2O konsantrasyonuna karşılık gelir. - Daha doğru sonuçlar için, çeşitli çoğaltır deneyi gerçekleştirmek. Seçenek olarak ise, 2 H2O konsantrasyonunun daha dar bir aralık deneyi tekrar.
C14SB miselleri içine SH 2. çökelme dengesi
2.1. Run parametreler
- SEDNTERP kullanarak tampon yoğunluk ve viskozite, protein kısmi spesifik hacim ve santrifüj hızı hesaplayın. D 2 O konsantrasyonu da dahil olmak üzere, "Tampon Veri Seç" bölümündeki tampon ve yoğunluk seçin Compute hesaplamak ve buna göre tampon bileşenleri girmek için.
- 2.1.1.1 "V-bar" bölümünde protein kısmi spesifik hacim seçin Compute hesaplamak ve protein amino asit dizisini girin. "N = Bu monomer bir oligomer olun" en yüksek beklenen oligomerik boyutunu belirtinalan, bu durumda N = 5. ana penceresinde RPM alanındaki değerleri girerek hızını hesaplayın kadar σ ≈ 1; Bu radyal dağılım profili 25 iyi bir üstel şekli sağlamak için başparmak bir kuraldır.
Not: Bu, aşağıdaki gibi deney için hesaplanan değerler olarak: ρ = 1,03839 g / ml, η = 1,0267 cP = 0,7569 ml / g arasında, ω 1 = 16000 rpm. - Bir hız ve sonraki 25 de dağıtım profili arasında yeterli fark sağlamak için takip sonraki hızları hesaplayın.
Not: Bu da işlevinden yapılabilir hesaba çözüm sütunu (dolum hacmi) alır SEDFIT içinde, "denge rotor işlevi hızlandırır tahmin".
2.2. Numune hazırlanmasına,
- 5 mM C14SB ile 1 ml referans solüsyonu ve% 32,3 2 H 2 O hazırlayın 100 ul 10X tampon Solutio karıştırarak yoğunluk eşleştirme deney (bölüm 1), belirlenen şekilden, (aşama 1.1.1), 20 ul 50X deterjan çözeltisi (aşama 1.1.1), 323 ul 2 H2O (% 99.9) ve 527 ul H2O deiyonize
- Örneğin metanol veya% 50 h / h sulu asetonitril gibi uygun bir çözücü içinde, liyofilize edilmiş, HPLC ile saflaştırılmış, SH peptidleri (daha önce tarif edilen 31 ifadesi ve saflaştırılması) çözündürülür. Her bir seyreltilmiş bir 280 vermek üzere üç numune için bir mikrolitre ölçekli UV / Vis spektrometre ve kısım içinde çözülmüş peptidlerin A280 ölçümü, 12 mm = 0.3, 0.5 ve 0.8 (A 280, 10 mm = 0.25, 0.417 ve 0.67) 130 ul. Gecede örnekleri liyofilize ve tekrar süspansiyon 130 ul referans çözeltisi (adım 2.2.1) örnek çözümleri vermek.
Not: Trp, Tyr ve kalıntılarını içerdiği için, SH proteini 280 nm'de UV / Vis emme tespit edilebilir. Aromatik artıkların olmayan proteinler ya da müdahale ile, uygun bir kromofor ile etiketleyerek Bir Trp ihtiva eden mutant kullanılarak tespit edilebiliryerine absorbans ım ölçümleri. - Kuvars pencereli bir 6-kanal EAA hücre montajı bölüm 1.2 adımları izleyin. En yakın rotor merkezine rotor merkezi ve en düşük konsantrasyon numunesi (A 280, 12mm = 0.3) uzak (A 280, 12mm = 0.8) kanal yüksek konsantrasyon örneği yükleyin.
2.3. Absorbans ölçümleri ayarlama
- "Denge" ve "Absorbans" ölçümü belirterek | (Yeni Dosya Dosya) Yeni kurmak dosyası oluşturun. Dedektör dalga boyu olarak 280 nm belirtin.
- Tek Tarama Radyal adım büyüklüğü = 0.01 cm, çoğaltır = 3 (düşük çözünürlükte, hızlı) ile örneğin, düşük çözünürlükte veri toplama belirterek, Tarama Seçenekleri "ilk taramadan önce Radyal kalibrasyon" kontrol ve yürüterek 3000 rpm'de radyal kalibrasyon yapın . Tarama tamamlandıktan sonra, seçeneğinin işaretini kaldırın.
- "(Metho bir sedimantasyon denge yöntemi kurmak"düğmesi) d 20 ° C'de, adım 2.1.3 hesaplanan ilk hızda çalışacak ve 1 Tarama her 30 dakikada bir toplamak. Her hücrelerin "Detay", adım 2.3.2 gibi düşük çözünürlükte veri toplama belirtin. En az 18 saat sonra "Maç" fonksiyonunu HeteroAnalysis veri dosyaları açma ve seçerek denge ilerlemesini izlemek (yaklaşık gecede, Şek. 4).
Not: sonraki hızları daha az zaman alacak ise denge ulaşılması, ilk hız için önemli ölçüde daha uzun sürebilir.
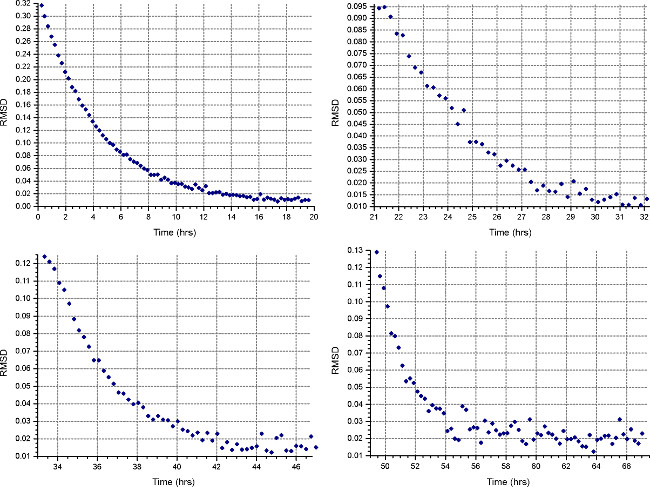
HeteroAnalysis Maç işlevinden Şekil 4. sonuçları. Birinci ve ikinci hızları (sol üst ve sağ) dengeye ulaşmış görünüyor, ama emin olmak için bir kaç saat daha beklemek daha iyidir. Buna karşılık, üçüncü ve dördüncü hızları (alt sol ve sağ) açıkça dengeye ulaşmıştırdaha kısa sürede. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Denge ulaşıldığında, Radyal adım büyüklüğü = 0.001 cm, çoğaltır = 10 (yüksek çözünürlüklü, yavaş) ile yüksek çözünürlükte, örneğin tek bir tarama toplamak.
- Tarama tamamlandıktan sonra, bir sonraki hız için adım 2.3.3 ve 2.3.4 tekrarlayın.
- Zaman, her hız için denge bilinen (hesaplanan veya deneyim) ulaşması için gerekli zaman İsteğe bağlı, her biri için dengeleme süre sonra 1 tarama toplamak için adım ve 2.1.3 hesaplanan tüm hızları dahil sedimantasyon denge yöntemi tarama kurmak hız. Bu durumda, her bir hücrelerin "Detay" yüksek çözünürlüklü veri toplama belirtin.
2.4. SEDFIT ve SEDPHAT Veri analizi
Not: Daha fazla bilgi ve veri analizi okuyucu olarak hususlar için t denirwww.analyticalultracentrifugation.com: Aşağıdaki web o.
- Açık yüksek çözünürlüklü SEDFIT içinde taramalar (Veri | yük sedimantasyon denge verileri) ve 3 kanallar (; | Yükleme Seçenekleri | 3 Alt Grupları 6-kanal ham veri kaydetme Seçenekler bu farklı her bir örnek için konsantrasyonlara karşılık) veri bölünmüş.
- Yeniden-açık SEDFIT aynı örnek ve aynı konsantrasyonda ancak farklı hızlarda ait veri dosyaları. Menisküs (dikey kırmızı çizgi), hücre alt (dikey mavi çizgi) ve montaj sınırları (dikey yeşil çizgiler) ayarlayın ve SEDPHAT kullanılmak üzere veri ihracat (Veri | SEDPHAT İhracat Verileri). Girdi istendiği gibi rotor türü ve merkezinde türü yanı sıra, adım 2.1.1 hesaplanan parametreler. Her numune ve konsantrasyon için bu adımı tekrarlayın.
- SEDPHAT aynı örnekten tüm verileri (tüm konsantrasyonlar ve hızlar) açın ve Deney Parametreleri doldurun; Bir örnek, Şekil l'de gösterilmiştir. 5.
Not: D 2 O tamponu Deut ilave edildiğinde Değiştirilebilir protonlar birleşmeleri T ciddi ölçüde suda çözünür proteinleri, protein moleküler ağırlığı değiştirebilir. Membran-gömülü bölgeler döviz korunur, çünkü zar proteinleri, SH proteini gibi özellikle küçük olanlar, daha az etkilenir. Bunu düzeltmek için, girişi "D mol fraksiyonu tampon".
Not: Bu aşamada menü Veri seçerek ayrı ayrı düzenlenmiş veri kümesi kaydetmek için tavsiye edilir | Yeni Yapılandırması Olarak Kopyala Tüm Veri ve Kaydet. - Bir Model seçin ve bu model için Küresel Parametreleri doldurun.
Not: Örnek olarak, "monomer-n-mer kendi kendine birleşmeme özelliği" modeli ve parametreleri Şekil l'de gösterilmektedir. 6.
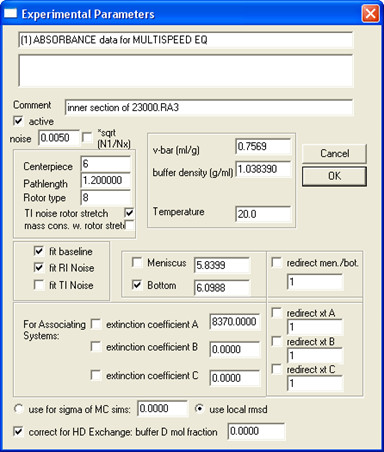
Şekil 5. Deneysel Parametreler doldurmak için nasıl bir örnek.
dosya / ftp_upload / 52.404 / 52404fig6.jpg "/>
Şekil 6. Monomer-n-Mer Self-Dernek modeli için Küresel Parametreleri doldurmak için nasıl bir örnek.
- Menü Fit seçerek Küresel Fit çalıştırın | Küresel Fit ve fit yakınsak kadar bekleyin. Aşağı Not (veya bir ekran görüntüsü almak) uydurma sonuçlar, özellikle küresel azaltılmış ki-kare ve K adet bir günlük değerleri. Termodinamik Bilgileri Göster | sığdırma veri ve menü Kopyala ve Display montaj artıklar gibi diğer verileri ayıklayın.
- Küresel Parametreler dönün ve (1) monomer molekül ağırlığı uyacak ve adım 2.4.5 tekrarlamak için M kontrol edin. Takılan molekül ağırlığı ve küresel azaltılmış ki-kare not edin.
- Adımı yineleyin 2.4.3 her model test edilecek için 2.4.6 ve düşük küresel ki-kare değerinin yanı sıra montaj artıklar karşılaştırarak, her modelin uygun kalitesini karşılaştırmak için.
Not: Küçük ve rastgele uydurma artıklar genelde iyi bir uyum gösterir, ve olur en uygun modeliküçük küresel azaltılmış ki-kare var. monte monomer molekül ağırlığı ve ki-kare değeri sabit (teorik) molekül ağırlığı bundan önemli ölçüde farklılık olmamalıdır. - İlk seçme İstatistik göre değer elde günlüğüne Ka için güven aralığı hesaplayın | Kritik hata yüzey projeksiyonları için ki-kare ve istenen güven aralığı girilerek. Günlük Ka için ki-kare değerleri elde etmek için Küresel Parametreleri iletişim Ka giriş 1-boyutlu hata yüzey projeksiyon oluşturun ve seçimini kaldırabilirsiniz | Sonraki İstatistik gidin.
Not: okuyucular, bu yöntemin 33 yöntemi 32 yanı sıra illüstrasyon hakkında daha fazla bilgi için aşağıdaki kaynakları (http://www.analyticalultracentrifugation.com/ sedphat / statistics.htm) başvurmaları önerilir.
Sonuçlar
50 mM Tris, C14SB deterjan miseller radyal dağılım profili, 100 mM NaCI, pH 7.3 formları doğrusal modeli (Şekil 7A) monte edilebilir, çok sığ bir üslü. Bu dağılım eğimi ters D 2 O konsantrasyonu (Şekil 7B) ile korele edilir. eğim sıfır olduğu nokta, eşleştirme D 2 O konsantrasyonu,% 32.3 olarak bulunmuştur, yani.
Aşağıda Şekil 7 Bkz.
Aynı deney f...
Tartışmalar
Bu çalışma, numune hazırlama ve denge sedimantasyon kullanılarak deterjan küçük bir zar proteini oligomerizasyon analizi için bir deney protokolü sağlar. yoğunluk eşleme aşaması gerekli değildir olarak açıklanan protokol, aynı derecede geçerlidir -ve çözünür proteinler için simpler- olup. Gerçekten de, deterjanlar ve proteinin bir karışımından teşekkül eder. Parçacık flotasyon katkıda bulunmaz, böylece sedimantasyon çalışmalar yapmak, deterjan yerçekimi alanına görünmez olmalı...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This work has been funded by the National Research Foundation grant NRF-CRP4-2008-02 (J.T.) and Tier 1 grant RG 51/13.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3-(N,N-dimethylmyristylammonio)propanesulfonate | Sigma | T0807 | |
| Deuterium oxide 99.8% | Cambridge Isotope | DLM-4-99.8 | |
| An-50 Ti Rotor, Analytical, 8-Place | Beckman Coulter | 363782 | |
| An-60 Ti Rotor, Analytical, 4-Place | Beckman Coulter | 361964 | |
| Cell housing | Beckman Coulter | 334784 | |
| 12 mm six-channel centerpiece, epon charcoal-filled | Beckman Coulter | 331376 | |
| Window holder | Beckman Coulter | 305037 | |
| Window gasket | Beckman Coulter | 327021 | |
| Window liner | Beckman Coulter | 362329 | |
| Sapphire window | Beckman Coulter | 307177 | |
| Quartz window | Beckman Coulter | 301730 | |
| Screw-ring washer | Beckman Coulter | 362328 | |
| Screw ring | Beckman Coulter | 301922 | |
| Spinkote | Beckman Coulter | 306812 | |
| Torque stand assembly | Beckman Coulter | 361318 | |
| Counterbalance | Beckman Coulter | 360219 | |
| Cell alignment tool | Beckman Coulter | 362340 | |
| SEDNTERP | http://bitcwiki.sr.unh.edu/index.php/Main_Page | ||
| HeteroAnalysis | http://www.biotech.uconn.edu/auf/?i=aufftp | ||
| SEDFIT | http://www.analyticalultracentrifugation .com/sedfit.htm | ||
| SEDPHAT | http://www.analyticalultracentrifugation .com/sedphat/default.htm |
Referanslar
- Laue, T. M., Stafford, W. F. Modern applications of analytical ultracentrifugation. Annu. Rev. Biophys. Biomol. Struct. 28, 75-100 (1999).
- Lebowitz, J., Lewis, M. S., Schuck, P. Modern analytical ultracentrifugation in protein science: A tutorial review. Protein Sci. 11, 2067-2079 (2002).
- Balbo, A., Zhao, H., Brown, P. H., Schuck, P. . Assembly, Loading, and Alignment of an Analytical Ultracentrifuge Sample Cell. , e1530 (2009).
- Rivas, G., Stafford, W., Minton, A. P. Characterization of heterologous protein-protein interactions using analytical ultracentrifugation. Methods-a Companion to Methods in Enzymology. 19, 194-212 (1999).
- Howlett, G. J., Minton, A. P., Rivas, G. Analytical ultracentrifugation for association and assembly the study of protein. Curr. Opin. Chem. Biol. 10, 430-436 (2006).
- MacGregor, I. K., Anderson, A. L., Laue, T. M. Fluorescence detection for the XLI analytical ultracentrifuge. Biophys. Chem. 108, 165-185 (2004).
- Phizicky, E. M., Fields, S. Protein-Protein Interactions - Methods for Detection and Analysis. Microbiol. Rev. 59, 94-123 (1995).
- Alexandrov, A. A facile method for high-throughput co-expression of protein pairs. Mol. Cell. Proteomics. 3, 934-938 (2004).
- Nooren, I. M. A., Thornton, J. M. Structural characterisation and functional significance of transient protein-protein interactions. J. Mol. Biol. 325, 991-1018 (2003).
- Ebel, C. Sedimentation velocity to characterize surfactants and solubilized membrane proteins. Methods. 54, 56-66 (2011).
- Minton, A. P. Quantitative characterization of reversible macromolecular associations via sedimentation equilibrium: an introduction. Exp. Mol. Med. 32, 1-5 (2000).
- Dowell, S. F. Respiratory syncytial virus is an important cause of community-acquired lower respiratory infection among hospitalized adults. J. Infect. Dis. 174, 456-462 (1996).
- Bukreyev, A., Whitehead, S. S., Murphy, B. R., Collins, P. L. Recombinant respiratory syncytial virus from which the entire SH gene has been deleted grows efficiently in cell culture and exhibits site-specific attenuation in the respiratory tract of the mouse. J. Virol. 71, 8973-8982 (1997).
- Fuentes, S., Tran, K. C., Luthra, P., Teng, M. N., He, B. Function of the respiratory syncytial virus small hydrophobic protein. J. Virol. 81, 8361-8366 (2007).
- Jin, H. Recombinant respiratory syncytial viruses with deletions in the NS1, NS2, SH, and M2-2 genes are attenuated in vitro and in vivo. Virology. 273, 210-218 (2000).
- Karron, R. A. Respiratory syncytial virus (RSV) SH and G proteins are not essential for viral replication in vitro: clinical evaluation and molecular characterization of a cold-passaged, attenuated RSV subgroup B. Proc. Nat. Acad. Sci. USA. 94, 13961-13966 (1997).
- Whitehead, S. S. Recombinant respiratory syncytial virus bearing a deletion of either the NS2 or SH gene is attenuated in chimpanzees. J. Virol. 73, 3438-3442 (1999).
- Rixon, H. W. The small hydrophobic (SH) protein accumulates within lipid-raft structures of the Golgi complex during respiratory syncytial virus infection. J. Gen. Virol. 85, 1153-1165 (2004).
- Collins, P. L., Mottet, G. Membrane orientation and oligomerization of the small hydrophobic protein of human respiratory syncytial virus. J. Gen. Virol. 74, 1445-1450 (1993).
- Collins, P. L., Olmsted, R. A., Johnson, P. R. The small hydrophobic protein of human respiratory syncytial virus: comparison between antigenic subgroups A and B. J. Gen. Virol. 71, 1571-1576 (1990).
- Chen, M. D., Vazquez, M., Buonocore, L., Kahn, J. S. Conservation of the respiratory syncytial virus SH gene. J. Infect. Dis. 182, 1228-1233 (2000).
- Gan, S. W. The small hydrophobic protein of the human respiratory syncytial virus forms pentameric ion channels. J. Biol. Chem. 287, 24671-24689 (2012).
- Gan, S. W., Ng, L., Xin, L., Gong, X., Torres, J. Structure and ion channel activity of the human respiratory syncytial virus (hRSV) small hydrophobic protein transmembrane domain. Protein Sci. 17, 813-820 (2008).
- Li, Y. Inhibition of the Human Respiratory Syncytial Virus Small Hydrophobic Protein and Structural variations in a bicelle environment. J. Virol. 88 (22), 11899-914 (2014).
- Burgess, N. K., Stanley, A. M., Fleming, K. G. Determination of membrane protein molecular weights and association equilibrium constants using sedimentation equilibrium and sedimentation velocity. Meth. Cell. Biol. 84, 181-211 (2008).
- Cole, J. L., Lary, J. W., Moody, T. P., Laue, T. M. Analytical Ultracentrifugation: Sedimentation Velocity and Sedimentation Equilibrium. Meth. Cell. Biol. 84, 143-179 (2008).
- Fleming, K. G. Determination of membrane protein molecular weight using sedimentation equilibrium analytical ultracentrifugation. Curr. Protoc. Prot. Sci. 53, 17.12.11-17.12.13 (2008).
- . . An-50 Ti and An-60 Ti Analytical Rotor, Cells, and Counterbalance. , (2005).
- Mayer, G. Studying membrane proteins in detergent solution by analytical ultracentrifugation: Different methods for density matching. Prog. Colloid Polym. Sci. 113, 176-181 (1999).
- Laue, T. Ch. 20.3. Current Protocols in Protein Science. 20, 20.23.21-20.23.13 (2001).
- Gan, S. W. The Small Hydrophobic Protein Of The Human Respiratory Syncytial Virus Forms Pentameric Ion Channels. J. Biol. Chem. 287, 24671-24689 (2012).
- Bevington, P. R., Robinson, D. K. . Data reduction and error analysis for the physical sciences. 336, (1969).
- Schuck, P., Radu, C. G., Ward, E. S. Sedimentation equilibrium analysis of recombinant mouse FcRn with murine IgG1. Molecular Immunology. 36, 1117-1125 (1999).
- Gan, S. W., Vararattanavech, A., Nordin, N., Eshaghi, S., Torres, J. A cost-effective method for simultaneous homo-oligomeric size determination and monodispersity conditions for membrane proteins. Anal. Biochem. 416, 100-106 (2011).
- Montserret, R. NMR structure and ion channel activity of the p7 protein from hepatitis C virus). J. Biol. Chem. 285, 31446-31461 (2010).
- Stouffer, A. L., DeGrado, W. F., Lear, J. D. Analytical Ultracentrifugation Studies of the Influenza M2 Homotetramerization Equilibrium in Detergent Solutions. Progr Colloid Polym Sci. 131, 108-115 (2006).
- Sorkin, A., von Zastrow, M. Signal transduction and endocytosis: Close encounters of many kinds. Nat. Rev. Mol. Cell Biol. 3, 600-614 (2002).
- Gan, S. W., Ng, L., Lin, X., Gong, X., Torres, J. Structure and ion channel activity of the human respiratory syncytial virus (hRSV) small hydrophobic protein transmembrane domain. Protein science : a publication of the Protein Society. 17, 813-820 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır