Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
L'équilibre de sédimentation d'une Membrane Protein Petit Oligomer formation: Effet de l'histidine Protonation sur pentamériques stabilité
Dans cet article
Résumé
Sedimentation equilibrium (SE) can be used to study protein-protein interactions in a physiological environment. This manuscript describes the use of this technique to determine the effect of pH on the stability of a homo-pentamer formed by the small hydrophobic (SH) protein encoded by the human syncytial respiratory virus (hRSV).
Résumé
Ultracentrifugation analytique (AUC) peut être utilisé pour étudier les interactions entre macromolécules réversible sur une large gamme de forces d'interaction et dans des conditions physiologiques. Cela rend AUC une méthode de choix pour évaluer quantitativement stoechiométrie et thermodynamique des homo- et hétéro-association qui sont transitoires et réversibles dans les processus biochimiques. Dans la modalité de l'équilibre de sédimentation (SE), un équilibre entre la diffusion et la sédimentation présente un profil en fonction de la distance radiale qui dépend d'un modèle d'association spécifique. Ici, un protocole détaillé est décrit SE afin de déterminer la taille et de monomère-monomère association énergie d'une petite oligomère de protéine de membrane en utilisant une ultracentrifugeuse analytique. AUC-ES-étiquette est libre, basé uniquement sur des principes physiques, et peut être utilisé sur les deux protéines solubles et membranaires eau. Un exemple est illustré de celle-ci, la petite hydrophobe (SH) à la protéine de virus syncytial respiratoire humain (hRSV), Un polypeptide de 65 acides aminés avec un seul transmembranaire (TM) de domaine α-hélicoïdale qui forme des canaux ioniques pentamères. Sur la base des données de structure RMN montre que la protéine SH a deux résidus His protonable dans son domaine transmembranaire qui sont orientés face de la lumière du canal. SE expériences ont été conçues pour déterminer comment le pH affecte constante d'association et de la taille oligomères de la protéine SH. Bien que la forme pentamérique a été préservée dans tous les cas, sa constante d'association a été réduite à un pH faible. Ces données sont en accord avec un pH dépendance similaire observée pour l'activité des canaux SH, conformément à une orientation luminale des deux résidus His dans la protéine SH. Ce dernier peut éprouver une répulsion électrostatique et la stabilité d'oligomères réduite à faible pH. En résumé, cette méthode est applicable à chaque fois que des informations quantitatives sur les changements subtils association protéine-protéine dans des conditions physiologiques doivent être mesurés.
Introduction
Ultracentrifugation analytique 1-5 est une des méthodes les plus importantes pour étudier les interactions des macromolécules dans des conditions physiologiques, étant accessibles à la fois aux interactions faibles et forts. Le procédé est sans marqueur et utilise l'absorption de lumière ou d'interférences, et même des systèmes optiques de fluorescence peut être utilisée pour accéder à des plages de concentration de plusieurs ordres de magnitude 6.
Cette méthode est particulièrement utile étant donné que la plupart des processus biochimiques dépendent des interactions réversibles. La stoechiométrie et la force de ces interactions doivent être caractérisée quantitativement à comprendre des processus biologiques, et un certain nombre de méthodes existent à cette fin 7, 8. Cependant, les interactions transitoires sont difficiles à étudier neuf.
Le choix d'une méthode pour caractériser les interactions macromoléculaires dépend de sa nature statique ou dynamique. Dans le premier cas, Sedim vitesse de entation (SV) est utilisé, où le taux de transport radial est mesuré et complexes sont fractionné sur la base des différences de masse flottante et la forme.
En revanche, les associations dynamiques qui sont réversibles sur l'échelle de temps de l'expérience ne peuvent pas être physiquement séparés. Dans ce cas, l'auto-hétéro ou interactions conduisant à des interactions non covalentes sont dans un équilibre qui dépend de la concentration totale en protéines. Ces interactions dynamiques peuvent être étudiés à la fois l'équilibre de sédimentation (SE) et de la vitesse de sédimentation (SV) 10. Toutefois, le premier procédé est plus simple à réaliser et est décrite ici. Dans SE, la centrifugation est réalisée à une vitesse suffisamment basse de sorte qu'un équilibre est atteint entre la diffusion et la sédimentation. À ce stade, le profil d'équilibre d'un signal optique (UV-VIS) en fonction de la distance radiale, peut être analysé en utilisant des modèles thermodynamiques prédéfinis pour les associations 11.
ve_content "> Dans le présent document, une étude de sédimentation à l'équilibre est présenté de l'auto-association d'une protéine de membrane virale qui forme canaux ioniques. En raison de son caractère hydrophobe, l'expérience est conduite en présence d'un détergent, et dans ce cas, la densité de solvant doit être adaptée à celle du détergent. Cependant, le protocole décrit serait identique dans le cas d'une protéine soluble dans l'eau, à l'exception qu'aucun solvant de recherche de densité serait nécessaire.La protéine utilisée est codé dans le virus respiratoire syncytial humain (hRSV), un pneumovirus enveloppé dans la famille de paramyxoviridae qui cause la maladie des voies respiratoires inférieures chez les nourrissons, les personnes âgées et les populations immunodéprimées dans le monde entier 12. Jusqu'à 64 millions de cas déclarés d'infection hRSV et 160 000 décès surviennent chaque année.
Le génome de hRSV transcrit 11 protéines, y compris les trois protéines membranaires F, G, et petite hydrophobe (SH). protéine SH est impliquédans la pathogenèse de l'infection par le VRS. RSV dépourvu du gène SH (de RSVΔSH) était viable, a provoqué la formation de syncytia et a grandi ainsi que le type sauvage (WT) virus 13-16. Cependant, le virus RSVΔSH reproduit 10 fois moins efficace que le WT dans le tractus respiratoire supérieur 15, 16. En outre, le virus a été atténuée dans RSVΔSH chez la souris in vivo et des modèles de chimpanzés 13, 17.
La protéine SH est un groupe (sous-groupe de RSV A) 64 ou 65 (VRS sous-groupe B) acides aminés II protéine de membrane intégrale qui se accumule principalement dans les membranes de Golgi le compartiment 18 de type long. protéine SH a une seule prédit une hélice transmembranaire (TM) domaine 19 qui est hautement conservée 20,21. Les domaines de extramembrane C- et N-terminales sont orientées lumenally / extracellulaire et cytoplasmique, respectivement.
Les deux domaines TM synthétique (résidus 18-43) Et pleine longueur de protéine SH ont été représentés pour former homopentamers dans une variété de détergents. La forme homopentameric est responsable de l'activité du canal dans des bicouches lipidiques planes 22,23. L'orientation correcte des monomères de TM dans la bicouche lipidique a été déterminée en utilisant le site dichroïsme infrarouge spécifique 23, qui a montré Sa-22 pour être dans un luminal, près de inter-hélicoïdale, l'orientation. Le même domaine TM orientation a été confirmée par des études de RMN qui reconstruit le pentamère un faisceau en hélice de la protéine de pleine longueur dans dodécylphosphocholine (DPC) 22 micelles. Dans ce modèle de «micelles», un seul domaine de TM hélicoïdale a- était flanqué N-terminale par une hélice, et C-terminale par un b-épingle prolongée. Les deux résidus protonables de protéine SH, His-22 et His-51, se trouvent dans le domaine TM (orienté lumenally), et à l'extrémité de la extramembrane β épingle C-terminal (loin du pore du canal), respectivement. Dans un enviro bicellarnement, cependant, la TM α-hélice se étend jusqu'à His-51, et les deux résidus His, sont disponibles à la lumière du canal 24. Structure de canal adopte une architecture en forme d'entonnoir 22, où la région étroite (Ser-29 à Cys-45) 22 est revêtu avec des chaînes latérales hydrophobes (Ile-32, Ile-36 Ile-40 et Leu-44), et Ile-36 définit le point le plus étroit dans la lumière du canal. His-22 est située à la plus grande ouverture de cet entonnoir, alors que His-51 est à l'extrémité de la plus petite ouverture.
Dans le présent document, la centrifugation analytique dans un mode de sédimentation à l'équilibre a été utilisée pour déterminer si sa protonation affecte la stabilité de la protéine pentamère SH. Dans ce cas, la protéine SH a été solubilisé dans un détergent C14-bétaïne, qui a été utilisé précédemment pour montrer que les formes de la protéine SH oligomères 22 pentamères.
Protocole
Ce protocole est basé sur les ressources suivantes, qui doivent être visées pour plus de détails et des considérations spéciales 3, 25-28.
1. Densité appariement des micelles de détergent avec 2 H 2 O
Remarque: La densité de la solution tampon doit être adaptée à la densité des micelles de détergent. Des agents d'ajustement de densité communs incluent 2 H 2 O, H 2 18 O, 2 H 2 18 O, le glycérol et le saccharose 29. H 2 O 18 a la même densité que 2 H 2 O et peut être un meilleur choix si deutération de protons échangeables dans la protéine ne est pas souhaitée. Dans cette procédure, la densité de l'acide 3- (N, N-dimethylmyristylammonio) -propanesulfonate (C14SB) détergent dans du Tris 50 mM pH 7,3, NaCl 100 mM seront recherchés à 2 H 2 O. Comme une estimation initiale les concentrations suivantes de2 H 2 O est utilisé: 10, 30, et 50% v / v.
1.1. La préparation des échantillons
- Préparer les solutions et filtre mères suivantes stériliser à travers un filtre à seringue de 0,2 um: 50 ml de Tris 500 mM pH 7,3 et 1 M de NaCl (solution tampon 10X); 1 mL C14SB 250 mM (solution de détergent 50X).
- Préparer 200 ul de solution d'échantillon en mélangeant 20 ul de solution tampon 10X, 4 ul de solution détergente 50X, 20 ul de H 2 O 2 (99,9%) et 156 ul de H 2 O. désionisée Préparez aussi 200 pi de solution de référence en mélangeant 20 ul solution tampon 10X, 20 pi 2 H 2 O (99,9%), et 160 pi H 2 O. déminéralisée
- Répétez l'étape 1.1.2 pour les autres 2 H 2 O concentrations, soit 30% et 50%, en ajustant les montants 2 H 2 O et H 2 O appropriée.
1.2. Assemblée des six-canal AUC cellules et le chargement des échantillons dans les cellules.
Remarque: Il ya deux types de cellules ASC selon la méthode de chargement d'échantillon. Cellules sans remplissage externe doit être chargé avant de sceller la cellule, alors que externe remplissent les cellules peuvent être chargés après que les cellules sont scellées. Assemblée d'une cellule ASC externe de remplissage a été décrit précédemment 3. Dans ce protocole, l'assemblage d'une cellule 6 canaux AUC sans remplissage externe est décrit. La principale différence est qu'il a des bagues à vis des deux côtés qui doivent être durcies séparément, et il n'a pas besoin bouchons de boîtier (Fig. 1). La différence dans les étapes d'assemblage sont mis en évidence ci-dessous.
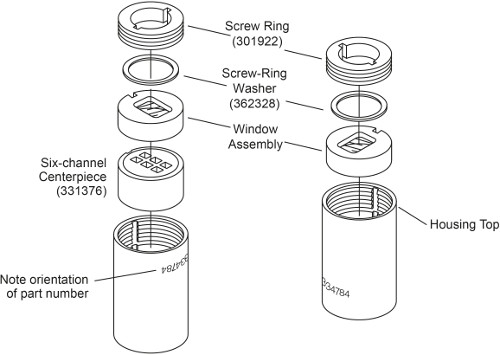
Figure 1. Vue d'une cellule AUC 6-canal sans remplissage externe éclatée. Ce chiffre a été modifié depuis Beckman Coulter An-50 et An Ti-Ti 60 Analytical Rotor, cellules, et l'utilisateur d'équilibrage manuel.
- Préparer deux ensembles de fenêtres pour chaque cellule AUC avec fenêtre saphir au lieu de la fenêtre de quartz (Fig. 2). Placer la fenêtre dans le porte-joint de la fenêtre. Plier légèrement la fenêtre doublure et le placer dans le support de fenêtre de telle sorte que la fente est formée en face de la rainure de porte-fenêtre. Placez la fenêtre de saphir dans la fenêtre revêtement, en alignant la marque avec la rainure de porte-fenêtre.
Remarque:. La fenêtre de quartz est compressible et donc se produire réfraction plus de lumière à grande vitesse 28, 30 Par conséquent, pour les mesures d'interférence au-dessus 30 000 tours par minute, comme dans cette expérience d'adaptation de densité, fenêtres en saphir sont utilisés. Une fenêtre en saphir est plus lourd que la fenêtre de quartz et a un "X" gravé sur le côté.
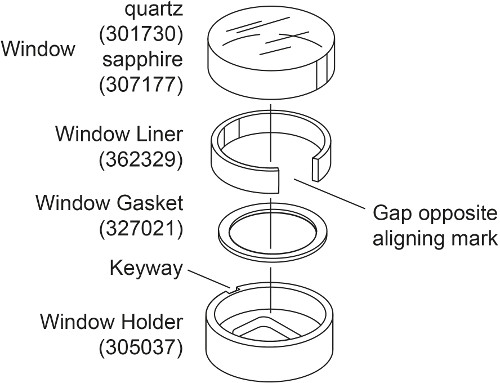
Figure 2. Vue éclatée of l'ensemble de fenêtre. Ce chiffre a été modifié depuis Beckman Coulter An-50 et An Ti-Ti 60 analytique Rotor, cellules, et le manuel utilisateur de Chariot
- Placer le boîtier de la cellule avec le numéro de pièce à l'envers. Avec les rainures de clavettes alignées avec la clé du logement, coulissant dans le boîtier de cellule d'une part un élément central 6 du secteur avec le côté biseauté vers le bas, suivi d'un ensemble de fenêtre de la fenêtre vers le bas (Fig. 1, à gauche).
- Enduire la vis fils de sonnerie et à vis rondelle avec spinkote. Placer une rondelle annulaire de la vis sur le dessus de l'assemblage de fenêtre. Installez l'anneau de vis dans le boîtier de la fenêtre avec le mot "OUT" face à l'extérieur. Serrez à la main l'anneau de vis en utilisant l'outil d'alignement des cellules.
- Utilisation de la clé dynamométrique, serrer la bague de vis pour seulement 60 livres-pouces.
- Placez la cellule avec le numéro de pièce verticale et positionnée à 12h. LADO 120 pi référence dans les rangées gauche et 110 pi échantillon dans les bonnes lignes. Veiller à ce que chaque échantillon et la référence est correctement appariés.
Remarque: volume d'échantillon exacte ne est pas critique, mais la référence doit avoir un peu plus de volume de l'échantillon (5 à 10 pi) de sorte que l'échantillon sera distinct ménisque. - Faites glisser délicatement dans le boîtier de la cellule un ensemble de fenêtre avec la fenêtre vers le bas (Fig. 1, à droite). Prenez soin de ne pas perturber la cellule excessive et renverser le contenu.
- Répétez l'étape 1.2. 3 et 1,2. 4, serrant la deuxième anneau de vis à 120 pouces-livres. Inversez la cellule et resserrez le premier anneau de la vis à 120 pouces-livres.
- Charger les cellules dans le rotor, le rotor installer dans la centrifugeuse et installer le monochromateur selon les instructions du fabricant 28.
Remarque: Les détails sur ce stEP peut également être trouvée dans cette référence 3.
1.3. Mise en place de mesure d'interférence
- Démarrer le logiciel d'interface utilisateur pour l'instrument AUC et effectuer la configuration et de calibrage de laser radial pour chacune des cellules à 3000 rpm, selon les instructions du fabricant, qui seront brièvement résumées dans l'étape suivante.
- 1.3.1.1 Après vide suffisant a été atteint (<100 microns), exécutez la centrifugeuse à 3000 rpm. Aperçu de l'image d'interférence dans le logiciel d'interface utilisateur et d'ajuster les paramètres du laser afin d'obtenir le contraste le plus élevé.
- Créer un nouveau ajuster le fichier (Fichier | Nouveau fichier) précisant "Equilibrium" et "interférences" mesure. Mettre en place une méthode de sédimentation à l'équilibre (bouton «méthode») pour fonctionner à 45 000 tours par minute ou la vitesse maximale prévue pour les échantillons de protéines, selon le plus élevé, avec une température de fonctionnement à 20 ° C et de recueillir une analyse toutes les 15 minutes. Monitor l'équilibre des progrès en ouvrant les fichiers de données dans HeteroAnalysis et en sélectionnant la fonction «Match» après au moins 12 heures (environ nuit, Fig. 3).
Remarque: une fonction similaire est également disponible en SEDFIT (Options | Chargement Options | Approche de test à l'équilibre).

Figure 3. Résultat de la fonction HeteroAnalysis Match. La fonction de match peut être utilisé pour suivre les progrès de l'équilibre en comparant RMSD entre les balayages successifs et la dernière analyse. Cet exemple montre le niveau d'équilibre après 8 h comme indiqué par les valeurs de DSMR asymptotique à l'axe X-.
1.4. L'analyse des données
- Pour chaque ensemble d'échantillons, tracer la pente du profil de distribution radiale contre la concentration H 2 O 2.
Remarque: La distribution sera un très faible exponentielle qui apapproches linéarité. Interception de l'axe X correspond à la concentration en H 2 O 2 correspondant. - Pour des résultats plus précis, réaliser l'expérience dans plusieurs répétitions. Sinon, répéter l'expérience avec une gamme étroite de 2 H 2 O concentration.
2. équilibre de sédimentation dans des micelles SH C14SB
2.1. Les paramètres de course
- Calculer la densité et de la viscosité de la mémoire tampon, le volume spécifique partiel de la protéine et la vitesse de centrifugation en utilisant SEDNTERP. Pour calculer la densité et de la viscosité de la mémoire tampon, sélectionnez Compute section «Data Buffer Sélectionnez" et saisissez les composants tampons en conséquence, y compris le D 2 O concentration.
- 2.1.1.1 pour calculer le volume spécifique partiel de la protéine, sélectionnez Compute section "V-bar" et entrez dans la séquence de la protéine acide aminé. Indiquez la taille oligomères plus attendue dans "Faire un oligomère de ce monomère: N ="terrain, dans ce cas N = 5. Calculer la vitesse en entrant des valeurs dans le domaine de RPM sur la fenêtre principale jusqu'à σ ≈ 1; ce est une règle de base pour assurer une bonne forme exponentielle du profil de distribution radiale 25.
Remarque: Les valeurs calculées pour cette expérience a été comme suit: ρ = 1,03839 g / ml, η = 1,0267 CP = 0,7569 ml / g, ω 1 = 16 000 rpm. - Calculer les vitesses suivantes à suivre pour assurer une différence suffisante entre le profil de distribution à une vitesse 25 et le suivant.
Note: Ceci peut également être fait à partir de la fonction «estimer accélère équilibre rotor fonction" dans SEDFIT, qui prend en compte la colonne de solution (volume de remplissage).
2.2. Préparation des échantillons
- Préparer la solution 1 ml de référence avec mM C14SB 5 et 32,3% 2 H 2 O comme déterminé à partir de l'expérience d'adaptation de densité (article 1), en mélangeant 100 ul solutio 10X tamponn (étape 1.1.1), 20 pl de 50X solution de détergent (étape 1.1.1), 323 ul de H 2 O 2 (99,9%) et 527 ul de H 2 O. désionisée
- Dissoudre lyophilisée, SH peptides purifiés par HPLC (expression et la purification 31 décrit précédemment) dans un solvant approprié tel que le methanol ou 50% v / v d'acétonitrile aqueux. Mesurer A280 des peptides dissous dans un microlitre dimension UV spectrophotomètre / Vis et aliquote de trois échantillons pour donner une 280, 12mm = 0,3, 0,5 et 0,8 (A 280, 10mm = 0,25, 0,417 et 0,67) chaque fois dilué à 130 ul. Lyophiliser les échantillons pendant la nuit et remettre en suspension dans 130 ul solution de référence (étape 2.2.1) pour donner des solutions de l'échantillon.
Remarque: protéine SH peut être détectée à partir de UV / Vis absorbance à 280 nm, car il contient des résidus Trp et Tyr. Les protéines sans résidus aromatiques peuvent être détectés par leur marquage avec un chromophore adapté en utilisant un mutant contenant Trp, ou en utilisant interfèrence mesures au lieu d'absorbance. - Suivez les étapes de la section 1.2 pour assembler une cellule 6 canaux AUC avec des fenêtres de quartz. Charger l'échantillon de concentration la plus élevée (280 A, 12 mm = 0,8) dans le canal le plus proche du centre du rotor et la plus faible concentration de l'échantillon (A 280, 12mm = 0,3) plus éloignée du centre du rotor.
2.3. Mise en place des mesures d'absorbance
- Créer un nouveau ajuster le fichier (Fichier | Nouveau fichier) précisant "Equilibrium" et la mesure "d'absorbance". Spécifiez 280 nm comme longueur d'onde du détecteur.
- Effectuer le calibrage radiale à 3000 rpm en cochant "calibration Radial avant la première analyse" dans les options de numérisation, en précisant la collecte de données à basse résolution, par exemple avec la taille de l'étape Radial = 0,01 cm, répétitions = 3 (faible résolution, rapide), et l'exécution d'une Image . Une fois l'analyse terminée, décochez l'option.
- Mettre en place une méthode de sédimentation d'équilibre ("Methobouton ") d de fonctionner à la première vitesse calculée à l'étape 2.1.3, à 20 ° C, et de recueillir une analyse toutes les 30 minutes. Dans "Détail" de chaque cellule, spécifiez la collecte de données à faible résolution comme à l'étape 2.3.2. Surveiller les progrès de l'équilibre en ouvrant les fichiers de données dans HeteroAnalysis et en sélectionnant la fonction «Match» après au moins 18 heures (environ nuit, Fig. 4).
Remarque: le niveau d'équilibre peut prendre sensiblement plus de temps pour la première vitesse, alors que les vitesses suivantes prendront moins de temps.
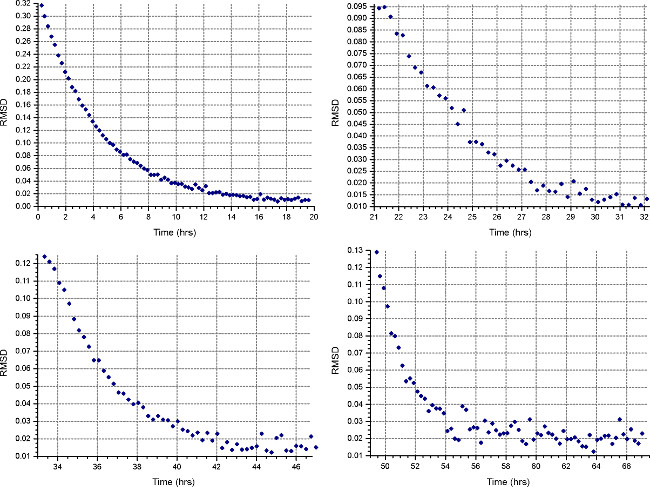
Figure 4. Les résultats de la fonction HeteroAnalysis Match. Les première et deuxième vitesses (en haut à gauche et à droite) semblent avoir atteint l'équilibre, mais il est préférable d'attendre quelques heures de plus pour être sûr. En comparaison, les troisième et quatrième vitesses (en bas à gauche et à droite) ont clairement atteint l'équilibredans un temps plus court. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Une fois l'équilibre a été atteint, recueillir un seul balayage à haute résolution, par exemple avec la taille de l'étape Radial = 0,001 cm, répétitions = 10 (haute résolution, lente).
- Une fois l'analyse terminée, répétez l'étape 2.3.3 et 2.3.4 pour la vitesse suivante.
- Éventuellement, lorsque le temps nécessaire pour atteindre l'équilibre pour chaque vitesse est connu (calculé ou de l'expérience), mis en place la méthode de sédimentation à l'équilibre de balayage pour inclure toutes les vitesses calculées à l'étape 2.1.3 et de recueillir une analyse après le temps d'équilibrage pour chaque la vitesse. Dans ce cas, spécifiez la collecte de données de haute résolution "Détail" de chaque cellule.
2.4. L'analyse des données dans SEDFIT et SEDPHAT
Remarque: Pour plus de détails et des considérations en lecteur de l'analyse des données est appelé to le site Web suivant: www.analyticalultracentrifugation.com.
- Ouvrez scans haute résolution dans SEDFIT (données | charge d'équilibre de sédimentation) et le partage des données dans trois canaux (ceux-ci correspondent à différentes concentrations pour chaque échantillon; options | Options de Chargement | Enregistrer Raw 6 canaux de données en trois sous-ensembles).
- Re-ouvertes fichiers de données qui appartiennent à un même échantillon et même concentration, mais des vitesses différentes dans SEDFIT. Ajuster le ménisque (trait vertical rouge), fond de la cellule (ligne bleue verticale) et les limites de montage (lignes verticales vertes), et exporter les données pour une utilisation dans SEDPHAT (données | Exporter les données vers SEDPHAT). Entrée des paramètres calculés dans l'étape 2.1.1, ainsi que le type de rotor et le type de pièce, sur demande. Répétez cette étape pour chaque échantillon et la concentration.
- Ouvrez toutes les données du même échantillon (toutes les concentrations et vitesses) dans SEDPHAT et remplir les paramètres de l'expérience; un exemple est représenté sur la Fig. 5.
Remarque: lorsque D 2 O est ajouté dans le tampon, deut ration de protons échangeables pourrait modifier de façon significative le poids moléculaire de la protéine, en particulier pour les protéines solubles dans l'eau. Les protéines membranaires, surtout les plus petits comme les protéines de SH, sont moins touchés parce que les régions de membrane intégré sont protégés de l'échange. Pour corriger cela, saisir le "tampon D fraction molaire".
Remarque: À cette étape, il est recommandé de sauvegarder l'ensemble de données édité séparément en sélectionnant le menu Données | Copier toutes les données et Save As New Config. - Sélectionnez un modèle et remplissez paramètres globaux pour ce modèle.
Note: A titre d'exemple, le modèle «Monomère-n-Mer auto-association» et ses paramètres sont représentés sur la figure. 6.
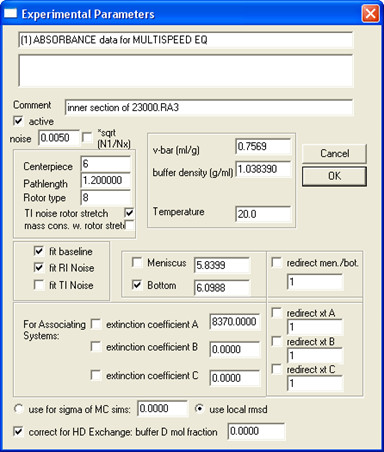
Figure 5. Un exemple sur la façon de remplir paramètres expérimentaux.
fichiers / ftp_upload / 52404 / 52404fig6.jpg "/>
Figure 6. Un exemple sur la façon de remplir des paramètres globaux pour le modèle monomère-n-Mer auto-association.
- Exécuter un ajustement global en sélectionnant le menu Fit | Global Fit et attendre jusqu'à ce que les converge ajustement. Notez (ou de prendre une capture d'écran) les résultats de l'ajustement, en particulier le chi carré mondiale réduite et un log K valeurs. Extraire d'autres données telles que les données d'ajustement et les résidus de montage du menu Copier et Affichage | Afficher les informations thermodynamique.
- Retour à des paramètres globaux et vérifiez M (1) en fonction du poids moléculaire de monomère et répétez l'étape 2.4.5. Notez le poids moléculaire aménagée et chi carré réduite mondiale.
- Répétez l'étape 2.4.3 à 2.4.6 pour chaque modèle à tester et comparer la qualité ajustement de chaque modèle en comparant la valeur du chi carré mondiale réduite ainsi que les résidus de montage.
Remarque: Les petits et aléatoires résidus de montage indique généralement un bon ajustement, et le modèle qui correspond le mieux seraitavoir le plus petit chi carré réduite mondiale. Le poids moléculaire équipée de monomère et sa valeur du chi carré ne devraient pas différer sensiblement de celle de la (théorique) poids moléculaire fixe. - Calculer l'intervalle de confiance pour le journal obtenu Ka en valeur par les premiers Statistiques de sélection | chi carré critique pour les projections de surface d'erreur et la saisie de l'intervalle de confiance désiré. Ensuite, allez à Statistique | Générer une projection dimensions de la surface d'erreur et désélectionner connecter Ka dans le dialogue Paramètres globaux pour obtenir les valeurs du chi carré pour journal Ka.
Nota: Les lecteurs sont invités à consulter les sources suivantes (http://www.analyticalultracentrifugation.com/ SEDPHAT / statistics.htm) pour plus de détails sur la méthode ainsi que 32 illustration de cette méthode 33.
Résultats
Le profil radial de distribution de C14SB micelles de détergent dans du Tris 50 mM, NaCl 100 mM pH 7,3, forme un exponentielles très peu profonde qui pourrait être montée sur un modèle linéaire (figure 7A). La pente de cette distribution est inversement corrélée à la concentration de D 2 O (Figure 7B). Le point où la pente est nulle, ce est à dire l'appariement D 2 O concentration, se est révélée être de 32,3%.
Discussion
Ce document fournit un protocole expérimental pour la préparation et l'analyse d'oligomérisation d'une petite protéine membranaire dans un détergent en utilisant l'équilibre sédimentation échantillon. Le protocole décrit est également valable pour simpler- -et protéines solubles, comme l'étape d'adaptation de la densité ne est pas nécessaire. En effet, le système est constitué par un mélange de détergent et de protéines. Pour réaliser des études de sédimentation, le déterge...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work has been funded by the National Research Foundation grant NRF-CRP4-2008-02 (J.T.) and Tier 1 grant RG 51/13.
matériels
| Name | Company | Catalog Number | Comments |
| 3-(N,N-dimethylmyristylammonio)propanesulfonate | Sigma | T0807 | |
| Deuterium oxide 99.8% | Cambridge Isotope | DLM-4-99.8 | |
| An-50 Ti Rotor, Analytical, 8-Place | Beckman Coulter | 363782 | |
| An-60 Ti Rotor, Analytical, 4-Place | Beckman Coulter | 361964 | |
| Cell housing | Beckman Coulter | 334784 | |
| 12 mm six-channel centerpiece, epon charcoal-filled | Beckman Coulter | 331376 | |
| Window holder | Beckman Coulter | 305037 | |
| Window gasket | Beckman Coulter | 327021 | |
| Window liner | Beckman Coulter | 362329 | |
| Sapphire window | Beckman Coulter | 307177 | |
| Quartz window | Beckman Coulter | 301730 | |
| Screw-ring washer | Beckman Coulter | 362328 | |
| Screw ring | Beckman Coulter | 301922 | |
| Spinkote | Beckman Coulter | 306812 | |
| Torque stand assembly | Beckman Coulter | 361318 | |
| Counterbalance | Beckman Coulter | 360219 | |
| Cell alignment tool | Beckman Coulter | 362340 | |
| SEDNTERP | http://bitcwiki.sr.unh.edu/index.php/Main_Page | ||
| HeteroAnalysis | http://www.biotech.uconn.edu/auf/?i=aufftp | ||
| SEDFIT | http://www.analyticalultracentrifugation .com/sedfit.htm | ||
| SEDPHAT | http://www.analyticalultracentrifugation .com/sedphat/default.htm |
Références
- Laue, T. M., Stafford, W. F. Modern applications of analytical ultracentrifugation. Annu. Rev. Biophys. Biomol. Struct. 28, 75-100 (1999).
- Lebowitz, J., Lewis, M. S., Schuck, P. Modern analytical ultracentrifugation in protein science: A tutorial review. Protein Sci. 11, 2067-2079 (2002).
- Balbo, A., Zhao, H., Brown, P. H., Schuck, P. . Assembly, Loading, and Alignment of an Analytical Ultracentrifuge Sample Cell. , e1530 (2009).
- Rivas, G., Stafford, W., Minton, A. P. Characterization of heterologous protein-protein interactions using analytical ultracentrifugation. Methods-a Companion to Methods in Enzymology. 19, 194-212 (1999).
- Howlett, G. J., Minton, A. P., Rivas, G. Analytical ultracentrifugation for association and assembly the study of protein. Curr. Opin. Chem. Biol. 10, 430-436 (2006).
- MacGregor, I. K., Anderson, A. L., Laue, T. M. Fluorescence detection for the XLI analytical ultracentrifuge. Biophys. Chem. 108, 165-185 (2004).
- Phizicky, E. M., Fields, S. Protein-Protein Interactions - Methods for Detection and Analysis. Microbiol. Rev. 59, 94-123 (1995).
- Alexandrov, A. A facile method for high-throughput co-expression of protein pairs. Mol. Cell. Proteomics. 3, 934-938 (2004).
- Nooren, I. M. A., Thornton, J. M. Structural characterisation and functional significance of transient protein-protein interactions. J. Mol. Biol. 325, 991-1018 (2003).
- Ebel, C. Sedimentation velocity to characterize surfactants and solubilized membrane proteins. Methods. 54, 56-66 (2011).
- Minton, A. P. Quantitative characterization of reversible macromolecular associations via sedimentation equilibrium: an introduction. Exp. Mol. Med. 32, 1-5 (2000).
- Dowell, S. F. Respiratory syncytial virus is an important cause of community-acquired lower respiratory infection among hospitalized adults. J. Infect. Dis. 174, 456-462 (1996).
- Bukreyev, A., Whitehead, S. S., Murphy, B. R., Collins, P. L. Recombinant respiratory syncytial virus from which the entire SH gene has been deleted grows efficiently in cell culture and exhibits site-specific attenuation in the respiratory tract of the mouse. J. Virol. 71, 8973-8982 (1997).
- Fuentes, S., Tran, K. C., Luthra, P., Teng, M. N., He, B. Function of the respiratory syncytial virus small hydrophobic protein. J. Virol. 81, 8361-8366 (2007).
- Jin, H. Recombinant respiratory syncytial viruses with deletions in the NS1, NS2, SH, and M2-2 genes are attenuated in vitro and in vivo. Virology. 273, 210-218 (2000).
- Karron, R. A. Respiratory syncytial virus (RSV) SH and G proteins are not essential for viral replication in vitro: clinical evaluation and molecular characterization of a cold-passaged, attenuated RSV subgroup B. Proc. Nat. Acad. Sci. USA. 94, 13961-13966 (1997).
- Whitehead, S. S. Recombinant respiratory syncytial virus bearing a deletion of either the NS2 or SH gene is attenuated in chimpanzees. J. Virol. 73, 3438-3442 (1999).
- Rixon, H. W. The small hydrophobic (SH) protein accumulates within lipid-raft structures of the Golgi complex during respiratory syncytial virus infection. J. Gen. Virol. 85, 1153-1165 (2004).
- Collins, P. L., Mottet, G. Membrane orientation and oligomerization of the small hydrophobic protein of human respiratory syncytial virus. J. Gen. Virol. 74, 1445-1450 (1993).
- Collins, P. L., Olmsted, R. A., Johnson, P. R. The small hydrophobic protein of human respiratory syncytial virus: comparison between antigenic subgroups A and B. J. Gen. Virol. 71, 1571-1576 (1990).
- Chen, M. D., Vazquez, M., Buonocore, L., Kahn, J. S. Conservation of the respiratory syncytial virus SH gene. J. Infect. Dis. 182, 1228-1233 (2000).
- Gan, S. W. The small hydrophobic protein of the human respiratory syncytial virus forms pentameric ion channels. J. Biol. Chem. 287, 24671-24689 (2012).
- Gan, S. W., Ng, L., Xin, L., Gong, X., Torres, J. Structure and ion channel activity of the human respiratory syncytial virus (hRSV) small hydrophobic protein transmembrane domain. Protein Sci. 17, 813-820 (2008).
- Li, Y. Inhibition of the Human Respiratory Syncytial Virus Small Hydrophobic Protein and Structural variations in a bicelle environment. J. Virol. 88 (22), 11899-914 (2014).
- Burgess, N. K., Stanley, A. M., Fleming, K. G. Determination of membrane protein molecular weights and association equilibrium constants using sedimentation equilibrium and sedimentation velocity. Meth. Cell. Biol. 84, 181-211 (2008).
- Cole, J. L., Lary, J. W., Moody, T. P., Laue, T. M. Analytical Ultracentrifugation: Sedimentation Velocity and Sedimentation Equilibrium. Meth. Cell. Biol. 84, 143-179 (2008).
- Fleming, K. G. Determination of membrane protein molecular weight using sedimentation equilibrium analytical ultracentrifugation. Curr. Protoc. Prot. Sci. 53, 17.12.11-17.12.13 (2008).
- . . An-50 Ti and An-60 Ti Analytical Rotor, Cells, and Counterbalance. , (2005).
- Mayer, G. Studying membrane proteins in detergent solution by analytical ultracentrifugation: Different methods for density matching. Prog. Colloid Polym. Sci. 113, 176-181 (1999).
- Laue, T. Ch. 20.3. Current Protocols in Protein Science. 20, 20.23.21-20.23.13 (2001).
- Gan, S. W. The Small Hydrophobic Protein Of The Human Respiratory Syncytial Virus Forms Pentameric Ion Channels. J. Biol. Chem. 287, 24671-24689 (2012).
- Bevington, P. R., Robinson, D. K. . Data reduction and error analysis for the physical sciences. 336, (1969).
- Schuck, P., Radu, C. G., Ward, E. S. Sedimentation equilibrium analysis of recombinant mouse FcRn with murine IgG1. Molecular Immunology. 36, 1117-1125 (1999).
- Gan, S. W., Vararattanavech, A., Nordin, N., Eshaghi, S., Torres, J. A cost-effective method for simultaneous homo-oligomeric size determination and monodispersity conditions for membrane proteins. Anal. Biochem. 416, 100-106 (2011).
- Montserret, R. NMR structure and ion channel activity of the p7 protein from hepatitis C virus). J. Biol. Chem. 285, 31446-31461 (2010).
- Stouffer, A. L., DeGrado, W. F., Lear, J. D. Analytical Ultracentrifugation Studies of the Influenza M2 Homotetramerization Equilibrium in Detergent Solutions. Progr Colloid Polym Sci. 131, 108-115 (2006).
- Sorkin, A., von Zastrow, M. Signal transduction and endocytosis: Close encounters of many kinds. Nat. Rev. Mol. Cell Biol. 3, 600-614 (2002).
- Gan, S. W., Ng, L., Lin, X., Gong, X., Torres, J. Structure and ion channel activity of the human respiratory syncytial virus (hRSV) small hydrophobic protein transmembrane domain. Protein science : a publication of the Protein Society. 17, 813-820 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon