Method Article
Katı ve Sıvı Tümörlerinde harekete geçirici Mutasyonlar Tespiti için Yeni Nesil Dizi
Bu Makalede
Özet
This manuscript describes clinical protocols for two next-generation sequencing panels. One panel interrogates hematologic malignancies while the other panel targets genes commonly mutated in solid tumors. Molecular classification of driver mutations in human malignancies offers valuable prognostic and predictive information.
Özet
As our understanding of the driver mutations necessary for initiation and progression of cancers improves, we gain critical information on how specific molecular profiles of a tumor may predict responsiveness to therapeutic agents or provide knowledge about prognosis. At our institution a tumor genotyping program was established as part of routine clinical care, screening both hematologic and solid tumors for a wide spectrum of mutations using two next-generation sequencing (NGS) panels: a custom, 33 gene hematological malignancies panel for use with peripheral blood and bone marrow, and a commercially produced solid tumor panel for use with formalin-fixed paraffin-embedded tissue that targets 47 genes commonly mutated in cancer. Our workflow includes a pathologist review of the biopsy to ensure there is adequate amount of tumor for the assay followed by customized DNA extraction is performed on the specimen. Quality control of the specimen includes steps for quantity, quality and integrity and only after the extracted DNA passes these metrics an amplicon library is generated and sequenced. The resulting data is analyzed through an in-house bioinformatics pipeline and the variants are reviewed and interpreted for pathogenicity. Here we provide a snapshot of the utility of each panel using two clinical cases to provide insight into how a well-designed NGS workflow can contribute to optimizing clinical outcomes.
Giriş
Klinik onkoloji örneklerin nesil dizileme (NGS) hedeflenebilir genetik değişiklikler ve tahmini / prognostik moleküler belirteçlerin tanımlanması önemine bilimsel literatür noktaları büyüyen olarak daha yaygın olarak kullanılabilir, son birkaç yıl içinde olmuştur. Çok gen paneli analizleri ve hastalık ilerledikçe ve nüksler hem epitel 1,2 ve hematolojik 3 malignitelerde tüm exome sıralama çalışmaları tümör heterojenite kavramını ve klonal evrim katılaşmış olması. Ek olarak, polimeraz zincir reaksiyonu (PCR) ya da Sanger sekanslama gibi rakip yöntemin aksine NGS tek bir tahlil 4 Tüm klinik olarak anlamlı kanser genlerinin en genomik değişiklik tespit edebilir.
Başlangıçta iki klinik NGS paneller, özel bir Hematolojik Paneli (Heme-NGS Paneli) ve bir off-the-raf FFPE numuneler için Kanser Paneli (Solid-NGS Panel) ile başlatılan Kişiselleştirilmiş Diagnostics Merkezi (bkz Şekil 1). Bu paneller, seçilen genlerin klinik açıdan anlamlı ya da yüksek faiz bölgeleri kapsamaktadır; tüm genler veya ekzon tamamen kaplıdır değil. Amplikonlar uzama ve ligasyon, ardından prob hibridizasyonu ile oluşturulur. Hedeflenen bölgeler daha sıralaması için toplanmış olan 96 numuneye kadar izin evrensel çift endeksli primerleri ile PCR kullanılarak güçlendirilir.
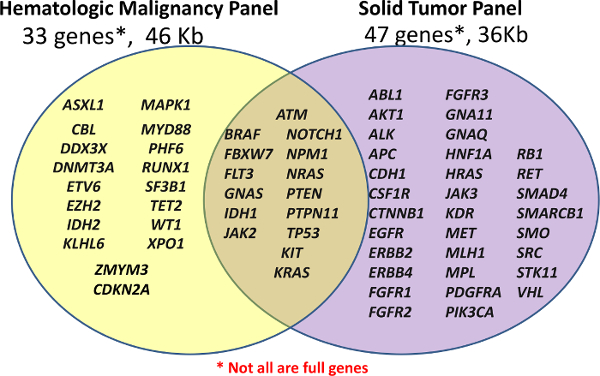
Şekil 1:. Panellerde Kapalı Genlerin Listesi Kütüphane hazırlık kullanılarak yapılır ya özel Hematolojik Paneli 33 genlerin ya da off-the-raf Amplikon Kanser Paneli 47 genin (Katı-NGS) içinde (Heme-NGS Panel). Genler ya da ekzon hepsi bir amplikonlar sadece belirli noktaları kapsayacak olabilir. Tam kaplıdır değil , bu rakamın büyük halini görmek için lütfen buraya tıklayınız. </ A>
Heme-NGS Panel içerik çoklu kaynaklardan elde edilen, ancak daha önce klinik yarar 5 yüksek seviyede gösteren olarak tarif akut myeloid lösemi (AML) mutasyona uğramış genlerin 16 civarında merkezleri oldu. Katı-NGS Paneli ticari (KOZMİK) veritabanı 6 Kanser Somatik Mutasyonlar Kataloğu belirtildiği gibi kanser yaygın mutasyona uğramış genlerin dayalı hedeflenmiş bölgeler ile üretilmektedir.
Birkaç önemli adımlar klinik NGS genel iş akışını karakterize eder. Klinisyen testi emir sonra, bir patolog tümör yüzdesi ve örnek hacmi için analiz aşağıdaki numunenin yeterliliğini belirler. Kurumumuzda, biz teknoloji arka plan sekans hata oranı ( "gürültü") ve hedeflenen yaklaşımının verimliliği nedeniyle en az% 10 tümör gerektirir. Doku testleri için yeterli ise, genomik DNA elde edildi. Bu DNA daha sonra (çoklu kalite kontrolüne tabi tutulurQC) adımlar. DNA, QC geçerse, bir amplikon kütüphanesi oluşturulur ve dizilenmiştir. Elde edilen veriler, in-house biyoinformatik boru hattı ile analiz edilir. biyoinformatik analizi takiben, varyantlar elle incelenir ve bir klinik raporu dahil edilmeden önce patojenik yorumlanır. biz tarif Aşağıda sonuçta bu titiz iş akışı ile gitti ve iki olgu klinik yönetiminde değişikliklere yol açmıştır.
Durum 1 - Akut Myeloid Lösemi
Hasta A kemik iliği biyopsisi olgunlaşması olmadan, AML için teşhis oldu. Sitogenetik çalışmalar kemik iliği örneğinin gönderilen ve normal kadın karyotip saptandı. Orada mevcut% 95 dolaşan patlamalar vardı, bu yüzden bir periferik kan numunesi Heme-NGS Panelinde kişiselleştirilmiş tanı testleri için gönderildi.
Akut miyeloid lösemi (AML), beyaz kan hücrelerinin myeloid hematolojik kanseridir. bulmaTekrarlayan gen mutasyonları patogenezi ve prognozu 7 önemli olarak kabul ile AML gen mutasyonlarının, prognoz ve tedavi için giderek daha önemli hale gelmiştir. FLT3'te iç tandem duplikasyonları (ITD) daha az olumlu sonuç 8 ile ilişkilendirilmiştir ise NPM1 ve CEBPA mutasyonlar, bir prognostik risk ile ilişkili bulunmuştur. Artan miktarda kanıt vücut AML 9, bu ve diğer mutasyonlar için bir patojenik rolünü desteklemektedir.
Durum 2 - Akciğer Adenokarsinom
Hasta B sol supraklaviküler kitle biyopsi akciğer adenokarsinomu gösterdi. % 50'den fazla tümör rulo / kıvrımları, bir mutasyon hedeflenen terapötik müdahale için hazır olup olmadığını belirlemek için formalin ile fikse parafine gömülü (FFPE) lenf nodu kütlesinden Biyopsi materyali genomik test (Katı-NGS Paneli) için gönderildi.
akciğer Cancer ABD'de kansere bağlı ölümlerin başta gelen nedenidir ve iki ana tipi, küçük hücreli olmayan akciğer kanseri (KHDAK) ve küçük hücreli dışı akciğer kanseri (KHAK) ayrılmıştır. NSCLC daha lezyonun histolojik göre, adenokarsinoma ya da skuamoz hücre karsinoması olarak tanımlanabilir. Akciğer adenokarsinomu sigara içen ve içmeyen hem görülen akciğer kanserinin en sık görülen alt tipi vardır ve sigara içmeyenler için 10 akciğer kanserinin en sık görülen şeklidir. Akciğer adenokarsinomlarında moleküler çalışmalar birden onkogenler 11 mutasyon belirledik. Sigara içenlerde tanımlanan en yaygın sürücü mutasyonlar KRAS ve BRAF mutasyonlar. Sigara içmeyen en yaygın mutasyonlar EGFR mutasyonları ve genleri ALK, RET ve ros1 içeren düzenlenmeleri vardır. Akciğer tümör geni ErbB2'nin bir çerçeve ekson 20 ekleme (HER2 / neu) ile tarif edilmiştir. HE en yaygın anormallikR2 / neu hedeflenen tedavi (: HER2 / neu karşı insan monoklonal antikoru trastuzumab) mevcut olduğu göğüs kanseri, bu lokus kuvvetlendirilmesi olan. 2 gözlenir HER2 / neu ekson 20 ekleme - akciğer% 4 12 (sırasıyla, neratinib ve temsirolimusun) 13 HER2 / neu ve mTOR inhibitörleri ile kombinasyon tedavisine kısmi yanıt göstermiştir adenocarcimomas.
Protokol
Bu protokol, sırasıyla katı ve sıvı tümörler genomik profil iki doğrulanmış laboratuar olan testler, belirgin aşamalarını içermektedir. Laboratuvarda yapılan testler 1988 Klinik Laboratuvar İyileştirme Değişiklikler (CLIA) gereklerine uygun olarak yapılır.
Periferik Kan veya Kemik İliği 1. DNA Ekstraksiyon
- Tablo 1'de göre alınacak önlemler ne kadar kan veya kemik iliği belirleyin.
| Örnek / WBC | Miktar 1 ml kan olarak tedavi edilecek |
| Kemik iliği | 250 ul |
| Kan lökosit 12.000 - 50.000 | 1 mi |
| Kan lökosit 50.000 - 100.000 | 500 ul |
| Kan WBC 100,000 - 200,000 | 200 ul |
| Kan WBC> 200000 | 100 ul |
| * Kan WBC <12,000, kan 2 ml almak için | |
Tablo 1:. Beyaz kan hücresi sayımı numuneden diğerine değişecektir beri Kan / Kemik İliği Ses Grafik kullanma, kullanmak için kan belirli bir hacmi belirtmek zordur. Bu nedenle, tahlil için kullanımı kan miktarı, deneyden önce başlayan beyaz kan hücresi sayımı (WBC) bakılarak tespit edilmelidir. daha az kan kullanıldığı rağmen, hala mevcut hücrelerin sayısı normalden daha büyük olduğu için kullanılan kan hacmi beri 1 ml azalır gibi tedavi edilmelidir.
- genomik DNA'nın izole edilmesi için ticari olarak temin edilebilen kiti protokolü takip edin.
Formalin sabit Parafin gömülü (FFPE) Doku 2. DNA Ekstraksiyon
- Dayalıpatolog H & E slayt daire tümör bölgesi, rehber H & E slayt ile lekesiz slaytlar sıraya ve çıkarma için benzer bir alan özetlemektedir. Makro-diseksiyon için, süreç sadece bir örnek / Bir defada slaytların hastanın seti.
- 45 ° C sıcaklıkta bir blok üzerinde kayar parafin hafifçe erimesine ısıtın. Dikkatle her örnek ayıklanmasını için yeni bir neşter kullanılarak, slayt üzerinde işaretlenmiş çizgiler içinde doku kazıyın. uygun şekilde etiketlenmiş 1.5 ml'lik tüp içine balmumu kazıntı yerleştirin. kazınarak balmumu çok elektrostatik ve tüp dışarı atlamak çünkü dikkatli olun.
- (- 30 mikron toplam 25) her beş mikron 5 altı bölümleri için Parafinden arındırma lamların Çözüm 320 ul ekleyin. Örneğin, 10 mikron rulo / kıvrılma 3 bölümleri içeren bir tüp işlenecek gidiyor, o zaman 320 ul kullanın, ama aynı kalınlıkta 5 kesitler elde edildi, sonra 640 ul kullanın.
- kuvvetlice en az 10 saniye boyunca ve aq gerçekleştirmek girdapBir mikrosantrifüj uick sıkma taraf ve kapaktan ve çözüm içine doku / balmumu kaldırmak için. . 3 dakika 56 ° C'de inkübe edin ve 5 için oda sıcaklığında inkübe - 10 dak.
- RT İnkübasyondan sonra, ilave Parafinden arındırma lamların çözeltileri 320 ul için ATL tampon 180 ul ekle. Her örnek için yeni bir havaneli kullanarak steril bir mini havaneli kullanarak dokuya on kere kıyma. çok yapışkan olabilir gibi, tokmak sıkışmış hiçbir doku olduğundan emin olun. Vorteks süspansiyon kuvvetli bir şekilde 3 saniye, daha sonra 1 dakika süreyle maksimum hızda santrifüj.
- Alt net faza Proteinaz K 10 ul ekleyin. Doku yeniden süspanse sağlamak için aşağı yukarı pipetleme ve hafifçe karıştırın. vorteks DEĞİL yapın. 500 rpm - gecede 400 çalkalanarak 56 ° C'de inkübe edin.
- Doku tamamen çözülmüş ise ertesi sabah (alt çözelti berrak ise bu oluştu) kontrol edin. Alt çözüm fo maksimum hızda 3 saniye ve santrifüj için şiddetle sonra vorteks, berrak değilser, 1 dakika. Proteinaz K 10 ul ve 30 için 56 ° C'de inkübe edin - - ilave bir 5 ekleyin, 60 dakika.
- Formaldehit çapraz bağlama yok etmeye yardımcı olacak, 1 saat boyunca 90 ° C'de inkübe edin. 10 dakika ve daha sonra kısa bir süre sıvı birleştirmek için her tüp santrifüj - örnekler 5 oda sıcaklığına soğumaya bırakın.
- etiketli 1.5 ml tüp içine alt net faz aktarın. (Örneğin, birden çok rulo kullanılıyorsa durum), aynı hasta numune birden fazla boru vardır, bu noktada, bir tüp içine alttaki fazlar bir araya toplamaktadır. Not: saflaştırma prosedürü ile engel olmamalıdır Parafinden arındırma lamların Çözüm küçük miktarlarda aktarılması, ama büyük bir miktarda aktarılır Bir riski vardır.
- RNaz bir çözeltisi 2 ul ekle. Vortex hafifçe veya bir mikrosantrifüj 25 kez ve hızlı bir spin ters. 5 dakika boyunca oda sıcaklığında inkübe edin.
- Protein çökelme çözeltisinden 200 ul ekle. bir ya da iki rulo yaparak ise, 200 ul kullanın. Üç rulo yaparak eğerbir kerede, daha sonra 400 ul kullanın s. şiddetle yüksek hızda 30 saniye boyunca girdap eşit lizis tamponlar karıştırın. 5 dakika boyunca buz üzerinde inkübe veya numuneler bir saat kadar buz üzerinde kalabilirler.
- 5 dakika boyunca 5000 x g'de santrifüjleyin. Çökelen protein, sıkı, beyaz topak oluşturmalıdır. etiketlenmiş bir 1.5 ml tüp içine süpernatan dökün ve en az 3 dakika süreyle buz üzerinde örneklerin inkübe edin. 3 dakika boyunca 5000 x g'de santrifüjleyin.
- Tampon ATL her 180 ul için 2-propanol (izopropanol) 200 ul daha önce işaretlenmiş bir 1.5 ml tüp eklenen kayıt (2 ml tüp kullanmak gerekli olabilir). Örneğin, yapıyor, üç rulo izopropanol 600 ul ekleyin. Daha önce izopropanol eklendi Tampon ATL her 180 ul için glikojen 1 ul ekleyin ve karıştırın tüpü birkaç kez ters çevirin.
- Isopropanol karışıma protein çökeltme aşaması süpernatant ekleyin. yavaşça, en az 50 kez ters yüz edilerek tüp karıştırın.
- Maksimum sp santrifüjleyin3 dakika boyunca EED. DNA tüpün dibinde küçük beyaz pelet olarak görünür olacaktır.
- Dökün ya da uygun bir atık tüp içine süpernatant aspire. kaybolması veya diğer örneklerin atıklarla karıştırılmaması olmayacak şekilde pelet yerinden geliyor durumunda her numune için ayrı bir 1.5 ml atık tüp tutun. Bir kağıt havlu üzerine tüp boşaltın ve izopropanol çoğunluğu çıkarıldığından emin olun.
- taze yapılmış% 70 etanol 300 ul ekleyin. pelet yıkamak için hafifçe birkaç kez tüp ters çevirin. daha kapsamlı bir temizlik sağlamak için yerinden gelen pelet sağlamak için çalışın.
- 5 dakika boyunca yüksek hızda santrifüj. ve daha sonra dikkatli bir şekilde etanol çıkarın. Pelet gevşek olabilir, bu yüzden yavaş dökmek veya aspire ve pelet izleyebilirsiniz. Pelet dokunmadan, tüpün içinde aşırı etanol çıkarın. üzerinde örnek kuru değil dikkatli olmak, 15 dakika - 5 için kuru hava örnekleri izin verin.
- e DNA Hidrasyon Çözüm 100 ul - 25 arası ekleDNA, pelet boyutuna ve doku başlangıç miktarına bağlı olarak ACH örneği. Vorteks tüpler şiddetle ve kısaca bir mikrosantrifüj dönerler. Tam DNA rehidrate 65 ° C de 1 saat süreyle inkübe edin.
3. Genomik DNA Kalite Kontrolü
Not: DNA kalite kontrol (QC) için üç bağımsız adım vardır. Her QC adımı gerçekleştirilir neden daha fazla açıklama için Tablo 2'ye bakınız.
| Enstrüman | Sonuç | işaret | ideal Aralığı |
| DropSense96 | A260 / A230 | Kimyasal kirleticilerin tanımlanması (örn etanol) | 1,50-2,2 |
| DropSense96 | A260 / A280 | Protein kirletici tanımlanması | 1,60-2,2 |
| DropSense96 | konsantrasyon | DNA miktar | > 1 ng / ml |
| TapeStation | DNA Smear | DNA bütünlüğü belirlenmesi (örneğin, bozulma / çıkarılan DNA parçalanması) | > 1000 bp 50% |
| qubit 2.0 | konsantrasyon | Daha doğru DNA miktar | > 1 ng / ml |
Tablo 2:. DNA QC Beklenen Sonuçlar bu değerlerin tüm kütüphane hazırlık aşamasına devam etmek için bir örnek izin çalıştırmadan önce dikkate alınır.
- imalatçının protokolü izlenerek, çalışma konsantrasyonu numune (ng / ml) elde etmek için bir florometrede edilen DNA 2 ul çalıştırın.
- numunenin kalitesini (A260 / A230 ve A260 / A280 sıçan kontrol etmek için bir UV / VIS spektrofotometre üzerinde her numunenin 2 ul - 1 RunIOS) kullanılarak üreticinin talimatlarına göre aktifleştirilir.
- FFPE numuneler için imalatçının talimatları izlenerek, DNA parçalanma / parçalanma değerlendirmek için bir mikro-akışkan jel elektroforez sistemi ile her bir numunenin 1 ul çalıştırın. Örnekler için Şekil 2'ye bakınız.
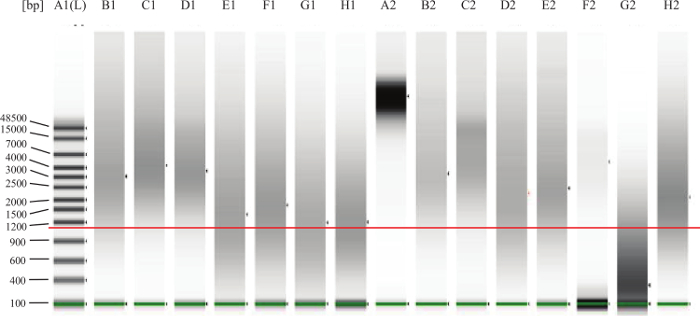
Şekil 2:. Genomik DNA QC Jel Örneği alt bantlar üzerinde yeşil hat alt işaretleyici işaret eder. katma kırmızı çizgi yaklaşık 1.000 bp işaret eder. Bir taze tis sue (örneğin, periferik kan veya kemik iliği) beklediğiniz gibi Lane A2, tamamen sağlam DNA temsil eder. Şerit B1, C1, D1, B2, C2, E2 iyi sağlam FFPE DNA örnekleridir. Şerit F2 DNA sağlam ama çok düşük bir konsantrasyonda olduğu görülmektedir. şerit G2 DNA bozulmuş veya parçalanmış ve deneyde işe yaramaz. Lanes E1, F1, G1, H1, D2,H2 tahlil de işe yarayabilecek yani 'gri bölge' düşüyor DNA'yı temsil fakat DNA bazıları da zarar görebilir veya çapraz bağlı ve bu nedenle tahlilinde iyi performans olmaz. Bir büyük görmek için tıklayınız Bu rakamın sürümü.
4. Amplikon Kütüphane hazırlanması
- Bağlı Oligoların Oligo Pool ve Hibritleşme Uzatma-Ligasyonu
- Her iyi tekabül eden genomik DNA 250 ng - Ön PCR odasında gerekli Düşük EDTA TE hacmi, Masası'nın Oligo Tüp (örneğin, Katı-NGS Panel veya Heme-NGS Paneli) 5 ul ve 100 ekleyin Hibridizasyon (HYB) plaka olarak etiketlenmiş bir yarı-etekli 96 iyi plaka.
- HYB plaka içindeki her bir örnek Ardışık Reaktif 1 için Oligo Hibridizasyon (OHS1) 40 ul ekle. karıştırmak için 6 kez - hafifçe aşağı en az 5 yukarı pipet ve. Her sütun önlemek için sonra değiştirin ipuçlarıçapraz bulaşma.
- 30 saniye boyunca 1000 xg yapışkan alüminyum folyo ve santrifüj ile HYB plaka mühür.
- 1 dakika boyunca 95 ° C'de önceden ısıtılmış melezleme inkübatörde HYB plaka inkübe edin. 40 ° C hibridizasyon inkübatör sıcaklığını ayarlayın. sürece 95 ° C ila 40 ° C (~ 90 dakika) azaltmak için kuluçka alır gibi kuluçkaya devam edin. Not: Bu kademeli Uygun soğutma hibridizasyon için kritiktir.
- Son 15 sırasında - melezleme inkübasyon 20 dakika, Filtre Levha Birimi (FPU) ön yıkama. Hazırlama yalnızca kuyu yani, sadece daha önce açılmış filtre plakası taze / kullanılmamış kuyu kullanarak, ama asla kullanılmıştır kuyu yeniden kullanabilir mevcut deneyde kullanılır. Not: Bu filtre plaka üzerinde Kit Numarası, filtre plakası üzerindeki işaretler ve plaka üzerinde kullanılan dolgu dayalı açık olmalıdır.
- Çok kanallı bir pipet kullanılarak, her bir sıkı yıkama 1 (SW1) 45 ul ekle.
UYARI: formamid içerir. Kapak ve santrifüj 20 ° C'de 3 dakika boyunca 2,250 x g'de FPU. artık sıvı için her kuyu kontrol edin (> 15 ul / kuyu). - artık sıvı varsa, FPU 180 ° döndürün ve ek 3 dakika boyunca tekrar santrifüj adımı tekrarlayın. artık sıvı ikinci kez dönüp duruyor ise o zaman filtre plakasında bir kusur olabilir ve mevcut plaka değiştirilmesi gerekir değilse, o zaman, bir sonraki adıma geçin.
- Çok kanallı bir pipet kullanılarak, her bir sıkı yıkama 1 (SW1) 45 ul ekle.
- melezleştirme kuluçka 40 ° C'ye soğuduktan sonra, yoğunlaşma toplamak için 20 ° C'de en az 30 saniye boyunca 1000 x g'de santrifüj plaka. FPU mukabil önceden yıkanmış kuyu merkezi üzerine HYB plaka Her numunenin tüm hacmi aktarın. Çapraz bulaşmayı önlemek için her sütunun ardından ipuçları değiştirin. 20 ° C'de 3 dakika boyunca 2,250 x g'de FPU ve santrifüj örtün.
- 20 ° C'de 3 dakika boyunca 2,250 x g de SW1 ve santrifüj 45 ul ekle. İki yıkamadan toplam tekrarlayın. tamamen tüm SW1 kaldırmak için 3 dakika boyunca 2.250 xg'de tekrar FPU 180 ° ve santrifüj döndürün.
- FPU yüzlülük. Uygun atık kabına tüm flow-through (formamid içeren) atın. Farklı bir MIDI Atık Toplama Plate kullanarak FPU monte edin. 20 ° C'de 3 dakika boyunca 2,250 x g hızında her bir örnek oyuk ve santrifüj Evrensel Tamponu 1 (UB1) 45 ul ekle. UYARI: formamid içerir.
- FPU plaka ve pipet up ve karıştırmak için aşağı 3 kez de her numune için Uzatma ligasyon Mix 3 (ELM3) 45 ul ekleyin. Not: Uzatma-ligasyon reaksiyonu filtre plakası zarında gerçekleşir.
- Yapışkan alüminyum folyo ile FPU plakası kapatılır ve 45 dakika boyunca ön ısıtılmış 37 ° C inkübatör içinde tüm FPU grubunu inkübe edin.
- Indeksleme ve PCR Amplifikasyon
- indeksler Endeksli Amplifikasyon Pl karşılık gelen kuyulara kullanılan alikoti5 astar tüpleri (beyaz kapaklar, berrak bir çözelti), dikey olarak, H den satır ile hizalanır, i7 primeri borular (turuncu kapaklar, san bir çözelti) yatay olarak aşağıdaki şekilde düzenlenmiş Ana plaka sabitleme primerler, düzenleyerek (IAP) yedi bir p10 çok kanallı pipet kullanarak 12. aracılığıyla sütun 1 ile aynı hizada, IAP her satır için i7 primerler (sarı çözelti) 4 ul ekleyin ve IAP her sütuna i5 primerlerin 4 ul (berrak çözelti) ekleyin.
- Buz veya soğutma bloğu üzerinde, numune başına PCR Master Mix 2 (PMM2) 25 ul DNA Polimeraz 1 (TDP1) 0.5 ul ekleyerek PCR Master Mix hazırlamak. kısaca Invert, hızla girdap ve karıştırmak için PCR Master Mix santrifüj.
- Her IAP oyuk ve pipet up ve karıştırmak için aşağı 3 kez PCR Master Mix 22 ul ekleyin. kuyular arasındaki ipuçları değiştirin. 4 ° C'de IAP tutun.
- 45 dakika Uzatma-ligasyon reaksiyonu (adım 4.1.10) sonra, al kaldırmak dikkatle inkübatör FPU kaldırmak vefolyo mühür uminum. 20 ° C'de 3 dakika boyunca 2,250 x g de kapak ve santrifüj ile kaplayın.
- FPU ile de her bir örnek için, 50 mM NaOH 25 ul ekle. aşağı en az 6 kez yukarı pipet ve; membran ile temas pipet uçları sağlar. Her sütunun sonra değiştirin ipuçları. 5 dakika boyunca oda sıcaklığında inkübe edilir.
- şöyle Aktarım örnekleri IAP FPU elüte:
- 20 ul ayarlanmış bir p100 çok kanallı pipet kullanarak, yukarı ve aşağı FPU plaka üzerinde en az 6 kez NaOH pipetle. Biraz kapalı plaka tam aspirasyon sağlamak için FPU plakasını yatırın.
- Aktarım IAP karşılık gelen sütuna FPU 20 ul. Yavaşça yukarı pipet ve aşağı en az 6 kere iyice PCR Master Mix DNA birleştirmek. 20 ° C'de 1 dakika için 1000 x g'de yapıştırıcı film ve santrifüj ile IAP kapatın.
- Post-PCR odasına PCR Plate getirin ve bir termal döngü üzerine plaka yükleyin. PCR p çalıştırın3 dakika boyunca 95 ° C 'de bir adım denatürasyon bir ısı oluşan rogram; 30 saniye, 30 saniye için 62 ° C, 60 sn için 72 ° C, 95 ° C 25 döngü, ardından; 5 dakika boyunca 72 ° C'lik bir nihai uzatma ve ardından, 10 ° C'de beklemeye ile biten. PCR tamamlandıktan sonra bir sonraki aşamaya geçmeden Eğer plaka gece boyunca termal döngü kalabilir ya da iki gün kadar 8 ° C, 2 saklanabilir.
- PCR Arıtma ve Boncuk Tabanlı Normalleştirme
- en az 20 dakika bir sonraki aşamadan önce, oda sıcaklığında, 4 ° C buzdolabı ve yer manyetik saflaştırma boncuk elüsyon tamponu (EBT) ve jel-elektroforez reaktifler çıkarın.
- PCR işlemi tamamlandıktan sonra, 20 ° C de 1 dakika boyunca 1000 x g'de santrifüj yoğunlaşma toplamak. Her PCR reaksiyonunun Transferi 1 ul örnekleri 1/5 sulandırmak için su 4 ul içeren tüpler / plaka kuyuları şerit. yukarı pipet ve aşağı karıştırın.
- 2 ul ekleyinMikroakışkan-jel tampon 2 ul PRCed örnekleri seyreltilmiş. şeritler / plaka basım. 30 saniye için 1000 xg en az 30 saniye ve santrifüj için 1800 rpm'de çalkalanır. Üreticinin protokolü takip kütüphane hazırlanması kabul edilebilir bir kütüphane (bakınız Şekil 3) elde olmadığını değerlendirmek için mikroakışkan jeli üzerinde karışımı çalıştırın.
- onlar iyi askıya ve renk homojen görünene kadar manyetik arıtma boncuk Vortex. Her bir örnek için boncuk 45 ul ekle.
- açık yapışkan film ile plaka mühür ve 2 dakika süreyle 1800 rpm'de plaka sallayın. 10 dakika boyunca çalkalamadan oda sıcaklığında inkübe edin.
- manyetik bir stand üzerine plaka koyun. süpernatant temizlendikten sonra, dikkatlice çıkarın ve supernatant atın. Herhangi bir boncuk yanlışlıkla ipuçları içine aspire edilir ise, arka plakaya boncuk dağıtmak ve izin mıknatıs üzerinde plaka dinlenme 2 dakika süreyle ve süpernatant netleşmiştir emin olun.
- t plaka ileO manyetik standı, her bir numune için taze hazırlanmış% 80 etanol 200 ul ekleyin. ileri geri birkaç kez plaka taşıyın. 30 sn manyetik stand üzerinde plaka inkübe. Dikkatlice çıkarın ve supernatant atın. İki yıkamadan toplam tekrarlayın.
- kısaca, tüp tarafta herhangi etanol aşağı çekmek için 1000 xg'de plaka santrifüj manyetik stand üzerine geri plaka yerleştirerek ve etanol kaldırmak için 10 ul ayarlanmış bir p10 çok kanallı pipet kullanarak aşırı etanol çıkarın. 8 dakika - 5 için kurumaya boncuk izin verin.
- Bir P100 çok kanallı pipet kullanarak her bir oyuğa EBT 30 ul ekle. yukarı pipet ve bir kaç kez aşağı boncuk tüp tarafı dökülmek sağlamak. açık yapışkan film ile plaka mühür ve 2 dakika süreyle 1800 rpm'de plaka sallayın.
- 3 dakika boyunca çalkalamadan oda sıcaklığında inkübe edin. boncuklar tamamen yeniden süspanse değil hangi örnekler varsa, yavaşça boncuklar tekrar süspansiyon aşağı yukarı pipet ve.
- manyetik bir stand üzerinde plaka koyun. Bir p100 çok kanallı pipet kullanarak, yepyeni bir plaka süpernatant 20 ul transfer Kütüphane Normalleştirme Plate (LNP) denir. Ayrı bir plaka bireysel sıralama kütüphanelerin ~ kalan 10 ul transfer Kalan Temizlenmiş-Yukarı Kütüphane Plate (RCLP) çağırdı. gerekirse, ikinci dizi çalıştırmak için bir yedek olarak kullanılabilir gibi, nihai kütüphane hazırlık ile birlikte bu plaka saklayın. sonraki aşamaya geçmeden Değilse, LNP ve RCLP -15 -25 ° C'de saklanabilir.
- Şiddetle vorteks ve Kütüphane Normalleştirme Boncuk 1 (LNB1) tekrar süspansiyon. Tamamen tüpün altındaki LNB1 kordon pelletini için çok önemlidir. numune başına Kütüphane Normalleştirme Katkı 1 (LNA1) 44 ul LNB1 8 ul karıştırarak Normalleştirme Mix, hazırlayın. 20 sn - kuvvetlice 10 Normalleştirme Mix girdap.
DİKKAT: LNA1 formamid içerir. - aralıklı inversiyon a ilend Normalizasyon Mix vorteks, LNP her numune 45 ul ekleyin. açık yapışkan film ile plaka mühür ve 30 dakika boyunca 1800 rpm'de plaka sallayın. Bu 30 dakika inkübasyon kütüphane temsil ve küme yoğunluğu etkileyen büyük veya daha az 30 dakika inkubasyon gibi uygun bir kütüphane normalleştirme için önemlidir.
- 30 dakika inkübasyon sırasında, reaktif kartuşunu çözdürme ve Hyb Tampon (HT1) ile sıralama için reaktifler hazırlamak [DİKKAT: Her iki formamit ihtiva]. Buna ek olarak, daha sonraki bir aşamada buz alma ve 96 ° C'ye ayarlanmış, 1.5 ml santrifüj tüplerine için uygun olan bir ısıtma bloğu sağlar.
- 30 dakika karıştırma aşaması tamamlandığında, manyetik bir stand üzerine LNP yerleştirin. süpernatant temizlendikten sonra, dikkatlice çıkarın ve uygun bir atık kabına süpernatant atmak için bir çok kanallı pipet kullanın.
- aşağıdaki gibi Kütüphane Normalleştirme Yıkama 1 (LNW1) ile boncuk manyetik stand LNP çıkarın ve yıkayın:
- 45 ekleher bir numune için LNW1 ul.
UYARI: formamid içerir. açık yapışkan film ile plaka mühür ve 5 dakika boyunca 1800 rpm'de plaka sallayın. İki yıkamadan toplam tekrarlayın. İkinci yıkamadan sonra tüm LNW1 kaldırmak için emin olun.
- 45 ekleher bir numune için LNW1 ul.
- Manyetik standından LNP çıkarın ve bir çok kanallı pipet kullanılarak, örnek elüt edilmesi için her bir oyuğa (daha az bir hafta eski yerine) 0.1 N NaOH, 30 ul ekle. açık yapışkan film ile plaka mühür ve 5 dakika boyunca 1800 rpm'de plaka sallayın.
- 5 dakika elüsyon sırasında, iyi bir depolama plaka (SGP) olarak adlandırılan yeni bir levha kullanılmak üzere, her kütüphane Normalleştirme saklama tamponu 1 (LNS1) 30 ul ekle.
- Manyetik standında LNP yerleştirin. süpernatant temizlendikten sonra, SGP LNS1 30 ul elüsyon aktarın. çapraz kontaminasyonu engellemek için örnekler arasındaki ipuçları değiştirin.
- en az 30 saniye boyunca 1000 xg yapışkan film ve santrifüj ile plaka mühür.
- 5 ekleyin1 'dir; her bir örnek l etiketlenmiş bir Toplanmış Amplikon kitaplığı (PAL) bir 1.5 ml'lik tübe sekanslanacak olan. karıştırın ve kısaca bir mikrosantrifüj aşağı dönmeye PAL Vortex.
- HT1 596 ul - 590 PAL 10 ul - kullanıldığını Ne sıralama kimya (V2 veya V3) bağlı 4 ekleyin. Genellikle, V2 kimya HT1 595 ul ve V3 kimya HT1 592 ul PAL 8.5 ul PAL 5.8 ul ekleyin. Seyreltik Amplikon Kütüphanesi (DAL) tüp olarak bu tüp etiketleyin.
- DAL vorteks ve kısaca bir mikrosantrifüj aşağı doğru döndürün. 2 dakika boyunca 96 ° C 'de DAL inkübe edin. DAL tüpü 3 kez ters çevirin ve dizileme için sequencer hazırlarken, en az 5 dakika boyunca buz üzerinde DAL koydu. 5 dakika sonra, DAL yüklenmesine hazırdır.
- SGP ile bitmiş olursa, yapışkan alüminyum folyo film ile plaka mühür ve tarih ve plaka numarası ile etiketleyin. -15 -25 ° C'de mühürlü SGP ve PAL saklayın.

Şekil 3:. Kütüphane Hazırlık QC Jel Örneği alt bantlar üzerinde yeşil hat alt işaretleyici ve üst bantlar üzerinde mor çizgiyi göstermek için daha yüksek işaretleyici işaret eder. Her şey şerit H1, A2, B2, C2, E2, ve G2 için çalıştı. Kütüphane hazırlık şerit D2, F2, ve H2 için, optimum işe yaramadı, ama sonuç yine onlar sadece yeterli kapsama sahip olmayabilir elde edilecektir. A3 için, kütüphane hazırlık zar zor çalıştı ve büyük olasılıkla bu DNA örneği tahlil için yeterli değildi. kısım iyi PRCed doğrudan alınan çünkü alt işaretleyici üzerinde alt bantlar, kullanılmayan astarlar vardır. NTC örnek sadece kullanılmayan astar bandı, ve başka bir şey olması gerekir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
5. Sıralama
- Doğru SampleSheet.csv çalıştırmak için yapılmıştır emin olun. Bir örnek Ek Şekil 1'e bakınız.
- Durulayın ve akış hücresi kurutun ve çözülmüş reaktif kartuşa DAL 600 ul ekleyin.
- Ekrandaki talimatları takip ederek sıralama için sequencer hazırlayın.
6. Veri Analizi
- biyoinformatik boru hattı yürütün. Mutasyonları, ekleme, silme ve ilâvelerle 18 tanımlamak için in-house, özel tasarlanmış biyoinformatik boru hattı yararlanın.
- Boru hattı tamamlandıktan sonra, boru hattı işleme QC herhangi bir önemli hatalar / uyarılar yardımcısı olarak, hata / uyarı için günlük dosyalarını kontrol edin.
- Sıralı kütüphane sağlamak için çalışma istatistiklerini (Tablo 3) analiz geçti laboratuvar QC ölçümlerini (Şekil 4) belirledi. El ile (genomik veri görüntüleyici, örneğin, Bütünleştirici Genomik Vi .bam dosyaları inceleyen her varyantı gözdenibrik 16 (IGV)).
NOT: valide alel-frekans aralığında ve kaliteli filtreleme sonra kapsama asgari derinliği üzerinde sadece varyantları (İnsan Genom Varyasyon Derneğinin (HGVs) terminolojisi kullanılarak) bildirilmiştir. büyük olasılıkla iyi huylu ve iyi huylu patojenik ilişkili muhtemelen hastalığı, bilinmeyen önemi (VU'lar) varyantı, final raporlama için, her egzonik varyant olarak kategorize edildi. Bu kabul huylu varyantları ve eşanlamlı değişiklikler haricinde% 5 alel frekansının raporlama kriterleri üzerindeki tüm varyantları, bildirildi.
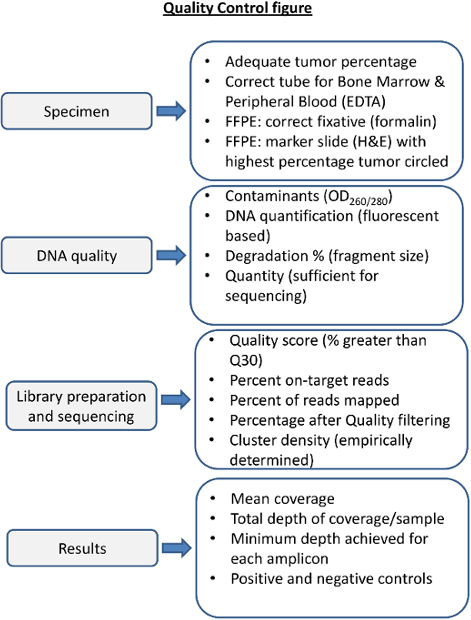
NGS için Kalite Kontrol Adımlar Şekil 4. bakış. Sürecinde her adımda kalite kontrol öncesi ve sonrası sıralama ölçütleri olarak kabul edilir böyle sonuçlar verecektir sıralamayı sağlamak için gereklidir. Uygun numune tedavisi yüksek kaliteli DNA için esastır. Kan veuygunsuz fiksatif kemik iliği düşük kaliteli DNA elde edebilirsiniz. Solid tümör örneklerinin uygunsuz tespit DNA (B5 örneğin, fiksasyon) düşürebilir. DNA kalitesi spektrofotometrik yollarla protein ve RNA kontaminasyonu açısından değerlendirildi ve doğru miktar ve DNA bütünlüğü için değerlendirilmelidir. sıralama ölçütleri ampirik sıralama laboratuvarda belirlenen ve her sıralama tepki ve her numune için takip edilmesi gerekir. Her numune için sıralama sonuçları rapor önce kapsama, derinlik ve pozitif ve negatif kontroller yeterli performansı için değerlendirilmelidir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Sonuçlar
Olgu 1 - Heme-NGS Paneli
Lösemi periferik kandan elde edilen DNA Heme-NGS Paneli için yeterli nitelik ve nicelik (176 ng / ul) oldu. kapsama genel ortalama derinliği (1,000x kapsamının asgari ortalama derinliği üzerinde) 4,933x oldu. Ek çalışma istatistikleri Tablo 3'te bulunmaktadır. 250x kapsama altına 8 bölgelerde ki, 3 nedeniyle primerlerin yanlış süsleme (yani, primer sekans düzgün nedeniyle sıralama hataları kaldırılmadı), 1 testin bilinen bir eser oldu vardı ve diğer 4 hayır raporlanabilir varyantları ile farklı genlerin ekson kısmi bölgeleri vardı. Klinik protokolü sadece en az 250 okur kapsadığı varyantları raporlama içerir rağmen, en az 100 ile tüm veri inceleme için veritabanına alınır okur.
Veri işleme from biyoinformatik boru hattı üç raporlanabilir, hastalıkla ilişkili mutasyonlar tespit; FLT3 bir missens mutasyonu IDH2 bir missens mutasyonu ve NPM1 bir çerçeve kayması mutasyon. Bunların alel frekansları ile egzonik varyantlar Tablo 4'te açıklanmıştır. FLT3'te ortak bir mutasyon otomatik olarak boru hattı denilen ve ekson 14 ekson 14. Görsel denetim gözle kontrol gerektirir değil FLT3 -İç tandem duplikasyon (ITD) 'dir FLT3 sunulan örnekte hiçbir ekleme ya da çoğaltılması gösterdi. FLT3 I836del% 1 allel frekansı oldu ve% 5 valide asgari alel frekansının altına düştü çünkü nihai raporda yer almamıştır. Bu mutasyon FLT3 D835Y değişikliği ile aynı DNA molekülü üzerinde değil (yani, aynı amplikon bölgede gözlenen, ancak "cıs" sıralama herhangi okur in) ve sadece .bam fi manuel inceleme ile izlendiles p.D835Y değişikliği doğrularken. İki FLT3 mutasyonlarının alt alel frekansları bu mutasyonların heterojenliği ve / veya klonal evrim temsil edebilir göstermektedir; Ancak, fark amplikon veya yakınındaki bir tek nükleotid polimorfizmi (SNP) ya da bu alel amplifikasyonu etkilenen primer dizisi örtüşen tahlil performansı nedeniyle olabilir.
FLT3, IDH2 ve NPM1 AML tespit mutasyonlar ile Olgu 1 Heme-NGS Panel sonuçları, FLT3'te AML. Mutasyonlarının üç yaygın Değişime uğramış genler AML (KOZMİK veritabanı 17) olan yetişkin hastaların ~% 25'inde görülen ve ya vardır edilir tirozin kinaz alanında iç tandem duplikasyonları (ITD) ya da yanlış anlamlı mutasyon. FLT3-ITD daha yaygın mutasyon ve standart kemoterapiye zayıf tepki ile ilişkili iken FLT3 kinaz d prognostik önemiOMain nokta mutasyonları, bu AML hastada görülen, prognozu 14 belirsiz bir etkisi vardır. Izositrat dehidrojenez 2 (NADP +), mitokondriyal (IDH2), yaygın olarak AML mutasyona uğramış bir epigenetik değiştirici kodlayan bir gendir. Epigenetik nitelemeler mutasyonlar gen disregülasyona neden genlerin bu sınıftaki diğer mutasyonları temsil IDH1 ve DNMT3A mutasyonlarla, AML nispeten yaygındır. Nucleophosmin (NPM1) genindeki mutasyonlar, AML en yaygın edinilmiş mutasyonların bir ve genellikle (a FLT3 yokluğunda - ITD) iyi bir prognostik faktör olarak kabul edilmektedir.
NPM1 ve IDH2 Eş mutasyonlar% 89 3 yıllık genel sağkalım, bir prognostik gösterge 5 literatürde tarif edilmiştir. genel 3-yıllık sağkalım ile karşılaştırıldığında bu önemli bir sağkalım avantajı temsilYabani tip NPM1 ve% 31 IDH2. Örneğin, standart-bakım uygulamaları UÖM 1 mutasyon analizi ve FLT3-ITD mutasyonu içerir. İkincil mutasyonlar olumlu olabilir gibi bu senaryoda, yalnızca bir NPM1 mutasyon tespiti, riski için uygun tabakalandırmak hasta başarısız olur (örneğin, IDH2) (örneğin, TET2) ya da olumsuz, bir kemik iliği nakli hafifletmek için güven azaltır.
Olgu 2 - Katı NGS Paneli
FFPE dokudan ekstre DNA, bir 252 ng / ul konsantrasyon ve 1000 baz çifti (bp) DNA bölgesinin sadece% 4'ü ile, katı-NGS Panel için yeterli kalite ve miktar. Veri analizinden sonra kapsama ortalama derinliği 9167 250 okuma derinliğinin altında hiçbir bölge ile (iyi 1000 minimum derinlik kesim okur üzeri) okur oldu. Ek QC metrikler sho vardırTablo 3'te wn.
ERBB2 (Her2 / neu) ekson 20 bir çerçeve ekleme ve TP53 bir yanlış anlamlı mutasyon: biyoinformatik boru hattı yoluyla işlenen veriler iki hastalıkla ilişkili mutasyonlar tespit etti. Bunların alel frekansları ile tüm egzonik türevleri Tablo 5'te temsil edilmektedir. Isimlendirme yansıtılan ErbB2 ekleme aslında, çoğaltılmış bir tandem (Her2 / neu) dizi temsil eder. Kimlik ve sıralama çerçeve ekleme gerekli manuel incelemenin onay IGV yoluyla okur. TP53 ve Her2 hem görüldüğü gibi% 50'den fazla mutasyon frekanslarının tespiti, / neu mutasyonları heterozigotluk (LOH) olay (tartışma) kaybı işaret ediyor.
akciğer adenokarsinomu tespit mutasyonlar ile Olgu 2 Katı NGS Panel sonuçları in ERBB2 (HER2 / neu) ve TP53, iki genin yaygın. HER2 / neu akciğer kanseri, EGFR başka yaygın mutasyona uğramış gene benzer bir tirozin kinaz reseptörünü kodlayan akciğer kanseri hastaları için geçerli standart-bakım parçası olarak test değil . 20 eklemeler 2 gözlenir HER2 / neu ekson etkinleştirilmesi - Akciğer adenokarsinomların% 4, akciğer kanseri gözlenen HER2 / neu mutasyonlarının çoğunluğunu oluşturmaktadır ve tipik olarak EGFR ve ALK 12 gibi diğer sürücü genlerindeki mutasyonlar olmadan tümörlerde görülür . HER2 / neu ve mTOR inhibitörleri 13 ve kemoterapi 15 ile birlikte monoklonal antikor Trastuzumab ile önemli hastalık kontrolü ile kombinasyon tedavisine kısmi yanıt da dahil olmak üzere, HER2 / neu eklemeleri, aktive olan hastalar için çeşitli tedavi seçenekleri için kanıt gösteren potansiyel birkaç satır vardır. Bir TP53 değişikliği keşfetme unco değilKanserde MMON, ancak şu anda hiçbir eyleme tedaviler vardır.
| Dava 1 | Olgu 2 | |
| Toplam Çalıştırma okur | 2.215.926 | 2.129.110 |
| Yüzde Mapping okur | 98,42% | 98,29% |
| Yüzde Hedef üzerinde okur | 99.01% | 97,29% |
| Yüzde Filtre sonra Target üzerinde okur | 97,60% | 95,45% |
| Kullanılabilir yüzdesi okur | 94,87% | 91,79% |
| 250x Kapsama yukarıdaki Üs yüzdesi | 98.40% | 100% |
| Üs a yüzdesiBove 1000x Kapsama | 95,90% | 99,70% |
| 250X altında Kapsam - Amplikon Numarası | 8 | 0 |
Tablo 3:. Sıralama Run QC Metrik Bu kütüphane hazırlık örnek QC geçti olmadığını belirlemek için veri inceleme için kullanılan ortalama kapsama dahil olmak üzere en önemli çalışma istatistiklerinin özetini değildir. tüm yüzdeler% 90'ın üzerinde ise tüm süreç başarılı olur, ancak FPU yıkama adımı ya da primer çapraz konuşma SW1 taşınmasını veya UB1, 80 aralığında 'Hedef üzerinde Yüzde' düşük olması ile mümkündür - % 90. 'Yüzde eşlenen "çok düşük ise, tüm numuneler, insan hizalamak gerektiği gibi, bu, bakteriler ya da diğer DNA kontaminasyonu işaret eder. Bu özelliklerde herhangi% 80 altında olduğunda, numune nasıl p belirlemeye yardımcı olmak için daha fazla inceleme için işaretlenirroceed ve sürecini iyileştirmek.
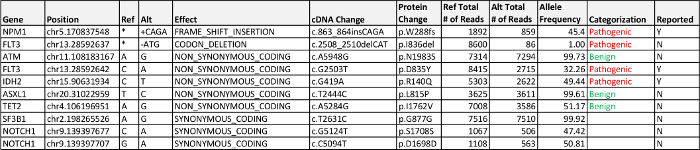
Tablo 4:.. Durum 1 Sonuçları Tespit edilen patojen, ilişkili hastalık, bilinmeyen önemi varyantı (VUS) ve listelenen% 5 alel frekansının raporlama kriterlerine üzerinde büyük olasılıkla iyi huylu egzonik varyantlar bu tabloyu indirmek için tıklayınız.
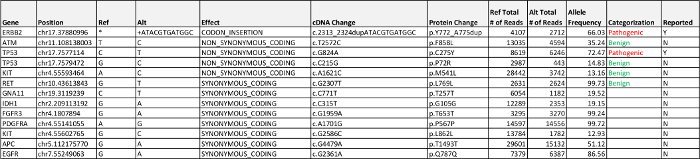
Tablo 5:.. Durum 2 Sonuçları Algılanan ilgili patojenik, hastalık, bilinmeyen önemi varyantı (VUS) ve listelenen% 5 alel frekansının raporlama kriterlerine üzerinde büyük olasılıkla iyi huylu egzonik varyantlar bu tabloyu indirmek için tıklayınız.
Yan Şekil 1: amplikon tabanlı SampleSheet.csv bir örnek. Bu levha ne iş akışı (örneğin, GenerateFastq) ne Uygulama ve Tahlili (örneğin, FastqOnly), kaç dizisine bazlar (ya da okur) (bu durumda 186 bp (bu durumda Amplikon olarak) çalıştırmak için hangi kimya sequencer için nakleden x 186 bp) ve örnekleri) bu durumda ikili indeksleme (bazı endeksler ile ilişkili son neler. Sarı vurgulanır parça deneyci istediğini değiştirildi, ancak laboratuvar bu parametreleri kullanan bu durumda. Edilebilmektedir bu rakamı indirmek için tıklayınız.
Tartışmalar
Bu yazıda anlatılan iki NGS testler klinik sunulmaktadır gibi, en önemli pratik göz kalite kontrolüdür. Özellikle, yakın dikkate kalitesi ve çıkarılan DNA miktarına dikkat edilmelidir. Bu genellikle değişken DNA verimi ile son derece bozulmuş FFPE örnekleri için özellikle önemlidir. Bir izopropanol çökeltme metodu kolon dayalı yöntemler bazen sınırlı elüsyon hacimleri ile, DNA makaslama yol bulunmuştur olarak FFPE örneklerinden DNA verimini en üst düzeye çıkarmak amacıyla geliştirilmiştir. Bu nedenle, bir örnek çok düşük konsantrasyon elde edilir ve analiz için çok bozulmuş çoğu zaman, bunun nedeni, doku boyut, tür ya da tespit olup çıkarma işlemi büyük olasılıkla. Bir ekstraksiyon hatası varsa kan / kemik iliği örnekleri için, bunun nedeni bir örnek olma hemodilute genellikle (yani, beyaz kan veya tümör o çekilişte hücrelerin yeterli sayıda olmaması) ablasyon veya kemoterapi.
. Doğrulama sırasında nt "> DNA nitelik ve nicelik kabul edilebilirliği için cutoffs kurulmalıdır 100 önerilen girdi - 250 ng genellikle tahlilde kullanılan DNA kalitesi iyi, ancak, daha sonra düşük girdi miktarları başarılı olabilir. (amplifiye DNA miktarı tavsiye edilen girdi ulaşacak beri) daha yüksek girdi miktarları sıralama sonuçlarının kalitesini artırabilir - DNA kalitesi düşükse ek olarak, (ng 250, yani büyütülebilir DNA miktarı az 100 olduğunu) . DNA kalite ve miktar için Metrik kütüphane hazırlık içine DNA ilerlemeden önce her bir örnek için uygulanmalıdır. Bu örnekleri bir "gri bölge" (Şekil 2) laboratuar müdürü veya designee takdirinde çalıştırılması gerekir. Şu anda en iyi DNA dizilimi sırasında iyi bir performans eğer tahmin yolu girişi DNA miktar ve kalite değerlendirmesi için izin veren bir qPCR tabanlı tahlil yapmaktır. Bu yaklaşım bioavailab adresleriFarklı büyüklükte parçalar (örneğin, 100 bp, 150 bp, 200 bp ve 300 bp) ve karşılaştırma verim amplifikasyonu yoluyla numune farklı büyüklükteki parçalardan, ility.Şu anda, kütüphane hazırlık birkaç kavşak noktası birinde bir yanlış adım kütüphane başarısız ya da kalitesiz olmasına neden olabilir manuel adımlar çok sayıda içerir. mikroakışkan jel analizi sıralama önce bir kütüphane hazırlık sorunu kontrol etmek için tek QC adımıdır. Buna göre, ekstra farkındalık başarılı bir reaksiyon olasılığını artırabilir birkaç kritik adımlar vardır. Doğru örnek ve oligonükleotid havuzu, her numune için kullanılan garanti zorunludur. Sağlanması ve uygun her bir numune çift endeksli PCR primer çiftlerinden birini 96 benzersiz kombinasyonu içeren kayıt örnek karıştırmak için şansını azaltır. Ayrıca, filtre plakası (FPU) doğru akar sağlamak için önemlidir; o uygun drenaj yoksa bu tamponlar neden olabilirKütüphane hazırlık nsion-ligasyonu adım vasatın altında performans ve kalitesiz sıralama verilerine yol. Kütüphane QC sonra LNB1 taneler tamamen yeniden süspansiyon haline sağlamak için önemlidir ve LNB1 / LNA1 bu çözelti konsantrasyonu kütüphanesinin molarite belirlemek için kullanılır olarak numunelerin eklemeden önce de karışık olduğu. boncuk elüsyon adım boncuk kapalı akıtılarak kütüphanenin bir optimal miktarda yol açarsa Nihayet, kümeleme yoğunluğu azalacak ve muhtemelen kütüphane yeterli ortalama kapsama almak değil neden olur. Tersine, kütüphanenin aşırı yoksul kaliteli okur yol açacaktır. Bu nedenle, sequencer kütüphanelerin uygun birleştirme ve kümelenmeyi sağlamak için boncuk esaslı normalizasyon adımında tutarlı olması önemlidir.
Kütüphane hazırlanmasına ek olarak, ham de-birden fazla mesaj göndermiş fastq dosyaları hassas mutasyon çağrı üretecek biyoenformatik boru hattı doğrulamak için kritik öneme sahiptir. seçimi birbir aracılığıyla elemek zorunda kalacak pek çok açık kaynak ve ticari olarak mevcut hizalama, varyant arayanlar ve NGS yazılım paketleri olduğu gibi özel çözüm zaman alıcı olabilir. Özel algoritmaları, temel performans istatistiklerini çıkarmak en açık kaynak araçları atlatmış benzersiz yinelenen mutasyonları tespit ve loci her aşkın kopya sayısı durumunu belirlemek için tasarlanmış olması gerekir. Bir biyoinformatik boru hattının doğrulama işlemi sırasında, karşılayan veya kalite filtreleme sonra kapsama minimum derinliği (örn en az 250 okur) ve asgari alel frekansı hem aşan varyantları için raporlanabilir kesilecek belirlemek önemlidir (örneğin, 4 %). Bu bir çoklanmış amplikon tabanlı tahlil yana, asgari kapsama derinliğini ortalama belirlenmesi önemlidir (örneğin, 1,000x) kütüphane okur asgari derinliği düşük performans Amplikon'u elde edebilmek için ulaşmak için ihtiyaç duyduğu. Buna ek olarak, deneyin birden fazla mesaj yapısı c yaparause kapalı hedef etkileri ve bu 'eserler' keşfetti ve tamamen lansmandan önce incelenmesi gerekir. tarif edilen deney bir diğer önemli bir sınırlama doğrulanmış az alel frekansı elde etmek için daha fazla,% 10 tümör içeren örnekler için bir ihtiyaç vardır.
Düşük frekans,% 1, FLT3 eklemeleri tespiti manuel yorum hala bu süreçte arzu edilir olduğunu kanıtıdır. Hatta% 5'lik bir allel sıklığı kesme ile, bazı önemli mutasyonlar belki cevapsız ve böylece el ile inceleme bu varyantları tespit etmek için gerekli olacaktır. FLT3-ITD için ekson 14 görsel muayene farkedilmeden gitmez düşük düzeyde ya da büyük ekleme / tekrarını sağlamak için tüm AML hastaları için yapılır. Buna ek olarak, yaygın primer dizisinin yanında olan HER2 ekson 20 eklemeler, manuel müdahale gerekiyor. sağlam bir biyoinformatik boru hattı olmasına rağmen, bazı varyantlar sert kesim olan sadece doğası olan gözden gitmek olabilirEn istatistikler yukarıda belirtilen kapalı. Iyi biyoinformatik, bu sorunu hafifletmek için gerekli olacak gibi olacak daha iyi bir kütüphane hazırlama ve / veya sıralama metodolojileri, bu daha az eser ve yanlış pozitif ihtiva daha düşük eşik iyi kalitede veri olması daha avantajlıdır çünkü.
Algılama ve alel frekansları yorumlanması tümörün yüzdesi belirlenmesi ve genom bazı bölgelerin amplifikasyonu yanlılığı zorluk zor olabilir. Bu heterozigozite (LOH) olay kaybı olarak yorumlanır halinde 2'de görüldüğü gibi, ek olarak,% 50'den fazla alel frekansları mutantının belirgin bir artışa yol açan, her iki yüzünden, normal alel kaybı tespit edilebilir, okuyan mutant alellin (örneğin, 2 mutantı ve bir normal kopyalama) ya da diğer mekanizmalar kazancı. Bu mekanizmalar dizisi karşılaştırmalı genomik hibridizasyon (aCGH 19) ve / veya bir SNP genotipleme dizisi kullanılarak açıklanacaktır edilebilir. 20.
Geçerli hedef zenginleştirme metodolojileri daha dizileme tek bir örnek kapsama ve hedef sıralama okur kapalı daha ihtiyacı neden verimsiz hibrid yakalama veya birden fazla mesaj göndermiş PCR teknikleri ya tam gün prosedürleri güveniyor. Yakın gelecekte beklenen NGS moleküler onkoloji için ek uygulamalar tam automatable olması ve giriş DNA çok düşük miktarlarda örnekleri işlemek mümkün olabilir kolay kütüphane hazırlama yöntemlerini içerecektir (yani, 1 ng az) yanı sıra örnekleri çok bozulmuş olan DNA. Bu zorlukları ele almak için, çoğu yöntemleri muhtemelen, PCR bazlı olacak ya çok aşamalı PCR yaklaşım ya da bir kitlesel paralel singleplex PCR yaklaşımında olmak. Buna ek olarak, tek tek amplikonların molekül barkod önemli ölçüde arka dizileme gürültüsünü azaltmak için gösterilmiştir ve alt alel frekansları elde etmek ve dolaştırma yakalama doğru hareket tümör hücrelerinin daha düşük oranlarda örneklerin test sağlayacaktırTümör hücreleri ing.
Kanser örneklerinde hastalıkla ilişkili mutasyonların saptanması yıllardır bakım standart olmuştur. Tarihsel olarak, genler, genellikle test dizisinin sonuna gelen bir mutasyonun belirlenmesi ile her seferinde sekans, tek bir gen / ekson test edildi. NGS gelişi neoplazi ile ilişkili birden fazla mutasyonun tanımlanması yol açan paralel birçok kanser ile ilişkili birden fazla gen sıralanması için daha az önyargılı bir yaklaşım için izin verdi. Kanser somatik mutasyonların saptanması için NGS klinik kullanımı giderek daha belirgindir. Gerçekten de, tümör örneklerinin NGS tabanlı analiz, geleneksel tek gen testi meydan okuyan yeni bir paradigma temsil eder, ama klinik yarar çok açıktır. Klinik laboratuvarlar bugün bu güçlü teknolojinin uygulanması ile dikkatli bir yöntem doğrulama ve test yorumunu evlenmek heyecan verici bir fırsat var.
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Yazarlar üretimde el yazması ve yardım okumak için Daniel Wild yardım kabul etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Genomic DNA ScreenTape | Agilent Technology | 5067-5365 | |
| Genomic DNA Reagents | Agilent Technology | 5067-5366 | |
| High Sensitivity D1000 ScreenTape | Agilent Technology | 5067-5584 | |
| High Sensitivity D1000 Reagents | Agilent Technology | 5067-5585 | |
| TapeStation 2200 | Agilent Technology | G2965A | |
| TapeStation Analysis Software | Agilent Technology | A.01.04 or higher | |
| 96-well Tube Storage Racks | Any Vendor | ||
| 15/50 ml Tube Rack | Any Vendor | ||
| 96-well Plate Rack | Any Vendor | ||
| Pipette, single-channel, 0.5–2.5 μL | Any Vendor | ||
| Pipette, single-channel, 1–10 μL | Any Vendor | ||
| Pipette, single-channel, 2–20 μL | Any Vendor | ||
| Pipette, single-channel, 10–100 μL | Any Vendor | ||
| Pipette, single-channel, 20–200 μL | Any Vendor | ||
| Pipette, single-channel, 100–1000 μL | Any Vendor | ||
| Serological Pipettor | Any Vendor | ||
| Vortexer | Any Vendor | ||
| Ice bucket | Any Vendor | ||
| Microcentrifuge (for tubes and strip tubes) | Any Vendor | ||
| Freezer, -20 °C | Any Vendor | ||
| 4 °C Refrigerator | Any Vendor | ||
| Water or Bead Bath | Any Vendor | ||
| Incubator (37 oC) | Any Vendor | ||
| Serological Pipettes, 1 mL | Any Vendor | ||
| Serological Pipettes, 5 mL | Any Vendor | ||
| Serological Pipettes, 10 mL | Any Vendor | ||
| Serological Pipettes, 25 mL | Any Vendor | ||
| Gloves | Any Vendor | ||
| Razor Blades/Scaples | Any Vendor | ||
| KimWipes | Any Vendor | ||
| 15 mL Conical Tube | Any Vendor | ||
| 50 mL Conical Tube | Any Vendor | ||
| Paper Towels | Any Vendor | ||
| 200 proof Ethanol | Any Vendor | Store in Flammable Cabinet | |
| 2-Propanol (Isopropanol) | Any Vendor | Store in Flammable Cabinet | |
| 25ml Reservoirs | Any Vendor | ||
| 10N NaOH | Any Vendor | ||
| Pipette, 8-channel, 1–10 μL | Any Vendor | ||
| Pipette, 8-channel, 10–100 μL | Any Vendor | ||
| Pipette, 8-channel, 20–300 μL | Any Vendor | ||
| Ice Bucket | Any Vendor | ||
| Water Squirt Bottle | Any Vendor | ||
| Alcohol Squirt Bottle | Any Vendor | ||
| Lens Cleaning Paper | Any Vendor | ||
| Plates, 96-well PCR, Semi-Skirted | Any Vendor | ||
| Tube strips, 8-well, 0.2 mL | Any Vendor | ||
| Agencourt AMPure XP Beads | Beckman Coulter | A63881 | |
| BioShake IQ or 3000-T elm | Bulldog Bio/Q.Instruments | 1808-0506/ 1808-0517 | |
| DropPlate96 S - LabChipDS | Caliper | 128876 | |
| DropPlate96 D - LabChipDS | Caliper | 132848 | |
| DropSense96 | Caliper (Trinean) | ||
| DropQuant Software | Caliper (Trinean) | ||
| Plate Sealing Film | Denville | B1212-5S | |
| Aluminum Seal Foil | Denville | B1212-6S | |
| Nuclease-Free, Pure Water System | EMD Millipore | ||
| 5424 centrifuge | Eppendorf | 22621408 | |
| 5804R centrifuge | Eppendorf | 22623508 | Both 15 ml tube and plate rotators, preferably a centrifuge that can go up to 2,500 x g. |
| Safe-Lock Tube 1.5 mL, Natural | Eppendorf | 22431021 | |
| 5 mL Tube, DNA LoBind Tube | Eppendorf | 30108310 | |
| 5430R Centrifuge | Eppendorf | 022620645 | Any plate rotator centrifuge will work |
| Hybex Microsample Incubator | Fisher Scientific | 1057-30-0 | |
| Hybex 0.2 mL Tube Block | Fisher Scientific | 1057-31-0 | |
| TruSeq Amplicon – Cancer Panel | Illumina | FC-130-1008 | 96 reactions |
| TruSeq Custom Amplicon | Illumina | PE-940-1011 | 96 reactions |
| TruSeq Custom Amplicon Index Kit | Illumina | FC-130-1003 | 96 Indices, 384 Samples |
| MiSeq Reagent Kit v3, 500 Cycles | Illumina | MS-102-3003 | |
| MiSeq Reagent Kit v2, 300 Cycles | Illumina | MS-102-2002 | |
| MiSeq Reagent Kit v2, 500 Cycles | Illumina | MS-102-2003 | |
| Experiment Manager | Illumina | 1.3 or higher | |
| MiSeq Reporter | Illumina | 2.0 or higher | |
| Sequencing Analysis Viewer | Illumina | 1.8 or higher | |
| TruSeq Index Plate Fixture and Collar Kit | Illumina | FC-130-1007 | |
| MiSeq v2 | Illumina | SY-410-1003 | |
| TruSeq Custom Amplicon Filter Plate | Illumina | FC-130-1006 | |
| Index Adapter Replacement Caps | Illumina | 11294657 | |
| Qubit 2.0 | Invitrogen | Q32866 | |
| Qubit 0.5 ml Tubes | Invitrogen | Q32856 | |
| Qubit dsDNA Broad Range Assay Kit | Invitrogen | Q32853 | |
| DynaMa6-96 Magnetic Stand, Side Skirted | Invitrogen | 120.27 | |
| GeneAmp PCR System 9700 (gold/silver block) | Life Technologies | N8050200 | |
| Gentra Puregene Blood Kit | Qiagen | 158489 | |
| Deparaffinization Solution (16ml) | Qiagen | 19093 | |
| Buffer ATL (4x50ml) | Qiagen | 939011 | |
| Protein Precipitation Solution (50 ml) | Qiagen | 158910 | |
| DNA Hydration Solution (100ml) | Qiagen | 158914 | |
| Glycogen Solution (500 μl) | Qiagen | 158930 | |
| Qiagen Proteinase K | Qiagen | 19133 | |
| Rnase (5ml) | Qiagen | 158924 | |
| Nuclease-Free Water (10 x 50 ml) | Qiagen | 129114 | |
| Pestles | USA Scientific | 1415-5390 | |
| TipOne RPT 10 ul elongated filter pipet tips in sterilized racks, 10 racks of 96 tips (960 tips). | USA Scientific | 1180-3810 | |
| TipOne RPT 100 ul natural, beveled filter pipet tips in sterilized racks, 10 racks of 96 tips (960 tips) | USA Scientific | 1180-1840 | |
| TipOne RPT 200 μl natural, beveled filter pipet tips in racks, sterilized racks, 10 racks of 96 tips (960 tips) | USA Scientific | 1180-8810 | |
| TipOne RPT 20 μl natural, beveled filter pipet tips in racks, sterilized racks, 10 racks of 96 tips (960 tips) | USA Scientific | 1180-1810 | |
| TipOne RPT 1000 μl natural, graduated XL filter pipet tips in | USA Scientific | 1182-1830 |
Referanslar
- Gerlinger, M., et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. N Engl J Med. 366 (10), 883-892 (2012).
- Campbell, P. J., et al. The patterns and dynamics of genomic instability in metastatic pancreatic cancer. Nature. 467 (7319), 1109-1113 (2010).
- Ding, L., et al. Clonal evolution in relapsed acute myeloid leukaemia revealed by whole-genome sequencing. Nature. 481 (7382), 506-509 (2012).
- Frampton, G. M., et al. Development and validation of a clinical cancer genomic profiling test based on massively parallel DNA sequencing. Nature Biotechnol. 31 (11), 1023-1031 (2013).
- Patel, J. P., et al. Prognostic relevance of integrated genetic profiling in acute myeloid leukemia. N Engl J Med. 366 (12), 1079-1089 (2012).
- Forbes, S. A., et al. COSMIC (the Catalogue of Somatic Mutations in Cancer ): a resource to investigate acquired mutations in human cancer. Nucleic Acids Res. 38 (Database Issue), 652-657 (2010).
- Shih, A. H., Abdel-wahab, O., Patel, J. P., Levine, R. L. The role of mutations in epigenetic regulators in myeloid malignancies. Nat Rev Cancer. 12 (9), 599-612 (2012).
- Liersch, R., Müller-Tidow, C., Berdel, W. E., Krug, U. Prognostic factors for acute myeloid leukaemia in adults - biological significance and clinical use. Br J Haematol. 165 (1), 17-38 (2014).
- Bacher, U., Schnittger, S., Haferlach, T. Molecular genetics in acute myeloid leukemia. Curr Opin Oncol. 22 (6), 646-655 (2010).
- Subramanian, J., Govindan, R. Lung cancer in "Never-smokers": a unique entity. Oncology (Williston Park). 24 (1), 29-35 (2010).
- Sakashita, S., Sakashita, M., Tsao, M. S. Genes and pathology of non-small cell lung carcinoma. Semin Oncol. 41 (1), 28-39 (2014).
- Arcila, M. E., Chaft, J. E., Nafa, K. Prevalence clinicopathologic associations, and molecular spectrum of ERBB2 (HER2) tyrosine kinase mutations in lung adenocarcinomas. Clin Cancer Res. 18 (18), (2012).
- Gandhi, L., et al. Phase I study of neratinib in combination with temsirolimus in patients with human epidermal growth factor receptor 2-dependent and other solid tumors. J Clin Oncol. 32 (2), 68-75 (2014).
- Sheikhha, M. H., Awan, A., Tobal, K., Liu Yin, J. A. Prognostic significance of FLT3 ITD and D835 mutations in AML patients. Hematol J. 4 (1), 41-46 (2003).
- Mazières, J., et al. Lung cancer that harbors an HER2 mutation epidemiologic characteristics and therapeutic perspectives. J Clin Oncol. 31 (16), 1-8 (2014).
- Robinson, J. T., et al. Integrative Genomics Viewer. Nat Biotechnol. 29 (1), 495-500 (2011).
- Forbes, S. A., et al. COSMIC: exploring the world's knowledge of somatic mutations in human cancer. Nucleic Acids Res. 43 (Database issue), D805-D811 (2014).
- Daber, R., Sukhadia, S., Morrissette, J. J. Understanding the limitations of next generation sequencing informatics, an approach to clinical pipeline validation using artificial data sets. Cancer Genetics. 206 (12), 441-448 (2013).
- Haraksingh, R. R., et al. Genome-Wide Mapping of Copy Number Variation in Humans: Comparative Analysis of High Resolution Array Platforms. PLoS ONE. 6 (11), e27859 (2011).
- de Leeuw, N., et al. SNP Array Analysis in Constitutional and Cancer Genome Diagnostics - Copy Number Variants, Genotyping and Quality Control. Cytogenet Genome Res. 135 (3-4), 212-221 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır