Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Voltaj kelepçesi florometrisi
Bu Makalede
Özet
Bu makale, iyon kanallarındaki yapısal yeniden düzenlenmeleri araştırmak için maleimid boyaları yerine Floresan Doğal olmayan Amino Asitlerin (fUAA) kullanıldığı klasik Voltaj-Kelepçe Florometrisinin (VCF) geliştirilmesini anlatıyor. Prosedür, Xenopus oosit DNA enjeksiyonu, RNA / fUAA koinjeksiyon ve eşzamanlı akım ve flüoresans ölçümlerini içerir.
Özet
Gerilim-Kelepçe Fluorometri (VCF), gerçek zamanlı floresan ve akım ölçümlerinin sırasıyla lokal düzenlenmeler ve küresel işlev üzerine rapor verdiği elektrojenik membran proteinlerinin yapısını ve fonksiyonunu araştırmak için tercih edilen bir tekniktir. Kriyo elektron mikroskopisi veya X-ışını kristalografisi gibi yüksek çözünürlüklü yapısal teknikler ilgi proteinlerin statik görüntülerini sağlarken, VCF yapısal yeniden düzenlenmeleri (flüoresan) dinamik fonksiyonel verilere (elektrofizyoloji) bağlamamızı sağlayan dinamik yapısal veriler sağlar. Yakın zamana kadar, proteinlerin yer yönünde flüoresan etiketlemesi için kullanılan tiyol reaktif kimyası, yaklaşımın kapsamını kısıtladı, çünkü endojen olanlar da dahil erişilebilir sisteinler etiketlenecek. Dolayısıyla, endojen sisteinlerden bağımsız proteinler oluşturmak gerekiyordu. Etiketleme ayrıca, hücre dışıyan. Bu, ortogonal bir tRNA ve tRNA sentetaz çifti 2 kullanılarak durdurma kodonunun bastırılmasına yanıt olarak küçük bir fluoresan probu özel olarak dahil etmek için Floresan Doğal Olmayan Amino Asitler (fUAA) kullanılarak değiştirildi. VCF gelişimi sadece DNA enjeksiyonunun (tRNA / sentetaz çifti) iki aşamalı enjeksiyon prosedürüne ve ardından RNA / fUAA ko-enjeksiyonuna ihtiyaç duyar. Şimdi hem hücre içi hem de gömülü alanları etiketlemek mümkündür ve VCF kullanımı önemli ölçüde genişlemiştir. Bu nedenle, VCF tekniği geniş bir protein yelpazesinin incelenmesi için çekici hale gelir ve daha da önemlisi, çok sayıda sitosolik düzenleyici mekanizmanın araştırılmasına izin verir.
Giriş
Çeşitli kimyasal ve fiziksel özelliklerin 200'den fazla doğal olmayan amino asitleri genetik olarak E. coli , maya ve memeli hücrelerindeki proteinlere dahil edilmiştir 3 . Doğal olmayan amino asit, ortogonal olarak tasarlanmış bir tRNA / sentetaz çiftiyle belirli bir durdurma kodonuna tepki olarak dahil edilir. Proteinleri değiştirmek için genetik yaklaşım, protein yapısına ve işlevine değerli bilgiler sağlamıştır. Burada, Gerilim-Kelepçe Florometrini (VCF) floresan bir UAA ile kombine etmek için bir protokol sunuyoruz.
VCF'de, flüoresan prob etrafında lokalize olan fonksiyonel verilerin ve yapısal yeniden düzenlemelerin aynı anda gözlemlenmesi (~ 5 Å), milisaniye çözünürlük 1 ile dinamik bilgi elde etmemize izin verir. Flüoresan problar, lokalize protein hareketi üzerine söndürme durumunu değiştirir. Sadece 1-2 A'lık bir hareket, flüoresanda önemli değişiklikler yaratmaya yeterlidirYoğunluk 4 . Hedef proteindeki ilgi alanının belirlenmesinden sonra, site nokta mutasyonu ile mutasyona uğratılmıştır. Klasik olarak, tortu bir sisteine dönüştürüldü, oysa şimdi, amber stop kodonu (TAG) genetik fUAA'nın birleşmesi için eklendi. Protein daha sonra in vitro olarak kopyalanır.
Xenopus oositleri, daha büyük manipülasyona ve daha yüksek floresans yoğunluğuna (daha fazla florofor) yol açan, yapı fonksiyonu çalışmaları için tercih edilirken , diğer ifade sistemleri ( örneğin, memeli hücreleri) 5 , 6 , 7 kullanılabilirken, Gürültü oranı. Üstelik, Xenopus oositleri, 2 , 8 nolu endojen proteinlerden düşük arka plana ve hayvan kutbu kalkanlarında karanlık pigmentasyona karşı tSitosol. Xenopus oositleri cerrahi olarak çıkarılır ve fUAA için spesifik olan ortogonal tRNA / tRNA sentetaz çiftini kodlayan DNA, oositlerin çekirdeğine enjekte edilir. 6-24 saatlik inkübasyon süresinden sonra, protein RNA, oositlerin sitozolüne fUAA ile birlikte enjekte edilir, bunu 2-3 gün inkübasyon periyodu takip eder. FUAA'ya herhangi bir hasar vermemek için (foto-ağartma), florofor uyarımını önlemek için Anap dahil prosedürler kırmızı ışık altında gerçekleştirilmelidir.
Oositler dik bir flüoresan mikroskopta monte edilmiş kesilmiş açık oosit gerilim-kelepçe düzeneği üzerinde incelenir ve elektrik akımı ve floresans değişiklikleri aynı anda 9 , 10 olarak kaydedilir. Alternatif olarak, iki elektrotlu voltaj kelepçesi 1 veya yama-kelepçe konfigürasyonları 11 kullanılabilir. Floresans, düşük RMS gürültüsü olan uygun dalga boyları tarafından uyarılır ve Yüksek amplifikasyonlu bir amplifikatöre bağlı bir fotodiyot kullanılarak kaydedilen emisyon.
Gerilim-kelepçe florometride flüoresan doğal olmayan amino asitler (fUAAs) kullanmanın çeşitli avantajları vardır. Bir tanesi membran proteinlerinin sitosolik tarafına erişimdir; ( Örneğin, Ca 2+ - veya nükleotid bağlanma bölgeleri, voltaj kapılı iyon kanallarının hızlı ve kapalı halde inaktivasyonu, gözenek açma, modül bağlantısı). Tüm bu süreçlere flüoresan etiketleme için artık erişilebilir.
Bir diğer avantaj ise, proteinin daha az bozulmasına yol açan probun küçük boyutu olmasıdır. Şimdiye kadar, fUAAs için iki ortogonal tRNA / tRNA sentetaz çiftleri, Xenopus oositlerinde kullanılan tek fUAA olan 3- (6-asetilnaftalen-2-ilamino) -2-aminopropanoik asitin (Anap) 12,13 olduğu düşünülmüştür 2 ,"Xref"> 8. Anap, 272.3 g / mol molekül ağırlığına sahip ve sadece triptofan 12'den biraz daha büyük olan çevreye duyarlı bir florofordur ( Şekiller 1A, 1B ). Küçük boyundan ötürü, bir bağlayıcı vasıtasıyla bağlanan konvansiyonel fluoroforlara kıyasla (genelde 500 g / mol'den fazla) florofor tarafından daha az sterik etkinin ortaya çıkması muhtemeldir. Dahası, Anapa durumunda, flüorofor, sisteinlerle bağlantılı olanlardan daha protein omurgasına yakın konumda bulunur ve sonuç olarak, Anap daha fazla lokalize yeniden düzenleme istemektedir. Son olarak, bölgeye özgü etiketlemeyi sağlamak için konvansiyonel VCF'deki endojen sisteinlerin uzaklaştırılması, UAA-VCF'de artık gerekli değildir ve bu nedenle (i) proteinleri neredeyse kendi doğal hallerinde bırakır ve (ii) VCF'nin uygulanmasına izin verir Fonksiyonun sistein ikamesi ile değiştirilebildiği daha geniş bir protein aralığını incelemek.

Şekil 1 : Anap ve Floresans Spektrumu. ( A ) Anapın kimyasal yapısı. ( B ) Anap floresanının solventin hidrofobikliğine duyarlılığını gösteren 1 nM Anap için normalleştirilmiş absorpsiyon spektrumu ve emisyon spektrumu. Emisyon spektrumu, 350 nm'de heyecan verici şekilde elde edildi. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Floresan UAAs'ın bir dezavantajı, aminoasillenmiş tRNA'ların miktarı azsa, durma kodonu okunması, translasyonel yeniden başlatma, C-terminali kesilmiş proteinler veya endojen aminoasilasyona sahip çapraz geçişten heterojen bir protein popülasyonunun oluşabilmesidir. Bu sızıntı ekspresyonu daima fUAA'nın ve tRNA / tRNA sentetaz çifti yokluğunda kontrol edilmelidir. Trans sorununu ele aldık.Lasyonel yeniden başlatma ve daha önce N-terminal ekleme siteleri için nasıl önüne geçileceği 14 . Bununla birlikte, fUAA, tRNA ve tRNA sentetaz doymuş miktarda mevcut olduğunda, sızıntı ekspresyonu olasılığı düşüktür.
FUAA-VCF ve konvansiyonel VCF arasındaki temel usul farkı, oositlerin enjeksiyonu ve taşınmasıdır; TRNA ve tRNA sentetazı (pAnap) kodlayan DNA'nın enjeksiyonu ya protein mRNA'yla birlikte enjekte edilen veya alternatif olarak bir asetoksimetil (AM) ester olarak inkübasyon solüsyonuna eklenen Anap'ın sokulması ile devam eder.
Protokol
Kurbağa manipülasyonları Kanadalı yönergelere uygun olarak gerçekleştirildi ve Montréal Üniversitesi etik komitesince (CDEA, protokol # 15-042) onaylandı.
1. fAAA Kuruluşu için mRNA Hazırlığı
- Konformasyonel değişikliklerin meydana gelmesi beklenen proteinde ilgi alanı seçin. Bu bölgede fUAA'nın yerini alacak bir amino asit seçin.
NOT: Konum seçimi, beklenen yapısal yeniden düzenlenmelere dayanmaktadır. Yüksek çözünürlüklü bir yapı ve beklenen hareketlerin bir hipotezi varsa, anap, kimyasal ortamın değişeceği şekilde yerleştirilmelidir; Bu dielektrik sabitindeki (hidrofobik veya hidrofilik ortamda) bir değişiklik olabilir veya muhtemelen başka bir amino asitle söndürülebilir. En iyi söndürücüler triptofanlardır. Anap bir devlette söndürücü ile temas halinde olmalıdır (van-der Waals yarıçapının örtüşmesi) ve bunun dışında serbest bırakılmalıdır.Diğeri. Yüksek çözünürlüklü yapılar veya modeller mevcut değilse, ilgilenilen bölgeyi taramak zorunda kalacaklar. Her iki durumda da, ekspresyon ve floresan sinyali alma ihtimalini artırmak için yakınlardaki birkaç yeri seçmeniz önerilir. Protein olgunlaşması ve / veya fonksiyonu sırasında sterik etkileri en aza indirgemek için büyük ve aromatik amino asitlerin (Phe, Trp, Tyr) yerini alabilir. Bununla birlikte, yazarlar, yer değiştirmiş amino asitten bağımsız olarak fUAA yerleştirilmesi için bir ilgi alanının taranmasının daha verimli olduğunu deneyimlediler. - Seçilen siteye, bölgeye yönlendirilmiş mutagenez 15'i kullanarak sarı bir stop kodonu (TAG) yerleştirin. İlgili proteinin kehribar stop kodonunda (TAG) bitmediğinden emin olun. Eğer öyleyse, farklı bir mutasyona (ohcher veya opal stop kodonu) mutasyon yapın. DNA'yı çoğaltın, izole edin ve dizileyin. Protein mRNA'sını in vitro transkripsiyon 16 ile elde edin ve mRNA'yı 20 ° C veya 80 ° C'de saklayın.
- Xenopus laevis kurbağalarından Cerrahi olarak Evre V veya VI oositleri elde edin ve daha önce tarif edildiği gibi 17 kolajenaz ile defolipüler hale getirin.
- Kurbağaları onaylanmış hayvan protokolüne (burada: 3-aminobenzoik asit etil ester) göre uygun bir anestezi ile anestezi uygulayın. Parmak uçlarına nazik bir çimdiklik yapmadığında (geri çekilme refleksi kaybı) ameliyat için uygun şekilde anestezi altındadırlar.
- Kurbağaları anestetik çözeltiden derhal çıkarın ve cildini temiz su ile iyice yıkayın. Bu durulama, hayvanın deri yüzeyinden emilmemiş kimyasalları çıkararak anestezinin daha derin seviyelerine düşmesini önleyecektir.
- Bir taraftan yumurtalık düğümlerini ameliyatla çıkarın ve iki forseps kullanarak düğümleri dikkatle açın. 20-30 dakika boyunca% 1 (w / v) kollajenaz içeren "standart oosit çözeltisi" (SOS) içinde oositleri inkübe edin ve çırpınKusmak için SOS çözeltisiyle üç kez yıkayın.
- Büyük ve sağlıklı oositleri ayrı ayrı seçin ve enjeksiyondan en az 4 saat önce 18 ° C'de, antibiyotikler (100 U / mL penisilin, 100 μg / mL streptomisin, 10 mg / 100 mL kanamisin) ve% 5 at serumu takviyeli Barth solüsyonunda inkübe edin .
NOT: Aralarında 4 ay gecikmeli olarak 2-4 ameliyattan sonra, Xenopus laevis , 3-aminobenzoik asit etil ester ile uzun süre (> 1 saat) kuluçka yapılarak ötenazi yapılır.
- DNA'nın nükleer enjeksiyonu için, çekirdeğe erişebilmek ve oositin zarar görmesini önlemek için uzun ve ince bir enjeksiyon ucu hazırlayın. Enjeksiyon ucu yağla doldurun ve nano-enjektör cihazına monte edin.
- Nano enjektörü bir stereo mikroskop altında kurun ve ucun ucunu kırmak için forseps kullanın. Ucun ucunda hava kabarcığı kalmayana kadar yağı çıkarın.
- 1 μL, 0.1 μg /# 181; L Parafilmin bir stereoskop altında NaOH (% 1 N NaOH) ihtiva eden nükleaz içermeyen suyun içine yerleştirin ve enjeksiyon ucunu DNA ile doldurun.
- 40 oosit Barth's solüsyonu antibiyotikler takviyeli mesh kaplı bir enjeksiyon kabına aktarılır.
NOT: Örgü kaplı enjeksiyon tabağını yapmak için, bir polistren Petri kabını doldurmak için uygun boyutta bir 800 μm naylon örgü parçasını kesin. Merkeze kloroform ekleyin ve daha sonra kafesin üzerine yerleştirin. Örgüyü plastik ayarlanıncaya kadar düz tutun. - Oosit çekirdeği hayvanda (karanlık) kutuda bulunduğundan, hayvan kutupunun ortasındaki enjeksiyon ucunu hedefleyin ve ucun hayvan yarı küresinin merkezine (veya RNA enjeksiyonuna kıyasla 2-3x derinliğe) ulaşacağı şekilde takozlayın. ). Her bir oositin çekirdeğine 9.2 nL pAnap enjekte edin. İnce uç ve küçük enjeksiyon hacmi, düzensiz enjeksiyon veya tıkanık uçla sonuçlanabilir. Enjeksiyonun havaya enjekte edip etmediğini zaman zaman kontrol edin.
NOT: DNA'nın çekirdeğe düzgün şekilde enjekte edilip edilmediği belirsizdir. Bu nedenle, oositlerin% 10-40'ının tRNA / sentetaz çiftini ekspres etmemesini bekleyin. Ayrıntılı bilgi için Tartışma'ya bakınız. - Anap spesifik tRNA'lar ve tRNA sentetazlarının sağlam ekspresyonunu sağlamak için, oositleri antibiyotikler ve% 5 At serumu (HS) ile desteklenmiş 2 mL Barth solüsyonunda 6-24 saat boyunca 18 ° C'de inkübe edin.
NOT: DNA inkübasyon süresi RNA enjeksiyonundan birkaç gün sürebilir, ancak ekspresyonu arttırmaz. - Nano enjektörü RNA enjeksiyonu için hazırlayın (adım 2.2 ile aynıdır, ancak enjeksiyon ucunun DNA enjeksiyonu kadar ince olması gerekmez). Anap'taki fotoğrafların ağartılmasını önlemek için bu noktadan itibaren yalnızca kırmızı ışık altında çalışın.
- Doğrudan bir parafilm parçası üzerinde 1-2 μg / μL mRNA'nın 1 μL'si ile 1 μL'lik 1 mM Anap'ı karıştırın ve enjeksiyon ucunu karışık solüsyon ile doldurun. Vejetalin hemen altında membran(Parlak) kutba yerleştirin ve pAnap enjekte edilen her oositte 46 nL enjeksiyon yapın.
NOT: Gerekli mRNA konsantrasyonu, ilgili proteine bağlıdır. - Işıktan korunan oositleri bir kutuya koyun veya Barth's solüsyonu ile desteklenmiş antibiyotikler ve% 5 at serumu içinde 18 ° C'de 2-3 gün alüminyum folyo ile sarın. Her gün yeni Barth'ın çözeltisiyle değiştirin ve kontaminasyonu önlemek için ölü oositleri çıkarın.
- Daha önce açıklandığı gibi kesik açık oosit voltaj sıkıştırma aletini takın 18 .
- Floresan ölçümlerini ( Şekil 2c ) gerçekleştirmek için oosit ve mikroskop yerleştirmek için standart stereoskop arasında hareket etmesini sağlayan bir kaydırıcı üzerine kayıt odasını yerleştirerek elektrofizyoloji kayıt sistemini dik bir floresans mikroskopu üzerine monte edin.
NOT: Kesit açık oositlerin odacığının geometrisi, normal traManipülasyon esnasında aydınlatma lambası. Bu nedenle, kırmızı filtreli bir "gooseneck" halojen lamba, yanlamasına üstten aydınlatmak için kullanılır. Mikroskopun kondansatörü, elektrofizyoloji odası için aşamayı düşürmek için boşluk bırakılabilir. - Floresan mikroskobun C-mount çıkış portuna bir fotodiyot tespit sistemi bağlayın ( Şekil 2a ). Fotokupl okumasını dijital sinyal işlemcisinde (DSP, analog / dijital - dijital / analog dönüştürücü) ikinci bir giriş kanalına bağlayın.
- Floresan uyarma için ışık kaynağı olarak 100 W, 12 V halojen lamba kullanın.
NOT: Alternatif olarak, Hg-brülörleri kullanılabilir, ancak kayıtlar sırasında çok hızlı foto-ağartmayı önlemek için yoğunluk azaltılmalıdır. LED aydınlatması, ilgili LED'ler uyarı aralığında önemli bir yoğunluk gösteriyorsa önerilir ( örn., Anap için ~ 350 nm). Çoğu beyaz LED, UV spektrumuna kadar uzanmaz. - insUyarım ışık kaynağı ile mikroskop arasında elektrikle kontrol edilen bir perde ve kontrolünü (tipik olarak TTL palsı) DSP'nin bir dijital çıkışına bağlayın. Kayıt yazılımında (üretici belgelerine bakın) TTL darbesini bekleyin, böylece deklanşör kayıt başlamadan ~ 100 ms önce açılır. Bu şekilde, açma işlemi sırasında herhangi bir titreşim kayıtta engel oluşturmaz. Zaman, deklanşörün hızına ve titreşimine bağlıdır. Şekil 4'te gösterildiği gibi, kayıt bitmeden önce darbeyi 5 ms sonlandırın. Bu şekilde toplam flüoresan için de değer kaydedilir.
- Filtre küpü taretine uygun bir filtre küpü (uyarma filtresi, dikroik ayna ve emisyon filtresi) takın. Anap için Örneği: 377/50 nm band pass, dikroik 409 nm longpass ve Em: 470/40 nm bant geçiren kullanın.
- Daha önce açıklandığı gibi kesilmiş açık oosit voltaj kelepçesi için hazırlama adımlarını izleyin ve 18 (agar köprüsü hazırlığı, oositin monte edilmesi, saponin permeabilization) görünür hale getirin. Bununla birlikte, kayıtlardan önce flüoroforun ağartılmasını önlemek için her zaman kırmızı ışık altında çalışın. Oosit yerleştirirken hayvan kutuplarının yukarı baktığından emin olun. Hayvan kutbu zarının altındaki pigmentasyon, sitoplaziden kaynaklanan otofloresansa karşı koruma sağlar ve dolayısıyla arka plan floresanını azaltır.
- Odayı mikroskop üzerine kaydırın ve 4X'lik bir objektif kullanarak odaklayın.
- Vücudun voltajını algılayan V1 elektroduyla (3 M KCl) implante edin, 40X suda daldırma (NA 0.8 - 0.9) objektifine geçin. Yukarı bakan hayvan direğine odaklanın.
- Kırmızı ışığı kapatın. Filtre küpü taretini ve fotodiyotöre bağlı optik çıkış portunu çevirerek doğru filtre küpünü seçin. Sersem açınEn lambayı en yüksek yoğunluğa getirin ve oositten çıkan arka plan flüoresan yoğunluğunu okumak için kısa süre 2-5 saniye açık tutun. Tarif edilen kurulum ile değer Anap için yaklaşık 50-200 pA olmalıdır.
- Kelepçeyi açın, banyo / koruma şalterini aktif konuma getirin ve ben sahne üstündeki topuzu çevirerek membran potansiyelini (V1 - V2) komut potansiyeline ayarlayın.
- Kayıt yazılımında tutma potansiyeli, adım protokolü, sayı ve darbe uzunluğu vb. Değerlerini seçin. Gerilime bağlı akıntıları ve Anap floresan yoğunluklarını kaydedin.
- Aynı proteindeki iki lokasyonu aynı anda izlemek için, ekstraselüler ve erişilebilir bir amino asidi sisteyin haline getirin ve tiol kimyasıyla spesifik etiketlemeyi sağlamak için diğer sisteinleri çıkarın.
- Adım 2.1-2.5'i uygulayın.
- VCF kayıtlarından önce, oositleri 15 dakika boyunca etiketleme solüsyonunda 5 μM TMR-maleimid içinde inkübe edin (veya diğer boyaÖrtüşmeyen spektrumlarla Anap'a kıyasla).
- Aşırı boya çıkarmak için oositleri etiketleme çözeltisi ile üç kez yıkayın.
- Adım 4.1-4.6 uygulayın.
- Filtre küpü taretinde TMR için uygun bir filtre küpü (uyarma filtresi, dikroik ayna ve emisyon filtresi) yerleştirin. Filtre taretini çevirerek TMR filtre küpüne geçin.
- 4.4. Adımda Anap için açıklandığı üzere TMR'nin arka plan flüoresansını okuyun.
NOT: Tiyol kimyası ile etiketleme, zarda spesifik olmayan etiketleme nedeniyle yüksek arka plan flüoresanına neden olur. Bu nedenle TMR arka plan floresan amplifikatöre doymuş olabilir (> 2.000 pA). Bu durumda, ışık yoğunluğunu azaltmayın, ancak foto diyoda bir ofset akımı ekleyerek arka plan flüoresanını çıkarın. Piyasada bulunan sistemlerde dedektör sistemindeki "örnek tutma" özelliğini kullanın. Bir laboratuvarda j fonundaki flüoresan değerini (10X nötr yoğunluk filtresi kullanarak) not edin.Bu değer kaydedilmez (doygunluk). - Adım 4.6'daki gibi aynı anda voltaja bağlı akımları ve TMR floresan yoğunluklarını kaydedin.
2. Oosit Hazırlama ve Enjeksiyon
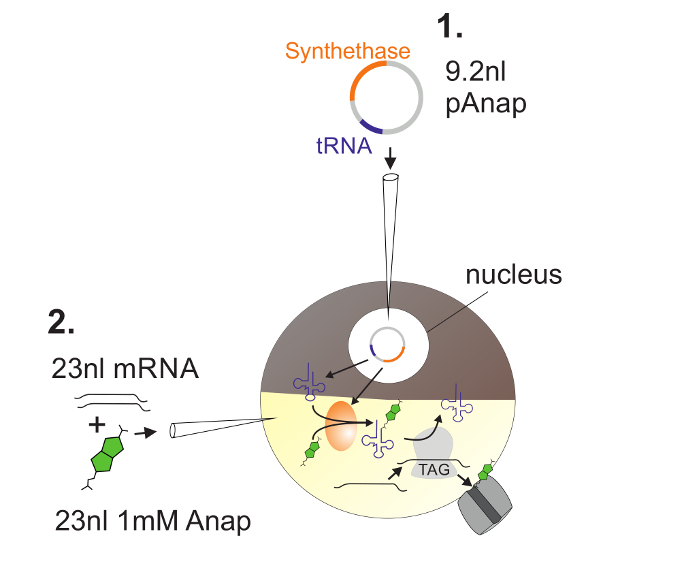
Şekil 2 : Anap Kuruluşu için Xenopus Oositlerine DNA ve RNA Enjeksiyonunun İllüstrasyonu.
Önce, pAnap Xenopus oositinin çekirdeğine enjekte edilir ( 1 ). 6-24 saat sonra, Anap ve kanal RNA, bitki sütununa ( 2 ) birlikte dökülür. Anap, pAnap tarafından kodlanan aminoasil-tRNA sentetazı tarafından bir amber stop anti-kodonu taşıyan tRNA ile ortogonal olarak aminoasillenmiş olacaktır. Bu şekilde, aminoasillenmiş Anap-tRNA'lar, şanlın içerisine yerleştirilen amber stop kodonundaki ribozom tarafından tanınırlarL RNA, durdurma kodonunun bastırılması ve Anap sokulması ile sonuçlanır. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
3. VCF Kurulumu

Şekil 3 < / Strong > : VCF kurulumu. ( A ) Mikroskop içindeki ışık yolunu gösteren VCF kurulumunun yandan görünüşü. Filtre küpü bir uyarma filtresi, dikroik ayna ve bir emisyon filtresi içerir. ( B ) Seçilen oosit odası boyutları, üst oda yarıçapı (1) için 3.4 cm, alt oda uzunluğu (2) için 5.5 cm, alt oda genişliği için (3) 1.4 cm ve orta oda genişliği (4) için 1.7 cm'dir. ( C ) VCF kurulumunun ön görünüşü. Soldaki ilk oküler, oositin kesik açık gerilim sıkıştırma bölmesine monte edilmesi ve permeabilizasyon için. Sonra, oda sağdaki ikinci oküler mikroskop altında kaydırılır. Burada, V1 elektrot 4X objektif kullanarak oosit içine yerleştirilir ve flüoresan suya daldırılmış 40X objektif kullanılarak kaydedilir. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
5. İki renkli VCF
Sonuçlar
Şekil 4 , pAnap ve Anap'ın varlığında hızlı inaktivasyon (IR), L382stop-W434F bulunan Shaker kanallarını ifade eden bir oositten elde edilen VCF kayıtlarının bir örneğini göstermektedir. W434F mutasyonu iyonik potasyum akımlarını bloke eder, bu da geçiş kapısı şarjı yer değiştirmelerini (geçiş akımları) ölçmeyi mümkün kılar. Depolarizasyon üzerine kapı akımlarının (üst iz) ve Anap floresans yoğunluğu değişikliklerinin (alt...
Tartışmalar
Sürekli olarak tRNA sentetaz ile transkribe edilen tRNA'ların in vivo aminoasilasyonu, floresan ölçümleri için yüksek ekspresyon seviyeleri elde etmeyi mümkün kılar. Etkin fUAA birleşimi için pAnap'ın çekirdeğe doğru enjekte edilmesi önemlidir. Çekirdeğin tam yerinin belirsizliği nedeniyle, DNA enjeksiyonlarının% 10-40'ında başarısız olması ve bunun da ifade edilmeyen (veya sızıntı ifade eden) oositlerin ortaya çıkması beklenir. Bu nedenle, sızıntı kanallarında m...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
PAnap, Dr. Peter Schultz (Scripps Araştırma Enstitüsü) 'nin kibar bir hediyesiydi. Bu çalışma, Kanada Sağlık Araştırma Grants Enstitüleri MOP-102689 ve MOP-136894 (RB'ye) ve Canadian Foundation for Innovation Grant 950-225005 tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Solutions | |||
| Barth's solution | |||
| NaCl | Sigma-Aldrich | S7653 | 90 mM |
| KCl | Fisher Scientific | BP366-500 | 3 mM |
| MgSO4 | Sigma-Aldrich | M-9397 | 0.82 mM |
| CaCl2 | Sigma-Aldrich | C-7902 | 0.41 mM |
| Ca(NO3)2 | Sigma-Aldrich | C-1396 | 0.33 mM |
| HEPES | Sigma-Aldrich | H4034 | 5 mM |
| NaOH hydrate | BDH | BDH7225-4 | pH 7.6 |
| Penicilin | Invitrogen | 15140122 | 100 U/mL |
| Streptomycin | Invitrogen | 15140122 | 100 µg/mL |
| Kanamycin | Invitrogen | 15160054 | 10 mg/100mL |
| Horse Serum (HS) | Invitrogen | 16050122 | 5% |
| SOS Standard Oocyte Solution | |||
| NaCl | Sigma-Aldrich | 746398 | 102 mM |
| KCl | Sigma-Aldrich | 746436 | 3 mM |
| MgCl2 | Sigma-Aldrich | M9272 | 1 mM |
| HEPES | Sigma-Aldrich | H4034 | 5 mM |
| External recording solution | |||
| N-methyl-D-glucamine (NMDG) | Alfa Aesar | L14282 | 115 mM |
| HEPES | Sigma-Aldrich | H4034 | 10 mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2 mM |
| MES hydrate | Sigma-Aldrich | 258105 | pH 7.2 |
| Internal recording solution | |||
| N-methyl-D-glucamine (NMDG) | Alfa Aesar | L14282 | 115 mM |
| HEPES | Sigma-Aldrich | H4034 | 10 mM |
| Ethylenediamine Tetraacetic Acid (EDTA) | Fisher Scientific | E478-500 | 2 mM |
| MES hydrate | Sigma-Aldrich | 258105 | pH 7.2 |
| Labeling solution | |||
| KOH | Fisher Scientific | P250-1 | 115 mM |
| HEPES | Sigma-Aldrich | H4034 | 10 mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2 mM |
| MES hydrate | Sigma-Aldrich | 258105 | pH 7.2 |
| TMR stock solution | |||
| Tetramethylrhodamine-5-maleimide (TMR) | Molcular Probes by Life Technologies | T6027 | 5 mM in DMSO |
| Anap stock solution | |||
| Anap | ABZENA (TCRS) | Custom synthesis TCRS-170 | 1 mM in nuclease-free water and 1% NaOH 1 N |
| Name | Company | Catalog Number | Comments |
| Material/Equipment | |||
| pAnap | Addgene | 48696 | |
| High Performance Oocyte Clamp | Dagan Corporation | CA-1B | |
| Gpatch Acquisition software | Department of Anesthesiology, University of California, Los Angeles | ||
| Analysis software | Department of Anesthesiology, University of California, Los Angeles | ||
| Recording Chamber | Custom machined | ||
| Photo diode detection system | Dagan Corporation | PhotoMax-200/PIN | |
| Electrical shutter driver | UNIBLITZ | VCM-D1 |
Referanslar
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in K(V) channels probed by a fluorescent unnatural amino acid. Proc Natl Acad Sci U S A. 110 (20), 8272-8277 (2013).
- Xiao, H., Schultz, P. G. At the Interface of Chemical and Biological Synthesis: An Expanded Genetic Code. Cold Spring Harb Perspect Biol. 8 (9), (2016).
- Blunck, R. Chapter 9. Handbook of Ion Channels. , 113-133 (2015).
- Chatterjee, A., Guo, J., Lee, H. S., Schultz, P. G. A genetically encoded fluorescent probe in mammalian cells. J Am Chem Soc. 135 (34), 12540-12543 (2013).
- DeBerg, H. A., Brzovic, P. S., Flynn, G. E., Zagotta, W. N., Stoll, S. Structure and Energetics of Allosteric Regulation of HCN2 Ion Channels by Cyclic Nucleotides. J Biol Chem. 291 (1), 371-381 (2016).
- Shen, B., et al. Genetically encoding unnatural amino acids in neural stem cells and optically reporting voltage-sensitive domain changes in differentiated neurons. Stem Cells. 29 (8), 1231-1240 (2011).
- Aman, T. K., Gordon, S. E., Zagotta, W. N. Regulation of CNGA1 Channel Gating by Interactions with the Membrane. J Biol Chem. 291 (19), 9939-9947 (2016).
- Haddad, G. A., Blunck, R. Mode shift of the voltage sensors in Shaker K+ channels is caused by energetic coupling to the pore domain. J Gen Physiol. 137 (5), 455-472 (2011).
- Batulan, Z., Haddad, G. A., Blunck, R. An intersubunit interaction between S4-S5 linker and S6 is responsible for the slow off-gating component in Shaker K+ channels. J Biol Chem. 285 (18), 14005-14019 (2010).
- Kusch, J., et al. How subunits cooperate in cAMP-induced activation of homotetrameric HCN2 channels. Nat Chem Biol. 8 (2), 162-169 (2012).
- Lee, H. S., Guo, J., Lemke, E. A., Dimla, R. D., Schultz, P. G. Genetic incorporation of a small, environmentally sensitive, fluorescent probe into proteins in Saccharomyces cerevisiae. J Am Chem Soc. 131 (36), 12921-12923 (2009).
- Summerer, D., et al. A genetically encoded fluorescent amino acid. Proc Natl Acad Sci U S A. 103 (26), 9785-9789 (2006).
- Kalstrup, T., Blunck, R. Reinitiation at non-canonical start codons leads to leak expression when incorporating unnatural amino acids. Sci Rep. 5, 11866 (2015).
- Liu, H., Naismith, J. H. An efficient one-step site-directed deletion, insertion, single and multiple-site plasmid mutagenesis protocol. BMC Biotechnol. 8, 91 (2008).
- Beckert, B., Masquida, B. Synthesis of RNA by in vitro transcription. Methods Mol Biol. 703, 29-41 (2011).
- Goldin, A. L. Maintenance of Xenopus laevis and oocyte injection. Methods Enzymol. 207, 266-279 (1992).
- Rudokas, M. W., Varga, Z., Schubert, A. R., Asaro, A. B., Silva, J. R. The Xenopus oocyte cut-open vaseline gap voltage-clamp technique with fluorometry. J Vis Exp. (85), (2014).
- Zhao, J., Blunck, R. The isolated voltage sensing domain of the Shaker potassium channel forms a voltage-gated cation channel. Elife. 5, (2016).
- Posson, D. J., Ge, P., Miller, C., Bezanilla, F., Selvin, P. R. Small vertical movement of a K+ channel voltage sensor measured with luminescence energy transfer. Nature. 436 (7052), 848-851 (2005).
- Chanda, B., Asamoah, O. K., Blunck, R., Roux, B., Bezanilla, F. Gating charge displacement in voltage-gated ion channels involves limited transmembrane movement. Nature. 436 (7052), 852-856 (2005).
- Taraska, J. W., Puljung, M. C., Zagotta, W. N. Short-distance probes for protein backbone structure based on energy transfer between bimane and transition metal ions. Proc Natl Acad Sci U S A. 106 (38), 16227-16232 (2009).
- Baker, B. J., et al. Genetically encoded fluorescent sensors of membrane potential. Brain Cell Biol. 36 (1-4), 53-67 (2008).
- Miranda, P., et al. State-dependent FRET reports calcium- and voltage-dependent gating-ring motions in BK channels. Proc Natl Acad Sci U S A. , (2013).
- Sisido, M., Ninomiya, K., Ohtsuki, T., Hohsaka, T. Four-base codon/anticodon strategy and non-enzymatic aminoacylation for protein engineering with non-natural amino acids. Methods. 36 (3), 270-278 (2005).
- Hohsaka, T., Ashizuka, Y., Murakami, H., Sisido, M. Five-base codons for incorporation of nonnatural amino acids into proteins. Nucleic Acids Res. 29 (17), 3646-3651 (2001).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır