Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Флуорометрия с фиксацией напряжения в
В этой статье
Резюме
В этой статье описывается усовершенствование традиционной флюорометрии с напряжением (VCF), в которой вместо малеимидных красителей используются флуоресцентные неестественные аминокислоты (fUAA), чтобы исследовать структурные перестройки в ионных каналах. Процедура включает в себя инъекцию ДНК ооцита Xenopus, совместную инъекцию РНК / fUAA и одновременные измерения тока и флуоресценции.
Аннотация
Флюорометрия с напряжением питания (VCF) была методом выбора для исследования структуры и функции белков электрогенной мембраны, где измерения флуоресценции и тока в реальном времени одновременно сообщают о локальных перестановках и глобальных функциях, соответственно 1 . В то время как структурные методы с высоким разрешением, такие как криоэлектронная микроскопия или рентгеновская кристаллография, обеспечивают статические изображения интересующих белков, VCF обеспечивает динамические структурные данные, которые позволяют связать структурные перестройки (флуоресценцию) с динамическими функциональными данными (электрофизиологию). До недавнего времени тиол-реактивная химия, используемая для сайт-направленного флуоресцентного мечения белков, ограничивала рамки подхода, поскольку все доступные цистеины, включая эндогенные, будут маркироваться. Таким образом, было необходимо сконструировать белки, свободные от эндогенных цистеинов. Маркировка также ограничивалась сайтами, доступными из внеклеточногобоковая сторона. Это изменилось с использованием флуоресцентных неестественных аминокислот (fUAA), чтобы специфически включить небольшой флуоресцентный зонд в ответ на подавление стоп-кодонов с использованием ортогональной пары тРНК и тРНК-синтетазы 2 . Для улучшения VCF требуется только двухступенчатая инъекционная инъекция ДНК (пара тРНК / синтетаза) с последующей совместной инъекцией РНК / fUAA. Теперь возможно маркировать как внутриклеточные, так и вложенные сайты, и использование VCF значительно расширилось. Таким образом, метод VCF становится привлекательным для изучения широкого спектра белков и, что еще важнее, позволяет исследовать многочисленные цитозольные регуляторные механизмы.
Введение
Более 200 неестественных аминокислот с различными химическими и физическими свойствами были генетически включены в белки в клетках E. coli , дрожжах и клетках млекопитающих 3 . Неестественная аминокислота вводится в ответ на специфический стоп-кодон через пару ортогональных инженерии тРНК / синтетаза. Генетический подход к модификации белков дал ценную информацию о структуре и функциях белка. Здесь мы представляем протокол для использования Voltage-Clamp Fluorometry (VCF) в сочетании с флуоресцентным UAA.
В VCF одновременное наблюдение функциональных данных и структурных перестроек, локализованных вокруг флуоресцентного зонда (~ 5 Å), позволяет получать динамическую информацию с миллисекундным разрешением 1 . Флуоресцентные зонды изменяют свое состояние гашения при локализованном движении белка. Движения только 1-2 Å достаточно, чтобы привести к значительным изменениям флуоресценцииИнтенсивность 4 . После идентификации сайта, представляющего интерес для целевого белка, сайт мутирован точечной мутацией. Классически остаток был мутирован до цистеина, тогда как теперь для включения генетического fUAA вводится янтарный стоп-кодон (TAG). Белок затем транскрибируется in vitro .
В то время как другие системы экспрессии ( например, клетки млекопитающих) могут быть использованы 5 , 6 , 7 , ооциты Xenopus являются предпочтительными для изучения структурно-функциональных функций из-за их большего размера, что приводит к более легким манипуляциям и более высокой интенсивности флуоресценции (больше флуорофоров) Шум. Кроме того, ооциты Xenopus имеют низкий фон от эндогенных белков 2 , 8 , а темная пигментация на полюсах животных защищает от фоновой флуоресценции от tОн цитозоль. Ооциты Xenopus удаляют хирургическим путем и ДНК, кодирующую парную ортогональную тРНК / тРНК-синтетазу, специфичную для fUAA, инъецируют в ядро ооцитов. Через 6-24 часа инкубации белковая РНК вводится совместно с fUAA в цитозоль ооцитов с последующим инкубационным периодом в 2-3 дня. Чтобы предотвратить любое повреждение fUAA (фотообесцвечивание), процедуры, включая Anap, должны выполняться под красным светом, чтобы избежать возбуждения флуорофора.
Ооциты изучаются на открытой срезе напряжения ооцита, установленной на вертикальном флуоресцентном микроскопе, и одновременно регистрируют изменения электрического тока и флуоресценции 9 , 10 . Альтернативно, можно использовать двухэлектродный зажим 1 напряжения или конфигурации 11 зажимных зажимов. Флуоресценция возбуждается соответствующими длинами волн с низким среднеквадратическим шумом и Записанного с использованием фотодиода, связанного с усилителем с высоким усилением.
Есть несколько преимуществ использования флуоресцентных неестественных аминокислот (fUAAs) в флюорометрии с зажимным напряжением. Одним из них является доступ к цитозольной стороне мембранных белков; Здесь расположены многие регуляторные процессы ( например, Са 2+ - или сайты связывания нуклеотидов, быстрая и закрытая инактивация ионно-канальных каналов с напряжением, открытие пор, модульная связь). Все эти процессы теперь доступны для флуоресцентной маркировки.
Другим преимуществом является небольшой размер зонда, приводящий к меньшему нарушению белка. До настоящего времени были разработаны две пары ортогональных тРНК / тРНК синтетаз для фуАА, 12 , где 3- (6-ацетилнафталин-2-иламино) -2-аминопропановая кислота (Anap) является единственным fUAA, который был использован в ооцитах Xenopus 2 ,"Xref"> 8. Анап является экологически чувствительным флуорофором с молекулярной массой 272,3 г / моль и лишь немного больше, чем триптофан 12 ( фиг.1А, 1В ). Из-за его небольших размеров флуорофором может быть введено меньше стерических эффектов по сравнению с обычными флуорофорами, прикрепленными через линкер (обычно более 500 г / моль). Более того, в случае Anap, флуорофор расположен ближе к основной белковой цепи, чем те, которые связаны с цистеинами, и, следовательно, Anap исследует более локализованные перестройки. Наконец, удаление эндогенных цистеинов в традиционном VCF для обеспечения специфичной для сайта маркировки больше не является требованием в UAA-VCF и, следовательно, (i) оставляет белки в (почти) их природном состоянии и (ii) позволяет применять VCF Для изучения более широкого диапазона белков, в которых функция может быть изменена путем замены цистеина.

Рисунок 1 : Анап и спектры флуоресценции. ( A ) Химическая структура Anap. ( B ) Нормализованный спектр поглощения и спектры излучения для 1 нМ Anap, демонстрирующие чувствительность флуоресценции Anap к гидрофобности растворителя. Спектры излучения были получены возбуждением при 350 нм. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Недостатком использования флуоресцентных UAAs является то, что гетерогенная популяция белков может быть результатом считывания стоп-кодона, трансляционной реинициации, С-концевых укороченных белков или перекрестных помех с эндогенным аминоацилированием, если количество аминоацилированных тРНК является недостаточным. Такое выражение утечки должно всегда проверяться на отсутствие пары fUAA и тРНК / тРНК синтетазы. Мы рассмотрели вопрос о трансИ как его обойти для N-терминальных сайтов вставки ранее 14 . Однако, когда fUAA, тРНК и тРНК синтетаза присутствуют в насыщенных количествах, остается только низкая вероятность выделения утечки.
Основной процедурной разницей между fUAA-VCF и традиционной VCF является инъекция и обращение с ооцитами; После инъекции ДНК, кодирующей тРНК и тРНК-синтетазу (pAnap), следует введение Anap, который либо совместно инъецируется с белковой мРНК, либо альтернативно добавляется к инкубационному раствору в виде ацетоксиметилового (AM) сложного эфира.
Access restricted. Please log in or start a trial to view this content.
протокол
Лягушка манипуляции были выполнены в соответствии с канадскими руководящими принципами и были одобрены этическим комитетом (CDEA, протокол № 15-042) Университета Монреаля.
1. Подготовка мРНК к встраиванию fUAA
- Выберите интересующий сайт в белке, где ожидаются конформационные изменения. Выберите аминокислоту в этом регионе для замены fUAA.
ПРИМЕЧАНИЕ. Выбор позиции основывается на ожидаемых структурных перестановках. Если существует структура с высоким разрешением и гипотеза ожидаемых движений, анап должен быть размещен так, чтобы изменилась химическая среда; Это может быть либо изменение диэлектрической постоянной (гидрофобная по сравнению с гидрофильной средой), либо, скорее, тушение другой аминокислотой. Лучшие тушители - триптофаны. Анап должен находиться в контакте с гасителем в одном состоянии (перекрытии радиусов Ван-дер-Ваальса) и свободен от него вдругой. Если структур или моделей с высоким разрешением не существует, нужно будет отсканировать интересующий регион. В любом случае рекомендуется выбрать несколько близлежащих мест для увеличения вероятности получения выражения и сигнала флуоресценции. Чтобы минимизировать стерические эффекты при созревании и / или функционировании белка, можно выбрать замену больших и ароматических аминокислот (Phe, Trp, Tyr). Однако авторы испытали, что сканирование интересующей области для введения fUAA, независимо от замещенной аминокислоты, является более продуктивным. - Вставьте янтарный стоп-кодон (TAG) на выбранный сайт с использованием сайт-направленного мутагенеза 15 . Убедитесь, что интересующий белок не заканчивается на янтарном стоп-кодоне (TAG). Если да, то мутировать в другой (охряный или опаловый стоп-кодон). Усиливает, изолирует и последовательность ДНК. Получают белковую мРНК с транскрипцией in vitro 16 и хранят мРНК при 20 ° C или 80 ° C.
- Хирургически получают ооциты V или VI стадии из лягушек Xenopus laevis и дефолликулируют с коллагеназой, как описано ранее 17 .
- Обезболить лягушек подходящим анестетиком в соответствии с утвержденным протоколом на животных (здесь: этиловый эфир 3-аминобензойной кислоты). Когда они не в состоянии отреагировать на нежный пинч на кончик пальца ноги (потеря рефлекторного отделяемого), тогда их соответствующим образом анестезируют для хирургического вмешательства.
- Сразу же удалите лягушек из анестезирующего раствора и тщательно промойте кожу свежей водой. Это полоскание предотвратит падение животного в более глубокие уровни анестезии, удалив непоглощенный химикат с поверхности кожи.
- Удалите узлы яичника с одной стороны хирургическим путем и тщательно откройте узлы с помощью двух щипцов. Инкубируйте и перемешивайте ооциты в «стандартном растворе ооцитов» (SOS), содержащем 1% (мас. / Об.) Коллагеназу в течение 20-30 минДефолликулировать. Трижды промыть раствором SOS.
- Выбирайте крупные и здоровые ооциты индивидуально и инкубируйте их в растворе Барта с добавлением антибиотиков (100 Е / мл пеницилина, 100 мкг / мл стрептомицина, 10 мг / 100 мл канамицина) и 5% лошадиной сыворотки при 18 ° С в течение не менее 4 ч перед инъекцией ,
ПРИМЕЧАНИЕ. После 2-4 операций с задержкой в 4 месяца между Xenopus laevis эвтаназируют путем длительной (> 1 ч) инкубации с этиловым эфиром 3-аминобензойной кислоты.
- Для ядерной инъекции ДНК, подготовьте длинный и тонкий наконечник для инъекции, чтобы иметь возможность достичь ядра и избежать повреждения ооцита. Наполните наконечник для инъекций маслом и установите его на наноинжектор.
- Установите наноинжектор под стерео микроскоп и используйте щипцы, чтобы сломать конец наконечника. Извлекайте масло до тех пор, пока в конце наконечника не окажется воздушных пузырьков.
- Поместите 1 мкл 0,1 мкг /L pAnap в воде, свободной от нуклеазы, содержащей NaOH (1% 1 N NaOH) на кусочке парафильма под стереоскопом и заполняйте инъекционный наконечник ДНК.
- Передача 40 ооцитов в чашку для инъекций, покрытую сеткой, содержащую раствор Барта, дополненный антибиотиками.
ПРИМЕЧАНИЕ. Чтобы сделать чашку для инъекций с сетчатым покрытием, вырежьте кусок нейлоновой сетки подходящего размера размером 800 мкм для заполнения чашки Петри из полистирола. Добавьте хлороформ в центр, а затем поместите сетку сверху. Держите сетку до тех пор, пока не установится пластик. - Поскольку ядро ооцита расположено на полюсе животного (темного), направьте наконечник инъекции в центр животного полюса и проведите так, чтобы конец достиг центра животного полушария (или на 2-3 раза больше глубины по сравнению с инъекцией РНК ). Внесите 9,2 мкл pAnap в ядро каждого ооцита. Тонкий наконечник и небольшой объем впрыска могут привести к неправильной инъекции или закупорке наконечника. Иногда проверяйте, работает ли инъекция, впрыскивая в воздух,
ПРИМЕЧАНИЕ. То, правильно ли введена ДНК в ядро, неизвестно. Поэтому следует ожидать, что 10-40% ооцитов не будут экспрессировать пар тРНК / синтетаза. Смотрите Обсуждение для дальнейшей проработки. - Инкубируйте ооциты в 2 мл раствора Барта с добавлением антибиотиков и 5% конской сыворотки (HS) при 18 ° С в течение 6-24 ч, чтобы обеспечить устойчивую экспрессию специфических Anap тРНК и тРНК-синтетаз.
ПРИМЕЧАНИЕ. Время инкубации ДНК может продолжаться несколько дней до инъекции РНК, но это не увеличивает экспрессию. - Подготовьте наноинжектор для инъекции РНК (такой же, как на этапе 2.2, но наконечник для инъекции не должен быть таким тонким, как для инъекции ДНК). С этого момента работайте только под красным светом, чтобы предотвратить фотообесцвечивание Anap.
- Смешайте 1 мкл 1 мМ Anap с 1 мкл 1-2 мкг / мкл мРНК непосредственно на части парафильма и заполните инъекционный наконечник смешанным раствором. Прокалывают чуть ниже мембраны в растительном(Яркий) полюс и вводили 46 нл в каждый ооцит, инъецированный pAnap.
ПРИМЕЧАНИЕ: Требуемая концентрация мРНК зависит от представляющего интерес белка. - Инкубируйте ооциты, защищенные от света в коробке или обернутые алюминиевой фольгой, в раствор Барта добавляли антибиотики и 5% лошадиную сыворотку при 18 ° C в течение 2-3 дней. Обменяйтесь со свежим раствором Барта каждый день и удаляйте мертвые ооциты, чтобы избежать заражения.
- Установите открытое зажимное устройство ооцита, как описано выше. 18 .
- Смонтируйте систему записи электрофизиологии на вертикальном флуоресцентном микроскопе, установив записывающую камеру на ползунке, который позволяет перемещать его между стандартным стереоскопом для размещения ооцита и микроскопа для выполнения измерений флуоресценции ( рис. 2в ).
ПРИМЕЧАНИЕ. Геометрия камеры для разрезанных ооцитов не подходит для использования обычной трассыИсключенный свет для освещения во время манипуляции. Поэтому для освещения сбоку сверху используется «галогенная лампа» с красным фильтром. Конденсатор микроскопа можно снять, чтобы освободить место для электрофизиологической камеры. - Подключите систему обнаружения фотодиодов к выходному порту C-mount флуоресцентного микроскопа ( рис. 2a ). Подключите показание фототока ко второму входному каналу в цифровом сигнальном процессоре (DSP, аналоговый / цифровой - цифровой / аналоговый преобразователь).
- Используйте галогенную лампу на 100 Вт, 12 В в качестве источника света для возбуждения флуоресценции.
ПРИМЕЧАНИЕ: В качестве альтернативы можно использовать ртутные горелки, но их необходимо уменьшить интенсивностью, чтобы предотвратить слишком быстрое фотообесцвечивание во время записи. Светодиодная подсветка рекомендуется, только если соответствующие светодиоды показывают значительную интенсивность в диапазоне возбуждения ( например, ~ 350 нм для Anap). Большинство белых светодиодов не попадают в ультрафиолетовый спектр. - InsErt электрически управляемый затвор между источником возбуждающего света и микроскопом и подключить его управление (обычно TTL-импульс) к цифровому выходу DSP. Время TTL-импульса в программном обеспечении записи (см. Документацию производителя), так что затвор открывается ~ 100 мс до начала записи. Таким образом, любая вибрация во время процесса открытия не мешает записи. Время зависит от скорости и вибрации затвора. Завершите импульс на 5 мс до конца записи, как показано на рисунке 4 . Таким образом, регистрируется также значение общей флуоресценции.
- Вставьте соответствующий фильтр-куб (фильтр возбуждения, дихроичное зеркало и эмиссионный фильтр) в турель фильтра. Для Anap используйте Ex: 377/50 нм полосовой, дихроичный 409 нм longpass и Em: 470/40 нм полосовой.
- Следуйте за подготовительными этапами для открытозакрытого зажима напряжения ооцита, как описано ранее и визуализируйте 18 (подготовка агарового моста, установка ооцита, проницаемость сапонина). Тем не менее, работайте под красным светом в любое время, чтобы избежать отбеливания флуорофора перед регистрацией. При размещении ооцита, убедитесь, что животный полюс направлен вверх. Пигментация под мембраной животного полюса защищает от аутофлуоресценции, происходящей из цитозоля, и, следовательно, снижает фоновую флуоресценцию.
- Передвиньте камеру к микроскопу и сфокусируйтесь, используя объектив 4X.
- Пробейте ооцит электрическим зондом V1 (3 M KCl) с напряжением, переключитесь на 40X водно-иммерсионное (NA 0,8 - 0,9) объектив. Сосредоточьтесь на полюсе животных, который смотрит вверх.
- Выключите красный свет. Выберите правый куб фильтра, поворачивая турель фильтра и оптическое выходное отверстие, подключенное к фотодиоду. Включить галогEn лампа с наивысшей интенсивностью и коротко переключите затвор на 2-5 с для считывания фоновой интенсивности флуоресценции, исходящей из ооцита. При описанной настройке значение должно быть около 50-200 pA для Anap.
- Включите зажим, поверните переключатель ванны / защиты в активное положение и настройте мембранный потенциал (V1 - V2) на командный потенциал, повернув ручку на I headstage.
- Выберите потенциал удержания, протокол шага, количество и длину импульсов и т. Д. В программном обеспечении записи. Регистрируйте зависящие от напряжения токи и интенсивности Anap флуоресценции.
- Одновременно контролировать два места в одном и том же белке, мутировать внеклеточную и доступную аминокислоту в цистеин и удалять другие цистеины, чтобы обеспечить специфическую маркировку с помощью тиол-химии.
- Выполните шаг 2.1-2.5.
- Перед регистрацией VCF инкубируйте ооциты в 5 мкМ TMR-малеимиде в растворе для маркировки в течение 15 мин (или другого красителяС неперекрывающимися спектрами по сравнению с Анапом).
- Трижды промыть ооциты раствором для маркировки, чтобы удалить избыточный краситель.
- Выполните шаг 4.1-4.6.
- Вставьте соответствующий фильтр-куб для TMR (фильтр возбуждения, дихроичное зеркало и фильтр эмиссии) в башню фильтра-куба. Переключитесь на куб фильтра TMR, поворачивая турель фильтра.
- Прочитать фоновую флуоресценцию для TMR, как описано для Anap на шаге 4.4.
ПРИМЕЧАНИЕ. Маркировка тиоловой химией приводит к высокой флуоресценции фона из-за неспецифической маркировки в мембране. Поэтому фоновая флуоресценция TMR может насыщать усилитель (> 2000 pA). В этом случае не уменьшайте интенсивность света, а просто вычитайте фоновую флуоресценцию, добавив к фотодиоду ток смещения. В коммерчески доступных системах используется функция «выборка и удерживание» в детекторной системе. Обратите внимание на фоновое значение флуоресценции (с использованием фильтра нейтральной плотности 10X) в лаборатории jOurnal, так как это значение не будет записано (насыщенность). - Регистрируйте зависящие от напряжения токи и интенсивности флуоресценции TMR одновременно, как на шаге 4.6.
2. Подготовка и инъекция ооцитов
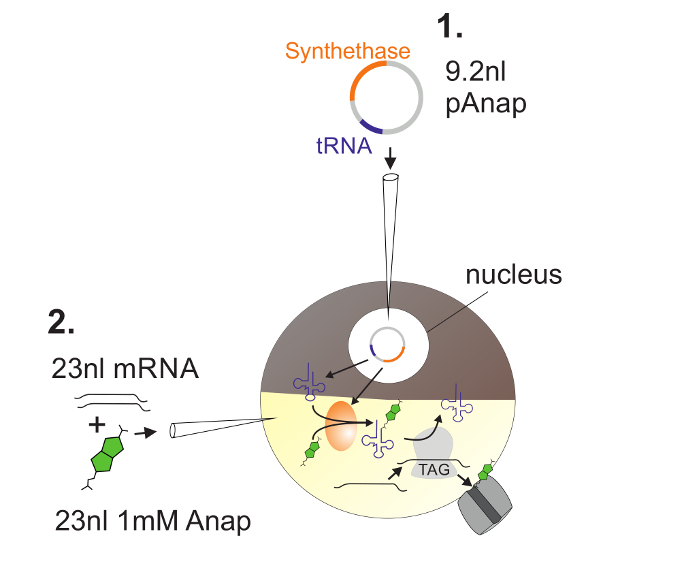
Рисунок 2 : Иллюстрация инъекции ДНК и РНК в ооциты Xenopus для включения Anap.
Во-первых, pAnap инъецируется в ядро ооцита Xenopus ( 1 ). Через 6-24 ч Anap и канальную РНК вводят в сон в растительный полюс ( 2 ). Анап будет ортогонально аминоацилирован тРНК, несущей антикодон с янтарной остановкой, аминоацил-тРНК синтетазой, которая кодируется pAnap. Таким образом, аминоацилированные Anap-тРНК распознаются рибосомой на вставленном янтарном стоп-кодоне в каналеЛ РНК, что приводит к подавлению стоп-кодона и вставке Anap. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Настройка VCF

Рисунок 3 < / Strong> : настройка VCF. ( A ) Вид сбоку установки VCF, показывающей траекторию света внутри микроскопа. Куб фильтра содержит фильтр возбуждения, дихроичное зеркало и фильтр излучения. ( B ) Выбранные размеры камеры ооцита составляют 3,4 см для радиуса верхней камеры (1), 5,5 см для нижней камеры (2), 1,4 см для нижней камеры (3) и 1,7 для средней ширины камеры (4). ( C ) Вид спереди установки VCF. Первый окуляр слева предназначен для установки ооцита в отсечной стенке отсекающего напряжения и для пермеабилизации. Затем камера скользит под микроскопом на втором окуляре справа. Здесь электрод V1 вводится в ооцит с использованием объектива 4Х, и флуоресценция регистрируется с использованием объектива с 40-кратным погружением в воду. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Двухцветный VCF
Access restricted. Please log in or start a trial to view this content.
Результаты
На рисунке 4 показан пример записи VCF, полученной из ооцитов, экспрессирующих шейкерные каналы с быстрой инактивацией (IR), L382stop-W434F в присутствии pAnap и Anap. Мутация W434F блокирует ионные токи калия, что позволяет измерять переходные смещения заряда стробирования (?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Аминоацилирование in vivo тРНК, которое непрерывно транскрибируется вместе с тРНК-синтетазой, позволяет получать высокие уровни экспрессии для измерений флуоресценции. Для эффективного включения fUAA важно, чтобы pAnap правильно вводился в ядро. Из-за неопределенности точного местопол...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
PAnap был добрым подарком от доктора Питера Шульца (исследовательский институт Скриппса). Эта работа финансировалась Канадскими институтами исследований в области здравоохранения Гранты MOP-102689 и MOP-136894 (для РБ) и Канадским фондом инновационных грантов 950-225005.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Solutions | |||
| Barth's solution | |||
| NaCl | Sigma-Aldrich | S7653 | 90 mM |
| KCl | Fisher Scientific | BP366-500 | 3 mM |
| MgSO4 | Sigma-Aldrich | M-9397 | 0.82 mM |
| CaCl2 | Sigma-Aldrich | C-7902 | 0.41 mM |
| Ca(NO3)2 | Sigma-Aldrich | C-1396 | 0.33 mM |
| HEPES | Sigma-Aldrich | H4034 | 5 mM |
| NaOH hydrate | BDH | BDH7225-4 | pH 7.6 |
| Penicilin | Invitrogen | 15140122 | 100 U/mL |
| Streptomycin | Invitrogen | 15140122 | 100 µg/mL |
| Kanamycin | Invitrogen | 15160054 | 10 mg/100mL |
| Horse Serum (HS) | Invitrogen | 16050122 | 5% |
| SOS Standard Oocyte Solution | |||
| NaCl | Sigma-Aldrich | 746398 | 102 mM |
| KCl | Sigma-Aldrich | 746436 | 3 mM |
| MgCl2 | Sigma-Aldrich | M9272 | 1 mM |
| HEPES | Sigma-Aldrich | H4034 | 5 mM |
| External recording solution | |||
| N-methyl-D-glucamine (NMDG) | Alfa Aesar | L14282 | 115 mM |
| HEPES | Sigma-Aldrich | H4034 | 10 mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2 mM |
| MES hydrate | Sigma-Aldrich | 258105 | pH 7.2 |
| Internal recording solution | |||
| N-methyl-D-glucamine (NMDG) | Alfa Aesar | L14282 | 115 mM |
| HEPES | Sigma-Aldrich | H4034 | 10 mM |
| Ethylenediamine Tetraacetic Acid (EDTA) | Fisher Scientific | E478-500 | 2 mM |
| MES hydrate | Sigma-Aldrich | 258105 | pH 7.2 |
| Labeling solution | |||
| KOH | Fisher Scientific | P250-1 | 115 mM |
| HEPES | Sigma-Aldrich | H4034 | 10 mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2 mM |
| MES hydrate | Sigma-Aldrich | 258105 | pH 7.2 |
| TMR stock solution | |||
| Tetramethylrhodamine-5-maleimide (TMR) | Molcular Probes by Life Technologies | T6027 | 5 mM in DMSO |
| Anap stock solution | |||
| Anap | ABZENA (TCRS) | Custom synthesis TCRS-170 | 1 mM in nuclease-free water and 1% NaOH 1 N |
| Name | Company | Catalog Number | Comments |
| Material/Equipment | |||
| pAnap | Addgene | 48696 | |
| High Performance Oocyte Clamp | Dagan Corporation | CA-1B | |
| Gpatch Acquisition software | Department of Anesthesiology, University of California, Los Angeles | ||
| Analysis software | Department of Anesthesiology, University of California, Los Angeles | ||
| Recording Chamber | Custom machined | ||
| Photo diode detection system | Dagan Corporation | PhotoMax-200/PIN | |
| Electrical shutter driver | UNIBLITZ | VCM-D1 |
Ссылки
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in K(V) channels probed by a fluorescent unnatural amino acid. Proc Natl Acad Sci U S A. 110 (20), 8272-8277 (2013).
- Xiao, H., Schultz, P. G. At the Interface of Chemical and Biological Synthesis: An Expanded Genetic Code. Cold Spring Harb Perspect Biol. 8 (9), (2016).
- Blunck, R. Chapter 9. Handbook of Ion Channels. , CRC Press. 113-133 (2015).
- Chatterjee, A., Guo, J., Lee, H. S., Schultz, P. G. A genetically encoded fluorescent probe in mammalian cells. J Am Chem Soc. 135 (34), 12540-12543 (2013).
- DeBerg, H. A., Brzovic, P. S., Flynn, G. E., Zagotta, W. N., Stoll, S. Structure and Energetics of Allosteric Regulation of HCN2 Ion Channels by Cyclic Nucleotides. J Biol Chem. 291 (1), 371-381 (2016).
- Shen, B., et al. Genetically encoding unnatural amino acids in neural stem cells and optically reporting voltage-sensitive domain changes in differentiated neurons. Stem Cells. 29 (8), 1231-1240 (2011).
- Aman, T. K., Gordon, S. E., Zagotta, W. N. Regulation of CNGA1 Channel Gating by Interactions with the Membrane. J Biol Chem. 291 (19), 9939-9947 (2016).
- Haddad, G. A., Blunck, R. Mode shift of the voltage sensors in Shaker K+ channels is caused by energetic coupling to the pore domain. J Gen Physiol. 137 (5), 455-472 (2011).
- Batulan, Z., Haddad, G. A., Blunck, R. An intersubunit interaction between S4-S5 linker and S6 is responsible for the slow off-gating component in Shaker K+ channels. J Biol Chem. 285 (18), 14005-14019 (2010).
- Kusch, J., et al. How subunits cooperate in cAMP-induced activation of homotetrameric HCN2 channels. Nat Chem Biol. 8 (2), 162-169 (2012).
- Lee, H. S., Guo, J., Lemke, E. A., Dimla, R. D., Schultz, P. G. Genetic incorporation of a small, environmentally sensitive, fluorescent probe into proteins in Saccharomyces cerevisiae. J Am Chem Soc. 131 (36), 12921-12923 (2009).
- Summerer, D., et al. A genetically encoded fluorescent amino acid. Proc Natl Acad Sci U S A. 103 (26), 9785-9789 (2006).
- Kalstrup, T., Blunck, R. Reinitiation at non-canonical start codons leads to leak expression when incorporating unnatural amino acids. Sci Rep. 5, 11866(2015).
- Liu, H., Naismith, J. H. An efficient one-step site-directed deletion, insertion, single and multiple-site plasmid mutagenesis protocol. BMC Biotechnol. 8, 91(2008).
- Beckert, B., Masquida, B. Synthesis of RNA by in vitro transcription. Methods Mol Biol. 703, 29-41 (2011).
- Goldin, A. L. Maintenance of Xenopus laevis and oocyte injection. Methods Enzymol. 207, 266-279 (1992).
- Rudokas, M. W., Varga, Z., Schubert, A. R., Asaro, A. B., Silva, J. R. The Xenopus oocyte cut-open vaseline gap voltage-clamp technique with fluorometry. J Vis Exp. (85), (2014).
- Zhao, J., Blunck, R. The isolated voltage sensing domain of the Shaker potassium channel forms a voltage-gated cation channel. Elife. 5, (2016).
- Posson, D. J., Ge, P., Miller, C., Bezanilla, F., Selvin, P. R. Small vertical movement of a K+ channel voltage sensor measured with luminescence energy transfer. Nature. 436 (7052), 848-851 (2005).
- Chanda, B., Asamoah, O. K., Blunck, R., Roux, B., Bezanilla, F. Gating charge displacement in voltage-gated ion channels involves limited transmembrane movement. Nature. 436 (7052), 852-856 (2005).
- Taraska, J. W., Puljung, M. C., Zagotta, W. N. Short-distance probes for protein backbone structure based on energy transfer between bimane and transition metal ions. Proc Natl Acad Sci U S A. 106 (38), 16227-16232 (2009).
- Baker, B. J., et al. Genetically encoded fluorescent sensors of membrane potential. Brain Cell Biol. 36 (1-4), 53-67 (2008).
- Miranda, P., et al. State-dependent FRET reports calcium- and voltage-dependent gating-ring motions in BK channels. Proc Natl Acad Sci U S A. , (2013).
- Sisido, M., Ninomiya, K., Ohtsuki, T., Hohsaka, T. Four-base codon/anticodon strategy and non-enzymatic aminoacylation for protein engineering with non-natural amino acids. Methods. 36 (3), 270-278 (2005).
- Hohsaka, T., Ashizuka, Y., Murakami, H., Sisido, M. Five-base codons for incorporation of nonnatural amino acids into proteins. Nucleic Acids Res. 29 (17), 3646-3651 (2001).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены