Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Pluripotent kök hücre kaynaklı hastalık modelleri lentiviral vektör platformu için Epigenome düzenleme araçları verimli bir şekilde teslim insan içine indüklenen
Bu Makalede
Özet
DNA epigenome temsil düzenleme güçlü bir tedavi yaklaşımı hedef. Bu iletişim kuralı üretim, arıtma ve toplama tüm-içinde-bir lentiviral vektörlerin İnsan İndüklenmiş pluripotent kök hücre (hiPSC)'epigenome düzenleme uygulamaları için CRISPR-dCas9-DNMT3A transgene yataklık açıklar-nöronlar türetilmiş.
Özet
HiPSC türetilmiş hücre kullanımı insan nörodejeneratif hastalıkları eğitim için değerli bir yaklaşım temsil eder. Burada, Alfa-synuclein gen (SNCA) locus triplication içine Parkinson hastalığı (PD) ile bir hastadan elde edilen hiPSCs farklılaşma için en iyi duruma getirilmiş bir protokol açıklamak-ilgili dopaminerjik nöron popülasyonları. Kanıt biriken SNCA yüksek düzeyde PD. yeni tedavi yaklaşımları PD için özellikle de SNCA ifade, Yönetmeliği hedeflemesi kurmak için karşılanmamış ihtiyaç tanımayı geliştirme için sorumlu olduğunu göstermiştir biz Son zamanlarda epigenetically SNCA intron 1 Düzenleyici bölgesi düzeylerinde metilasyonu zenginleştirici tarafından SNCA transkripsiyon modüle bir CRISPR/dCas9-DNA metilasyon-tabanlı sistem geliştiriyoruz. Bir ölü oluşan sistem, teslim etmek (devre dışı) yorum-in Cas9 (dCas9) erimiş DNA metiltransferaz enzim 3A katalitik etki alanı ile (DNMT3A), lentiviral bir vektör kullanılır. Bu sistem ile SNCA locus triplication hücrelere uygulanmış ve SNCA intron 1 hedeflenen DNA metilasyonu ile yaklaşık % 30 SNCA-mRNA ve protein düzeyleri azaltır. SNCA düzeyleri ince ayar downregülasyon hücresel fenotipleri hastalığı ile ilgili kurtarır. Geçerli protokol, amacımız hiPSCs nöral progenitör hücre (NPCs) ve kuruluş ve pyrosequencing deneyleri SNCA metilasyonu profilinde değerlendirilmesi için doğrulama differentiating için adım adım bir yordam tarif etmek intron 1. Daha ayrıntılı olarak bu deneylerde kullanılan lentivirus-CRISPR/dCas9 sistemi seviyelendirmek için bu iletişim kuralını üretmek için arındırmak ve lentiviral vektörler konsantre ve kullanarak epigenome ve genom düzenleme uygulamaları için uygunluk vurgulamak için açıklar hiPSCs ve NPCs. Kolayca uyarlanabilir ve yüksek titresi lentiviruses tüp bebek ve içinde vivo uygulamaları için üretmek için kullanılan iletişim kuralı.
Giriş
Birden çok platform epigenome düzenleme son zamanlarda herhangi bir DNA dizileri gene expression1,2kontrol bölgeleri hedeflemek için geliştirilmiştir. Oluşturulan epigenome düzenleme araçları (i) transkripsiyon düzenleyen, (II) alter ardından Histon değişiklikler, (III) DNA metilasyonu değiştirmek ve (iv) düzenleyici öğe etkileşimleri modüle için tasarlanmıştır. Devre dışı bırakılan bir (ölü) Cas9 için transkripsiyon/Kromatin değiştiriciler tutturmak yaklaşım (dCas9) yükseltilmiş üzerinden daha önce çinko gibi epigenome düzenleme Gelişmiş platformlar parmak proteinleri (ZFPs) ve transkripsiyon harekete geçirmek gibi effectors (hikayeler), güçlü transkripsiyon efektör etki alanı barındıran (ED) tasarlanmış DNA'ya bağlanıcı etki alanına (DBD)3erimiş. Etkinleştirme veya baskı gibi istenen fenotip sonucunu endojen loci (şekil 1) demirlemiş efektör molekül tarafından tanımlanır. Programlanabilir transkripsiyon aktivatörleri oluşturmak için dCas9/gRNA modülleri VP164,5,-6 (şekil 1A), Pol II ve genel transkripsiyon makine acemi bir viral harekete geçirmek etki alanına bağlıdır. Bu sistem modifikasyonu bile daha sağlam bir etkinleştirme oranı5,6sağlayan VP64, bir tetramer VP16 alanlarının yer verdi. Sistem başarıyla rehberleri ve onların düzenleyici elemanlarının hedefleyerek kodlama ve kodlamayan bölgeler etkinleştirmek için istihdam edilmiştir. VP64 molekülleri doğrudan hedef bölge Kromatin yapısında değişiklik yapmayın olsa bile, önemlisi, H3/H4 asetilasyon ve H3-K4 di da dahil olmak üzere etkin (euchromatin) işaretleri birikimi içinde sonuçları bağlama Kromatin değiştiriciler acemi / Tri-metilasyonu5,6. VP64 ek olarak, insan NF-κB kompleks p65 alt birim için dCas9/gRNA modül7gergin. İlginçtir, bu effectors bölgelere akıntıya karşı transkripsiyon başlangıç siteleri (TSSs) ve rehberleri içinde hayvan zinciri bir güçlü gen indüksiyon sonuçlanır. Yine de, VP64 ve p65 effectors da activatory etkileri uygulamayın aşağı TSSs ve distal arttırıcılar7,8bulunan bölgelere bağlı iken. Daha sağlam bir transkripsiyon yanıt temin için birden çok dCas9-VP64 veya dCas9-p65 füzyon bir tek hedef locus9,10' a işe gerekir. Bu nedenle, birden çok efektör etki alanı SunTag gibi bir tek dCas9-gRNA kompleksi tarafından işe yeni nesil harekete geçirmek son gelişmeler bir daha güçlü harekete geçirmek yetenek dCas9-VP64 füzyon karşılıkları11 ' e karşılaştırarak sonuçlandı , 12. geliştirilmiş bir transkripsiyon etkinleştirme VP64, p65 ve Rta (VPR), C-terminus dCas913 (şekil 1A) için gama-herpesviruses, bir transactivation etki alanı füzyon yoluyla elde etti. Benzer CRISPR/dCas9 sistemleri hedef özel baskı (şekil 1B) için geliştirilmiştir.
Endojen gen baskı mühendislik önleyici füzyon ile çeşitli mekanizmalar (şekil 1B) elde edilebilir. CRISPR/dCas9 sistemleri, önleyici DBD (bile olmadan bir efektör etki alanı/sn), bağlantılı verimli bir organizatörü veya akış yukarı/aşağı-TSS bölgeleri3,-6 gergin iken gen ekspresyonu sessizlik gösterilmiştir ,14. Transkripsiyon üzerindeki etkileri transkripsiyon faktörü bağlama ve RNA polimeraz işleme steric girişim tarafından neden oldu. Yine de, daha kapsamlı yaklaşımlar gerekli, steric engel yalnız gen baskı kez sağlam susturmak için yeterli değil gibi. Susturucular yeni nesil son geliştirme tabanlı transkripsiyon önleyici etki alanları (TRDs), Histon değiştiriciler taşıyan CRISPR/dCas9 sistemler üzerinde (H3-K9 di-/ tri-metilasyonu, H3-K27 di-/ tri-metilasyonu; H3-K36 di-/ tri-metilasyonu, H3/H4 deasetilasyonu) ve etkileri4,5,15,16, susturmak daha sağlam izin epigenetik araçlar inşaat için liderliğindeki (KSY) DNA metilasyonu 17,18,19,20. Bu epigenetik değiştiricileri için DNA alımı genellikle bir daha güçlü silencing sonucu21,22oluşturmak daha fazla kapalı ve yoğun Kromatin oluşumu için neden olabilir kanıtlanmıştır. DBDs ile kullanılan en yaygın silencing etki alanını Krüppel ilişkili kutusu (KRAB)4,5' tir. Faktör alımı Kromatin değişikliklerle karşılık göstermiştir; Bununla birlikte, bu değişiklikler mekanizmaları henüz aydınlatılmamıştır16,17,18olmak vardır. Son zamanlarda, bu KRAB DNA için yerelleştirme Histon metiltransferaz SETDB1 ve Histon deasetilasyonu (HDAC) NuRD kompleksleri, bu etkileşimler oluşumuna aracılık olasılığını ima kurul yükseltebilirsiniz gösterilmiştir Kromatin yoğunlaşma ve transkripsiyon susturmak3,13. Alternatif bir yaklaşım efektör etki alanları DBDs için özel bir epigenetik silencing protein oluşturmak için erimiş. Bu sistem doğrudan baskıcı DNA işaretleri veya Histon değişiklikler tromboksan.
DNMT3A enzim kaşif Balonlu keşif sentetik CRISPR/dCas9 sistemlerinin kullanımı son zamanlarda, transkripsiyon deaktivasyon için repurposed. DNMT3A endojen gen rehberleri ve diğer düzenleyici bölgeleri (şekil 1B)18,20heterochromatin oluşumu boyunca transkripsiyon baskı giderek artan DNA metilasyonu tromboksan. McDonald et al.18 ve Vojta vd.20 DNA metilasyonu epigenome-gen susturmak veya baskı, plazmid teslim dCas9-DNMT3A fusion sistemi kuvvetli artırabilir gösteren için kullanılabilir rapor için ilk yazarlar vardı sitozin metilasyonu TSS18,20civarında. McDonald ve iş arkadaşlarınızın istihdam stratejisinin önemli bir azalma (yaklaşık % 40) neden olabilir gösterdi bir Tümör baskılayıcı gen CDKN2A mRNA18düzeyleri. Benzer şekilde, BACH veya IL6ST genlerin bazlar organizatörü bölge hedefleme gen ifade20iki kat azalma ile ilişkili artan CpG metilasyonu gösterir. Laboratuarımızın son zamanlarda SNCA overexpression (Şekil 2)23patolojik sonuçlar inceltiyorum için DNA metilasyonu kullanımı repurposed. Daha önce hypomethylated PD ve demans Lewy organları (DLB) beyin24,25olduğu bildirilen gibi strateji DNA metilasyonu SNCA intron 1 bölgede seçici geliştirme dayanır, 26. Bu hypomethylation SNCA overexpression, böylece terapötik müdahale24,27,28için cazip bir hedef sunan bağlı. Biz son zamanlarda SNCA intron 1 hiPSC kaynaklı dopaminerjik NPCs bölgede bir PD hasta SNCA triplication23ile elde edilen DNA metilasyonu düşük düzeyde gösterdi. Bu deneysel model NPCs sağlam kültüründe yayılır veya daha fazla olgun nöronların hücresel fenotipleri oksidatif dahil olmak üzere, arabuluculuk genetik faktörlerin tanımlamak etkili bir tarama etkinleştirme ayrıştırılan avantajdır stres ve Apoptozis29. Ayrıca, bu modeli sistem belirti başlangıçlı hastalarda önce gelişim olayları özetlemek bilim adamları sağlar. Buna ek olarak, hiPSC elde edilen NPCs gen ekspresyonu ile ilişkili hücresel ve moleküler yollar test etmek için harika bir araç temsil eder. Önemlisi, state-of--art CRISPR/Cas9-epigenome teknoloji ile birlikte hiPSC elde edilen NPCs büyük ölçüde ilaçların"yeni nesil" pek çok nörodejeneratif hastalıklar için geliştirme kolaylaştırabilir.
Biz son zamanlarda bir dCas9-DNMT3A füzyon proteini ve gRNA için özel olarak hedef CpG metilasyonu SNCA intron 1 (şekil 2A) içinde taşıyan lentivirus tabanlı bir sistemin SNCA ifade patolojik düzeyde azaltmak için geliştirilen23. Bu iletişim kuralı lentiviral vektör (LV) tasarım ve üretim ayrıntılı olarak açıklanmıştır. CRISPR/dCas9 bileşenleri çeşitli nedenlerden ötürü teslim etmek için etkili bir yol LVs temsil, yani hantal DNA yürütmek için (i) kendi kapasitesi ekler, hücre bölünmesi ve nondividing hücreleri30 da dahil olmak üzere, geniş bir transducing (II) bir yüksek verimlilik ve (iii) yeteneklerini en az sitotoksik ve immünojenik yanıt-e doğru uyarmak için. Son zamanlarda, LV sistem SNCA locus triplication ile bir hastadan hiPSC kaynaklı dopaminerjik nöron için uygulanan ve LVs tedavi potansiyelini'dır epigenome düzenleme gösterdi metilasyonu23 ( araçları Şekil 2B). Gerçekten de, bir LV-gRNA/dCas9-DNMT3A sistemi DNA metilasyonu SNCA intron 1 bölge, önemli bir artış neden olur. Bu artış SNCA mRNA ve protein23düzeyde azalma ile karşılık gelir. Ayrıca, SNCA downregülasyon PD ile ilgili fenotipleri SNCA triplication/hiPSC-türetilmiş dopaminerjik nöron (örneğin, mitokondrial ROS üretim ve hücre canlılığı)23yılında kurtarır. Önemlisi, biz gösterdi SNCA ifade LV-gRNA-dCas9-DMNT3A sistem tarafından azalma hiPSC kaynaklı dopaminerjik nöron taşıyan bir PD hastadan için karakteristik olan fenotipleri geri yeteneğine SNCA triplication, mitokondrial ROS üretim ve hücre canlılığı23gibi. Bu iletişim kuralı 1) üretim Protokolü ve konsantrasyon viral hazırlıklar yüksek tittered oluşturmak için en iyi duruma getirilmiş bir LV platformu belirlemenizi ve 2) hiPSCs farklılaşma olgun dopaminerjik olmak için desenli NPCs içine açıklamak için hedeftir nöronlar31,32 ve SNCA intron 1 hedeflenen bölgeye metilasyon düzeyi karakterizasyonu.
Lentiviral platformlar eski büyük genetik ekler33,34uyum yeteneği olan yani adeno ilişkili vektörel çizimler (AAVs), en popüler vektör platformu üzerinde büyük bir avantaj var. AAVs önemli ölçüde daha yüksek verim-ebilmek var olmak oluşturmak ama düşük paketleme kapasitesine sahip (< 4,8 kb), All-In-one CRISPR/Cas9 sistemleri sunmak için bunların kullanımı ödün. Böylece, görünüşe göre LVs platformu-in-seçimi CRISPR/dCas9 araçların teslimi ilgili uygulamalarda olurdu. Bu nedenle, burada özetlenen Protokolü hücre ve organların epigenome düzenleme bileşenleri etkin bir şekilde teslim etmek isteyen araştırmacılar için değerli bir araç olacak. Daha fazla iletişim kuralı vektörel çizimler vektör ifade kaset30,35içindeki öğeler CIS içinde bir değişiklik ile üretim ve ifade yeteneklerini artırmak için strateji özetliyor. Strateji dayanır romanından sistem geliştirdi ve bizim laboratuarımızda okudu ve 1010 viral adet (VU) /mL30,35aralığında viral parçacıkların üretmek için onun yetenek vurgulamaktadır.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. sistem tasarımı ve virüs üretim
- Plazmid tasarım ve İnşaat
Not: Bir all-in-one LV-gRNA-dCas9-DNMT3A vektörü inşaatı bir üretim kullanarak gerçekleştirilen- ve ifadesi en iyi şekilde ifade kaset Ortinski vd30tarafından yayınlandı. Vektör kaset transkripsiyon faktörü Sp1 ve state-of--art silme Çevrilmeyen içinde tanıma sitenin tekrarı taşır (U3') bölge bir 3' uzunluğundaki terminal tekrar (LTR) (şekil 2A)30,36. Vektör omurga CRISPR/Cas930,35ifade etme ve teslim içinde etkili olduğu tespit edilmiştir.- SpCas9 devre dışı bırak (ölü) sürümünü edinmek (dCas9) üzerinden site yönettiği mutagenesis (veri gösterilmez). Katalitik etki alanı HNH ve RuvC D10A ve H840A mutasyonların enzim, sırasıyla, AgeI-BamHI parçaları (şekil 3) alışverişi tarafından pBK30129 aktif Cas9 ile yataklık klon değiştirin.
- DNMT3A katalitik etki alanı pdCas9-DNMT3A-eGFP türetmek ( Tablo malzemelerigörmek) DNMT3A yükseltecek tarafından BamHI-429/R 5 '- GAGCGGATCCCCCTCCCG - 3' BamHI-429/L 5' - CTCTCCACTGCCGGATCCGG - 3' (şekil 3) bölümü. DNMT3A içeren bölge yükseltmek için aşağıdaki koşullar kullanın: (1) 95 ° C 60 s, (2) 95 ° C 10 s, (3) 60 ° C 20 s, (4) 68 ° C 60 s. tekrar koşulları 2-4 30 x için. Son uzantısı 68 ° C 3 dakikadır kullanın ve 4 ° C. tutun
- DCas9 taşıyan değiştirilmiş pBK301 vektör BamHI siteye BamHI restriksiyon enzimi tarafından sindirilmiş DNMT3A parçası klon. Doğrudan Sanger tarafından klonlama doğrulayın sıralama. Neden plazmid dCas9-DNMT3A-p2a-puromisindir transgene limanlar unutmayın. Plazmid gRNA iskele insan U6 organizatörü (şekil 3) üzerinden ifade eder.
- Puromisindir muhabir gen yeşil flüoresan protein (dCas9-DNMT3A-p2a-GFP oluşturmak için GFP) ile değiştirin. FseI ile dCas9-DNMT3A-p2a-Puro plazmid sindirmek. Bir jel arıtma yöntemi kullanarak vektör parçası arındırmak. PBK201a sindirerek tarafından INSERT hazırlamak (pLenti-GFP) ile FseI. FseI parçası vektör kopyalayın. Neden plazmid pBK539 dCas9-DNMT3A-p2a-GFP transgene (şekil 3) liman.
- HEK-293T hücre kültürü çalışmalarının ve hücreler transfection için kaplama
Not: İnsan embriyonik böbrek 293T (HEK-293T) hücreler kültürlü tam yüksek-glikoz Dulbecco kartal orta değiştiren'ın (DMEM; % 10 inek buzağı serum, 1 x antibiyotik antimycotic, 1 x sodyum pyruvate, 1 x önemli olmayan amino asit, 2 mM L-glutamin) % 5 ile 37 ° C'de CO 2. protokol tekrarlanabilirlik için bu farklı bir çok/toplu işlemine geçiş yaparken buzağı serum test etmek için tavsiye edilir. Altı 15 cm kadar tabak lentiviral üretim için ihtiyaç vardır.- Düşük-geçiş hücreleri yeni bir kültür (geçit 20 daha düşük) başlatmak için kullanın. Hücreleri % 90-%95 izdiham ulaştığınızda, medya Aspire edin ve yavaşça steril 1 fosfat tamponlu tuz çözeltisi (PBS) x ile yıkayın.
- Tripsin-EDTA (% 0.05) 2 mL ekleyin ve 3-5 dk 37 ° C'de kuluçkaya. Ayrılma reaktif devre dışı bırakabilirsiniz tam yüksek glikoz DMEM ve pipet 10 x-15 x 10 mL serolojik pipet ile 4 x 106 hücre/mL bir tek hücreli askıya oluşturmak için 8 mL ekleyin.
- Transfections için % 0,2 jelatin ile 15 cm tabak kat. Yüksek glikoz orta 22,5 mL ekleyin ve hücreleri hücre süspansiyon (Toplam ~ 1 x 107 hücreler/plaka) 2.5 mL ekleyerek temel olarak belirler. % 70-%80 izdiham ulaşılana kadar 37 ° c % 5 CO2 tabak kuluçkaya.
- HEK-293T hücre transfection
- BES arabelleğe alınmış çözüm BBS x 2 ve 1 M CaCl2, Vijayraghavan ve Kantor35göre hazırlayın. 0,22 µm filtreden geçirerek çözümleri filtre ve onları 4 ° C'de depolayın Transfection mix kendi ek hücreleri olarak önce açık olmak zorunda. Mix kuluçka sırasında bulutlu olursa, taze 2 x BBS hazırlamak (pH 6,95 =).
- Plazmid karışım hazırlamak için dört plazmid listelendiği gibi kullanın (aşağıdaki karışımı bir 15 cm tabak için yeterlidir): 37,5 µg CRISPR/dCas9-transfer vektörünün (pBK492 [DNMT3A-Puro-NO-gRNA] veya pBK539 [DNMT3A-GFP-NO-gRNA]); pBK240 25 µg (psPAX2); pMD2.G 12.5 µg; 6.25 µg pRSV-rev (şekil 4A). Konsantrasyonları üzerinde dayalı plazmid hacmi hesaplamak ve gerekli miktarda 15 mL konik tüp içine ekleyin. 1 M CaCl2 312,5 µL eklemek ve son hacim için 1,25 mL getirmek, steril dd-H2o yavaşça kullanarak 1,25 mL vortexing karışımı ise 2 x BBS çözeltisi ekleyin. Oda sıcaklığında 30 dk için kuluçkaya. Sonra onları %70-%80 birleşmesi transfection için hazır hücrelerdir.
- Medya Aspire edin ve 22,5 mL serum olmadan taze hazırlanmış yüksek glikoz DMEM ile değiştirin. Transfection karışımı 2.5 mL dropwise her 15 cm plakasına ekleyin. Girdap plakaları ve % 5 CO2 için 2-3 h 37 ° C'de kuluçkaya.
- 3 saat sonra 2.5 mL (% 10) ekleyin plaka başına bir serum ve gecede %5 CO237 ° C'de kuluçkaya.
- 1 gün sonra transfection, olmasını sağlamak için hücre gözlemlemek yok veya çok az hücre ölümü ve hücreleri Konfluent kültür (% 100) kurdu.
- Medya her plaka için 25 mL taze hazırlanmış yüksek glikoz serum DMEM ve % 10 ekleyerek değiştirin.
- 48 saat için % 5 CO2 ile 37 ° C'de kuluçkaya.
- Hasat virüs
- Transfected hücrelerden süpernatant toplamak ve onları 50 mL konik tüplerde Havuzu. 10 dakika süreyle 400 – 450 x g , santrifüj süpernatant 0,45 µm vakum filtre ünitesi aracılığıyla filtre. Filtrasyon sonra süpernatant kısa süreli depolama (4 gün) 4 ° C'de tutulabilir. Uzun süreli depolama için aliquots hazırlamak ve onları-80 ° C'de depolayın
Not: Nonconcentrated viral hazırlıklar ~ 2 x 10 olması beklenen7 3 x 107 vu/ml (titresi belirlenmesi için 1.5 bölümüne bakınız). Birden çok donma-çözülme çevrimleri fonksiyonel titreleri % 10-% 20 kaybına neden olur bu yana tek kullanımlık aliquots, hazırlamak için önerilir.
- Transfected hücrelerden süpernatant toplamak ve onları 50 mL konik tüplerde Havuzu. 10 dakika süreyle 400 – 450 x g , santrifüj süpernatant 0,45 µm vakum filtre ünitesi aracılığıyla filtre. Filtrasyon sonra süpernatant kısa süreli depolama (4 gün) 4 ° C'de tutulabilir. Uzun süreli depolama için aliquots hazırlamak ve onları-80 ° C'de depolayın
- Viral parçacıkların konsantrasyonu
Not: Arıtma, sukroz degrade adım ve sukroz yastık adım içeren bir iki adım çift-Sükroz yöntemi (şekil 4B) gerçekleştirilen.- Sükroz gradyan oluşturmak için aşağıdaki sırada konik ultrasantrifüj tüpleri hazırlayın: 1 x PBS, DMEM, DMEM % 30 Sükroz 1 mL ve 1 x PBS % 20 sukroz 2 mL % 60 Sükroz 0.5 mL % 70 Sükroz 0.5 mL.
- Dikkatle, süpernatant, Bölüm 1.4, göre toplanan degradeye ekleyin. Dört 15 cm tabak toplanan Toplam hacim 100 mL olduğu için altı ultrasantrifüj tüpler viral süpernatant işlemek için kullanın.
- Aynı derecede viral süpernatant her ultrasantrifüj tüp arasında dağıtın. Santrifüjü sırasında tüp kırılma önlemek için en az üç-dört toplam birim kapasitesinin ultrasantrifüj tüpleri doldurun. 1 x PBS tüplerini denge. 70.000 x g 17 ° C'de 2 h için de örnekler santrifüj kapasitesi
Not: Sükroz katman hızlanma ve yavaşlama adımları boyunca korumak için yavaş yavaş hızlandırmak ve rotor 0'dan 200 g x ve 200 0 x g için ilk ve son 3 dk sırasında spin, sırasıyla yavaşlatmak ultracentrifuge izin verir. - Yavaşça % 30-%60 Sükroz kesirler temiz tüpler (şekil 4B) içine toplamak. PBS (soğuk) up x 1 toplam hacminin 100 mL ekleyin. Birden çok kez pipetting karıştırın.
- Dikkatle, viral hazırlık Sükroz yastık üzerinde % 20 sukroz (içinde 1 x PBS) 4 mL tüp ekleyerek tabakalaşmak. Pipetting ~ 20-25 tarafından devam mL başına her tüpün viral çözeltisi. Bunların içeriğini birim tüp daha az üç dördüncü ise tüpler 1 x PBS ile doldurun. Dikkatle tüpler denge. 17 ° C'de 2 h için 70.000 x g , santrifüj Süpernatant boş ve kalan izin vermek için kağıt havlu üzerine boruları ters sıvı süzün.
- Tüm sıvı geri kalan sıvı aspirating tarafından dikkatli bir şekilde çıkarın. Bu adımda, virüs içeren granül küçük saydam spot renkleri görünür zor olduğunu, unutmayın. 1 x PBS 70 µL Pelet resuspend için ilk tüp ekleyin. İyice süspansiyon pipette ve tüm parçaları resuspended kadar sonraki tüp transferi.
- 1 x PBS ve karışımı olarak önce bir ek 50 µL tüplerini yıkayın. Bu adımda, son süspansiyon hacmi ~ 120 µL olduğunu ve biraz sütlü görünür, unutmayın. Açık bir süspansiyon elde etmek için 10.000 x gde 60 s aralıklarla devam. Süpernatant için yeni bir tüp aktarın, 5 µL aliquots yapmak ve onları-80 ° C'de depolayın
Not: Lentiviral vektör hazırlıklar dondurma ve çözme yinelenen döngüleri için duyarlıdır. Buna ek olarak, bu geri kalan adımları doku kültürü kapsama bitmiş veya içinde Biyogüvenlik standartları (4B rakam) yeterli düzeyde olmak açısından nitelikli alanları belirlenmiş önerilmektedir.
- Viral titreleri miktar
Not: Viral titreleri tahmini (p24gag ELISA) p24 enzim bağlı immunosorbent assay (ELISA) yöntemi kullanılarak gerçekleştirilir ve ulusal kurumları Sağlık (NIH) AIDS aşısı programına göre HIV-1 p24 antijen tayini ile yakalamak için protokol hafif değişiklikler.- 96-şey plaka 3 Kuyu yıkamak için 200 µL % 0.05 arası 20 içinde soğuk 1 x PBS (PBS-T) kullanın x.
- Plaka kat için 1 x PBS 1:1,500, seyreltilmiş monoklonal anti-p24 antikor 100 µL kullanın. Gecede 4 ° C'de plaka kuluçkaya
- Engelleme reaktif (%1 sığır serum albümin [BSA] 1 x PBS içinde) hazırlamak ve 200 µL nonspesifik bağlama önlemek için her şey için ekleyin. Oda sıcaklığında en az 1 h için de 3 x yıkamak için PBS-t 200 µL kullanın.
- Numune hazırlama ile devam edin. Konsantre vektör hazırlıkları ile çalışırken, vektör 1: 100, 1 µL örnek, dd-H20 89 µL ve Triton X-100 10 µL (bir son konsantrasyonu % 10) kullanarak oranında seyreltin. Nonconcentrated hazırlıkları örnekleri 1:10 oranında seyreltin.
- HIV-1 standartları (başlangıç konsantrasyonu 5 ng/mL'dir) bir iki kat seri seyreltme kullanarak elde.
- RPMI 1:10, 000, elde etmek için % 0,2 ara 20 ve % 1 BSA ile desteklenmiş 1640 konsantre örneklerinde (1.6.4 adımda hazırlanan) seyreltik 1:50, 000 ve 1:250,000 dilutions. Benzer şekilde, RPMI 1:500, 1:2, kurmak için % 0,2 ara 20 ve % 1 BSA ile desteklenmiş 1640 nonconcentrated örneklerinde (1.6.4 adımda hazırlanan) seyreltik 500 ve 1:12,500 dilutions.
- Örnekleri ve standartları triplicates plaka ekleyin. Gecede 4 ° C'de kuluçkaya
- Ertesi gün, kuyu 6 yıkama x.
- Poliklonal tavşan anti-p24 antikor, RPMI 1640, % 10 fetal sığır serum (FBS), % 0.25 BSA ve % 2 normal fare serum (NMS), 1:1,000, seyreltilmiş 100 µL ekleyin ve 4 h için 37 ° C'de kuluçkaya.
- Kuyu 6 yıkama x. Keçi Anti-tavşan horseradish peroksidaz adlı 1:10,000 RPMI %2 NMS, % 0.25 BSA ve % 0,01 ile % 5 normal keçi serum 1640 yılında seyreltilmiş IgG eklemek ara 20. 1s için 37 ° C'de kuluçkaya.
- Kuyu 6 yıkama x. TMB peroksidaz substrat ekleyin ve 15 dakika oda sıcaklığında kuluçkaya.
- Reaksiyon durdurmak için 1 N HCL 100 µL ekleyin. Mikroplaka okuyucu içinde 450 Absorbans ölçmek nm.
- Floresan muhabir yoğunluğu ölçümü
- Viral süspansiyon (üzerinden 10-1 10-5) bir 10 kat seri seyreltme 1 x PBS içinde elde etmek için kullanın.
- 5 x 105 HEK-293T hücreleri her iyi 6-şey plaka plaka. Her viral seyreltme 10 µL hücrelere uygulayın ve % 5 CO2 48 h 37 ° C'de kuluçkaya.
- (FACS) analizi aşağıdaki gibi sıralama Floresans aktif hücre devam: hücreleri 200 µL % 0.05 tripsin-EDTA çözüm ekleyerek bağlantısını kesin. 5 min için 37 ° C'de hücreler kuluçkaya ve onları DMEM orta (serum ile) 2 ml resuspend. 15 mL konik tüp ve santrifüj 400 x g 4 ° C'de de örnekler toplamak Pelet soğuk 1 x PBS 500 µL içinde resuspend.
- %4 paraformaldehyde (PFA) 500 µL ekleyerek hücreleri tamir ve oda sıcaklığında 10 dakika için kuluçkaya.
- 400 x g 4 ° c de santrifüj kapasitesi ve Pelet 1 mL 1 x PBS resuspend. Ortinski ve ark.30' açıklandığı gibi bir FACS enstrüman kullanarak GFP ifade analiz. Virüs fonksiyonel titresi belirlemek için aşağıdaki formülü kullanın.

Burada,
TG GFP pozitif hücreleri; =
TN toplam sayısı; =
N = toplam sayısı transduced hücreleri;
V = (microliters içinde) iletim için kullanılan birim.
- GFP pozitif Hücre sayımı
Not: Enfeksiyon (MOI) iletim için istihdam çeşitliliğini belirlemek. MOIs bir geniş aralığı test (MOI = 1 MOI = 10).- 3 x 105 ' e 4 x 105 HEK-293T hücreleri her şey 6-şey plaka başına tohum.
- Hücreleri ulaştığınız zaman > % 80 izdiham, onlara ilgi MOI, vektör ile transduce.
- %5 CO237 ° C'de kuluçkaya ve hücrelerdeki GFP sinyal 1 – 7 gün boyunca izlemek.
- GFP pozitif hücreleri saydırmak. Floresan mikroskop istihdam (Plan 4 x amaç, 0,1 N.A., 40 x büyütme) GFP filtre kullanarak (uyarma dalga boyu 470 = nm, emisyon dalga boyu 525 = nm). Untransduced hücreleri kontrol nüfus GFP negatif hücre ayarlamak için kullanın.
- Virüsün fonksiyonel titresi belirlemek için aşağıdaki formülü kullanır.
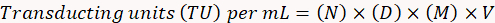
Burada,
N = sayısı GFP pozitif hücreler;
D = seyreltme faktörü;
M = büyütme faktörü;
V iletimi için kullanılan virüs hacmi =.
Not: Bu örnek takip sonuçları hesaplamak: 10-4 (1:10, 000) 20 x büyütme (M) bir 10 µL örnek (V) adlı bir seyreltme (D), sayılan 10 GFP pozitif hücreler için (N), (10 x 104) TU mililitre başına olacak x (20) x (10) x (100) = 2 x 108 vu/mL.
2. dopaminerjik nöral progenitör hücre farklılaşma
- HiPSCs kültürü
Not: hiPSCs SNCA odağı, ND34391, triplication ile bir hastadan (bkz. tablo reçetesi) sinir hastalıkları Ulusal Enstitüsü ve kontur (NINDS) katalog elde.- Kültür hiPSCs besleyici bağımsız koşullarda besleyici-Alerjik ESC-IPSC kültür ortamında ( Tablo malzemelerigörmek) temel matris hESC nitelikli membran (BMM) üzerine-kaplamalı plakalar (bkz: Malzemeler tablo). 1 mL DMEM/F12 ile Konfluent kolonileri yıka, ayrılma reaktif 1 mL ekleyin (bkz. Tablo reçetesi) ve oda sıcaklığında 3 min için kuluçkaya.
- Ayrılma reaktif Aspire edin ve besleyici-Alerjik ESC-IPSC kültür orta 1 mL ekleyin.
- Bir hücre lifter kullanarak plaka scrape ve besleyici-Alerjik ESC-IPSC kültür ortamının 11 mL kolonilerde borosilikat Pipetler kullanarak x pipetting 4 x-5 tarafından resuspend.
- Koloni süspansiyon BMM kaplı plakalar üzerine 2 mL plaka ve plaka %5 CO237 ° C'de yer. Bir günlük Orta değişiklik yapmak ve her 5-7 gün hücreleri bölme.
- Farklılaşma dopaminerjik nöral progenitör hücre içine
Not: HiPSCs farklılaşma dopaminerjik nöral progenitör hücre (MD NPCs) içine üreticilerin yönergeler, her bir piyasada bulunan sinir indüksiyon orta protokolü kullanılarak hafif değişiklikler31,32 () ile gerçekleştirilir Malzemeler tablobkz.). Farklılaşma ilk gün gün 0kabul edilir. Yüksek kaliteli hiPSCs verimli sinirsel farklılaşması için gerekli değildir. MD NPCs indüksiyon performedusing bir embryoid vücut (EB) olduğunu-tabanlı protokol.- HiPSCs farklılaşma başlatmadan önce microwell kültür plaka hazırlamak ( Tablo malzemelerigörmek) onun üreticinin yönergelerine uygun.
- Microwell kültür plaka hazırladıktan sonra sinirsel indüksiyon orta (NIM; bkz: Malzemeler tablo) ile 10 µM takıma 1 mL ekleyin Y-27632.
- Plaka kullanıma hazır kadar kenara koyun.
- HiPSCs DMEM/F12 ile yıkayın, hücre dekolmanı çözümü 1 mL ekleyin (bkz. Tablo reçetesi) ve % 5 CO237 ° C'de 5 min için kuluçkaya.
- DMEM/F12 Tek Kişilik hücrelerde resuspend ve onları vasıl 300 x g 5 dk santrifüj kapasitesi.
- Dikkatle süpernatant Aspire edin ve NIM + 10 µM hücrelerde resuspend 3 x 106 hücre/mL nihai bir konsantrasyon elde etmek için Y-27632.
- Tek hücreli süspansiyon 1 mL microwell kültür plaka tek bir şey için ekleyin ve 100 x g 3 dk de plaka santrifüj kapasitesi.
- Plaka hücreler microwell arasında eşit dağılımı sağlamak için mikroskop altında incelemek ve % 5 CO237 ° C'de hücreler kuluçkaya.
- Gün 1-4, bir günlük kısmi orta değiştirmek gerçekleştirin.
- 1 mL micropipette kullanarak, orta 1,5 mL kaldırmak ve atın. Yavaş yavaş, Y-27632 olmadan taze NIM 1,5 mL ekleyin.
- 2.2.10 4 güne kadar adımları yineleyin.
- 5. gün, BMM. 6-şey plakalı bir kuyu kat
- 37 µm tersinir süzgeç yerleştirin (bkz. Tablo reçetesi) 50 mL konik tüp (atık) üstüne. Tersine çevrilebilir süzgeç yukarı ok işaret.
- Orta microwell kültür plaka kurulan EBs bozmadan kaldırın.
- 1 mL DMEM/F12 ekleyin ve derhal EBs borosilikat pipet ile toplamak ve onları süzgeç aracılığıyla filtre.
- Tüm EBs kaldırıldı kadar microwell kültür plaka 2.2.15 tekrarlayın.
- Süzgeç bir yeni 50 mL konik tüp üzerinde ters çevir ve tüm EBs toplamak için NIM 2 mL ekleyin.
- EB süspansiyon 2 mL tek borosilikat pipet kullanarak BMM kaplı kalıbının kuyuya plaka. EBs %5 CO237 ° C'de kuluçkaya.
- 6. gün, NIM + 200 ng/mL ŞŞŞ 2 mL hazırlamak ( Tablo malzemelerigörmek) ve bir günlük Orta değişiklik yapmak.
- 8. gün, nöronal indüksiyon yüzdesi inceleyin.
- Tüm bağlantılı EBs saymak ve özellikle, sinirsel rozet ile dolu her bireysel EB sayısını belirleyin. Aşağıdaki formülü kullanarak sinirsel rozet indüksiyon ölçmek.
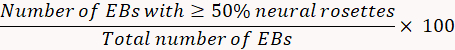
Not: Sinirsel indüksiyon ise < % 75, sinirsel rozet seçim verimsiz olabilir. - Gün 12, N2B27 orta 250 mL neurobasal orta, 119 mL DMEM/F12 orta, GlutaMAX, 2.5 mL 2.5 mL NEAA, N2 ek, A vitamini olmadan 5 mL-B27 de 2.5 mL, gentamisin (50 mg/mL) 250 μL 119 mL ile hazırlamak ve 19. 66 μL BSA (7 mg/mL).
- Tam N2B27 orta 50 mL hazırlamak, 3 mikron ekleyin CHIR99021, 2 mikron SB431542, 20 ng/mL bFGF, 20 ng/mL EGF ve 200 ng/mL ŞŞŞ.
Not: Tamamlanan hazırlamak önemlidir kullanmadan önce orta. - Orta sinirsel rozet içeren kuyulardan Aspire edin ve 1 mL DMEM/F12 ile yıkayın.
- Reklam sinirsel rozet seçimi reaktif 1 mL ( Tablo malzemelerigörmek) ve % 5 CO2 için 1 h 37 ° C'de kuluçkaya.
- Seçim reaktif çıkarın ve 1 mL pipettor kullanarak, doğrudan rozet kümeleri nişan al.
- Süspansiyon 15 mL konik tüp eklemek ve adım 2.2.25 ve 2.2.26 sinir rozet kümeleri çoğunluğu kadar toplanan tekrarlayın.
Not: Nonneuronal hücre tipleri ile kirlenmesini önlemek için overselect değil. - 350 x g 5 dk. aspiratı de rozet süspansiyon süpernatant santrifüj kapasitesi ve sinirsel rozet N2B27 + 200 ng/mL ŞŞŞ resuspend. Sinirsel rozet süspansiyon BMM kaplı bir kuyu ekleyin ve 37 ° c % 5 CO2plaka kuluçkaya.
- Gün 13 – 17, bir günlük orta değiştirmek tamamlanmış N2B27 orta kullanarak gerçekleştirin. Kültürleri % 80-%90 birleşmesi olduğunda hücreleri geçiş.
- Hücreleri bölmek için BMM kaplı bir tabak hazırla.
- 1 mL DMEM/F12 hücrelerle yıkama, orta Aspire edin ve ayrılma reaktif 1 mL ekleyin ( Tablo malzemelerigörmek).
- 37 ° C'de 5 min için kuluçkaya, DMEM/F12 1 mL ekleyin ve yukarı ve aşağı pipetting tarafından eklenen hücreleri çıkarmak. 15 mL konik tüp NPC süspansiyon toplamak. 5 min için 300 x g , santrifüj.
- Süpernatant Aspire edin ve resuspend tam N2B27 1 mL hücrelerde + 200 ng/mL ŞŞŞ.
- Hücreleri saymak ve onları 1,25 x 105 hücreleri/cm2yoğunluğu, plaka ve % 5 CO237 ° C'de hücreler kuluçkaya.
- Orta her geçen gün, tam N2B27 + 200 ng/mL ŞŞŞ kullanarak değiştirin.
Not: Bu pasaj NPCs geçiş (P) kabul edilir 0. ŞŞŞ, P2, N2B27 ortamdan çekilebilir. - Bir kez onlar uzanmak % 80-%90 izdiham hücreleri geçiş.
- Bu aşamada hücreleri Nestin ve FoxA2 immunocytochemistry ve qPCR kullanarak hızlı onaylayın. Bu iletişim kuralı % 85 kişilik pozitif hücre üretimi için Nestin ve FoxA2 işaretleri yol açar.
- Hücreleri passaging için adımları 2.2.31–2.2.36 tekrarlayın.
- Geçiş P2 başlangıç hücreleri, dondur. Hücrelerin Dondurulması, tekrarlamak merdiven 2.2.31–2.2.36 ve 2 x 106 4 x 106 hücre/ml kullanarak orta buz gibi soğuk nöral progenitör hücre Pelet resuspend (bkz. Tablo malzeme).
- Hücre süspansiyon 1 mL her cryovial aktarmak ve standart bir yavaş hızı kontrollü soğutma sistemi kullanarak hücreleri dondurma. Uzun süreli depolama için hücreler sıvı azot içinde tutmak.
- MD NPCs çözdürme
- BMM kaplı bir tabak hazırlamak ve tam N2B27 sıcak. 10 mL sıcak DMEM/F12 15 mL konik tüp ekleyin. Bir cryovial için 2 dk 37 ° C ısı bloğu yerleştirin.
- Hücreleri cryovial DMEM/F12 içeren tüp aktarın. 5 min için 300 x g , santrifüj.
- Süpernatant Aspire edin, N2B27 2 mL hücrelerde resuspend ve hücre süspansiyon BMM kaplı plaka bir şey için ekleyin. %5 CO237 ° C'de hücreler kuluçkaya.
- BMM kaplı bir tabak hazırlamak ve tam N2B27 sıcak. 10 mL sıcak DMEM/F12 15 mL konik tüp ekleyin. Bir cryovial için 2 dk 37 ° C ısı bloğu yerleştirin.
3. iletim MD NPCs ve metilasyonu değişiklikleri analiz
-
MD NPCs iletim
- MOI, LV-gRNA/dCas9-DNMT3A Vektörler ile % 70 izdiham, MD NPCs transduce = 2. N2B27 orta 16 h posttransduction değiştirin.
- N2B27 5 µg/mL puromisindir, 48 h iletim sonra ekleyin. Hücreleri 3 hafta boyunca istikrarlı MD NPC hatlarını edinmeniz N2B27 artı puromisindir kültür. Hücreleri aşağı akım uygulamaları (DNA, RNA, protein analizleri, dondurma ve passaging fenotipik karakterizasyonu23,) için hazırsınız demektir.
-
SNCA intron 1 metilasyonu profil karakterizasyonu
- DNA'sı stabil transduced her hücreden ayıklamak hattı ile DNA ekstraksiyon Kiti ( Tablo malzemelerigörmek).
- Ticari olarak kullanılabilir kullanarak bir Bisülfit dönüştürme gerçekleştirmek için DNA'ın kullanım 800 ng ( Tablo malzemelerigörmek) kit. Bisülfit dönüştürme işleminden sonra 20 ng/µL için Bisülfit dönüştürülmüş DNA elute.
-
PCR pyrosequencing analizi için
- Nükleaz ücretsiz tüp ana PCR karışımında hazırlayın. Her reaksiyon için ters astar (10 µM), ileri astar (10 µM), MgCl2 (25 mM), 10 x CoralLoad konsantre, 2 x PCR ana Mix 10 µL, 5 4 µL 2 µL 1.6 µL 0.4 µL 0.4 µL kullanın x Q-çözüm, DNA'ın 1 µL ve 0.6 µL nükleaz ücretsiz su.
- Reaksiyon plaka bir thermocycler aktarmak ve PCR aşağıdaki koşullar kullanarak gerçekleştirmek: 15 dk, 30 50 devredir 94 ° c için 95 ° C s, 30 56 ° C s ve 72 ° C 30 s, 72 ° C'de son 10 dk uzantısı adımla Astar SNCA intron 1 pyrosequencing için kullanılan Tablo 1, şekil 7Ave tamamlayıcı şekil 1listelenir.
- Amplifikasyon sonra 2 µL PCR ürünü boyama, etidyum bromür ile aşağıdaki özel Jel Elektroforez kullanarak amplicons gözünün önüne getir.
- Pyrosequencing deneyleri karışımları bazlar (u) kullanılarak doğrulanır ve metillenmiş (M) DNA'lar aşağıdaki oranları, yani 100U:0M, 75U:25M, 50U:50M, 25U:75M ve 0U:100M ( Tablo malzemelerigörmek) içinde Bisülfit dönüştürülür.
- Pyrosequencing ( Tablo malzemelerigörmek) pyrosequencing reaktifler kullanarak yürütmek ve pyrosequencing yazılımı kullanan her CpG site metilasyonu değerlerini hesaplamak. Detaylı pyrosequencing iletişim kuralı için Bassil ve ark.37için başvurun.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Üretim titreleri saf GFP Özgününü karşılaştırıldığında LV-dCas9-DNMT3A-GFP/Puro vektörlerin doğrulama
P24gag ELISA LV-dCas9-DNMT3A-GFP/Puro fiziksel titreleri saf GFP/Puro meslektaşları ile arasında karşılaştırmak için gerçekleştirilen. Temsilcisi sonuçları şekil 5A', sunulan, burada özetlenen, iletişim kuralı kullanılarak oluşturulan Vekt...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
LVs epigenome düzenleme, özellikle genetik hastalıklar bağlamında için Seçim aracı olarak ortaya çıkmaya başladık, (i) karşılamak için esas olarak yeteneklerini nedeniyle büyük DNA payloads ve (ii) bölme geniş bir yelpazesi verimli bir şekilde transduce ve nondividing hücreleri. LVs büyük ambalaj etkinliğinin ambalaj büyük boyutlu CRISPR/dCas9 sistemleri içeren uygulamalar için özellikle yararlıdır. Bu açıdan bakıldığında, LVs platformu-in-seçim tüm-içinde-bir CRISPR/Cas9 sistemler...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Duke Üniversitesi, bu çalışma için ilgili geçici bir patent başvurusunda.
Teşekkürler
Bu eser kısmen Kahn NÖROTEKNOLOJİ geliştirme Ödülü (OC) ve ulusal kurumları, sağlık/Ulusal Enstitüsü, nörolojik bozukluklar ve kontur (NIH/NINDS) tarafından finanse edildi (R01 NS085011 O.C. için).
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Optima XPN-80 Ultracentrifuge | Beckman Coulter | A99839 | |
| 0.22 μM filter unit, 1 L | Corning | 430513 | |
| 0.45-μm filter unit, 500 mL | Corning | 430773 | |
| 100 mm TC-Treated Culture Dish | Corning | 430167 | |
| 15 mL conical centrifuge tubes | Corning | 430791 | |
| 150 mm TC-Treated Cell Culture dishes with 20 mm Grid | Corning | 353025 | |
| 50 mL conical centrifuge tubes | Corning | 430291 | |
| 6-well plates | Corning | 3516 | |
| Aggrewell 800 | StemCell Technologies | 34811 | |
| Allegra 25R tabletop centrifuge | Beckman Coulter | 369434 | |
| BD FACS | Becton Dickinson | 338960 | |
| Conical bottom ultracentrifugation tubes | Seton Scientific | 5067 | |
| Conical tube adapters | Seton Scientific | PN 4230 | |
| Eppendorf Cell Imaging Slides | Eppendorf | 30742060 | |
| High-binding 96-well plates | Corning | 3366 | |
| Inverted fluorescence microscope | Leica | DM IRB2 | |
| QIAprep Spin Miniprep Kit (50) | Qiagen | 27104 | |
| Reversible Strainer | StemCell Technologies | 27215 | |
| SW32Ti rotor | Beckman Coulter | 369650 | |
| VWR® Disposable Serological Pipets, Glass, Nonpyrogenic | VWR | 93000-694 | |
| VWR® Vacuum Filtration Systems | VWR | 89220-694 | |
| xMark™ Microplate Absorbance plate reader | Bio-Rad | 1681150 | |
| Name | Company | Catalog Number | Comments |
| Cell culture reagents | |||
| Human embryonic kidney 293T (HEK 293T) cells | ATCC | CRL-3216 | |
| Accutase | StemCell Technologies | 7920 | |
| Anti-Adherence Rinsing Solution | StemCell Technologies | 7010 | |
| Anti-FOXA2 Antibody | Abcam | Ab60721 | |
| Anti-Nestin Antibody | Abcam | Ab18102 | |
| Antibiotic-antimycotic solution, 100x | Sigma Aldrich | A5955-100ML | |
| B-27 Supplement (50x), minus vitamin A | Thermo Fisher Scientific | 12587010 | |
| BES | Sigma Aldrich | B9879 - BES | |
| Bovine Albumin Fraction V (7.5% solution) | Thermo Fisher Scientific | 15260037 | |
| CHIR99021 | StemCell Technologies | 72052 | |
| Corning Matrigel hESC-Qualified Matrix | Corning | 08-774-552 | |
| Cosmic Calf Serum | Hyclone | SH30087.04 | |
| DMEM-F12 | Lonza | 12-719 | |
| DMEM, high glucose media | Gibco | 11965 | |
| DNeasy Blood & Tissue Kit | Qiagen | 69504 | |
| EpiTect PCR Control DNA Set | Qiagen | 596945 | |
| EZ DNA Methylation Kit | Zymo Research | D5001 | |
| Gelatin | Sigma Aldrich | G1800-100G | |
| Gentamicin | Thermo Fisher Scientific | 15750078 | |
| Gentle Cell Dissociation Reagent | stemCell Technologies | 7174 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Human Recombinant bFGF | StemCell Technologies | 78003 | |
| Human Recombinant EGF | StemCell Technologies | 78006 | |
| Human Recombinant Shh (C24II) | StemCell Technologies | 78065 | |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fisher Scientific | 11140050 | |
| mTeSR1 | StemCell Technologies | 85850 | |
| N-2 Supplement (100x) | Thermo Fisher Scientific | 17502001 | |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | |
| Non-Essential Amino Acid (NEAA) | Hyclone | SH30087.04 | |
| PyroMark PCR Kit | Qiagen | 978703 | |
| RPMI 1640 media | Thermo Fisher Scientific | 11875-085 | |
| SB431542 | StemCell Technologies | 72232 | |
| Sodium pyruvate | Sigma Aldrich | S8636-100ML | |
| STEMdiff Neural Induction Medium | StemCell Technologies | 5835 | |
| STEMdiff Neural Progenitor Freezing Medium | StemCell Technologies | 5838 | |
| TaqMan Assay FOXA2 | Thermo Fisher Scientific | Hs00232764 | |
| TaqMan Assay GAPDH | Thermo Fisher Scientific | Hs99999905 | |
| TaqMan Assay Nestin | Thermo Fisher Scientific | Hs04187831 | |
| TaqMan Assay OCT4 | Thermo Fisher Scientific | Hs04260367 | |
| TaqMan Assay PPIA | Thermo Fisher Scientific | Hs99999904 | |
| Trypsin-EDTA 0.05% | Gibco | 25300054 | |
| Y27632 | StemCell Technologies | 72302 | |
| Name | Company | Catalog Number | Comments |
| p24 ELISA reagents | |||
| Monoclonal anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | 3537 | |
| Goat anti-rabbit horseradish peroxidase IgG | Sigma Aldrich | 12-348 | Working concentration 1:1500 |
| Goat serum, Sterile, 10 mL | Sigma | G9023 | Working concentration 1:1000 |
| HIV-1 standards | NIH AIDS Research and Reference Reagent Program | SP968F | |
| Normal mouse serum, Sterile, 500 mL | Equitech-Bio | SM30-0500 | |
| Polyclonal rabbit anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | SP451T | |
| TMB peroxidase substrate | KPL | 5120-0076 | Working concentration 1:10,000 |
| Name | Company | Catalog Number | Comments |
| Plasmids | |||
| pMD2.G | Addgene | 12253 | |
| pRSV-Rev | Addgene | 52961 | |
| psPAX2 | Addgene | 12259 | |
| Name | Company | Catalog Number | Comments |
| Restriction enzymes | |||
| BsmBI | New England Biolabs | R0580S | |
| BsrGI | New England Biolabs | R0575S | |
| EcoRV | New England Biolabs | R0195S | |
| KpnI | New England Biolabs | R0142S | |
| PacI | New England Biolabs | R0547S | |
| SphI | New England Biolabs | R0182S |
Referanslar
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Gaj, T., Gersbach, C. A., Barbas, C. F. 3rd ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering. Trends in Biotechnology. 31 (7), 397-405 (2013).
- Thakore, P. I., Black, J. B., Hilton, I. B., Gersbach, C. A. Editing the epigenome: technologies for programmable transcription and epigenetic modulation. Nature Methods. 13 (2), 127-137 (2016).
- Gilbert, L. A., et al. CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes. Cell. 154 (2), 442-451 (2013).
- Gilbert, L. A., et al. Genome-Scale CRISPR-Mediated Control of Gene Repression and Activation. Cell. 159 (3), 647-661 (2014).
- Perez-Pinera, P., et al. RNA-guided gene activation by CRISPR-Cas9-based transcription factors. Nature Methods. 10 (10), 973-976 (2013).
- Chavez, A., et al. Highly efficient Cas9-mediated transcriptional programming. Nature Methods. 12 (4), 326-328 (2015).
- Horlbeck, M. A., et al. Nucleosomes impede Cas9 access to DNA in vivo and in vitro. eLife. 5, (2016).
- Chavez, A., et al. Comparison of Cas9 activators in multiple species. Nature Methods. 13 (7), 563-567 (2016).
- Zhou, H., et al. In vivo simultaneous transcriptional activation of multiple genes in the brain using CRISPR-dCas9-activator transgenic mice. Nature Neuroscience. 21 (3), 440-446 (2018).
- Tanenbaum, M. E., Gilbert, L. A., Qi, L. S., Weissman, J. S., Vale, R. D. A protein-tagging system for signal amplification in gene expression and fluorescence imaging. Cell. 159 (3), 635-646 (2014).
- Konermann, S., et al. Genome-scale transcriptional activation by an engineered CRISPR-Cas9 complex. Nature. 517 (7536), 583-588 (2015).
- Holtzman, L., Gersbach, C. A. Editing the Epigenome: Reshaping the Genomic Landscape. Annual Review of Genomics and Human Genetics. , (2018).
- Perez-Pinera, P., et al. Synergistic and tunable human gene activation by combinations of synthetic transcription factors. Nature Methods. 10 (3), 239-242 (2013).
- Thakore, P. I., et al. Highly specific epigenome editing by CRISPR-Cas9 repressors for silencing of distal regulatory elements. Nature Methods. 12 (12), 1143-1149 (2015).
- Amabile, A., et al. Inheritable Silencing of Endogenous Genes by Hit-and-Run Targeted Epigenetic Editing. Cell. 167 (1), 219-232 (2016).
- Liu, X. S., et al. Editing DNA Methylation in the Mammalian Genome. Cell. 167 (1), 233-247 (2016).
- McDonald, J. I., et al. Reprogrammable CRISPR/Cas9-based system for inducing site-specific DNA methylation. Biology Open. 5 (6), 866-874 (2016).
- Huang, Y. H., et al. DNA epigenome editing using CRISPR-Cas SunTag-directed DNMT3A. Genome Biology. 18 (1), 176(2017).
- Vojta, A., et al. Repurposing the CRISPR-Cas9 system for targeted DNA methylation. Nucleic Acids Research. 44 (12), 5615-5628 (2016).
- Razin, A., Kantor, B. DNA methylation in epigenetic control of gene expression. Progress in Molecular and Subcellular Biology. 38, 151-167 (2005).
- Kantor, B., Ma, H., Webster-Cyriaque, J., Monahan, P. E., Kafri, T. Epigenetic activation of unintegrated HIV-1 genomes by gut-associated short chain fatty acids and its implications for HIV infection. Proceedings of the National Academy of Sciences of the United States of America. 106 (44), 18786-18791 (2009).
- Kantor, B., et al. Downregulation of SNCA Expression by Targeted Editing of DNA Methylation: A Potential Strategy for Precision Therapy in PD. Molecular Therapy. , (2018).
- Jowaed, A., Schmitt, I., Kaut, O., Wullner, U. Methylation regulates alpha-synuclein expression and is decreased in Parkinson's disease patients' brains. Journal of Neuroscience. 30 (18), 6355-6359 (2010).
- Wang, Y., et al. A DNA methyltransferase inhibitor, 5-aza-2'-deoxycytidine, exacerbates neurotoxicity and upregulates Parkinson's disease-related genes in dopaminergic neurons. CNS Neuroscience & Therapeutics. 19 (3), 183-190 (2013).
- Matsumoto, L., et al. CpG demethylation enhances alpha-synuclein expression and affects the pathogenesis of Parkinson's disease. PLOS One. 5 (11), e15522(2010).
- Desplats, P., et al. Alpha-synuclein sequesters Dnmt1 from the nucleus: a novel mechanism for epigenetic alterations in Lewy body diseases. Journal of Biological Chemistry. 286 (11), 9031-9037 (2011).
- Ai, S. X., et al. Hypomethylation of SNCA in blood of patients with sporadic Parkinson's disease. Journal of the Neurological Sciences. 337 (1-2), 123-128 (2014).
- Tagliafierro, L., Chiba-Falek, O. Up-regulation of SNCA gene expression: implications to synucleinopathies. Neurogenetics. 17 (3), 145-157 (2016).
- Ortinski, P. I., O’Donovan, B., Dong, X., Kantor, B. Integrase-Deficient Lentiviral Vector as an All-in-One Platform for Highly Efficient CRISPR/Cas9-Mediated Gene Editing. Molecular Therapy - Methods & Clinical Development. 5, 153-164 (2017).
- Tagliafierro, L., et al. Genetic analysis of alpha-synuclein 3' untranslated region and its corresponding microRNAs in relation to Parkinson's disease compared to dementia with Lewy bodies. Alzheimer’s & Dementia. 13 (11), 1237-1250 (2017).
- Tagliafierro, L., Zamora, M. E., Chiba-Falek, O. Multiplication of the SNCA locus exacerbates neuronal nuclear aging. Human Molecular Genetics. , (2018).
- Kantor, B., McCown, T., Leone, P., Gray, S. J. Clinical applications involving CNS gene transfer. Advances in Genetics. 87, 71-124 (2014).
- Kantor, B., Bailey, R. M., Wimberly, K., Kalburgi, S. N., Gray, S. J. Methods for gene transfer to the central nervous system. Advances in Genetics. 87, 125-197 (2014).
- Vijayraghavan, S., Kantor, B. A Protocol for the Production of Integrase-deficient Lentiviral Vectors for CRISPR/Cas9-mediated Gene Knockout in Dividing Cells. Journal of Visualized Experiments. (130), e56915(2017).
- Bayer, M., et al. A large U3 deletion causes increased in vivo expression from a nonintegrating lentiviral vector. Molecular Therapy. 16 (12), 1968-1976 (2008).
- Bassil, C. F., Huang, Z., Murphy, S. K. Bisulfite pyrosequencing. Methods in Molecular Biology. 1049, 95-107 (2013).
- Truong, D. J., et al. Development of an intein-mediated split-Cas9 system for gene therapy. Nucleic Acids Research. 43 (13), 6450-6458 (2015).
- Nishimasu, H., et al. Crystal Structure of Staphylococcus aureus Cas9. Cell. 162 (5), 1113-1126 (2015).
- Ran, F. A., et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 520 (7546), 186-191 (2015).
- Van Lint, C., Ghysdael, J., Paras, P., Burny, A., Verdin, E. A transcriptional regulatory element is associated with a nuclease-hypersensitive site in the pol gene of human immunodeficiency virus type 1. Journal of Virology. 68 (4), 2632-2648 (1994).
- Van Lint, C., et al. Transcription factor binding sites downstream of the human immunodeficiency virus type 1 transcription start site are important for virus infectivity. Journal of Virology. 71 (8), 6113-6127 (1997).
- Goffin, V., et al. Transcription factor binding sites in the pol gene intragenic regulatory region of HIV-1 are important for virus infectivity. Nucleic Acids Research. 33 (13), 4285-4310 (2005).
- Kim, Y. S., et al. Artificial zinc finger fusions targeting Sp1-binding sites and the trans-activator-responsive element potently repress transcription and replication of HIV-1. Journal of Biological Chemistry. 280 (22), 21545-21552 (2005).
- Kantor, B., et al. Notable reduction in illegitimate integration mediated by a PPT-deleted, nonintegrating lentiviral vector. Molecular Therapy. 19 (3), 547-556 (2011).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır