Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Genomlarda (TILLING) küçük tahıl bitkilerinin etil methanesulfonate Mutagenezinde kaynaklı lokal lezyonların hedeflemesinin geliştirilmesi
Bu Makalede
Özet
Açıklanan bir mutajen olarak etil methanesulfonate (EMS) kullanımı ile küçük tahıl bitkileri nüfus (TILLING) nüfusun hedefleme kaynaklı yerel lezyonlar geliştirmek için bir protokoldür. Ayrıca sağlanan cel-1 tahlil kullanarak mutasyon algılama için bir protokoldür.
Özet
Genomlarda indüklenen yerel lezyonlar hedefleme (Tilling) kimyasal mutagenez ve hedef genlerde sıra varyasyonu tespiti içeren güçlü bir ters genetik araçtır. TILLING, özellikle dönüşüm tabanlı yaklaşımların ciddi sınırlamalar tutacağı küçük tahıllarda gen doğrulama için son derece değerli işlevsel bir genomik aracıdır. Sağlam bir mutajize nüfus geliştirmek, bir TILLING bazlı gen doğrulama çalışmasının verimliliğini belirlemenin anahtarıdır. Düşük bir genel mutasyon frekansına sahip bir toprak popülasyon, istenilen mutasyonları bulmak için pratik olmayan büyük bir nüfusun taranması gerektiğini gösterir, ancak yüksek mutajen konsantrasyonu nüfusun yüksek mortaliteye yol açmasına karşın, yetersiz bir mutajize edilen bireylerin sayısı. Etkili bir nüfus geliştirildikten sonra, ilgi bir geni içinde mutasyonları algılamak için birden fazla yol vardır ve platform seçimi, kaynakların deneysel ölçekte ve kullanılabilirliği üzerine bağlıdır. Cel-1 tahlil ve mutant tanımlama için agaroz jel tabanlı yaklaşım, uygun, reproducible ve daha az kaynak yoğun bir platformdur. Bu basit, hiçbir Hesaplamalı bilgi gerektiren, ve özellikle temel Laboratuar donanımları ile genlerin az sayıda doğrulama için uygundur avantajlıdır. Bu yazıda, açıklanan iyi bir Tilling nüfusun geliştirilmesi için yöntemler, doz eğrisi hazırlanması dahil, mutagenez ve mutant nüfusun bakımı, ve mutant nüfusun tarama PCR tabanlı cel-1 tahlil kullanarak .
Giriş
Genomlarda nokta mutasyonları araştırmacılar için birçok yararlı amaca hizmet edebilir. Kendi doğası ve konuma bağlı olarak, Bu mutasyonlar genler ve hatta ilgi proteinlerinin farklı etki alanları için işlevler atamak için kullanılabilir. Öte yandan, yeni genetik varyasyonun kaynağı olarak, fenotipleme ekranları kullanılarak istenilen özellikler için yararlı mutasyonlar seçilebilir ve daha fazla ürün iyileştirmesinde kullanılır. Tilling, kimyasal mutagenez ve hedef geni sıralı varyasyon tespiti içeren güçlü bir ters genetik araçtır. İlk Arabidopsis1 ve drosophilia melanogaster2' de geliştirilen, eğme nüfusu geliştirilen ve Hexaploid ekmek buğday (Triticum aestivum) gibi birçok küçük tahıl bitkileri kullanılan3, arpa (Hordeum vulgare)4, tetraploidlerin durum buğday (t. Triticumdicoccoides durum)5, diploid buğday (t. bağlantılar)6 ve buğday aegilops tauschii7 "D" genom progenitör . Bu kaynaklar Abiotik ve biyotik stres toleransı8düzenleyen genlerin rollerini doğrulamak için kullanılan, çiçekli zaman düzenleyen9, ve beslenme üstün ürün çeşitleri geliştirmek5.
Eğriltme, etil methanesulfonate (EMS), sodyum azid, n-metil-n-nitrosourea (MNU) ve metil methanesulfonate (MMS) gibi alkilleyici mutajenik ajanlar kullanımı ile birlikte, çeşitli nedenlerle diğer ters genetik araçlar üzerinde avantajları vardır. İlk olarak, mutagenez neredeyse herhangi bir tür veya tesis10 çeşitli yapılabilir ve dönüşüm darboğazından bağımsızdır, özellikle küçük tahıllar durumunda zorlu11. İkincisi, diğer gen doğrulama yaklaşımlar tarafından elde edilebilir nakavt mutasyonlar üreten ek olarak, yanlış ve yapıştırma mutasyonlar bir dizi indüklenen olabilir, hangi faiz proteinlerinin bireysel etki fonksiyonları ayırt edebilir12. Ayrıca, TILLING genom boyunca mutasyonlar ölümsüz bir koleksiyon üretir; Böylece, tek bir nüfus birden fazla genlerin işlevsel doğrulama için kullanılabilir. Buna karşılık, diğer ters genetik Araçları çalışma13altında sadece geni spesifik kaynaklar üretir. TILLING ile tanımlanan yararlı mutasyonlar üreme amaçları için dağıtılabilir ve transjenik olmayan sınıflandırma birçok ülkede hala belirsiz olan gen düzenlemesinin aksine yönetmeliğe tabi değildir. Bu, özellikle uluslararası işlem gören küçük taneler ile ilgilidir14.
TILLING basit ve verimli bir gen doğrulama stratejisidir ve ilgi genlerini araştırmak için mutagenized nüfusun geliştirilmesini gerektirir. Etkili bir mutajize nüfus geliştirmek, bir TILLING bazlı gen doğrulama çalışmasının verimliliğini belirlemenin anahtarıdır. Düşük genel mutasyon frekansına sahip bir eğme nüfusu, istenilen mutasyonlar için pratik olmayan büyük bir nüfusun gösterildiğini gösterir, ancak yüksek mutajen konsantrasyonu nüfusun yüksek mortaliteye yol açan ve yetersiz sayıda mutajize bireyler. İyi bir nüfus geliştirdikten sonra, ilgi genlerinde mutasyonları algılamak için birden fazla yol vardır ve platform seçimi, kaynakların deneysel ölçekte ve kullanılabilirliği üzerine bağlıdır. Tüm genom sıralamaları ve ekzom sıralaması, küçük genomlar15,16ile bitkilerin içinde yer alan tüm mutasyonları karakterize etmek için kullanılmıştır. Ekmek ve durum buğday ve arzu mutasyonlar tanımlamak ve ilgi mutant hatları sipariş için kamu için kullanılabilir iki TILLING nüfus exome sıralamaları yapılmıştır17. Bu arzu mutasyonların kullanılabilirliği açısından büyük bir kamu kaynağıdır; Ancak, gen doğrulama çalışmalarında, vahşi tip hattı faiz aday geni sahip olmalıdır. Ne yazık ki, hala maliyet-başka bir arka planda birkaç aday genlerin ters genetik tabanlı doğrulama için tüm Tilling nüfusun ekzom dizisi için yasak. Amplicon sıralaması ve cel-1 tabanlı bilgiler, buğday içinde hedeflenen nüfuslarda mutasyonları tespit etmek için kullanılmıştır ve cel-1 uygulamaları basit, hiçbir Hesaplamalı bilgi gerektiren, ve özellikle temel ile genlerin az sayıda doğrulama için uygundur Laboratuar Ekipmanları6,18.
Bu yazıda, açıklanan iyi bir Tilling nüfus gelişimi için yöntemler, doz eğrisi hazırlanması dahil, mutagenez ve mutant nüfusun bakımı, ve mutant nüfusun tarama PCR tabanlı cel-1 tahlil kullanarak . Bu protokol zaten gelişen ve Triticum aestivum, Triticum monoccocum6, arpa, aegilops tauchii7ve çeşitli mutagenized nüfusu kullanan başarıyla uygulandı Diğer. Dahil bu yöntemlerin açık detayları ile birlikte araştırmacılar, seçim herhangi bir küçük tahıl bitkisinde bir mutajen olarak EMS kullanarak TILLING nüfus geliştirmek yardımcı olacaktır yararlı ipuçları vardır.
Protokol
1. etkili mutagenez için dozaj eğrisi hazırlanması
- 6 250 ml cam flsorlara (her Flask içinde 100) olan 50 ml distile su içeren ilgi genotip ile 100 tohumları ıslatın. Tohum tarafından imbiyon için oda sıcaklığında (RT) 8 h için 100 RPM at sallamak.
- Bir duman kaput, hazırlamak 50 mL 0,4%, 0,6%, 0,8%, 1,0%, ve 1,2% (w/v) etil methanesulfonate (EMS) çözelti tarafından 0,167, 0,249, 0,331, 0,415, ve 0,498 mL distile su içinde EMS, sırasıyla.
Not: EMS 1,206 g/mL yoğunluğu ile RT sıvı olduğunu.
DIKKAT: EMS kullanırken uygun kişisel koruyucu ekipman (PPE) kullanın. - Beş flsorun dışında su decant ve eklemek 50 her Flask içinde EMS çözüm mL% 0,0,% 0,4,% 0,6, 0,8%, 1,0% ile altı farklı tedaviler var böylece imbibed tohum içeren, ve 1,2% EMS çözüm. 75 rpm ve RT 'de 16 h için Shake şişeler.
- EMS çözeltisi decant ve peynir bezi kullanarak her tedavi için ayrı olarak tedavi tohum toplamak. EMS-devre dışı çözüm (0,1 M NaOH, 20% w/v na2S2O3) için 24 h bir hacim ekleyerek kullanılan EMS çözümünü inactivate. Ayrıca, kontamine olan flsorlar ve Pipet uçları için EMS-inaktivasyonu çözeltisi ile 24 saat tedavi edin.
- 2 h için musluk suyu çalışan altında EMS-tedavi tohumlar yıkayın. her tohumu, çömlekçilik topraklarını içeren kök eğitmenler halinde tek başına nakletme.
- 16 h ışık döneminde 20 – 25 °C ' de bitkiler büyütün.
- 15 günlük transplantasyondan sonra bitkinin hayatta kalması hakkında veri kaydedin. Her tedavi için hayatta kalma oranını hesaplamak için aşağıdaki denklemi kullanın:
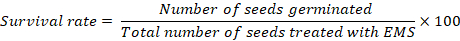
Not: çimlenme oranı kontrollerde% 100 ' den düşük ise, tüm tedavilerin doğru hayatta kalma oranları denetimlerde çimlenme başarısız tohum sayısını çıkararak hesaplanmalıdır. Etkili Mutagenezi için% 40 –% 60 ' lık bir hayatta kalma oranı arzu edilir. % 40-% 60 ' lık arzu edilen insellik oranı elde edene kadar işlenmiş tohumların hayatta kalma göre değiştirilmiş bir konsantrasyon ile doz optimizasyonu ikinci bir tur gerçekleştirmek için gerekli olabilir.
2. mutagenesis ve mutant nüfusun Bakımı
- 300 mL distile su içeren 5 1.000 mL flsorlarda eşit olarak bölünmüş en az 3.000 tohumları (600 tohum her) son toplu emmek. Imbiyon için RT altında 100 RPM 'de 8 h için sallamak.
Not: arzu edilen nüfusun son boyutu genotipin mutasyon sıklığı ve ploidye düzeyine bağlı olacaktır, ancak hexaploids için en az 3.000 tohum, tetraploids için 4.000 tohum ve diploids için 7.000 ' den fazla tohum kullanmak tavsiye edilir. - Bir duman kaputu, damıtılmış suda optimum EMS konsantrasyon çözeltisi 1.500 mL hazırlayın.
- Şişeler su dışarı decant ve 600 imbibed tohumları içeren her Flask EMS çözüm optimum konsantrasyon 300 ml ekleyin. 75 rpm ve RT 16 h için şişeler sallamak.
- EMS decant ve peynir bezi tedavi tohum toplamak. EMS solüsyonu ve tedavi konteynerleri, 1,4 adımda yapılan EMS-inaktivasyonu çözeltisi ile inactivate.
- 2 saat için musluk suyu çalışan altında EMS-tedavi tohumları yıkayın. her EMS-tedavi M1 tohum bireysel kök eğitmenler içine nakli.
- M1 bitkileri (m0 tohumları türetilmiştir) 20 – 25 °c ' de 16 h ışık döneminde büyütün.
Not: Bu iki yaprak aşamasında fide vernalize etmek için gerekli olabilir 6 hafta 4 °c, Eğer ilgi genotip bir kış tipi büyüme alışkanlığı varsa. - M1 tesislerin kendi kendine polekması için izin verin ve her verimli m1 fabrikası için m2 tohumları ayrı olarak hasat etme.
Not: potansiyel outcrossing şansını önlemek Için, anthesis önce pollinasyon torbaları ile M1 bitkiler sivri kapak. - Genetik artıklığı önlemek için her M1 Plant tek bir m2 tohum bitki.
- M2 bitkiler iki yaprak aşamasında doku toplamak 1,1 ml racked 96 iyi microtubes. Her bitkinin yaklaşık 80 mm yaprak dokusunu toplayın ve her bir numunenin KIMLIĞINI bir doku toplama planında kaydedin.
- Bir kurutucu kullanarak yaprak dokusunu dondurup kurutun-80 °c ' de saklayın.
- M2 tesislerinin 20 – 25 °c ' de 16 h ışık döneminde olmasını sağlayın.
- M2 tesislerinin mutant fenotipleri üzerinde düzenli aralıklarla veri kaydedin. Beklenen fenotipleri Albino, chlorina, çimenli ateş, varisi, kısmen bereketli, steril, vb.
- M2 bitkiler kendini döllemek ve olgun izin verin. M2 tesislerinin m3 tohumlarını ayrı olarak hasat edin ve saklayın (Şekil 1).
Not: M tohumları ters genetik çalışmalarda fenotip doğrulamak için kullanılır. Bu nedenle, M dikkatle kataloglanmış ve serin ve kuru koşullarda depolanmalıdır. Alternatif olarak, tohum alanında artırılmalıdır, baş satırlar her M bitki için dikilebilir ve her satırdan M tohumları hasat ve ayrı olarak TILLING nüfus kaynağı olarak kaydedilebilir.
Mutantların genetik karakterizasyonu için 3. cel-1 tahlil
- Bir DNA arıtma sistemi ile bir bitki DNA ekstraksiyon kiti kullanarak M2 yaprak dokusundan DNA ayıklamak ( malzeme tablosunabakın) üreticinin önerileri takip.
- Spektrofotometreyi kullanarak DNA 'yı ölçün ve 96 iyi bloklarda nükleücretsiz su ile 25 ng/μL 'ye DNA konsantrasyonlarını Normalleştir.
Not: bir jel üzerinde çalıştırarak DNA kalitesini kontrol etmek önemlidir, gibi düşük kaliteli DNA (bulaşmış DNA) havuzlanmış örneklerinde yanlış negatiflere neden olabilir. - Her örnek satır ve sütun kimliğini korurken, bir plaka içine 4 96 iyi blokları DNA birleştirerek 4X DNA havuzları oluşturun. Her bir örnekten havuz plakasına 50 μL DNA ekleyin, böylece her havuz plakası dört farklı 96 iyi bloktan toplam 200 μL DNA içerir.
- Havuza alınan DNA 'nın kimliğini Havuz plakası satır sütunu biçiminde kataloglar (örn. havuz 1 a1 = Box1A1 + Box2A1 + Box3A1 + Box4A1).
- Genom özgül astar (GSP) sayfası < https://probes.pw.usda.gov/GSP > polyploid türler için varsayılan ayarlarla ilgi geni için genom özel astar [a1] tasarlayın. Diplomlarda, varsayılan ayarları kullanarak astar tasarlamak için primer 3 < http://primer3.UT.ee/> kullanın. Gerekirse, ilgi geni tüm kodlama bölgesini kapsayacak şekilde, birden fazla astar tasarımı.
Not: son IWGSC montaj URGI BLAST aracı kullanarak buğday ilgi geni için dizileri elde etmek için kullanılabilir < https://wheat-urgi.versailles.inra.fr/Seq-Repository/BLAST >. Optimum amplikon uzunluğu 800 – 1500 BP aralığında. Tablo 1 hexaploid buğday balmumu genler için astar örnekleri gösterir. - Havuz DNA 'sında gen spesifik astar için bir PCR çalıştırın:
- 5 μL PCR tampon, 2 μL (her biri) 4 μM ileri ve ters astar, 0,1 μL DNA polimeraz (bkz. malzeme tablosu), 5 μL havuza alınmış DNA şablonu, sonra hacmini 25 μL 'e kadar çekirdeksiz su ile artırın.
- PCR reaksiyonu aşağıdaki gibi bir termal bisikletçi üzerinde çalıştırmak için bir dokunma aşağı profil kullanın: 95 °C 1 dakika, 1 dakika için 95 °C 7 döngü, 1 dakika için 67 °C-60 °C sıcaklık azalır ve 2 dakika için 72 ° c, döngü başına 1 °C , ardından 1 dakika için 95 °C 30 döngü, 1 dakika için 60 °C, 2 dakika için 72 °C ve 7 dakika için 72 °C ' de son uzatma.
Not: Yukarıdaki PCR profili, astar 3 varsayılan ayarları kullanılarak tasarlanan astar çoğu için buğday DNA şablonu üzerinde çalışır. Spesifik olmayan amplifikasyon durumunda, bir sonraki adımlara geçmeden önce PCR profili sıkı yapılmalıdır.
- Aşağıdaki gibi profil kullanarak termal bisikletçi PCR ürünleri inkükleyici tarafından uyumsuz DNA arasında heteroduplexes oluşturun: 95 °C 2 dakika, 5 döngü için 95 °C 1 s, 95 °C için 85 °C sıcaklık azalır 1 dakika döngüsü başına 2 °C, ve 60 döngüsü ile 25 °c döngüsü başına 1 °C azalır.
- 2,5, heteroduplexed PCR ürünlerine ev yapımı cel-1 endonükleaz μL ekleyin ve 45 °c ' de 45 dakika boyunca kuluçk yapın. 2,5 μL 0,5 M EDTA (pH 8,0) ekleyerek cel-1 reaksiyonu sonlandırın.
Not: cel-1 endonükleaz Till ve al.19 tarafından gerçekleştirilen protokol kullanılarak taze kereviz sapları ayıklanabilir daha önce karakterize mutantlar kullanılarak test edilebilir cel-1 endonükleaz, aktivite ve optimum miktarda test etmek çok önemlidir veya ticari olarak kullanılabilen bir mutasyon algılama kiti. - 100 V 'de 2,5 h için% 3,0 agaroz jel üzerinde cel-1 tedavi edilen ürünleri çalıştırın. Tam uzunlukta uncleaved bantları ek olarak, küçük ve benzersiz parçalanabilen Band (ler) içeren kuyular, mutant DNA örneği içerir.
- Denconvolute mutant havuzları.
- Adım 3,9 ' de tanımlanan mutant havuzlarını oluşturan bireysel M2 DNA örnekleri için 3,6, 3,7, 3,8 ve 3,9 adımları izleyin.
- Mutantların ziggolarını belirlemek için, bireysel M2 DNA 'sı için iki PCR (adım 3,6 ' de açıklandığı gibi) çalıştırın, ilk reaksiyon 2,5 μL m2 DNA ve 2,5 ΜL vahşi tip DNA içerir ve Ikinci reaksiyon sadece 5 μL m2 DNA içerir. Mutasyon heterozygous ise, her iki reaksiyonda ek bir parçalanabilen bandı mevcut olacaktır. Diğer taraftan, mutant homozygous ise ek parçalanabilen bantları sadece ilk reaksiyon içinde bulunacaktır.
- Mutasyonun doğasını belirlemek için, onaylı mutantların PCR ürünlerini üreticinin talimatlarını takiben bir Sanger sıralama platformu kullanarak sıralayın.
4. mutasyon frekansının hesaplanması
Not: bir TILLING nüfusunun mutasyon frekansı, bir mutasyonun bu nüfusun bireylerde oluştuğu ortalama fiziksel mesafeyi ifade eder. Örneğin, bir TILLING popülasyonunda 1/35 KB 'lik bir mutasyon sıklığı, bu nüfusun ortalama bir bireyin genomda her 35 KB başına 1 mutasyona sahip olduğu anlamına gelir.
- Bir eğme nüfusunun mutasyon sıklığını belirlemek için, toplam baz sayısını hesaplayın.
- Ekranlaştırılmış toplam baz sayısını hesaplamak için PCR ürün boyutunu, toplam kişi sayısı ile çarpın.
- Verilen TILLING nüfusu 1 mutasyon sahip fiziksel bölge verecektir aşağıdaki denklem kullanılarak gözlenen benzersiz mutasyonlar sayısı ile ekran baz toplam sayısını Böl:
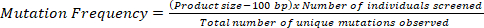
Not: bir agaroz jel tabanlı platforma dayalı her iki ucunda 50 BP çözünürlüğünde sınırlama için hesap için, hesaplamadaki ürün boyutundan 100 BP çıkarın.
Sonuçlar
Şekil 2 hexaploid ekmek buğday organtivar dozaj eğrisi gösterir Jagger, diploid buğday Triticum monokokum6, ve buğday aegilops tauschii7bir genom donör. EMS dozlarda istenen 50% hayatta kalma oranları yaklaşık% 0,25,% 0,6 ve% 0,7 t. bağlantılar, AE. tauschiive t. aestivumiçin sırasıyla. Hexaploid buğday yüksek EMS toleransı, genom tampon kapasitesi n...
Tartışmalar
TILLING, özellikle dönüşüm tabanlı yaklaşımların ciddi darboğazlara sahip olduğu küçük tahıllar için gen doğrulama için son derece değerli bir tersgenetik araçtır. Yüksek mutasyon frekansı ile mutajize edilmiş bir nüfus geliştirmek fonksiyonel genomik etütler yürütmenin önemli adımlardan biridir. Güçlü bir TILLING nüfus geliştirme en önemli adım EMS optimum konsantrasyon belirlemektir. M1 ' de% 40-60% hayatta kalma oranı, buğday ve arpa
Açıklamalar
Yazarlar hiçbir rakip mali ilgi bildirir.
Teşekkürler
Bu çalışma USDA Ulusal Gıda ve Tarım Enstitüsü, Hatch proje 1016879 ve Maryland tarım deney Istasyonu tarafından MAES Grant No 2956952 tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96 well 1.1 ml microtubes in microracks | National Scientific | TN0946-08R | For collecting leaf tissues |
| Agarose I biotechnology grade | VWR | 0710-500G | |
| Biosprint 96 DNA Plant Kit | Qiagen | 941558 | Kit for DNA extraction |
| Cel-1 endonuclease | Extracted as described by Till et al 2006 | Single strand specific endonuclease | |
| Centrifuge 5430 R | Eppendorf | ||
| Ethyl methanesulfonate | Sigma Aldrich | M-0880-25G | EMS, Chemical mutagen |
| Freeze Dry/Shell freeze system | Labconco | For lyophilization of leaf tissue | |
| Kingfisher Flex purification system | Thermo fisher scientific | 5400610 | High throughput DNA extraction robot |
| My Taq DNA Polymerase | Bioline | BIO-21107 | |
| Nuclease free water | Sigma aldrich | W4502-1L | |
| NuGenius gel imaging system | Syngene | ||
| Orbit Environ-shaker | Lab-line | ||
| SPECTROstar Nano | BMG LABTECH | Nano drop for DNA quantification | |
| T100 Thermal cycler | BIO-RAD | 1861096 |
Referanslar
- McCallum, C. M., Comai, L., Greene, E. A., Henikoff, S. Targeted screening for induced mutations. Nature Biotechnology. 18 (4), 455-457 (2000).
- Bentley, A., MacLennan, B., Calvo, J., Dearolf, C. R. Targeted Recovery of Mutations in Drosophila. Genetics. 156 (3), 1169-1173 (2000).
- Tsai, H., et al. Discovery of Rare Mutations in Populations: TILLING by Sequencing. Plant Physiology. 156 (3), 1257-1268 (2011).
- Caldwell, D. G., et al. A structured mutant population for forward and reverse genetics in Barley (Hordeum vulgare L.). The Plant Journal. 40 (1), 143-150 (2004).
- Hazard, B., et al. Induced Mutations in the Starch Branching Enzyme II ( SBEII ) Genes Increase Amylose and Resistant Starch Content in Durum Wheat. Crop Science. 52 (4), 1754-1766 (2012).
- Rawat, N., et al. A diploid wheat TILLING resource for wheat functional genomics. BMC Plant Biology. 12, 205 (2012).
- Rawat, N., et al. TILL-D: An Aegilops tauschii TILLING Resource for Wheat Improvement. Frontiers in Plant Science. 9, (2018).
- Rawat, N., et al. Wheat Fhb1 encodes a chimeric lectin with agglutinin domains and a pore-forming toxin-like domain conferring resistance to Fusarium head blight. Nature Genetics. 48 (12), 1576-1580 (2016).
- Kippes, N., Chen, A., Zhang, X., Lukaszewski, A. J., Dubcovsky, J. Development and characterization of a spring hexaploid wheat line with no functional VRN2 genes. Theoretical and Applied Genetics. 129 (7), 1417-1428 (2016).
- Greene, E. A., et al. Spectrum of Chemically Induced Mutations From a Large-Scale Reverse-Genetic Screen in Arabidopsis. Genetics. 164 (2), 731-740 (2003).
- Harwood, W. A. Advances and remaining challenges in the transformation of barley and wheat. Journal of Experimental Botany. 63 (5), 1791-1798 (2012).
- Henikoff, S., Comai, L. Single-Nucleotide Mutations for Plant Functional Genomics. Annual Review of Plant Biology. 54 (1), 375-401 (2003).
- Uauy, C., et al. A modified TILLING approach to detect induced mutations in tetraploid and hexaploid wheat. BMC Plant Biology. 9 (1), 115 (2009).
- Uauy, C., Wulff, B. B. H., Dubcovsky, J. Combining Traditional Mutagenesis with New High-Throughput Sequencing and Genome Editing to Reveal Hidden Variation in Polyploid Wheat. Annual Review of Genetics. 51 (1), 435-454 (2017).
- Li, G., et al. The Sequences of 1504 Mutants in the Model Rice Variety Kitaake Facilitate Rapid Functional Genomic Studies. The Plant Cell. 29 (6), 1218-1231 (2017).
- Jiao, Y., et al. A Sorghum Mutant Resource as an Efficient Platform for Gene Discovery in Grasses. The Plant Cell. 28 (7), 1551-1562 (2016).
- Krasileva, K. V., et al. Uncovering hidden variation in polyploid wheat. Proceedings of the National Academy of Sciences. , 201619268 (2017).
- Dong, C., Dalton-Morgan, J., Vincent, K., Sharp, P. A Modified TILLING Method for Wheat Breeding. The Plant Genome. 2 (1), 39-47 (2009).
- Till, B. J., Zerr, T., Comai, L., Henikoff, S. A protocol for TILLING and Ecotilling in plants and animals. Nature Protocols. 1 (5), 2465-2477 (2006).
- Wu, J. -. L., et al. Chemical- and Irradiation-induced Mutants of Indica Rice IR64 for Forward and Reverse Genetics. Plant Molecular Biology. 59 (1), 85-97 (2005).
- Feldman, M., Levy, A. A. Genome Evolution Due to Allopolyploidization in Wheat. Genetics. 192 (3), 763-774 (2012).
- Comai, L. The advantages and disadvantages of being polyploid. Nature Reviews Genetics. 6 (11), 836-846 (2005).
- Guo, H., et al. Development of a High-Efficient Mutation Resource with Phenotypic Variation in Hexaploid Winter Wheat and Identification of Novel Alleles in the TaAGP.L-B1 Gene. Frontiers in Plant Science. 8, (2017).
- Rakszegi, M., et al. Diversity of agronomic and morphological traits in a mutant population of bread wheat studied in the Healthgrain program. Euphytica. 174 (3), 409-421 (2010).
- Tsai, H., Ngo, K., Lieberman, M., Missirian, V., Comai, L. Tilling by Sequencing. Plant Functional Genomics: Methods and Protocols. , 359-380 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır