Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Memeli Hücrelerinde Havuzlu CRISPR Tabanlı Genetik Ekranlar
Bu Makalede
Özet
CRISPR-Cas9 teknolojisi, memeli lerin genomunu herhangi bir hücre tipinde tam olarak dizmek için etkili bir yöntem sağlar ve genom çapında genetik ekranlar gerçekleştirmek için yeni bir araç tır. Havuzlu genom genişliğindeCRISPR-Cas9 ekranlarının başarılı bir şekilde performans alabildikleri adımları tartışan ayrıntılı bir protokol burada verilmiştir.
Özet
CRISPR-Cas sistemini kullanarak genom düzenleme, çeşitli organizmaların genomlarını tam olarak düzenleme yeteneğini büyük ölçüde ilerletmiştir. Memeli hücreleri bağlamında, bu teknoloji fonksiyonel genomik çalışmalar için genom çapında genetik ekranlar gerçekleştirmek için yeni bir araç temsil eder. Tüm açık okuma çerçevelerini hedefleyen kılavuz RNA'ların (sgRNA) kütüphaneleri, gen fonksiyonunu ve hücresel süreçleri bir tarafsız ve sistematik bir şekilde. CRISPR-Cas ekranlar, araştırmacılara hücresel fenotiplerin genetik planlarını ortaya çıkarmak için basit, verimli ve ucuz bir yöntem sunar. Ayrıca, çeşitli hücre hatları ve farklı kanser türlerinde gerçekleştirilen ekranların diferansiyel analizi tümör hücrelerinde bağlamsal olarak gerekli olan genleri belirleyebilir, belirli antikanser tedavileri için potansiyel hedefleri ortaya koymaktadır. İnsan hücrelerinde genom genişliğinde ekranlar yapmak göz korkutucu olabilir, çünkü bu on milyonlarca hücrenin işlenmesini gerektirir ve büyük veri kümelerinin analizini gerektirir. Hücre satırı karakterizasyonu, CRISPR kitaplık konuları ve analiz sırasında CRISPR teknolojisinin sınırlamalarını ve yeteneklerini anlama gibi bu ekranların ayrıntıları genellikle göz ardı edilir. Burada havuzlu genom çapında CRISPR-Cas9 tabanlı ekranların başarılı performans için ayrıntılı bir protokol sağlanmaktadır.
Giriş
CRISPR-Cas, kümelenmiş düzenli olarak aralıklı kısa palindromik tekrarlar ve CRISPR ilişkili nükleaz ın kısaltması, sentetik bir kılavuz RNA (sgRNA) ile kompleks halinde tek bir nükleaz proteininden (örn. Cas9) oluşur. Bu ribonükleoprotein kompleksi Cas9 enzimini hedef alarak belirli bir genomik lokus1'deçift iplikçikli DNA kırıklarına neden olur. Çift iplikli molalar homoloji yönelimli onarım (HDR) veya daha yaygın olarak, homolog olmayan son birleştirme (NHEJ) yoluyla onarılabilir, sık sık gen fonksiyonunu bozan ekleme ve/veya silme (INDELS) ile sonuçlanan hataya açık bir onarım mekanizması 1. CRISPR'ın etkinliği ve basitliği, önceki genom düzenleme teknolojilerini (örneğin, çinko parmak çekirdekleri (ZNF) veya transkripsiyon aktivatör benzeri efektör çekirdekleri aşan daha önce ulaşılmaz bir genomik hedefleme düzeyisağlar ( TALENS), her ikisi de artan tasarım karmaşıklığı muzdarip, düşük transfection verimliliği, ve multipleks gen düzenleme sınırlamaları2].
CRISPR tek kılavuzLu RNA tabanlı genom düzenleme temel araştırma uygulaması bilim adamları verimli ve ucuza bireysel genlerin işlevlerini ve genetik etkileşim ağlarının topoloji sorgulamak için izin verdi. Özellikle RNA paraziti (RNAi) ve gen kapanı mutagenezi gibi daha önceki genetik pertürbasyon teknolojileri ile karşılaştırıldığında, crispr-Cas sisteminin kullanımı yla fonksiyonel genom çapındaki ekranlar gerçekleştirebilme yeteneği büyük ölçüde artırılmıştır. Özellikle, RNAi yüksek off-hedef etkileri ve eksik nakavt muzdarip, CRISPR göre daha düşük duyarlılık ve özgüllük sonuçlanan3,4,5, gen tuzak yöntemleri haploid sadece uygulanabilir iken fonksiyon kaybı ekranlar için hücreler, sorgulanabilir hücre modellerinin kapsamını sınırlayan6. CRISPR'ın tam gen nakavtı üretme yeteneği, mutant fenotipleri sorgulamak için daha biyolojik olarak sağlam bir sistem sağlar, düşük gürültü, minimum hedef dışı etkiler ve reaktifler arasında tutarlı aktivite5. Tüm insan genomunu hedefleyen CRISPR-Cas9 sgRNA kütüphaneleri artık yaygın olarak mevcuttur, tek bir deneyde binlerce gen nakavtının aynı anda üretilmesine izinverir 3,7,8,9 .
Toronto Knock-out (TKO) kütüphaneleri (Addgene aracılığıyla temin edilebilir) adı verilen ve yüksek çözünürlüklü genomik ekranları kolaylaştırmak için kompakt ve dizi optimize edilmiş benzersiz CRISPR-Cas9 genom çapındaki sgRNA lentiviral kütüphaneler geliştirdik. En son kütüphane, TKOv3, hedef ~ 18,000 insan protein kodlama genleri ile 71.090 kılavuzları ampirik veri10kullanarak düzenleme verimliliği için optimize edilmiştir. Buna ek olarak, TKOv3 tek bileşenli bir kütüphane olarak kullanılabilir (LCV2::TKOv3, Addgene ID #90294) tek bir vektör üzerinde Cas9 ve sgRNA'ları ifade ederek, geniş bir yelpazede genom çapında nakavt sağlayan, kararlı Cas9 ifade eden hücreler üretme ihtiyacını hafifleterek memeli hücre tipleri. TKOv3 cas9 olmadan bir vektör de mevcuttur (pLCKO2::TKOv3, Addgene ID # 125517) ve Cas911ifade hücrelerde kullanılabilir.
Genom çapında crispr-Cas9 düzenlenmiş hücre popülasyonu farklı büyüme koşullarına maruz kalabilir, zaman içinde sgRNA bolluğu yeni nesil sıralama ile ölçülür, izlenebilir genetik hücrelerin terk veya zenginleşmesi değerlendirmek için bir okuma sağlayan tedirginlikler. CRISPR nakavt kütüphaneleri, tedirginlik üzerine hücresel fitness bozukluklarına, orta derecede ilaç duyarlılığına (örneğin, hassas veya dirençli genler) neden olan, protein ekspresyonunu (örn. muhabir) düzenleyen veya belirli bir yol fonksiyonu ve hücresel durum12,13,14. Örneğin, bir kanser hücresi hattında diferansiyel fitness ekranları hem tükenmesi veya onkogenlerin azaltılması ve zenginleştirme veya tümör bastırıcıgenler genlerin bir artış tespit edebilirsiniz3,14,15. Benzer şekilde, terapötik ilaçların ara dozlarda kullanarak hem ilaç direnci ve duyarlılık genleri ortaya çıkarabilir16,17.
Burada verilen genom ölçekli CRISPR-Cas9 fonksiyon kaybı tarama için ayrıntılı bir tarama protokolü Toronto Knock-out kütüphaneleri kullanarak (TKOv1 veya v3) kütüphane nesil memeli hücrelerde, veri analizi için tarama performansı. Bu protokol Toronto Knock-out kitaplıkları kullanılarak tarama için optimize edilmiş olsa da, uygulanabilir ve tüm CRISPR sgRNA havuzlu kütüphaneler için ölçeklenebilir hale.
Protokol
Aşağıda özetlenen deneyler, enstitünün Çevre Sağlığı ve Güvenliği Ofisi yönergelerine uymalıdır.
1. Havuzlu CRISPR sgRNA lentiviral kütüphane plazmid amplifikasyon
- Hazır CRISPR sgRNA plazmid DNA kitaplığını TE'de 50 ng/μL'ye seyreltin (örn. TKOv3).
- Elektro-yetersiz hücreleri kullanarak kütüphaneyi elektroporate. Aşağıda açıklandığı gibi toplam dört elektroporasyon reaksiyonu ayarlayın.
- 2 μL 50 ng/μL TKO kitaplığına 25 μL çözülmüş elektroyit hücrelerini önceden soğutulmuş cuvettelere (1,0 mm) buz üzerinde ekleyin.
- Üreticiprotokolü tarafından önerilen optimum ayarları kullanarak elektroporate. Darbenin 10 s içinde, cuvette için Kurtarma Orta (veya SOC orta) 975 μL ekleyin.
- Elektrohaplı hücreleri bir kültür tüpüne aktarın ve 1 mL Kurtarma Ortamı ekleyin. 37 °C'de 1 saat için 250 rpm bir sallayarak inkübatör tüpleri.
- Kitaplığı titretlemek ve dönüşüm verimliliğini tahmin etmek için bir seyreltme plakası ayarlayın.
- 8 mL'lik tüm hücreleri birleştirin ve iyice karıştırın. Havuzlanmış hücrelerin 10 μL'sini 800 kat seyreltme için 990 μL'lik Kurtarma Ortamı'na aktarın ve iyice karıştırın.
- Önceden ısıtılmış 10 cm LB + carbenicillin (100 μg/L) agar plaka üzerine seyreltmenin 20 μL'si. Bu dönüşüm verimliliğini hesaplamak için kullanılacak dönüştürücülerin 40.000 kat seyreltilmesi ile sonuçlanır.
- Toplam 20 önceden ısıtılmış 15 cm LB + carbenicillin agar plakası boyunca her plakaüzerinde kurtarılan hücrelerin plaka400 μL' si. Plakaları 30 °C'de 14-16 h'ye inkübedin.
NOT: Bu düşük sıcaklıktaki büyüme, uzun terminal tekrarları (LTR)18arasındaki rekombinasyon en aza indirir. - Dönüşüm verimliliğini hesaplamak için, 40.000 kat seyreltme plakası üzerindeki koloni lerin sayısını sayın (adım 1.3.2). Tüm plakalarda toplam koloni sayısını elde etmek için 40.000 ile sayılan kolonilerin sayısını çarpın. Toplam koloni sayısı sgRNA başına en az 200x koloniye eşdeğer bir kitaplık kapsamını temsil ediyorsa devam edin (en uygun u500-1000x).
- Örneğin, TKOv3 kütüphanesi (71.090 sgRNA) için en az koloni numarası 1.4 x 107'dirve bu sayı sgRNA başına 200x koloniye eşittir. Koloni temsili yetersizse, minimum kütüphane kapsamını elde etmek için seyreltme plakasındaki kolonilerin sayısına bağlı olarak 1.2.
- Aşağıda açıklandığı gibi kolonileri hasat
- Her 15 cm plaka için, 7 mL LB + carbenicillin (100 μg/L) orta ekleyin, sonra bir hücre yayıcı ile kolonileri kazıyın. 10 mL'lik pipetle, kazınmış hücreleri steril 1 L konik şişeye veya şişeye aktarın.
- Bir kez daha 5 mL LB + carbenicillin orta ile plakayı durulayın ve çözeltiyi şişeye aktarın.
- Tüm tabaklar için 20 tabaktan steril bir şişeye hücreleri bir araya getirin.
- Toplanan hücreleri oda sıcaklığında 1 saat (RT) boyunca bir karıştırma çubuğuyla karıştırarak hücre kümelerini ayırın. Hücreleri önceden tartılmış santrifüj şişelerine ve 7.000 x g'de pelet bakterisine aktarın, sonra da ortamı atın.
- Isliç hücre peletini tartın ve ıslak peletin son ağırlığını belirlemek için santrifüj şişesinin ağırlığını çıkarın. Her sütunun işleyebileceği bakteriyel pelet miktarına bağlı olarak bir maxi veya mega ölçekli plazmid arıtma kiti kullanarak plazmid DNA arındırın.
2. Büyük ölçekli CRISPR sgRNA kütüphane lentivirus üretimi
NOT: Protokolün bu bölümündeki tüm adımlar Sınıf II, Tip A2 biyogüvenlik kabininde bir BSL2+ tesisinde gerçekleştirilir.
- Virüs üretimi için gereken 15 cm plaka sayısını, genellikle 15 cm'lik bir plakadan 18 mL virüs hasat edildiği tahminine göre hesaplayın.
- Hek-293T ambalaj hücrelerini düşük antibiyotikli büyüme ortamlarında (DMEM + %10 FBS + isteğe bağlı: 0,1x kalem/strep) 15 cm'lik plaka başına 8 x 106 hücrede 20 mL'lik ortama tohumlayarak hücreleri transfeksiyona hazırlayın. 37 °C, %5 CO2'debir gecede inkübasyon hücreleri . Kaplamalı hücrelerin %70-%80 oranında aksadığından ve transfeksiyon anında eşit olarak yayıldığından emin olun.
- Ertesi gün, 15 cm plakalar için Tablo 1'de belirtildiği gibi üç transfection plazmid karışımı hazırlayın. Bir transfeksiyon için gerekli plazmid miktarını hesaplayın ve plaka sayısı için plazmidkarışımı yapmak, artı bir transfected olmak.
- Tablo 2'de belirtildiği gibi her transfeksiyon için lipid bazlı transfeksiyon reaktifi hazırlayın. Aliquot, serum ortamını tek tek 1,5 mL mikrosantrifüj tüpe indirgeyerek transfected plaka sayısını azalttı. Transfeksiyon reaktifi ekleyin, hafifçe karıştırın ve RT 5 dakika kuluçka.
- 5 dk inkübasyon dan sonra, transfeksiyon reaktifine bir transfeksiyon reaktifine bir transfeksiyon reaktifi için gerekli DNA miktarını ekleyin. Yavaşça karıştırın ve RT 30 dakika kuluçka.
NOT: Sonraki transfeksiyonlar, zaman ayarı için optimize etmek ve aşırı kuluçkadan kaçınmak için 5 dakika aralıklarla beş veya daha az sethalinde hazırlanabilir. - Kuluçka 30 dakika sonra, dikkatle ambalaj hücrelerinin her plaka her transfection karışımı aktarın. Hücre monolayer rahatsız etmeden dairesel, zikzak hareket içinde 1 mL pipet ucu dropwise kullanarak tüm karışımı ekleyin. 37 °C'de %5 CO2'de18 saat boyunca kuluçka ya.
- Viral hasat ortamı hazırlayın: 500 mL DMEM orta + 32 mL BSA stoku (20 g/100 mL, DMEM'de çözünmüş, 0,22 μm filtre ile sterilize edilmiş) + 5 mL 100x kalem/strep.
- 18 saat sonra, ortam kaldırın (imha dan önce 30 dakika boyunca % 1 sodyum hipoklorit inkübasyon gibi lentivirus atıkların uygun kullanımı kullanın). Her plakaya 18 mL viral hasat ortamı ile hafifçe değiştirin. 37 °C'de %5 CO2'de18 saat boyunca kuluçka ya.
- 24 saat sonra, iyi bir virüs üretiminin bir göstergesi olarak anormal ve erimiş morfoloji için ambalaj hücreleri kontrol edin. Sonra, tüm supernatant toplayarak ve steril konik santrifüj tüp içine transfer lentivirus hasat.
- Virüs içeren medyayı 5 dk için 300 x g'de döndürün ve ambalaj hücrelerini peletleyin. Aliquot pelet rahatsız etmeden steril bir polipropilen tüp içine supernatant.
- Virüsü kısa süreler için 4 °C'de (1 haftadan az) veya uzun süreli depolama için hemen -80 °C'de saklayın. Aliquot büyük ölçekli virüs, donma/çözülmeyi önlemek için uzun süreli depolama için tek kullanım hacimlerine hazırlanır.
3. Tarama için hücre çizgisi karakterizasyonu
- İstenilen hücre satırını seçin.
- Hücrelerin yaklaşık iki katına çıkarma süresini ölçün ve kaydedin.
- Tercih edilen bir doku kültürü damarında (örn. 15 cm doku kültürü plakaları) her 3-4 hücrede bir hücre nin doku kaplamayoğunluğunu belirlemek.
- Puromisin direnç belirteci içeren TKO kütüphanelerinin seçimi için istenilen hücre hattında kullanılacak puromisin konsantrasyonu aşağıdaki gibi belirleyin:
- 72 saat sonra biraraya ulaşmak için gerekli yoğunlukta 12 kuyu plakası tohum hücreleri, daha sonra bir gecede kuluçka (37 °C,% 5 CO2).
- Ertesi gün, 0,5 g/mL'lik artışlarla 0 μg/mL'den 10 g/mL'ye kadar seyreltme püromisin konsantrasyonları içeren bir ortama geçiş. Hücreleri 48 saat kuluçkaya yatırın.
- 48 saat sonra, hücre sayma veya alamarBlue boyama ile hücre canlılığını ölçün.
- 48 h. 4.6 ve 5.2.6 adımlarında CRISPR kitaplığı transduced hücre popülasyonları için seçmek için bu konsantrasyonu kullanın.
NOT: Daha uzun katlama süresine sahip hücre hatları için puromisin ile daha uzun kuluçkalara tolere edilebilir. Bu gibi durumlarda, <3 hücre ikikatına için gerekli kuluçka süresi için öldürme eğrisini belirleyin. Tarama başlamadan önce temel genlerin terk önlemek için seçim için süre en aza indirin.
- Püromisin duyarlılığını ölçmek için kullanılan yöntemle bir doz yanıt eğrisi gerçekleştirerek hücreleri hekaksimethrine bromüre (8 g/mL'ye kadar) duyarlılığı kontrol edin (adım 3.2). Heksadimethrine bromür <8 μg/mL ile toksisite gözlenirse kullanmayın.
4. MOI tayini için havuzlu CRISPR lentivirus kütüphanesinin fonksiyonel titrasyonu
- Havuzlu CRISPR sgRNA kütüphane lentivirus taze bir aliquot çözülme (örneğin, LCV2::TKOv3) ve buz üzerinde tutmak.
- 0-2 mL (yani 0 mL, 0,25 mL, 0,5 mL, 1 mL ve 2 mL) aralığını test etmek için bir dizi virüs hacmi tasarla.
- 72 saat içinde biraraya ulaşmak için gerekli yoğunlukta 15 cm plakalar hedef hücreleri ve tohum hücreleri hasat.
- Test edilecek her virüs hacmi için, yinelenen plakalar hazırlayın. Hücreleri, virüs, hekaksimethrine bromür (8 μg/mL) ve 20 mL'lik son bir sese ortam ekleyin. Plakaları iyice karıştırın, plakaları kuvözde düz bir şekilde oturun ve 24 saat (37 °C, %5 CO2)kuluçkaya yatırın.
- 24 saat sonra, medya içeren virüs kaldırmak ve bertaraf (lentivirus atık ların taşınması için biyogüvenlik önlemleri kullanın). İsteğe bağlı olarak, hafifçe yabancı virüs kaldırmak için sıcak PBS ile plaka yıkayın.
- Her virüs durumu için, bölüm 3 hücreleri öldürmek için belirlenen konsantrasyonu kullanarak puromisin içeren medya 20 mL ile değiştirin, bir çoğaltma plaka. Diğer plaka için, puromisin olmadan taze medya 20 mL ekleyin. 48 saat (37 °C, %5 CO2)için kuluçka makinesi .
- 48 saat sonra, püromisin ile tedavi edilen tüm enfekte olmayan hücrelerin (0 mL virüs durumu) ölü olup olmadığını kontrol edin. Tüm tabakları tek tek hasat edin ve tekrarlanan nazik pipetleme ile hücreleri dağıtın.
- Tüm plakalardan hücreleri sayın ve her virüs hacmi için moi'yi puromisin (yani +/- puromisin) içermeyen hücre sayılarıyla püromisin seçimiyle karşılaştırarak hesaplayın.
- Puromisin seçimi ile %30-40 hücre sağkalımını sağlayan virüs hacmini belirlemek için grafik sonuçları. Aynı doku kültürü koşulları altında ekran sırasında 0.3-0.4 moi elde etmek için bu virüs hacmi kullanın.
5. Primer ekran enfeksiyonu, seçimi ve hücre geçişi
- Ekran boyunca muhafaza edilecek CRISPR sgRNA kitaplık kapsamını seçin (en az 200 kat önerilir).
- Kütüphane kapsamına bağlı olarak, sgRNA başına bu kapsama alanını korumak için gereken hücre sayısını ve MOI 0.3'te(Tablo 3)enfeksiyon için gerekli olan hücre sayısını belirleyin.
- Enfeksiyonu ayarlamak için gereken plaka sayısını belirleyin(Tablo 4).
- CRISPR kitaplığı ile hücreleri enfekte etme
- Hasat hücreleri ve tohum her 15 cm plaka için gerekli hücre numarası.
- Tüm plakalara hexadimethrine bromür (8 g/mL) ekleyin.
- Virüs moi 0.3 için gerekli hacimde tarama ve Kontrol 2 plakaları ekleyin. Denetim 1 için virüs eklemeyin ve bu birimi medyayla değiştirin.
- Plakaları yatırarak iyice karıştırın. Plakaları kuvöze yerleştirin, düz olduğundan emin olun.
NOT: Toplu enfeksiyonlar, virüs, medya ve hexadimethrine bromür karışımını kaplamadan önce süspansiyondaki hücrelere birleştirerek yapılabilir. - Ortamı çıkarın ve 3.2.4'te belirlenen konsantrasyonda puromisin içeren taze ortamla değiştirin ve virüs enfeksiyonundan sonra 1 plakayı 24 saat kontrol edin. Kontrol 2 plaka hiçbir puromisin ile taze medya ekleyin. 48 saat (37 °C, %5 CO2)için kuluçka hücreleri.
- Puromisin eklenmesinden sonra 48 saat, tüm enfekte olmayan hücrelerin ölü olduğundan emin olun (kontrol 1) puromisin aktivitesini onaylamak için, sonra enfekte hücreleri hasat.
- Enfekte hücre popülasyonu ve hücre geçişi hasat
- Tüm tarama plakalarından puromisin seçilmiş hücreleri tek bir steril kap içine hasat. Her kontrol plakasından hücreleri ayrı ayrı toplayın. Hücreleri nazik tekrarlı pipetleme ile dağıtın.
- Havuzlu tarama hücrelerinden hücreleri sayın, 1'i kontrol edin ve 2'yi ayrı ayrı kontrol edin ve 1 mL'deki hücre sayısını hesaplayın.
- MOI'yi hesaplayın ve elde edilen kapsamı aşağıdaki gibi katlayın:
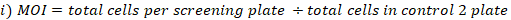
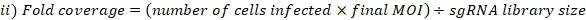
- Genomik DNA çıkarma için seçilen kütüphane kapsama toplanan hücrelerden hücre peletlerinin üç kopyasını toplayın. 5 dk. PBS ile yıkayın için 500 x g hücreleri santrifüj. Tüpleri etiketleyin ve hücre peletlerini -80 °C'de dondurun (bunlar T0 referans örnekleridir).
- Virüslü hücrelerin havuzunu üç çoğaltma grubuna bölün (örneğin, A'yı çoğaltmak, B çoğaltmak, C'yi çoğaltmak), her çoğaltma içinde kitaplık kapsamını koruyarak. Tohum hücreleri aynı tohumlama yoğunluğunda normalde onları genişletirken kullanılacak. Her çoğaltma plakası için aynı sayıda hücre ve çoğaltmalar arasında aynı toplam hücre sayısını kullanın.
- Hücreleri geçiş ve yukarıdaki gibi havuzlu enfekte hücrelerin her çoğaltma hücre pelet üç çoğaltma hasat devam, her 3-8 gün hücre hattına bağlı olarak, 15-20 hücre iki katına kadar. Her geçitte, her çoğaltma grubundaki tüm plakalardan alınan hücreleri birbiriyle toplayın (örneğin, çoğaltma A plakalarından tüm hücreler birbirine yeniden karıştırılır, B plakalarını çoğaltan tüm hücreler yeniden karıştırılır, vb.).
- Her peleti bir zaman (T) ile etiketlendirin ve atamayı çoğaltın. Bu, T0 sonrası gün sayısına karşılık gelir pelet toplanır (örneğin, T3_A, T3_B, T3_C, vb.
- Negatif seçim ilaç ekranları için, hücrelerin tedaviden önce T0 sonra en az bir geçiş için kurtarmak için izin. T3 veya T6'da, her çoğaltma grubundaki hücreleri (A, B, C) 5.3.5 adımında kullanılan aynı tohumlama yoğunluğunu kullanarak ilaç tedavisi ve kontrol popülasyonlarına bölün.
- Ayrıca, ilaç tedavi grubundaki her çoğaltma için kitaplık kapsamı için gereken hücre sayısını ayrı ayrı birleştirin. Ara konsantrasyonlarda ilaç ekleyin (IC20-IC50). Hücreleri tohumve kuluçka (37 °C, 5% CO2) sonraki geçişe kadar.
- Araç kontrol grubundaki her çoğaltma için kitaplık kapsamı için gereken hücre sayısını ayrı ayrı birleştirin. İlaçla aynı hacmi kullanarak araç kontrolünü ekleyin (<%0.5 v/v). Hücreleri tohumve kuluçka (37 °C, 5% CO2) sonraki geçide kadar.
- Her pasajda ilaç veya araç ferahlatıcı iken, her adım 5.3.5 açıklandığı gibi genomik DNA için hücre pelet leri her 3 günde bir hücreleri geçiş ve hasat devam edin.
- Pozitif seçim veya ilaç direnci ekranları için, her çoğaltma grubunu kitaplık kapsamı için gereken hücre sayısına göre bölün. Her çoğaltmak IC90 ilaç konsantrasyonları ekleyin. IC90'dahücrelerin çoğu öldürülecek. Genomik DNA çıkarma için dirençli popülasyonların büyümesine ve hücre peletlerinin (1-2 x 107 hücre) toplanmasına izin verin.
6. CRISPR numune hazırlama ve sıralama
- Genomik DNA arınması
- Çözülmüş hücre peletlerini 5-10 dakika boyunca RT'de eritmek için kuluçkaya yatırın.
- Hücre peleti içeren 50 mL'lik santrifüj tüpüne 1,4 mL PBS ekleyin. Girdap 20 s hücreleri yeniden askıya almak ve 1 dakika dinlenmek için. Gerekirse, kalan hücre kümeleri kırmak için P1000 ile pipet 15x. Hücreleri 15 mL veya 1,5 mL'lik bir tüpten aktarıyorsanız, 1 mL PBS ile hücreleri yeniden askıya alın, ardından hücreleri 50 mL'lik bir tüpe aktarın ve orijinal tüpü 400 μL PBS ile durulayın.
- Resuspended hücrelere 5 mL Çekirdek Lisis Çözeltisi ekleyin. 10 mL'lik pipet kullanarak, numuneyi 5 x yukarı ve aşağı borular oluşturarak karıştırın.
- Nükleer lysate'ye 32 μL RNase A (20 mg/mL; son konsantrasyonu elde etmek için 100 g/mL) ekleyin ve tüpü 5x ters çevirerek numuneyi karıştırın. Karışımı 37°C'de 15 dakika kuluçkaya yatırın ve numunenin RT'de 10 dakika soğumasını bekleyin.
- 20 s. Küçük protein kümeleri karıştırıldıktan sonra görülebilir.
- RT'de 10 dk için 4.500 x g santrifüj.
- 10 mL'lik pipet kullanarak süpernatantı 5 mL izopropanol içeren 50 mL'lik bir santrifüj tüpüne aktarın. DNA gözlemlenene kadar çözeltiyi 10x'i ters çevrilerek hafifçe karıştırın.
NOT: DNA, görünür bir kütle oluşturan beyaz, iplik benzeri iplikler olarak görülebilir. - 4.500 x g'de sentrifuge 5 dk RT'de DNA'yı peletlemek için.
- 10 mL'lik pipet kullanarak, süpernatantı dikkatlice çıkarın ve DNA peletini çıkarmaktan kaçının. DNA'ya RT'ye 5 mL %70 etanol ekleyin. Dna peletini ve santrifüj tüpünün kenarlarını yıkamak için tüpü yavaşça döndürün.
- RT 5 dakika için 4.500 x g centrifuge.
- 10 mL'lik pipet kullanarak% 70 etanol çıkarın ve DNA pelet inislodging kaçının. RT'de 10 dakika boyunca hava kurugenomik DNA.
- Tüpe 400 μL TE çözeltisi ekleyin ve 1 saat boyunca 65 °C'de kuluçkaya yatarak DNA'nın erimesine izin verin. DNA tamamen çözünmezse, tüpü 65 °C'de 1 saat ek olarak inkübüne, tüpü 15 dakikada bir hafifçe hareket ettirin ve gece boyunca 4 °C'de bırakın.
- RT'de 1 dakika için 4.500 x g'de santrifüj ve genomik DNA'yı 1,5 mL düşük bağlayıcı bir tüpe aktarın.
- Genomik DNA'nın saflığını hem spektrofotometrede (toplam nükleik asit içeriği için) hem de florometrede (çift iplikçikli DNA içeriği için) ölçün ve ölçün.
- İsteğe bağlı olarak, aşağıdaki gibi sgRNA downstream PCR amplifikasyon ile ilgili sorunlar varsa genomik DNA çökelti.
- 400 μL genomik DNA'yı 1,5 mL mikrosantrifüj tüpe aktarın.
- 18 μL 5 M NaCl (0,2 M son konsantrasyon) ve 900 μL%95 etanol ekleyin.
- Tüp 10x iyice karıştırılır kadar ters tüp, sonra 16.000 x g 10 dakika RT için santrifüj.
- Dikkatle supernatant çıkarın ve DNA pelet islodging kaçının. DNA peletini %70 etanol500 μL ile yıkayın. DNA peletini yıkamak için tüpü yavaşça döndürün.
- CENTRIFUGE 16.000 x g 5 dk RT için.
- Dikkatle supernatant kaldırmak ve DNA pelet sökme kaçının. RT'de 10 dakika boyunca hava kurugenomik DNA.
- 6.1.12 adımlarında açıklandığı gibi DNA'yı eritmek için 300 μL TE ekleyin.
- Adım 6.1.14'te açıklandığı gibi genomik DNA'nın saflığını ölçün ve ölçün.
- CRISPR sıralama kitaplığı hazırlama
- Toplam 100 μg genomik DNA kullanarak Tablo 5'te belirtildiği gibi PCR 1'i ayarlayın. 50 μL reaksiyon başına 3,5 g genomik DNA ekleyin ve istenilen kapsama alanını elde etmek için aynı 50 μL reaksiyonları ayarlayın. Tablo 6, LCV2 amplifikasyon için astar dizileri örneklerini listeler::TKOv3 sıralama kitaplıkları. Tablo 7 pLCKO2 amplifikasyon için astar dizileri örnekleri listeler::TKOv3 sıralama kütüphaneleri.
- Tablo 8'deözetlenen programı kullanarak bir termocycler PCR 1 reaksiyonlarını artırın.
- PCR ürününün 2 μL'sini %1 agarose jel üzerinde çalıştırarak PCR 1 amplifikasyonu kontrol edin. PCR 1 600 bp'lik bir ürün verir.
- Her genomik DNA örneği için tüm bireysel 50 μL reaksiyonları bir araya ve girdap ile karıştırın.
- Tablo 9'da özetlenen her örnek için bir PCR 2 reaksiyonu (50°L) ayarlayın ve havuzlu PCR 1 ürününün 5 μL'sini şablon olarak kullanarak. Kitaplık örneklerinin birleştirilmesine izin vermek için her bir örnek için benzersiz dizin astar kombinasyonları kullanın.
- Tablo 10'daözetlenen programı kullanarak bir termocycler PCR 2 reaksiyonu yükseltmek.
- Bir jel döküm önce 10 dakika için 0,1 N HCl ile güçlendirilmiş ürünleri arındırmak için agarose jel ekipman temizleyin. PCR 2 güçlendirilmiş ürünleri arındırmak için DNA lekesi içeren %2'lik agarose jel hazırlayın.
- PCR 2 ürününü %2'lik agarose jelüzerinde düşük voltajda (1,0-1,5 saat çalıştırın) çalıştırın. PCR 2 200 bp'lik bir ürün verir.
- PCR ürünlerini mavi ışık transilluminator üzerinde görselleştirin. 200 bp bandı çıkarmak ve bir jel çıkarma kiti kullanarak agarose jel dilim DNA arındırMak. Sıralama kitaplığı saflığını hem spektrofotometre hem de florometrede ölçün ve ölçün.
NOT: Tipik bir jel-saflaştırılmış sıralama kütüphanesi konsantrasyonu 5-10 ng/μL arasında değişmekte ve toplam verim 150-300 ng arasında değişmektedir.
- Yüksek iş ortası sıralaması
- CRISPR dizilimini yeni nesil sıralayıcılarda sıralayın.
- 400-500 kat kitaplık kapsama daha yüksek okuma derinliğinde sırareferans T0 örnekleri. En az 200 kat okuma derinliğinde açılan ekranlar için deneysel zaman noktası örneklerini sıralayın. Güçlü pozitif seçim ekranları için, zenginleştirilmiş sgRNA'ların tanımlanması için en az 50 kat kapsama alanı okuma derinliği yeterlidir.
NOT: Belirli bir ekran için kitaplık gösterimini belirlemek ve zaman içinde sgRNA kıvrım değişikliklerini belirlemek için bir referans olarak hizmet vermek için T0 örneğini sıralamak önemlidir.
7. Veri analizi
- Sırayı eşlemek için Bowtie gibi programları kullanarak sırayı hizalayın aşağıdaki parametreleri kullanarak başvuru kitaplığına okur: -v2 (iki uyuşmazlık lara izin verir) ve -m1 (kitaplıkta birden fazla sıraya eşlenen herhangi bir okumayı atmak).
- Belirli bir örnek için her bir sgRNA için örnek başına 10 milyon okuma için benzersiz eşlenen okuma sayısını aşağıdaki gibi normalleştirin:
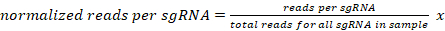 107 000
107 000
- T0 örneğine (Tn/T0) kıyasla her zaman noktasında (Tn) her çoğaltma için her sgRNA'nın log2 kat değişimini hesaplayın. Sıfırlardan süreksizlikleri önlemek için tüm okuma sayımlarına 0,5 okuma sahtesini ekleyin. Kat değiştirme hesaplamasından ve akış aşağı analizinden T0 örneğinde <30 ham okuma içeren SGRNA'ları hariç titibarıyla hariç t.c.
- Gen Özgünlük Bayes analizi (BAGEL) algoritması , gen özgünlük ekranları için daha önce19 tanımlanan temel ve gerekli olmayan eğitim setleri kullanarak kat değişiklikleri analiz ( Ek Tablo S1) veya DrugZ ilaç ekranları için20.
- BF puanlarını kullanarak ekran performansı değerlendirmesi için hassasiyeti ve geri çağırmayı hesaplayın. Python için Scikit-learn kitaplığı'nın precision_recall_curve işlevi için yukarıdaki BF puan alt kümesiyle birlikte 7.4 adımdaki temel seti kullanın. Alternatif olarak, R'deki PRROC paketini kullanarak aynı şeyi gerçekleştirin.
- Her gen için tüm kılavuzların ortalama kıvrım değişimini hesaplayın. R veya eşdeğer yazılımda temel ve gerekli olmayan genler için yoğunluk çizimleri oluşturun (bkz. adım 7.4). R'de, x.ess temel genlerin günlük kıvrım değişim değerlerini içeren bir vektörse ve x.nonEss gerekli olmayan genler içeriyorsa, aşağıdaki komutu kullanarak çizim yapın:
plot( yoğunluk( x.ess), xlab="ortalama logFC",col="red",lwd=2 )
çizgiler ( yoğunluk( x.nonEss), col="mavi",lwd=2 )
NOT: Python sürüm detayları ve kullanılan paketler için bkz: scikit-learn v0.19.1: (Pedregosa ve ark.21tarafından yayımlandı).
Sonuçlar
Genom ölçeğinde CRISPR tarama iş akışına genel bakış
Şekil 1, tek entegrasyon olayları ve yeterli kütüphane gösterimi (genellikle 200- 1000) sağlamak için düşük bir MOI CRISPR kütüphane lentivirus ile hedef hücrelerin enfeksiyonu ile başlayan, havuzlu CRISPR tarama iş akışı genel bir bakış göstermektedir -katlayın). Enfeksiyon dan sonra, hücreler tran...
Tartışmalar
Kullanım kolaylığı ve yüksek esnekliği sayesinde CRISPR teknolojisi hassas genom düzenleme için tercih edilen bir araç olarak yaygın olarak benimsenmiştir. Havuzlu CRISPR taraması, tek bir deneyde binlerce genetik tedirginliği sorgulamak için bir yöntem sağlar. Havuzlu ekranlarda, sgRNA kitaplıkları moleküler barkod görevi görehizmet eder, çünkü her dizi benzersizdir ve hedeflenen genle eşlenir. Genomik DNA'nın hücre popülasyonundan izole edilmesiyle, ilgi fenotipine neden olan genler, sgRNA b...
Açıklamalar
Yazarlar hiçbir rakip mali çıkarları beyan.
Teşekkürler
Bu çalışma Genom Kanada, Ontario Araştırma Fonu ve Kanada Sağlık Araştırma Enstitüleri (MOP-142375, PJT-148802) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 micron filter | |||
| 30°C plate incubator | |||
| 37°C shaking incubator | |||
| 37°C, 5% CO2 incubator | |||
| 5 M NaCl | Promega | V4221 | |
| 50X TAE buffer | BioShop | TAE222.4 | |
| 6 N Hydrochloric acid solution | BioShop | HCL666.500 | |
| 95% Ethanol | |||
| Alamar blue | ThermoFisher Scientific | DAL1025 | |
| Blue-light transilluminator | ThermoFisher Scientific | G6600 | |
| Bovine Serum Albumin,Heat Shock Isolation, Fraction V. Min. 98%, Biotechnology grade | Bioshop | ALB001.250 | |
| Dulbecco's Modification of Eagles Medium | Life Technologies | 11995-065 | Cel culture media |
| Electroporation cuvettes | BTX | 45-0134 | |
| Electroporator | BTX | 45-0651 | |
| Endura electrocompetent cells | Lucigen | 90293 | |
| Fetal Bovine Serum | GIBCO | 12483-020 | |
| HEK293T packaging cells | ATCC | CRL-3216 | recommend passage number <15 |
| Hexadimethrine Bromide (Polybrene) | Sigma | H9268 | Cationic polymer to enhance transduction efficiency |
| Hexadimethrine Bromide (Polybrene) | |||
| LB agar plates with carbenicillin | |||
| LB medium with carbenicillin | |||
| Low molecular weight DNA ladder | New England Biolabs | N3233S | |
| Nanodrop spectrophotometer | ThermoFisher Scientific | ND-ONE-W | |
| NEBNext Ultra II Q5 Master Mix | New England Biolabs | M0544L | |
| Opti-MEM | Life Technologies | 31985-070 | Reduced serum media |
| Plasmid maxi purification kit | Qiagen | 12963 | |
| pMD2.G (envelope plasmid) | Addgene | Plasmid #12259 | lentiviral system |
| psPAX2 (packaging plasmid) | Addgene | Plasmid #12260 | lentiviral system |
| Puromycin | Wisent | 400-160-UG | |
| QIAquick gel extraction kit | Qiagen | 28704 | |
| Qubit dsDNA BR assay | ThermoFisher Scientific | Q32853 | |
| Qubit fluorometer | ThermoFisher Scientific | Q33226 | |
| RNAse A | Invitrogen | 12091021 | |
| S.O.C recovery medium | Invitrogen | 15544034 | |
| SYRB Safe DNA gel stain | ThermoFisher Scientific | S33102 | |
| Toronto KnockOut CRIPSR library (TKOv3) - Cas9 included | Addgene | Addgene ID #90203 | Genome-wide CRISPR library , includes Cas9, 71,090 sgRNA |
| Toronto KnockOut CRIPSR library (TKOv3) - non-cas9 | Addgene | Addgene ID #125517 | Genome-wide CRISPR library, non-Cas9, 71,090 sgRNA |
| Tris-EDTA (TE) solution, pH8.0 | |||
| UltraPure agarose | ThermoFisher Scientific | 16500500 | |
| Wizard genomic DNA purification kit | Promega | A1120 | |
| X-tremeGENE 9 DNA transfection reagent | Roche | 06 365 809 001 | Lipid based transfection reagent |
Referanslar
- Jiang, F., Doudna, J. A. CRISPR-Cas9 Structures and Mechanisms. Annual Review of Biophysics. 46, 505-529 (2017).
- Baliou, S., et al. CRISPR therapeutic tools for complex genetic disorders and cancer (Review). International Journal of Oncology. 53 (2), 443-468 (2018).
- Hart, T., et al. High-Resolution CRISPR Screens Reveal Fitness Genes and Genotype-Specific Cancer Liabilities. Cell. 163 (6), 1515-1526 (2015).
- Morgens, D. W., Deans, R. M., Li, A., Bassik, M. C. Systematic comparison of CRISPR/Cas9 and RNAi screens for essential genes. Nature Biotechnology. 34 (6), 634-636 (2016).
- Evers, B., et al. CRISPR knock-out screening outperforms shRNA and CRISPRi in identifying essential genes. Nature Biotechnology. 34 (6), 631-633 (2016).
- Miles, L. A., Garippa, R. J., Poirier, J. T. Design, execution, and analysis of pooled in vitro CRISPR/Cas9 screens. The FEBS Journal. 283 (17), 3170-3180 (2016).
- Wang, T., Wei, J. J., Sabatini, D. M., Lander, E. S. Genetic screens in human cells using the CRISPR-Cas9 system. Science. 343 (6166), 80-84 (2014).
- Wang, T., et al. Identification and characterization of essential genes in the human genome. Science. 350 (6264), 1096-1101 (2015).
- Sanson, K. R., et al. Optimized libraries for CRISPR-Cas9 genetic screens with multiple modalities. Nature Communications. 9 (1), 5416 (2018).
- Hart, T., et al. Evaluation and Design of Genome-Wide CRISPR/SpCas9 Knock-out Screens. G3: Genes|Genomes|Genetics. 7 (8), 2719-2727 (2017).
- Mair, B., Tomic, J., et al. Essential gene profiles for human pluripotent stem cells identify uncharacterized genes and substrate dependencies. Cell Reports. 27 (2), 599-615 (2019).
- Shalem, O., et al. Genome-scale CRISPR-Cas9 knock-out screening in human cells. Science. 343 (6166), 84-87 (2014).
- Sharma, S., Petsalaki, E. Application of CRISPR-Cas9 Based Genome-Wide Screening Approaches to Study Cellular Signalling Mechanisms. International Journal of Molecular Sciences. 19 (4), (2018).
- Steinhart, Z., et al. Genome-wide CRISPR screens reveal a Wnt-FZD5 signaling circuit as a druggable vulnerability of RNF43-mutant pancreatic tumors. Nature Medicine. 23 (1), 60-68 (2017).
- Wang, T., et al. Gene Essentiality Profiling Reveals Gene Networks and Synthetic Lethal Interactions with Oncogenic Ras. Cell. 168 (5), 890-903 (2017).
- Zimmermann, M., et al. CRISPR screens identify genomic ribonucleotides as a source of PARP-trapping lesions. Nature. 559 (7713), 285-289 (2018).
- Deans, R. M., et al. Parallel shRNA and CRISPR-Cas9 screens enable antiviral drug target identification. Nature Chemical Biology. 12 (5), 361-366 (2016).
- Trinh, T. J. J., Bloom, F., Hirsch, V. STBL2: an Escherichia coli strain for the stable propagation of retroviral clones and direct repeat sequences. Focus. 16, 78-80 (1994).
- Hart, T., Moffat, J. BAGEL: a computational framework for identifying essential genes from pooled library screens. BMC Bioinformatics. 17, 164 (2016).
- Wang, G. Z. M., et al. Identifying drug-gene interactions from CRISPR knock-out screens with drugZ. bioRxiv. , (2017).
- Pedregosa, F. V., G, , et al. Scikit-learn: Machine Learning in Python. Journal of Machine Learning Research. 12, 2825-2830 (2011).
- Ketela, T., et al. A comprehensive platform for highly multiplexed mammalian functional genetic screens. BMC Genomics. 12, 213 (2011).
- Doench, J. G. Am I ready for CRISPR? A user's guide to genetic screens. Nature Review Genetics. 19 (2), 67-80 (2018).
- Hartenian, E., Doench, J. G. Genetic screens and functional genomics using CRISPR/Cas9 technology. FEBS Journal. 282 (8), 1383-1393 (2015).
- Li, W., et al. MAGeCK enables robust identification of essential genes from genome-scale CRISPR/Cas9 knock-out screens. Genome Biology. 15 (12), 554 (2014).
- Sheel, A., Xue, W. Genomic Amplifications Cause False Positives in CRISPR Screens. Cancer Discovery. 6 (8), 824-826 (2016).
- Meyers, R. M., et al. Computational correction of copy number effect improves specificity of CRISPR-Cas9 essentiality screens in cancer cells. Nature Genetics. 49 (12), 1779-1784 (2017).
- Henser-Brownhill, T., Monserrat, J., Scaffidi, P. Generation of an arrayed CRISPR-Cas9 library targeting epigenetic regulators: from high-content screens to in vivo assays. Epigenetics. 12 (12), 1065-1075 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır