Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yakınlık-Ligasyon-Tahlil Kullanarak Farklı Sıvı Kesme Stres Koşulları Altında TGFβ/BMP/SMAD Sinyalinin Görselleştirilmesi ve Nicelleştirilmesi
Bu Makalede
Özet
Burada, patolojik ve fizyolojik sıvı kesme stres koşullarına maruz kalan endotel hücrelerinde yakınlık ligasyon testini (PLA) kullanarak birden fazla SMAD kompleksini aynı anda görselleştirmek ve analiz etmek için bir protokol oluşturuyoruz.
Özet
Büyüme Faktörü β (TGFβ)/Kemik Morfogenetik Protein (BMP) sinyalinin dönüştürülmesi, vaskülür sisteminin gelişimi ve homeostazı sırasında sıkı bir şekilde düzenlenir ve dengelenir Bu nedenle, bu sinyal yolundaki deregülasyon pulmoner arter hipertansiyonu, kalıtsal hemorajik telanjiektazi ve ateroskleroz gibi ciddi vasküler patolojilerle sonuçlanır. Kan damarlarının en iç tabakası olarak endotel hücreleri (VC' ler) sürekli olarak sıvı kesme stresine (SS) maruz kalır. Anormal sıvı SS paternlerinin, diğer uyaranlarla birlikte aterogenez indükleyen TGFβ/BMP sinyalini arttırdığı gösterilmiştir. Bununla ilgili olarak, ateroprotektif, yüksek laminar SS bu sinyali azaltırken, ateroprotektif, düşük laminar SS'nin TGFβ/ BMP sinyalini artırdığı bulunmuştur. Bu yolların aktivasyonunu verimli bir şekilde analiz etmek için, piyasada bulunan bir pnömatik pompa sistemi ve yakınlık ligasyon tahlilini (PLA) kullanarak düşük laminar SS ve yüksek laminar SS koşulları altında transkripsiyon faktörü komplekslerinin oluşumunu araştırmak için bir iş akışı tasarladık.
Aktif TGFβ/BMP-sinyalizasyon, iki düzenleyici SMAD'den (R-SMAD) oluşan trimerik SMAD komplekslerinin oluşumunu gerektirir; SMAD2/3 ve SMAD1/5/8 sırasıyla TGFβ ve BMP sinyalizasyon için) ortak bir arabulucu SMAD (ortak SMAD; SMAD4). Trimerik SMAD kompleksinin farklı alt birimlerini, yani R-SMAD/co-SMAD veya R-SMAD/R-SMAD'ı hedefleyen PLA kullanılarak, aktif SMAD transkripsiyon faktörü komplekslerinin oluşumu floresan mikroskopisi kullanılarak nicel ve mekansal olarak ölçülebilir.
Seri olarak bağlanabilen 6 küçük paralel kanallı akış slaytlarının kullanımı, transkripsiyon faktörü karmaşık oluşumunun araştırılmasına ve gerekli kontrollerin dahil edilmesine olanak tanır.
Burada açıklanan iş akışı, farklı sıvı SS koşullarında SMAD'lerin diğer transkripsiyon faktörlerine veya SMAD'ler dışındaki transkripsiyon faktörü komplekslerine yakınlığını hedefleyen çalışmalar için kolayca uyarlanabilir. Burada sunulan iş akışı, VC'lerde sıvı SS kaynaklı TGFβ/BMP sinyalini hem nicel hem de mekansal olarak incelemenin hızlı ve etkili bir yolunu göstermektedir.
Giriş
Dönüşen büyüme faktörleri beta (TGFβ) süper ailenin proteinleri, TGFβs, kemik morfogenetik proteinleri (BMP'ler) ve Activins1,2 dahil olmak üzere çeşitli üyelere sahip pleiotropik sitokinlerdir. Ligand bağlama, fosforilasyona ve böylece sitosolik düzenleyici SMAD'nin (R-SMAD) aktivasyonuna yol açan reseptör oligomerlerinin oluşumuna neden olandır. Ligandların alt ailesine bağlı olarak, farklı R-SMAD'ler etkinleştirilir1,2. TGFβs ve Activins esas olarak SMAD2/3 fosforilasyonuna neden olurken, BMP'ler SMAD1/5/8 fosforilasyona neden olur. Bununla birlikte, BMP'lerin ve TGFβs/Activins'in de ilgili diğer alt ailenin R-SMAD'lerini etkinleştirdiğine dair kanıtlar vardır, 'yanal sinyal'3,4,5,6,7,8 olarak adlandırılan bir süreçte ve her iki SMAD1/5 ve SMAD2/3, üyeden oluşan karışık SMAD kompleksleri vardır. . İki aktif R-SMAD daha sonra ortak mediatör SMAD4 ile trimerik kompleksler oluşturur. Bu transkripsiyon faktörü kompleksleri daha sonra çekirdeğe yerle bir olabilir ve hedef genlerin transkripsiyonunu düzenleyebilir. SMAD'ler çeşitli transkripsiyonal ko-aktivatörler ve yardımcı baskılayıcılarla etkileşime girebilir ve bu da hedef genleri düzenleme olanaklarının çeşitlendirilmesine yol açabilir10. SMAD sinyalinin deregülasyonunun çeşitli hastalıklarda ciddi etkileri vardır. Buna paralel olarak dengesiz TGFβ/BMP sinyali pulmoner arter hipertansiyonu, kalıtsal hemorajik telanjiektazi veya ateroskleroz3,11,12,13,14 gibi ciddi damar patolojilerine yol açabilir.
Endotel hücreleri (VC' ler) kan damarlarının en iç tabakasını oluşturur ve bu nedenle kanın viskoz akışı tarafından uygulanan sürtünme kuvveti olan kesme stresine (SS) maruz kalır. İlginçtir ki, vaskülatın yüksek düzeyde üniforma, laminar SS'ye maruz kalan kısımlarında bulunan VC'ler homeostatik ve sessiz bir durumda tutulur. Buna karşılık, düşük, homojen olmayan SS deneyimine sahip VC'ler, örneğin bifurkasyonlarda veya aort kemerinin daha az eğriliğinde, proliferatiftir ve enflamatuar yolları aktive eder15. Buna karşılık, işlevsiz EC siteleri ateroskleroz geliştirmeye eğilimlidir. İlginçtir ki, bu ateropron alanlarındaki VC'ler anormal derecede yüksek aktif SMAD2/3 ve SMAD1/516,17,18 seviyeleri gösterir. Bu bağlamda, gelişmiş TGFβ/BMP sinyalinin aterosklerotik lezyonların gelişiminde erken bir olay olduğu saptanmıştır19 ve BMP sinyaline müdahalenin damar iltihabını, aterom oluşumunu ve ilişkili kireçlenmeyi belirgin şekilde azalttığı bulunmuştur20.
Yakınlık Ligasyon Tahlil (PLA), protein-protein etkileşimlerini yerinde incelemek için kullanılan biyokimyasal bir tekniktir21,22. Hedef proteinleri birbirine bağlayabilen farklı türlerdeki antikorların özgüllüğüne dayanır ve endojen protein etkileşimlerinin tek hücre düzeyinde son derece spesifik olarak tespit edilmesine izin verir. Burada, primer antikorların tespite izin vermek için 40 nm'den daha az bir mesafede hedef epitoplarına bağlanmaları gerekir23. Bu nedenle PLA, endojen protein etkileşimlerini tespit etmek için birkaç milyon hücreye ihtiyaç duyulan geleneksel eş-immüno-immün premünipitasyon yaklaşımları üzerinde büyük ölçüde faydalıdır. PLA'da, DNA parçalarına (Artı ve Eksi problar olarak added) yaygın olarak bağlanan türe özgü ikincil antikorlar, birincil antikorları bağlar ve ilgi proteinleri etkileşime girerse, Artı ve Eksi probları yakın mesafededir. DNA aşağıdaki adımda liglenir ve dairesel DNA'nın yuvarlanan daire amplifikasyonu mümkün olur. Amplifikasyon sırasında, floresan olarak etiketlenmiş tamamlayıcı oligonükleotidler sentezlenmiş DNA'ya bağlanır ve bu protein etkileşimlerinin geleneksel floresan mikroskopi ile görselleştirilmesini sağlar.
Burada açıklanan protokol, bilim adamlarının PLA kullanarak ateroprotektif ve ateropron SS koşullarındaki aktif SMAD transkripsiyon komplekslerinin sayısını nicel olarak karşılaştırmalarını sağlar. SS, tanımlanmış seviyelerde laminar tek yönlü akış üretebilen ve akış hızlarının adım adım artmasına izin veren programlanabilir bir pnömatik pompa sistemi ile üretilir. Bu yöntem, SMAD4 ile SMAD1/5 veya SMAD2/3 arasındaki etkileşimlerin yanı sıra karışık R-SMAD komplekslerinin algılanmasını sağlar. SMAD'lerin transkripsiyonal yardımcı düzenleyicilerle etkileşimlerini analiz etmek veya SMAD'ler dışındaki transkripsiyon faktörü komplekslerine kolayca genişletilebilir. Şekil 1 aşağıda sunulan protokolün ana adımlarını göstermektedir.
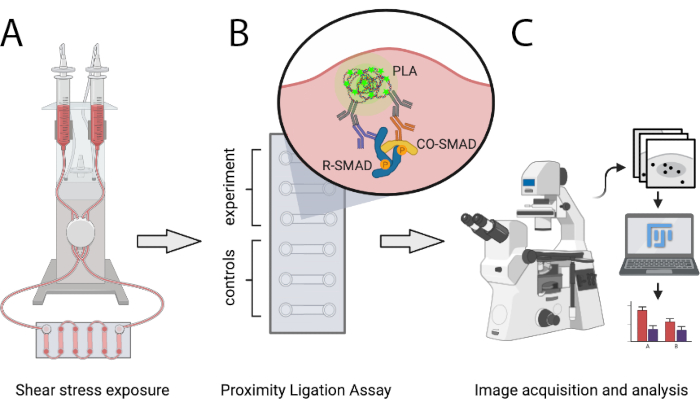
Şekil 1: Açıklanan protokolün şematik gösterimi. (A) 6 kanallı kaydıraklarda tohumlanan hücreler pnömatik pompa sistemi ile kesme stresine maruz kalır. (B) Sabit hücreler PLA deneyi veya kontrol koşulları için kullanılır. (C) PLA deneylerinin görüntüleri floresan mikroskop ile elde edilir ve ImageJ analiz yazılımı kullanılarak analiz edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
1. Hücre kültürü ve sıvı kesme stresine maruz kalma
NOT: SMAD'lerin SS kaynaklı etkileşimini incelemek için örnek olarak insan göbek damarı EBC'leri (HUVEC) kullanılmıştır. Aşağıda açıklanan iletişim kuralı her SS duyarlı hücre türüne uygulanabilir.
- 37 °C'de 30 dakika boyunca PBS'de % 0,1 porcine cilt jelatin ile 6 kanallı kaydırağı kapleyin.
- 30 μL M199 tam ortamda mL başına 2,5 x 106 hücre yoğunluğunda önceden kaplanmış 6 kanallı slaytlarda tohum HUVEC'leri.
NOT: Akış slaydındaki hücrelerin nasıl tohumlanılacağı hakkında daha fazla bilgi için bkz. - Hücrelerin nemlendirilmiş bir inkübatörde 37 °C'de 1 saat boyunca yapışmasına izin verin.
- Rezervuarların her birine 60 μL önceden ısıtılmış M199 tam orta ekleyin.
- Nemlendirilmiş bir inkübatörde 37 °C'de günde bir kez hafif bir orta değişimle 2 gün boyunca kültür.
- Rezervuarları tamamen aspire edin, rezervuarlardan birine önceden ısıtılmış 120 μL tam orta ekleyin ve diğer taraftan epire edin.
- Her iki rezervuara da 60 μL önceden ısıtılmış M199 tam orta ekleyin.
- Akış kurulumını başvuru25'te ayrıntılı olarak belirtildiği gibi birleştirin ve başlatın.
- Akışkan ünitelere boru monte edin. Burada sırasıyla 1 dyn/cm2 ve 30 dyn/cm2 kesme stresi uygulamak için 0,8 mm ve 1,6 mm çapında silikon borular kullanılmaktadır.
NOT: Değişiklikler ortaya çıkan kesme stresini etkileyebileceğinden, malzeme ve boru uzunluğu sabit kalmalıdır. Genel olarak, ortaya çıkan kesme stresi bilindiği ve pompa sabit bir laminar akış oluşturduğu sürece pompa sistemlerinin ve boruların diğer kombinasyonları kullanılabilir. - Rezervuarları uygun miktarda önceden ısıtılmış M199 tam orta (minimum 10 mL) ile doldurun.
- Akışkan üniteleri boru ile pompa sistemine bağlayın ve ortamı aşındırmak ve kalan havayı çıkarmak için hücresiz bir ön çalıştırma gerçekleştirin25.
- Seri bağlantı borusunu kullanarak 6 kanallı slayttaki tek kanalları seri olarak birbirine bağlayın. Slayttaki ilk ve son kanal 1.6.1'de monte edilen boruya bağlanır (şema için Şekil 1A'ya bakın). Hücrelere ciddi şekilde zarar verebileceği için sisteme herhangi bir hava sokmamaya dikkat edin. Seri bağlantı hakkında daha fazla bilgiyi reference26'da bulabilirsiniz.
- Hücrelerin yüksek düzeyde kesme stresine (>20 dyn/cm2) maruz kalması için bir rampa fazı kullanın, yani adaptasyon aşamaları ile kesme stresini adım adım artırın. Adımlar, 30 dakikada 5 dyn/cm2'lik artışlarla ayarlanabilir.
- Akışkan ünitelere boru monte edin. Burada sırasıyla 1 dyn/cm2 ve 30 dyn/cm2 kesme stresi uygulamak için 0,8 mm ve 1,6 mm çapında silikon borular kullanılmaktadır.
2. Fiksasyon
- Sıvı SS maruziyetinden sonra pompalardan kaydırakları ayırın. İnkübatördeki orta dökülmeyi önlemek için, ayırma yaparken boru üzerinde kelepçeler kullanın.
- Kalan boru sırayla ayrılırken, akış slaytlarını hemen buz üzerinde aktarın. Boruyu rezervuarlardan çıkarırken, kanaldaki hava kabarcıklarını hapsetmeyi önlemek için diğer taraftaki rezervuar bir parmakla kapalı tutulmalıdır. Bu, sabitleme adımlarını engelleyebilir.
- Hücreleri buzda tutarak, ortamı rezervuarlardan dikkatlice epire edin, ancak hücrelerin bulunduğu kanaldan değil. Daha sonra, numuneleri soğuk steril PBS (4 °C) ile kanal hacminin üç katı (90 μL) ile yıkayın. Bir rezervuara PBS ekleyin ve diğer rezervuardan dikkatlice aspire edin. Bu adımı slayt başına 6 kanalın her birinde yineleyin.
NOT: Tüm yıkama ve kuluçka adımları için ilgili çözelti rezervuarlardan birine eklenir ve bu da kanalda çözüm değişimine yol açar. Çözeltilerin kanaldaki tam olarak değiştirilmesine izin vermek için, fazla çözelti daha sonra diğer rezervuardan emilir. Kanaldaki hücrelerin üstündeki çözelti çıkarılmaz. Hücreler herhangi bir zamanda kurumamalıdır. Bu nedenle, slaytlara herhangi bir hava kabarcığı takılmadan dikkatlice yıkamak önemlidir. - PBS'nin önceden eklendiği aynı rezervuara 90 μL tamponlanmış% 4 PFA çözeltisi ekleyerek hücreleri sabitlayın ve benzer şekilde sıvıyı diğer rezervuardan epire edin. Bu adımı her slayttaki her kanalda yineleyin. PFA çözeltisinin eklenmesinden sonra, numuneleri buzdan oda sıcaklığına (RT) aktarın ve 20 dakika kuluçkaya yatırın.
DİkKAT: PFA toksiktir ve dikkatli bir şekilde ele alınmalıdır. Eldiven kullanın ve duman kaputunun altında çalışın. - Hücreleri bir rezervuara ekleyerek ve diğer rezervuardan dikkatlice soluyarak PBS (RT) ile 3x yıkayın. Kanalın kurumamasını sağlamak için sadece rezervuarları boşaltın. Slayt başına 6 kanalın her biri için bu adımı yineleyin.
- Rezervuarlardan birine PBS'de 90 μL ortam 50 mM amonyum klorür ekleyerek PFA fiksasyonunu söndür. Diğer rezervuardan fazla çözeltiyi aspire edin. Slayttaki her kanal için yineleyin. Rt'de örnekleri 10 dakika kuluçkaya yatırın.
- 2.5. adımda açıklandığı gibi yıkayın.
NOT: Bu noktada, numuneler bir gecede 4 °C'de saklanabilir veya protokole hemen blokaj ve primer antikor inkübasyonu ile devam edilebilir (bkz. adım 3).
3. Blokaj ve primer antikor inkübasyonu
- Hücrelerin dengesini sağlamak için, boşaltılmış bir rezervuarda PBS'ye% 0.3 Triton-X-100'ün 90 μL'sini ekleyin ve her kanal için diğer rezervuardan aspire edin. RT'de 10 dakika kuluçkaya yaslanın.
- 2.5. adımda açıklandığı gibi yıkayın.
- Bir kanalın bir rezervuarında 90 μL steril PLA engelleme çözeltisi ekleyin ve diğer taraftan aspire edin. Her kanal için bu adımı yineleyin. Nemlendirilmiş bir odada 37 °C'de 1 saat boyunca blok.
- Nemlendirilmiş bir oda yapmak için, balmumu filmi ile kapatılmış ıslak dokulu 10 cm'lik bir tabak kullanın ve kabı inkübatöre yerleştirin. Alternatif olarak, nemli bir atmosfer sağlayan diğer nem odası formatları kullanılabilir.
NOT: Alternatif olarak, kendi kendine yapılan engelleme çözeltisi kullanılabilir (örneğin, PBS'de% 3 (w / v) BSA, steril filtreli).
- Nemlendirilmiş bir oda yapmak için, balmumu filmi ile kapatılmış ıslak dokulu 10 cm'lik bir tabak kullanın ve kabı inkübatöre yerleştirin. Alternatif olarak, nemli bir atmosfer sağlayan diğer nem odası formatları kullanılabilir.
- PLA antikor seyrelticisinde primer antikorları (1:100) hazırlayın. Kanal başına 30 μL çözelti hazırlayın. Hem primer antikorları aynı anda hem de girdabı ekleyin.
NOT: Alternatif olarak, kendi kendine yapılan antikor seyreltici kullanılabilir (örneğin, PBS'de% 1 (w/ v) BSA). Burada kullanılan antikorlar SMAD1-SMAD2/3, SMAD2/3-SMAD4 ve fosfo-SMAD1/5-SMAD4 kombinasyonlarıdır. Detaylı bilgiye Malzeme Tablosundan ulaşabilirsiniz. - Birincil antikorların uygulanmasından önce, blokaj çözeltisini rezervuarlardan ve ayrıca kanaldan dikkatlice epire edin. Birincil antikor çözeltisinin pipet 30 μL'si, çözeltiyi eklerken kanalı yatırarak hemen boş kanala girer.
NOT: Blokaj çözeltisinin çıkarılmasını ve hücrelerin arada kurumamasını sağlamak için kanal kanal antikor çözeltisinin eklenmesini gerçekleştirin. - Numuneleri birincil antikorlarla birlikte 4 °C'de nemlendirilmiş odalarda bir gecede kuluçkaya yatırın.
NOT: Kuluçka, aynı gün aşağıdaki adımlarla devam ederek devam ederse, oda sıcaklığında 1 saat boyunca da yapılabilir.
4. PLA prob inkübasyonu
NOT: Bölüm 4.1-7.3'teki tüm adımlar için, A ve B yıkama tamponları 4 °C'de saklanır ve kullanımdan önce RT'ye ısıtılması gerekir.
- PLA problarını (+)-fare ve (-)-tavşanı PLA antikor seyreltici (veya% 1 BSA) çözeltisinde 1:5'e seyreltin. Kanal başına 30 μL hazırlayın.
- Rt'de 90 μL yıkama tamponu A kullanarak numuneleri 5 dakika boyunca 2x yıkayın, rezervuarlardan birine ekleyerek ve diğer rezervuardan dikkatlice emiş yaparak. Slayt başına 6 kanalın her biri için bu adımı yineleyin.
- Yıkama tamponu A'yı dikkatlice epire edin ve adım 3.5'teki birincil antikorların eklenmesine benzer şekilde 30 μL PLA prob çözeltisi ekleyin (adım 4.1'de hazırlanmıştır).
- Örnekleri nemlendirilmiş bir odada 37 °C'de 1 saat kuluçkaya yatırın.
5. Ligasyon
- 4,2'de açıklandığı gibi, RT'de 90 μL yıkama tamponu A kullanarak numuneleri 5 dakika boyunca 2x yıkayın.
- Deiyonize suda ligasyon tamponunun 1:5 seyreltilmesini hazırlayın. Ligaz enzimini 1:40'a (buzda) seyreltmek için bu tamponu kullanın. Kanal başına 30 μL kullanın.
- Yıkama tamponu A'yı tamamen epire edin ve ligasyon çözeltisini 3,5'te açıklandığı gibi ekleyin.
- Örnekleri nemlendirilmiş bir odada 37 °C'de 30 dakika kuluçkaya yatır.
6. Amplifikasyon
- 4,2'de açıklandığı gibi RT'de 90 μL yıkama tamponu A kullanarak numuneleri 2 dakika boyunca 2x yıkayın.
- Amplifikasyon tamponunu deiyonize suda 1:5 seyrelterek hazırlayın ve polimeraz enzimini 1:80'e (buz üzerinde) seyreltmek için kullanın. Işıktan kork. Kanal başına 30 μL hazırlayın.
- Yıkama tamponu A'yı tamamen epire edin ve hazırlanan amplifikasyon çözeltisini 3,5'te açıklandığı gibi hemen boş kanala ekleyin. Örnekleri nemlendirilmiş bir odada 37 °C'de 100 dakika kuluçkaya yatır.
7. Montaj
- RT'de 4,2'de açıklandığı gibi 90 μL Yıkama TamponU B kullanarak numuneleri 10 dakika boyunca 2x yıkayın. Çekirdekleri lekeleyecek ilk yıkamaya 1 mg/mL stok çözeltisinden (deiyonize suda) DAPI (1:500) ekleyin. Kanalı kurutmayın.
- Yıkama tamponu B'yi deiyonize suda seyreltin (1:10) ve 4.2'de açıklandığı gibi 90 μL 0.1x tampon B çözeltisi ile 1x yıkayın.
- Yıkama tamponu B'yi tamamen epire edin ve hemen bir rezervuara 2-3 damla sıvı montaj ortamı ekleyin. Slaydı yatırarak kanalda dağıtın. Numuneleri görüntülemeye kadar nemli bir ortamda 4 °C'de saklayın.
8. Görüntü alımı
- Floresan mikroskobu kullanarak görüntüler elde edin. Floresan PLA problarına uyan ilgili filtrelerin mevcut olduğundan emin olun.
NOT: Elde edilen PLA lekeleri daha tanımlandığı için mümkünse konfokal mikroskop kullanmak faydalıdır. Bu aynı zamanda daha fazla görüntü işleme ve veri analizini de destekler.
9. ImageJ/FIJI kullanarak görüntü analizi ve niceleme
- Dışa aktarılan görüntüleri (.tiff) ImageJ27 gibi bir görüntü işleme programıyla işleyin.
NOT: Bu çalışmada kullanılan ve hücresel, nükleer ve tüm PLA olaylarının (hücre başına) otomatik sayımı için gerekli olan tüm komut dosyaları gitHub deposunda bulunabilir: https://github.com/Habacef/Proximity-Ligation-Assay-analysis. Uygun herhangi bir program veya araç kullanarak istatistiksel analiz yapın.
Sonuçlar
Daha önce farklı SMAD proteinlerinin etkileşimlerini tespit etmek için PLA kullandık3 ve SMAD fosforilasyonundaki kesme stresi kaynaklı değişiklikleri analiz ettik28.
Burada her iki yöntem de yukarıda açıklanan protokol ile birleştirildi. HUVEC'ler 1 dyn/cm2 ve 30 dyn/cm2 kesme stresine maruz kaldı ve SMAD transkripsiyon faktörlerinin etkileşimleri için analiz edildi. Yüksek kesme stresi (30 dyn/cm2
Tartışmalar
Burada açıklanan PLA tabanlı protokol, nicel ve mekansal çözünürlükle kesme stresine maruz kalan VC'lerde iki proteinin (örneğin doğrudan etkileşimlerinin) yakınlığını belirlemenin etkili bir yolunu sunar. Birden fazla paralel kanallı akış slaytları kullanılarak, aynı mekanik koşullar altında hücrelerde aynı anda birkaç farklı protein etkileşimi incelenebilir. Buna karşılık, özel yapım akış odası sistemleri genellikle bir cam kapak parçası etrafında inşa edilen tek bir kanaldan y...
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyanda bulunun.
Teşekkürler
Dr. Maria Reichenbach ve Dr. Christian Hiepen'e akış sistemine verdikleri destek için, Eleanor Fox ve Yunyun Xiao'ya ise makaleyi eleştirel bir şekilde okudukları için teşekkür ederiz. P-L.M. uluslararası Max Planck Araştırma Okulu IMPRS-Biology and Computation (IMPRS-BAC) tarafından finanse edildi. PK, DFG-SFB1444 tarafından fon aldı. Şekil 1 BioRender kullanılarak oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| µ-Slide VI 0.4 | ibidi | 80606 | 6-channel slide |
| Ammonium Chloride | Carl Roth | K298.1 | Quenching |
| Bovine Serum Albumin | Carl Roth | 8076.4 | Blocking |
| DAPI | Sigma Aldrich/ Merck | D9542 | Stain DNA/Nuclei |
| DPBS | PAN Biotech | P04-53500 | PBS |
| Duolink In Situ Detection Reagents Green | Sigma Aldrich/ Merck | DUO92014 | PLA kit containing Ligase, ligation buffer, polymerase and amplification buffer (with green labeled oligonucleotides) |
| Duolink In Situ PLA Probe Anti-Mouse MINUS | Sigma Aldrich/ Merck | DUO92004 | MINUS probe |
| Duolink In Situ PLA Probe Anti-Rabbit PLUS | Sigma Aldrich/ Merck | DUO92002 | PLUS probe |
| Duolink In Situ Wash Buffers, Fluorescence | Sigma Aldrich/ Merck | DUO82049 | PLA wash buffers A and B |
| Endothelial Cell Growth Supplement | Corning | supplement for medium (ECGS) | |
| Fetal calf Serum | supplement for medium | ||
| FIJI | Image Analysis software | ||
| Formaldehyde solution 4% buffered | KLINIPATH/VWR | VWRK4186.BO1 | PFA |
| Full medium | M199 basal medium +20 % FCS +1 % P/S + 2 nM L-Glu + 25 µg/mL Hep + 50 µg/mL ECGS | ||
| Gelatin from porcine skin, Type A | Sigma Aldrich | G2500 | Use 0.1% in PBS for coating of flow channels |
| GraphPad Prism v.7 | GarphPad | Statistical Program used for the Plots and statistical calculations | |
| Heparin sodium salt from porcine intestinal mucosa | Sigma Aldrich | H4784-250MG | supplement for medium (Hep) |
| HUVECs | |||
| ibidi Mounting Medium | ibidi | 50001 | Liquid mounting medium |
| ibidi Pump System | ibidi | 10902 | pneumatic pump |
| Leica TCS SP8 | Leica | confocal microscope | |
| L-Glutamin 200mM | PAN Biotech | P04-80100 | supplement for medium (L-Glu) |
| Medium 199 | Sigma Aldrich | M2154 | Base medium |
| mouse anti- SMAD1 Antibody | Abcam | ab53745 | Suited for PLA |
| mouse anti- SMAD2/3 Antibody | BD Bioscience | 610843 | Not suited for PLA in combination with CST 9515 |
| mousee anti- SMAD4 Antibody | Sanata Cruz Biotechnology | sc-7966 | Suited for PLA |
| Penicillin 10.000U/ml /Streptomycin 10mg/ml | PAN Biotech | P06-07100 | supplement for medium (P/S) |
| Perfusion Set WHITE | ibidi | 10963 | Tubings used for 1 dyn/cm2 |
| Perfusion Set YELLOW and GREEN | ibidi | 10964 | Tubings used for 30 dyn/cm2 |
| rabbit anti- phospho SMAD1/5 Antibody | Cell Signaling Technologies | 9516 | Suited for PLA |
| rabbit anti- SMAD2/3 XP Antibody | Cell Signaling Technologies | 8685 | Suited for PLA |
| rabbit anti- SMAD4 Antibody | Cell Signaling Technologies | 9515 | Not suited for PLA in combination with BD 610843 |
| Serial Connector for µ-Slides | ibidi | 10830 | serial connection tubes |
| Triton X-100 | Carl Roth | 6683.1 | Permeabilization |
Referanslar
- Yadin, D., Knaus, P., Mueller, T. D. Structural insights into BMP receptors: Specificity, activation and inhibition. Cytokine and Growth Factor Reviews. 27, 13-34 (2016).
- Sieber, C., Kopf, J., Hiepen, C., Knaus, P. Recent advances in BMP receptor signaling. Cytokine and Growth Factor Reviews. 20 (5-6), 343-355 (2009).
- Hiepen, C., et al. BMPR2 acts as a gatekeeper to protect endothelial cells from increased TGFβ responses and altered cell mechanics. PLoS Biology. 17 (12), 3000557 (2019).
- Hildebrandt, S., et al. ActivinA induced SMAD1/5 Signaling in an iPSC derived EC model of Fibrodysplasia Ossificans Progressiva (FOP) can be rescued by the drug candidate saracatinib. Stem Cell Reviews and Reports. , (2021).
- Goumans, M. J., et al. Balancing the activation state of the endothelium via two distinct TGF-beta type I receptors. The EMBO Journal. 21 (7), 1743-1753 (2002).
- Goumans, M. J., et al. Activin receptor-like kinase (ALK)1 is an antagonistic mediator of lateral TGFbeta/ALK5 signaling. Molecular Cell. 12 (4), 817-828 (2003).
- Daly, A. C., Randall, R. A., Hill, C. S. Transforming growth factor beta-induced Smad1/5 phosphorylation in epithelial cells is mediated by novel receptor complexes and is essential for anchorage-independent growth. Molecular and Cellular Biology. 28 (22), 6889-6902 (2008).
- Ramachandran, A., et al. TGF-β uses a novel mode of receptor activation to phosphorylate SMAD1/5 and induce epithelial-to-mesenchymal transition. eLife. 7, 31756 (2018).
- Flanders, K. C., et al. Brightfield proximity ligation assay reveals both canonical and mixed transforming growth factor-β/bone morphogenetic protein Smad signaling complexes in tissue sections. The Journal of Histochemistry and Cytochemistry : The Official Journal of The Histochemistry Society. 62 (12), 846-863 (2014).
- Miyazono, K., Maeda, S., Imamura, T., Dijke, P. T., Heldin, C. -. H. . Smad Signal Transduction: Smads in Proliferation, Differentiation and Disease. , 277-293 (2006).
- Goumans, M. J., Zwijsen, A., Ten Dijke, P., Bailly, S. Bone morphogenetic proteins in vascular homeostasis and disease. Cold Spring Harbor Perspectives in Biology. 10 (2), 031989 (2018).
- Cai, J., Pardali, E., Sánchez-Duffhues, G., ten Dijke, P. BMP signaling in vascular diseases. FEBS Letters. 586 (14), 1993-2002 (2012).
- Cunha, S. I., Magnusson, P. U., Dejana, E., Lampugnani, M. G. Deregulated TGF-β/BMP signaling in vascular malformations. Circulation research. 121 (8), 981-999 (2017).
- MacCarrick, G., et al. Loeys-Dietz syndrome: a primer for diagnosis and management. Genetics in Medicine : An Official Journal of the American College of Medical Genetics. 16 (8), 576-587 (2014).
- Baeyens, N., Bandyopadhyay, C., Coon, B. G., Yun, S., Schwartz, M. A. Endothelial fluid shear stress sensing in vascular health and disease. The Journal of Clinical Investigation. 126 (3), 821-828 (2016).
- Min, E., et al. Activation of Smad 2/3 signaling by low shear stress mediates artery inward remodeling. bioRxiv. , 691980 (2019).
- Zhou, J., et al. BMP receptor-integrin interaction mediates responses of vascular endothelial Smad1/5 and proliferation to disturbed flow. Journal of Thrombosis and Haemostasis. 11 (4), 741-755 (2013).
- Zhou, J., et al. Force-specific activation of Smad1/5 regulates vascular endothelial cell cycle progression in response to disturbed flow. Proceedings of the National Academy of Sciences of the United States of America. 109 (20), 7770-7775 (2012).
- van Dijk, R. A., et al. Visualizing TGF-β and BMP signaling in human atherosclerosis: A histological evaluation based on Smad activation. Histology and Histopathology. 27 (3), 387-396 (2012).
- Derwall, M., et al. Inhibition of bone morphogenetic protein signaling reduces vascular calcification and atherosclerosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 32 (3), 613-622 (2012).
- Fredriksson, S., et al. Protein detection using proximity-dependent DNA ligation assays. Nature Biotechnology. 20 (5), 473-477 (2002).
- Söderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nature Methods. 3 (12), 995-1000 (2006).
- Alam, M. S. Proximity Ligation Assay (PLA). Current Protocols in Immunology. 123 (1), 58 (2018).
- Application Note 03: Growing Cells in µ-Channels. ibidi Available from: https://ibidi.com/img/cms/support/AN/AN03_Growing_cells.pdf (2012)
- Application Note 13: HUVECs under perfusion. ibidi Available from: https://ibidi.com/img/cms/support/AN/AN13_HUVECs_under_perfusion.pdf (2019)
- ibidi. Application Note 31: Instructions µ-Slide VI 0.4. ibidi. , (2013).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Reichenbach, M., et al. Differential impact of fluid shear stress and YAP/TAZ on BMP/TGF-β induced osteogenic target genes. Advanced Biology. 5 (2), 2000051 (2021).
- Hiepen, C., Mendez, P. L., Knaus, P. It takes two to tango: Endothelial TGFβ/BMP signaling crosstalk with mechanobiology. Cells. 9 (9), 1965 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır