JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
근접-리깅-분석기 사용 이체 유체 전단 응력 조건 하에서 TGFβ/BMP/SMAD 신호의 시각화 및 정량화
요약
여기서, 병리학및 생리학적 유체 전단 응력 조건에 노출된 내피 세포에서 근접 계각 분석(PLA)을 사용하여 여러 SMAD 복합체를 동시에 시각화하고 분석하는 프로토콜을 수립합니다.
초록
성장인자 β 변형(TGFβ)/뼈 형태유전학 단백질(BMP) 시그널링은 혈관시스템의 발달 및 항상성 동안 엄격하게 조절되고 균형을 이루며, 따라서 이 신호 경로에서 의변조절은 폐동맥 고혈압, 유전출혈성 및 혈관경화와 같은 심한 혈관 병리를 초래한다. 혈관의 가장 안쪽 층인 내피 세포(EC)는 유체 전단 응력(SS)에 지속적으로 노출됩니다. 유체 SS의 비정상적인 패턴은 TGFβ/BMP 시그널링을 향상시키는 것으로 나타났으며, 이는 다른 자극과 함께, 괴로발생을 유도한다. 이와 관련하여, 아테로경향이, 낮은 라미나르 SS는 TGFβ/BMP 신호를 향상시키는 동시에 높은 라미나르 SS를 향상시키는 것으로 밝혀졌으며, 이 신호는 감소시킨다. 이러한 경로의 활성화를 효율적으로 분석하기 위해, 우리는 상용 공압 펌프 시스템과 근접 계합 분석 (PLA)를 사용하여 낮은 라미나르 SS 및 높은 라미나르 SS 조건하에서 전사 인자 복합체의 형성을 조사하기 위해 워크플로우를 설계했습니다.
활성 TGFβ/BMP 신호는 두 개의 규제 SMADs(R-SMAD)로 구성된 트리메릭 SMAD 복합체의 형성을 필요로 한다. SMAD2/3 및 SMAD1/5/8 TGFβ 및 BMP 시그널링에 대한 각각)을 공통 중재자 SMAD(공동 SMAD; SMAD4). 트리메릭 SMAD 복합체, 즉 R-SMAD/공동 SMAD 또는 R-SMAD/R-SMAD의 상이한 하위 단위를 대상으로 하는 PLA를 사용하여 활성 SMAD 전사 인자 복합체의 형성은 형광 현미경을 사용하여 정량적으로 그리고 공간적으로 측정될 수 있다.
6개의 작은 병렬 채널이 있는 플로우 슬라이드를 사용하면 연재하여 연결할 수 있으며, 전사 인자 복합 형성 및 필요한 컨트롤의 포함에 대한 조사를 가능하게 합니다.
여기에 설명된 워크플로우는 다른 유체 SS 조건에서 SMAD가 아닌 다른 전사 인자 복합체에 대한 SMAD의 근접성을 대상으로 하는 연구에 쉽게 적응할 수 있습니다. 여기에 제시된 워크플로우는 정량적으로나 공간적으로 모두 EC에서 유도된 TGFβ/BMP 신호를 연구하는 빠르고 효과적인 방법을 보여줍니다.
서문
변형 성장 인자 베타 (TGFβ) 슈퍼 패밀리의 단백질은 TGFβs, 뼈 형태 유전학 단백질 (BmPs), 및 Activins1,2를 포함한 다양한 구성원을 가진 흉골 사이토카인이다. 리간드 결합은 인산화로 이어지는 수용체 올리고머의 형성을 유도하고, 이에 의해, 세포조절SMAD(R-SMAD)의 활성화를 유도한다. 리간드의 하위 패밀리에 따라 다른 R-SMAD가 활성화됩니다1,2. TGFβs 및 액티빈은 주로 SMAD2/3의 인산화를 유도하는 반면, BMP는 SMAD1/5/8 인산화를 유도합니다. 그러나, BmPs와 TGFβs/Activins는 또한 '측면 신호'3,4,5,6,7,8로 불리는 프로세스에서 각각다른 하위 가족의 R-SMADs를 활성화하고 SMAD1/5 및 SMAD2/3, 회원 으로 구성된 혼합 SMAD 복합체가 있다는 증거가 축적되어 있습니다. . 두 개의 활성 R-SMADs는 이후 공통 중재자 SMAD4와 트리메릭 복합체를 형성한다. 이러한 전사 인자 복합체는 핵으로 배분하고 표적 유전자의 전사를 조절할 수 있습니다. SMADs는 다양한 상이한 전사 공동 활성제 및 공동 억압자와 상호 작용할 수 있으며, 표적 유전자10을 조절할 수 있는 가능성의 다양화로 이어집니다. SMAD 신호의 규제 완화는 다양한 질병에 심각한 영향을 미칩니다. 이에 따라 불균형한 TGFβ/BMP 시그널링은 폐 동맥 고혈압, 유전출혈성 혈관기암증 또는 죽상 경화증3,11,12,13,14와 같은 심한 혈관 병리로 이어질 수 있다.
내피 세포 (EC)는 혈관의 가장 안쪽 층을 형성하고, 따라서, 전단 응력 (SS),에 노출, 혈액의 점성 흐름에 의해 가해지는 마찰 력. 흥미롭게도, 균일한, 라미나르 SS의 상부에 노출되는 혈관의 부분에 거주하는 IC는, 정각적이고 정지상태에 보관됩니다. 대조적으로, 비균일한 SS를 경험하는 EC는, 예를 들면, 양면 또는 대동맥 아치의 더 적은 곡률에서, 증식하고 선동적인 통로를 활성화합니다15. 차례로, 기능 장애 PC의 사이트는 동맥 경화증을 개발하는 경향이있다. 흥미롭게도, 이러한 atheroprone 지역에 있는 EC는 활성화된 SMAD2/3 및 SMAD1/516,17,18의 비정상적으로 높은 수준을 표시합니다. 이러한 맥락에서, 향상된 TGFβ/BMP 시그널링은 동맥경화성 병변19의 개발초기 발생으로 밝혀졌으며 BMP 신호와의 간섭은 혈관 염증, 무종 형성 및 관련 석회화20을 현저하게 감소시키는 것으로 밝혀졌다.
근접 결찰 분석법(PLA)은 situ21,22에서 단백질-단백질 상호 작용을 연구하는 생화학 적 기술입니다. 그것은 관심있는 표적 단백질을 결합할 수 있는 상이한 종의 항체의 특이성에 의존하여 단일 세포 수준에서 내인성 단백질 상호 작용의 매우 특이적인 검출을 허용합니다. 여기서, 1차 항체는 검출을 허용하기 위해 40nm 미만의 거리에서 표적 에피토프에 결합해야 한다.23. 따라서 PLA는 내인성 단백질 상호 작용을 감지하기 위해 수백만 개의 세포가 필요한 전통적인 공동 면역 침전 접근 에 크게 유용합니다. PLA에서, 종 특정 이차 항체는, DNA 단편에 공유하게 연결됩니다 (플러스와 마이너스 프로브라고 합니다), 1 차적인 항체를 묶고 관심의 단백질이 상호 작용하는 경우에, 플러스와 마이너스 프로브는 가까이에 옵니다. DNA는 다음 단계에서 결찰되고 원형 DNA의 롤링 원 증폭이 가능하게 된다. 증폭 하는 동안, 형광 표지 보완 올리고 뉴클레오티드 합성 된 DNA에 바인딩, 이러한 단백질 상호 작용을 허용 하는 기존의 형광 현미경 검사법에 의해 시각화 될 수.
여기에 설명된 프로토콜은 과학자들이 PLA를 사용하여 시험관내 의 에로히어로프로텍션 및 아로테경향이 있는 SS 조건에서 활성 SMAD 전사 복합체의 수를 정량적으로 비교할 수 있게 합니다. SS는 정의된 레벨의 라미나르 단방향 흐름을 생성할 수 있고 유량의 단계별 증가를 허용하는 프로그래밍 가능한 공압 펌프 시스템을 통해 생성됩니다. 이 방법을 사용하면 SMAD1/5 또는 SMAD2/3과 SMAD4 및 혼합 R-SMAD 복합체 간의 상호 작용을 감지할 수 있습니다. SMAD와 전사 공동 규제 기관과의 상호 작용을 분석하거나 SMAD 이외의 전사 인자 복합체로 쉽게 확장할 수 있습니다. 그림 1 은 아래에 제시된 프로토콜의 주요 단계를 보여 주세요.
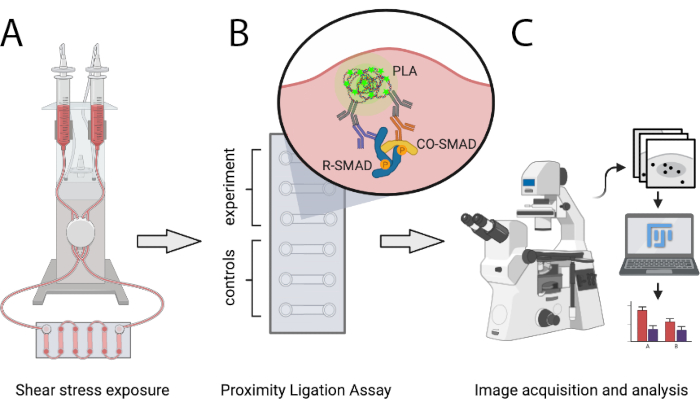
그림 1: 설명된 프로토콜의 회로도 표현입니다. (A) 6채널 슬라이드에서 시드된 셀은 공압 펌프 시스템으로 전단 응력에 노출된다. (B) 고정 셀은 PLA 실험 또는 제어 조건에 사용됩니다. (C) PLA 실험의 이미지는 형광 현미경으로 획득하고 ImageJ 분석 소프트웨어를 사용하여 분석된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
1. 세포 배양 및 유체 전단 응력 노출
참고: 인간 배꼽 정맥 IC(HUVECs)는 SMADs의 SS 유도 상호 작용을 연구하는 예로 사용되었습니다. 아래에 설명된 프로토콜은 모든 SS 반응형 세포 유형에 적용될 수 있다.
- PBS에서 0.1% 돼지 피부 젤라틴으로 6채널 슬라이드를 37°C에서 30분 동안 코팅합니다.
- M199 풀 배지의 30 μL에서 mL당 2.5 x 106 셀의 밀도로 미리 코팅된 6채널 슬라이드의 시드 HUVECs.
참고: 유량 슬라이드에서 셀을 시드하는 방법에 대한 자세한 내용은 참조24를 참조하십시오24를 참조하십시오. - 가습 된 인큐베이터에서 세포가 37 °C에서 1 h를 부착하십시오.
- 미리 따뜻해지는 M199 전체 매체의 60 μL을 각 저장소에 추가합니다.
- 가습 인큐베이터에서 하루에 한 번 37 °C에서 부드러운 중간 교환으로 2 일 동안 배양하십시오.
- 저수지를 완전히 흡인시키고, 미리 따뜻워진 M199의 120 μL을 저수지 중 하나에 넣고 다른 쪽에서 흡인합니다.
- 미리 따뜻워진 M199 전체 중간 크기의 60 μL을 두 저장소에 추가합니다.
- 참조25에 자세히 설명된 대로 흐름 설정을 어셈블하고 시작합니다.
- 유체 단위에 마운트 튜브. 여기서 직경 0.8mm 및 1.6mm의 실리콘 튜브는 각각 1 dyn/cm2 및 30 dyn/cm2의 전단 응력에 사용됩니다.
참고: 변경사항이 결과 전단 응력에 영향을 줄 수 있으므로 재료 및 튜브 길이는 일정하게 유지되어야 합니다. 일반적으로 펌프 시스템과 튜빙의 다른 조합은 결과 전단 응력이 알려져 있는 한 사용할 수 있으며 펌프는 꾸준한 라미나르 흐름을 생성합니다. - 미리 데워진 M199 전체 매체(최소 10mL)의 적절한 양으로 저장소를 채웁니다.
- 유체 단위를 튜브와 펌프 시스템에 연결하고 세포 없이 사전 실행을 수행하여 배지를 평형화하고 나머지 air25를 제거합니다.
- 직렬 연결 튜브를 사용하여 6채널 슬라이드의 단일 채널을 서로 연결합니다. 슬라이드의 첫 번째 채널과 마지막 채널은 1.6.1로 조립된 튜빙에 연결됩니다(구성표 의 그림 1A 참조). 이 심각하게 세포를 해칠 수 있기 때문에 시스템에 공기를 도입하지 않도록주의하십시오. 직렬 연결에 대한 자세한 내용은 참조26에서 찾을 수 있습니다.
- 전단 응력 (>20 dyn/cm2)에 세포의 노출을 위해 램프 단계, 즉 적응 단계와 함께 단계적으로 전단 응력을 증가시면 됩니다. 단계는 30분당 5dyn/cm2 단위로 설정할 수 있습니다.
- 유체 단위에 마운트 튜브. 여기서 직경 0.8mm 및 1.6mm의 실리콘 튜브는 각각 1 dyn/cm2 및 30 dyn/cm2의 전단 응력에 사용됩니다.
2. 고정
- 유체 SS 노출 후 펌프에서 슬라이드를 분리합니다. 배양기에서 중간 유출을 방지하기 위해 분리 할 때 튜브에 클램프를 사용합니다.
- 얼음에 흐름 슬라이드를 즉시 옮기고 나머지 튜브는 순차적으로 분리됩니다. 저수지에서 튜브를 제거할 때, 다른 쪽의 저수지는 채널에 기포를 포획하지 않도록 손가락으로 닫혀 있어야 합니다. 이렇게 하면 고정 단계가 방해가 될 수 있습니다.
- 얼음에 세포를 유지, 조심스럽게 저수지에서 매체를 흡인하지만 세포가 거주하는 채널에서. 이어서, 차가운 멸균 PBS(4°C)로 시료를 3배 채널 부피(90μL)로 세척한다. 한 저장소에 PBS를 추가하고 다른 저수지에서 조심스럽게 흡인합니다. 슬라이드당 6개 채널 각각에서 이 단계를 반복합니다.
참고: 모든 세척 및 배양 단계의 경우 각 솔루션이 저장소 중 하나에 추가되어 채널의 솔루션 교환이 됩니다. 채널에서 솔루션을 완벽하게 대체할 수 있도록 하려면 초과 솔루션이 다른 저장소에서 흡입됩니다. 채널내 셀 상단의 용액은 제거되지 않습니다. 세포는 언제든지 건조해서는 안됩니다. 따라서 슬라이드에 기포를 삽입하지 않고 신중하게 세척하는 것이 중요합니다. - PBS가 미리 첨가된 것과 동일한 저장소에 버퍼링된 4% PFA 용액의 90 μL을 추가하여 세포를 수정하고 다른 저장소에서 액체를 유사하게 흡인시합니다. 각 슬라이드의 각 채널에서 이 단계를 반복합니다. PFA 용액을 추가한 후 샘플을 얼음에서 실온(RT)으로 옮기고 20분 동안 배양합니다.
주의: PFA는 독성이 있으며 신중하게 처리해야 합니다. 장갑을 사용하고 연기 후드 아래에서 작업하십시오. - PBS (RT)로 셀 을 3 배 세척하여 하나의 저수지에 추가하고 다른 저수지에서 조심스럽게 흡입하십시오. 저수지만 비우면 채널을 건조시키지 않도록 합니다. 슬라이드당 6개 채널 각각에 대해 이 단계를 반복합니다.
- PBS에 주변 50mM 암모늄 염화암모늄의 90 μL을 저수지 중 하나에 추가하여 PFA 고정을 담금질하십시오. 다른 저수지에서 과도한 용액을 흡인합니다. 슬라이드의 각 채널에 대해 반복합니다. RT에서 10분 동안 샘플을 배양합니다.
- 2.5 단계에서 설명한 대로 씻으세요.
참고: 이 시점에서, 샘플은 하룻밤 사이에 4°C로 저장될 수 있거나, 프로토콜은 차단 및 1차 항체 배큐어로 즉시 계속될 수 있다(3단계 참조).
3. 차단 및 1 차 항체 배큐어
- 세포를 투과화하려면 비운 저수지에 PBS에 0.3% 트리톤-X-100의 90 μL을 추가하고 각 채널에 대해 다른 저장소에서 흡인합니다. RT에서 10 분 동안 배양하십시오.
- 2.5 단계에서 설명한 대로 씻으세요.
- 90 μL의 멸균 PLA 차단 용액을 채널의 한 저장소에 추가하고 다른 쪽에서 흡인합니다. 각 채널에 대해 이 단계를 반복합니다. 가습 챔버에서 37 °C에서 1 h에 대한 블록.
- 가습 챔버를 만들려면 왁스 필름으로 밀봉 된 젖은 티슈가있는 10cm 접시를 사용하여 인큐베이터에 접시를 놓습니다. 또는 습한 대기를 공급하는 다른 습도 챔버 형식을 사용할 수 있습니다.
참고: 또는, 자체 제작 차단 솔루션(예: PBS, 멸균 여과된 BSA)을 3%(w/v) BSA로 사용할 수 있다.
- 가습 챔버를 만들려면 왁스 필름으로 밀봉 된 젖은 티슈가있는 10cm 접시를 사용하여 인큐베이터에 접시를 놓습니다. 또는 습한 대기를 공급하는 다른 습도 챔버 형식을 사용할 수 있습니다.
- PLA 항체 희석제에서 1차 항체(1:100)를 준비한다. 채널당 용액의 30 μL을 준비합니다. 1 차적인 항체와 소용돌이 둘 다 동시에 추가하십시오.
참고: 대안적으로, 자체 만든 항체 희석제(예를 들어, PBS에서 1%(w/v) BSA)를 사용할 수 있다. 여기에 사용되는 항체는 SMAD1-SMAD2/3, SMAD2/3-SMAD4 및 인-SMAD1/5-SMAD4의 조합입니다. 자세한 정보는 재료 표에서 찾을 수 있습니다. - 1차 항체를 적용하기 전에, 저수지로부터 차단 용액을 흡인시키고, 또한 채널에서 신중하게 흡입한다. 1차 항체 용액의 파이펫 30 μL은 용액을 추가하는 동안 채널을 기울여 빈 채널로 즉시 들어갑니다.
참고: 차단 용액의 제거및 항체 용액 채널별 채널의 추가를 수행하여 세포가 그 사이에 건조하지 않도록 합니다. - 4°C에서 가습 챔버에서 하룻밤 동안 1 차 항체를 가진 시료를 배양한다.
참고: 같은 날 다음 단계를 계속 진행하려면 실온에서 1시간 동안 인큐베이션을 수행할 수도 있습니다.
4. PLA 프로브 인큐베이션
참고: 4.1-7.3 절의 모든 단계에 대해, 세척 버퍼 A와 B는 4°C에 저장되며 사용하기 전에 RT로 데워져야 합니다.
- PLA-프로브(+)-마우스 및 (-)-토끼를 PLA 항체 희석제(또는 1% BSA) 용액에서 1:5로 희석한다. 채널당 30μL를 준비합니다.
- 저수지 중 하나에 추가하고 다른 저수지에서 조심스럽게 흡입하여 RT에서 세척 버퍼 A의 90 μL을 사용하여 5 분 동안 샘플을 2 배 세척하십시오. 슬라이드당 6개 채널 각각에 대해 이 단계를 반복합니다.
- 세척 버퍼 A를 조심스럽게 흡인시키고 3.5 단계에서 1차 항체를 첨가하는 것과 유사한 PLA 프로브 용액(단계 4.1에서 제조됨)의 30 μL을 추가한다.
- 가습 챔버에서 37 °C에서 1 h에 대한 샘플을 배양합니다.
5. 결찰
- 4.2에 설명된 대로 RT에서 세척 버퍼 A의 90 μL을 사용하여 5 분 동안 샘플을 2 배 세척하십시오.
- 디온화된 물에 결찰 버퍼의 1:5 희석을 준비합니다. 이 버퍼를 사용하여 리구효소 효소를 1:40(얼음)으로 희석시 보세요. 채널당 30μL을 사용합니다.
- 세척 버퍼 A를 완전히 흡인하고 3.5에 설명된 대로 계합 용액을 추가합니다.
- 가습 챔버에서 37 °C에서 30 분 동안 샘플을 배양합니다.
6. 증폭
- 4.2에 설명된 대로 RT에서 90 μL의 세척 버퍼 A를 사용하여 2 분 동안 샘플을 2 배 세척하십시오.
- 증액 을 1:5로 희석하여 증폭 완충액을 준비하고 폴리머라제 효소를 1:80(얼음)으로 희석하는 데 사용합니다. 빛으로부터 보호하십시오. 채널당 30μL를 준비합니다.
- 세척 버퍼 A를 완전히 흡인하고 즉시 3.5에 설명된 대로 준비된 증폭 용액을 빈 채널에 추가합니다. 가습 챔버에서 37 °C에서 100 분 동안 샘플을 배양합니다.
7. 마운팅
- 4.2에 설명된 대로 RT에서 90 μL의 워시 버퍼 B를 사용하여 10분 동안 샘플을 2배 세척합니다. 염색 핵에 첫 번째 세척에 1 mg /mL 재고 용액 (탈화 된 물에)에서 DAPI (1:500)를 추가합니다. 채널을 건조하지 마십시오.
- 세척 버퍼 B를 탈이온 수분(1:10)으로 희석하고 4.2에 설명된 대로 0.1x 버퍼 B 용액의 90 μL로 1배 세척합니다.
- 세척 버퍼 B를 완전히 흡인하고 즉시 액체 장착 매체의 2-3 방울을 하나의 저장소에 추가합니다. 슬라이드를 기울여 채널에 배포합니다. 이미징까지 가습 된 환경에서 4 °C에서 샘플을 저장합니다.
8. 이미지 수집
- 형광 현미경을 사용하여 이미지를 획득하십시오. 형광 PLA 프로브에 맞는 각 필터를 사용할 수 있는지 확인합니다.
참고: 가능한 한, 획득한 PLA 반점이 더 정의되기 때문에 공초점 현미경을 사용하는 것이 유익합니다. 이를 통해 추가 이미지 처리 및 데이터 분석을 지원합니다.
9. ImageJ/FIJI를 이용한 이미지 분석 및 정량화
- ImageJ27과 같은 이미지 프로세싱 프로그램을 통해 내보낸 이미지(.tiff)를 처리합니다.
참고: 본 연구에서 사용되는 모든 스크립트는 셀룰러, 핵 및 셀당 모든 PLA 이벤트(셀당)의 자동 계수에 필요한 스크립트를 GitHub 리포지 https://github.com/Habacef/Proximity-Ligation-Assay-analysis 토리에서 찾을 수 있습니다. 적합한 프로그램이나 도구를 사용하여 통계 분석을 수행합니다.
결과
우리는 이전에 다른 SMAD 단백질3의 상호 작용을 검출하기 위하여 PLA를 사용하고 SMAD 인산화28에 있는 전단 응력 유도한 변경을 분석했습니다.
여기서, 두 방법은 위에서 설명한 프로토콜과 결합되었다. HUVECs는 1 dyn/cm2 및 30 dyn/cm2 의 전단 응력에 복종하고 SMAD 전사 요인의 상호 작용을 위해 분석되었습니다. 높은 전단 응력(30dy...
토론
여기에 설명된 PLA 기반 프로토콜은 정량적 및 공간 해상도를 가진 전단 응력에 노출된 IC에서 두 가지 단백질(예를 들어, 그들의 직접적인 상호 작용)의 근접성을 결정하는 효율적인 방법을 제공합니다. 여러 병렬 채널을 가진 유량 슬라이드를 사용하여 동일한 기계적 조건하에서 세포에서 동시에 여러 가지 단백질 상호 작용을 검사 할 수 있습니다. 대조적으로, 사용자 정의 빌드 흐름 챔버 시스?...
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
우리는 마리아 라이헨바흐 박사와 크리스티안 히펜 박사가 흐름 설정 시스템에 대한 지원에 감사를 표하고 엘리너 폭스와 윤윤 샤오는 원고를 비판적으로 읽었습니다. P-L.M. 국제 막스 플랑크 연구 학교 IMPRS 생물학 및 계산에 의해 투자되었다 (IMPRS-BAC). PK는 DFG-SFB1444에 의해 자금을 받았다. 그림 1은 BioRender를 사용하여 만들어졌습니다.
자료
| Name | Company | Catalog Number | Comments |
| µ-Slide VI 0.4 | ibidi | 80606 | 6-channel slide |
| Ammonium Chloride | Carl Roth | K298.1 | Quenching |
| Bovine Serum Albumin | Carl Roth | 8076.4 | Blocking |
| DAPI | Sigma Aldrich/ Merck | D9542 | Stain DNA/Nuclei |
| DPBS | PAN Biotech | P04-53500 | PBS |
| Duolink In Situ Detection Reagents Green | Sigma Aldrich/ Merck | DUO92014 | PLA kit containing Ligase, ligation buffer, polymerase and amplification buffer (with green labeled oligonucleotides) |
| Duolink In Situ PLA Probe Anti-Mouse MINUS | Sigma Aldrich/ Merck | DUO92004 | MINUS probe |
| Duolink In Situ PLA Probe Anti-Rabbit PLUS | Sigma Aldrich/ Merck | DUO92002 | PLUS probe |
| Duolink In Situ Wash Buffers, Fluorescence | Sigma Aldrich/ Merck | DUO82049 | PLA wash buffers A and B |
| Endothelial Cell Growth Supplement | Corning | supplement for medium (ECGS) | |
| Fetal calf Serum | supplement for medium | ||
| FIJI | Image Analysis software | ||
| Formaldehyde solution 4% buffered | KLINIPATH/VWR | VWRK4186.BO1 | PFA |
| Full medium | M199 basal medium +20 % FCS +1 % P/S + 2 nM L-Glu + 25 µg/mL Hep + 50 µg/mL ECGS | ||
| Gelatin from porcine skin, Type A | Sigma Aldrich | G2500 | Use 0.1% in PBS for coating of flow channels |
| GraphPad Prism v.7 | GarphPad | Statistical Program used for the Plots and statistical calculations | |
| Heparin sodium salt from porcine intestinal mucosa | Sigma Aldrich | H4784-250MG | supplement for medium (Hep) |
| HUVECs | |||
| ibidi Mounting Medium | ibidi | 50001 | Liquid mounting medium |
| ibidi Pump System | ibidi | 10902 | pneumatic pump |
| Leica TCS SP8 | Leica | confocal microscope | |
| L-Glutamin 200mM | PAN Biotech | P04-80100 | supplement for medium (L-Glu) |
| Medium 199 | Sigma Aldrich | M2154 | Base medium |
| mouse anti- SMAD1 Antibody | Abcam | ab53745 | Suited for PLA |
| mouse anti- SMAD2/3 Antibody | BD Bioscience | 610843 | Not suited for PLA in combination with CST 9515 |
| mousee anti- SMAD4 Antibody | Sanata Cruz Biotechnology | sc-7966 | Suited for PLA |
| Penicillin 10.000U/ml /Streptomycin 10mg/ml | PAN Biotech | P06-07100 | supplement for medium (P/S) |
| Perfusion Set WHITE | ibidi | 10963 | Tubings used for 1 dyn/cm2 |
| Perfusion Set YELLOW and GREEN | ibidi | 10964 | Tubings used for 30 dyn/cm2 |
| rabbit anti- phospho SMAD1/5 Antibody | Cell Signaling Technologies | 9516 | Suited for PLA |
| rabbit anti- SMAD2/3 XP Antibody | Cell Signaling Technologies | 8685 | Suited for PLA |
| rabbit anti- SMAD4 Antibody | Cell Signaling Technologies | 9515 | Not suited for PLA in combination with BD 610843 |
| Serial Connector for µ-Slides | ibidi | 10830 | serial connection tubes |
| Triton X-100 | Carl Roth | 6683.1 | Permeabilization |
참고문헌
- Yadin, D., Knaus, P., Mueller, T. D. Structural insights into BMP receptors: Specificity, activation and inhibition. Cytokine and Growth Factor Reviews. 27, 13-34 (2016).
- Sieber, C., Kopf, J., Hiepen, C., Knaus, P. Recent advances in BMP receptor signaling. Cytokine and Growth Factor Reviews. 20 (5-6), 343-355 (2009).
- Hiepen, C., et al. BMPR2 acts as a gatekeeper to protect endothelial cells from increased TGFβ responses and altered cell mechanics. PLoS Biology. 17 (12), 3000557 (2019).
- Hildebrandt, S., et al. ActivinA induced SMAD1/5 Signaling in an iPSC derived EC model of Fibrodysplasia Ossificans Progressiva (FOP) can be rescued by the drug candidate saracatinib. Stem Cell Reviews and Reports. , (2021).
- Goumans, M. J., et al. Balancing the activation state of the endothelium via two distinct TGF-beta type I receptors. The EMBO Journal. 21 (7), 1743-1753 (2002).
- Goumans, M. J., et al. Activin receptor-like kinase (ALK)1 is an antagonistic mediator of lateral TGFbeta/ALK5 signaling. Molecular Cell. 12 (4), 817-828 (2003).
- Daly, A. C., Randall, R. A., Hill, C. S. Transforming growth factor beta-induced Smad1/5 phosphorylation in epithelial cells is mediated by novel receptor complexes and is essential for anchorage-independent growth. Molecular and Cellular Biology. 28 (22), 6889-6902 (2008).
- Ramachandran, A., et al. TGF-β uses a novel mode of receptor activation to phosphorylate SMAD1/5 and induce epithelial-to-mesenchymal transition. eLife. 7, 31756 (2018).
- Flanders, K. C., et al. Brightfield proximity ligation assay reveals both canonical and mixed transforming growth factor-β/bone morphogenetic protein Smad signaling complexes in tissue sections. The Journal of Histochemistry and Cytochemistry : The Official Journal of The Histochemistry Society. 62 (12), 846-863 (2014).
- Miyazono, K., Maeda, S., Imamura, T., Dijke, P. T., Heldin, C. -. H. . Smad Signal Transduction: Smads in Proliferation, Differentiation and Disease. , 277-293 (2006).
- Goumans, M. J., Zwijsen, A., Ten Dijke, P., Bailly, S. Bone morphogenetic proteins in vascular homeostasis and disease. Cold Spring Harbor Perspectives in Biology. 10 (2), 031989 (2018).
- Cai, J., Pardali, E., Sánchez-Duffhues, G., ten Dijke, P. BMP signaling in vascular diseases. FEBS Letters. 586 (14), 1993-2002 (2012).
- Cunha, S. I., Magnusson, P. U., Dejana, E., Lampugnani, M. G. Deregulated TGF-β/BMP signaling in vascular malformations. Circulation research. 121 (8), 981-999 (2017).
- MacCarrick, G., et al. Loeys-Dietz syndrome: a primer for diagnosis and management. Genetics in Medicine : An Official Journal of the American College of Medical Genetics. 16 (8), 576-587 (2014).
- Baeyens, N., Bandyopadhyay, C., Coon, B. G., Yun, S., Schwartz, M. A. Endothelial fluid shear stress sensing in vascular health and disease. The Journal of Clinical Investigation. 126 (3), 821-828 (2016).
- Min, E., et al. Activation of Smad 2/3 signaling by low shear stress mediates artery inward remodeling. bioRxiv. , 691980 (2019).
- Zhou, J., et al. BMP receptor-integrin interaction mediates responses of vascular endothelial Smad1/5 and proliferation to disturbed flow. Journal of Thrombosis and Haemostasis. 11 (4), 741-755 (2013).
- Zhou, J., et al. Force-specific activation of Smad1/5 regulates vascular endothelial cell cycle progression in response to disturbed flow. Proceedings of the National Academy of Sciences of the United States of America. 109 (20), 7770-7775 (2012).
- van Dijk, R. A., et al. Visualizing TGF-β and BMP signaling in human atherosclerosis: A histological evaluation based on Smad activation. Histology and Histopathology. 27 (3), 387-396 (2012).
- Derwall, M., et al. Inhibition of bone morphogenetic protein signaling reduces vascular calcification and atherosclerosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 32 (3), 613-622 (2012).
- Fredriksson, S., et al. Protein detection using proximity-dependent DNA ligation assays. Nature Biotechnology. 20 (5), 473-477 (2002).
- Söderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nature Methods. 3 (12), 995-1000 (2006).
- Alam, M. S. Proximity Ligation Assay (PLA). Current Protocols in Immunology. 123 (1), 58 (2018).
- Application Note 03: Growing Cells in µ-Channels. ibidi Available from: https://ibidi.com/img/cms/support/AN/AN03_Growing_cells.pdf (2012)
- Application Note 13: HUVECs under perfusion. ibidi Available from: https://ibidi.com/img/cms/support/AN/AN13_HUVECs_under_perfusion.pdf (2019)
- ibidi. Application Note 31: Instructions µ-Slide VI 0.4. ibidi. , (2013).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Reichenbach, M., et al. Differential impact of fluid shear stress and YAP/TAZ on BMP/TGF-β induced osteogenic target genes. Advanced Biology. 5 (2), 2000051 (2021).
- Hiepen, C., Mendez, P. L., Knaus, P. It takes two to tango: Endothelial TGFβ/BMP signaling crosstalk with mechanobiology. Cells. 9 (9), 1965 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유