Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
RNA Aptamerleri ve Riboswitch'leri kodlayan DNA Plazmidleri ile Yüklü Çok Fonksiyonlu İpek Bazlı Mikrokapsüllerin Hazırlanması
Bu Makalede
Özet
Protokol, sağlam ve biyouyumlu DNA yüklü mikrokapsüllerin oluşumunu, birkaç ligandı izleyebilen çoklanmış in vitro biyosensörler olarak tanımlar.
Özet
DNA yüklü ipek fibroin mikrokapsüllerinin, kurban küresel çekirdekler üzerinde Katman Katman (LbL) montaj yöntemiyle hazırlanması için bir protokol sunuyoruz. Bir asal tabakanın ve DNA plazmidlerinin adsorpsiyonunu takiben, tek bir ipek tabakasının akut dehidrasyonu sırasında ipek sekonder yapıda β-tabakaların indüklenmesiyle sağlam mikrokapsüllerin oluşumu kolaylaştırılmıştır. Bu nedenle, katmanlama çoklu hidrojen bağı ve hidrofobik etkileşimler yoluyla gerçekleşti. Çok katmanlı kabukların adsorpsiyonu üzerine, çekirdek-kabuk yapıları, uzaktan algılama ve / veya hedeflenen teslimat için kullanılacak altın nanopartiküller (AuNP'ler) ve / veya antikorlar (IgG) ile daha da işlevselleştirilebilir. Bir polimer astarının varlığı, DNA ve ipek proteininin konsantrasyonu ve bir dizi adsorbe edilmiş katmanın yanı sıra bir dizi adsorbe edilmiş katman gibi anahtar makromoleküllerin silika çekirdekleri üzerinde sıralı birikimi sırasında birkaç anahtar parametrenin ayarlanması, değişken geçirgenlik ve DNA yüklemelerine sahip biyouyumlu, DNA yüklü mikrokapsüllerle sonuçlandı. Silika çekirdeklerinin çözünmesi üzerine, protokol, kapsül zarının iç yüzeyine hareketsiz hale getirilmiş DNA plazmidleri ile içi boş ve sağlam mikrokapsüllerin oluşumunu gösterdi. DNA plazmidleri ve dış ortam arasında seçici olarak geçirgen biyouyumlu bir zar oluşturmak, uzun süreli depolama sırasında DNA'yı korudu ve mekansal olarak sınırlandırılmış plazmidlerden gelen gelişmiş çıktı tepkisinde önemli bir rol oynadı. DNA şablonlarının aktivitesi ve erişilebilirliği, in vitro transkripsiyon ve translasyon reaksiyonları (hücresiz sistemler) sırasında test edildi. RNA ışıklandırma aptamerlerini ve riboswitchlerini kodlayan DNA plazmidleri, floresan olarak etiketlenmiş RNA transkriptlerinin veya GFPa1 proteininin kabuk zarlarında lokalizasyonu sırasında görselleştirildiği gibi, karşılık gelen analitlerle başarıyla aktive edildi.
Giriş
Sentetik biyoloji alanı, çevrelerini ve potansiyel tehditlerini izlemek için mikroorganizmalar tarafından geliştirilen doğal mekanizmalardan yararlanarak algılama yeteneklerini geliştirmek için eşsiz fırsatlar sunmaktadır. Önemli olarak, bu algılama mekanizmaları tipik olarak bu mikroorganizmaları zararlı maruziyetten koruyan, olumsuz etkileri hafifletmek veya toksik maddelerin alımını önlemek için gen ekspresyonunu düzenleyen bir yanıtla bağlantılıdır. Bu mikroorganizmaları, bu doğal tepkilerden yararlanarak tüm hücre sensörleri oluşturmak üzere tasarlamak, ancak yeni hedefleri tanımak ve / veya nicelleştirme amacıyla (tipik olarak floresan) ölçülebilen ölçülebilir bir sinyal üretmek için yeniden yönlendirmek için önemli çabalar sarf edilmiştir1,2. Şu anda, genetiği değiştirilmiş mikroorganizmaların (GDO'lar) kullanımıyla ilgili endişeler, özellikle çevrede veya insan vücudunda salınırken, tüm hücrelerin veya genetik materyallerinin bir kısmının sızması nedeniyle, bir polimer matrisinde kapsüllenmiş olsa bile, bu algılama yaklaşımlarından yararlanmak için alternatif yollara ihtiyaç duyulduğunu göstermektedir3.
GDO'ların konuşlandırılması endişesi olmadan mikroorganizma bazlı algılamanın faydalarından yararlanmak için güçlü bir yaklaşım, in vitro transkripsiyon / translasyon (IVTT) sistemlerinin kullanılmasıdır. Pratik bir bakış açısıyla, IVTT sistemleri, hücre bileşenlerinin çoğunu, sonikasyon, boncuk dövme veya diğerleri de dahil olmak üzere hücrelerden farklı yollarla "ekstrakte edilmiş" aktif bir durumda içeren bir karışımdan oluşur4. Bu işlemin nihai ürünü, tüm hücrelerin kullanımıyla ilişkili kısıtlamalar (membran difüzyonu, transformasyon verimliliği, hücre toksisitesi, vb.) olmaksızın, farklı sensörleri "açık kap" formatında test etmek için kullanılabilecek transkripsiyon ve translasyon gerçekleştirmek için zaten optimize edilmiş bir biyokimyasal reaksiyon karışımıdır. Önemli olarak, farklı sensör bileşenleri nicel olarak eklenebilir ve etkileri, gösterdiğimiz gibi farklı optik ve spektrometrik tekniklerle incelenebilir5. IVTT sistemlerinin performansının tutarsız olabileceği fark edilmiştir; Bununla birlikte, son zamanlarda yapılan çalışmalar, sensör tasarımı6'daki performanslarını incelerken çok yardımcı olan hazırlık ve karakterizasyonlarını standartlaştırmak için yaklaşımlar göstermiştir. Son zamanlarda, kağıt matrislerindeki bileşenlerinin liyofilizasyonu yoluyla kağıt bazlı tahliller oluşturmak için kullanılan IVTT sistemlerinin birçok örneği, ağır metal iyonlarının, ilaçların, çekirdek algılama elemanlarının ve diğerlerinin tespiti de dahil olmak üzere gösterilmiştir 7,8,9. IVTT tabanlı sensörler için heyecan verici bir uygulama alanı, toprak, su ve insan vücudu dahil olmak üzere farklı ortam türlerinde algılama uygulamalarında kullanılmasıdır. Bu IVTT sistemlerini bu zorlu ortamlara dağıtmak için, IVTT bileşenlerini içermek ve bozulmaya karşı korumak için bir kapsülleme yaklaşımının uygulanması gerekir.
IVTT sistemleri için en yaygın kapsülleme yaklaşımları, lipit kapsüllerin, misellerin, polimerzomların ve diğer sıkıca kapatılmış mikro kapların kullanımını içerir10,11,12. Bu yaklaşımın bir dezavantajı, dış çevre ile iletişime izin vermek ve algılama yetenekleri sağlamak için malzemeleri konteynerlerin içine ve dışına taşımak için pasif veya aktif mekanizmaların dahil edilmesi ihtiyacıdır. Bu sorunların bazılarının üstesinden gelmek için, buradaki çalışma, IVTT sistemlerinde ifade edilecek farklı sensör tasarımları için kodlama malzemelerini kapsüllemek için basit ama etkili bir yaklaşım sağlayan bir yöntem bildirmektedir. Bu yaklaşım, korunan genetik materyalin tercih edilen IVTT'nin farklı bileşenleri ile etkileşime girmesini sağlayan, yüksek gözenekliliğe sahip içi boş mikrokapsüller oluşturmak için ilgili plazmidlerin varlığında bir biyopolimerin Katman Katman (LbL) birikiminin kullanılmasına dayanmaktadır. Çalışma, kapsüllenmiş plazmidlerin, plazmid kodlu bir aptamer ve bir riboswitch'in karşılık gelen hedeflerine tepkisiyle gösterildiği gibi, bu polimerik matris içinde aktive edildiğinde transkripsiyon ve translasyonu yönlendirebileceğini göstermiştir. Ek olarak, bu LbL kaplama, plazmidleri herhangi bir özel depolama koşulu olmadan aylarca korur.
Protokol
1. Plazmid vektörünün yapımı.
- pJ201:23976-RS-GFPa1 vektöründen GFPa1 ile birleştirilmiş bir teofilin riboanahtarının (ThyRS) kodlama dizisinin amplifikasyonu ve E. coli ekspresyon vektörü, pSAL13'e eklenmesi yoluyla bir plazmid vektörü (pSALv-RS-GFPa1, 3.4 kb) oluşturun. GFPa1 ile birleştirilmiş ThyRS'nin kodlama dizisini yükseltmek ve üreticinin protokolü14'e göre DNA polimeraz kullanarak 50 μL hacimde bir PCR reaksiyonu gerçekleştirmek için ileri (5'-CGTGGTACCGGTTAAGCCAGCTCGTAG-3') ve geri (5'-CGTGCTCAGCTTAAGCCAGCTCGTAG-3') primerleri kullanın.
- 0.5 g agaroz, 50 mL TAE tamponu (40 mM Tris Asetat, 1 mM EDTA, pH 8.0) ve 3 μL DNA boyasından% 1'lik bir agaroz jeli hazırlayın.
- PCR ile güçlendirilmiş ürünün 5 μL aliquot'unu 5 μL RNaz / DNaz içermeyen su ve 2 μL 6x jel yükleme boyası ile karıştırın ve agaroz jel elektroforezi ile analiz edin. Referans olarak bir DNA merdiveni (0.1-10.0 kb) yükleyin. Boya hattı neredeyse jelin dibine ulaşana kadar jeli 120 V'ta çalıştırın.
- DNA15'in doğru boyutunu kontrol etmek için bir UV transilluminatör görüntüleme sistemi kullanarak DNA parçalarını görselleştirin.
- PCR ürününü, üreticinin protokolüne göre bir PCR saflaştırma kiti kullanarak saflaştırın16.
- PCR ürününü ve pSAL ekspresyon vektörünü KpnI ve BlpI kısıtlama enzimleri ile 10 μL PCR ürünü veya plazmid vektörü (konsantrasyon 20-50 ng / μL), 1.5 μL 10x enzim tamponu, her enzimin 1 μL'si ve 1.5 μL RNaz / DNaz içermeyen su içeren 15 μL reaksiyonda, 2 saat boyunca 37 ° C'de sindirin.
- Reaksiyon karışımına 3 μL 6x jel yükleme boyası ekleyin ve sindirilmiş parçaları 1.3-1.5 adımlarında açıklandığı gibi% 1'lik bir agaroz jeli üzerinde ayırın.
- DNA parçalarını, üreticinin protokolü16'ya göre bir jel ekstraksiyon kiti kullanarak saflaştırın.
- Sindirilmiş PCR ürününü, sindirilmiş vektörün 3-20 fmol'ü, sindirilmiş PCR ürününün 9-60 fmol'ü, 2 μL ligaz tamponu, 1 μL (1 ünite) T4 DNA Ligaz ve DNaz / RNaz içermeyen suyu içeren 10 μL'lik bir reaksiyonda T4 DNA ligaz ve takviye edilmiş ligaz tamponu kullanarak sindirilmiş doğrusallaştırılmış plazmid vektörü pSAL'a dökün. Ligasyon reaksiyonunu 25 ° C'de 3 saat boyunca inkübe edin.
NOT: Reaksiyon karışımındaki toplam DNA içeriğinin 0,01-0,1 μg olduğundan emin olun. - E. coli DH5α yetkin hücreleri, üreticinin protokolü17'ye göre 10 ng ligasyon reaksiyonu karışımı ile dönüştürün.
- Dönüştürülmüş hücreleri, ampisilin (100 μg / mL) ile desteklenmiş LB-agar plakaları üzerinde bir gecede 37 ° C'de büyütün.
- Plakadan 3-4 bakteri kolonisi seçin ve her birini aseptik olarak ampisilin (100 μg / mL) ile desteklenmiş 5 mL LB ortamına aktarın. Kültürleri gece boyunca 37 ° C'de 225 rpm'de çalkalayan bir inkübatörde büyütün.
- Gece kültürlerini oda sıcaklığında 3 dakika boyunca 11 x g'de santrifüjleme ile pelet yapın.
- Plazmidleri üreticinin protokolü16'ya göre saflaştırmak için bir saflaştırma kiti kullanın.
- DNA dizilimi ile saflaştırılmış plazmidlerin dizilerini doğrulayın. Plazmid haritası ve elde edilen yapının sırası (pSALv-RS-GFPa1) Şekil 1'de gösterilmiştir.
2. Büyük ölçekli DNA saflaştırma.
- Plazmid vektörü pSALv-RS-GFPa1 (3.4 kb) (GFPa1 muhabir geni ile birleştirilmiş teofilin riboswitch'i kodlayan) veya pET28c-F30-2xBrokoli (5.4 kb) (Brokoli aptamerini kodlayan) üreticinin protokolü17'ye göre E. coli DH5α yetkili hücrelerine dönüştürün.
- Dönüştürülmüş hücreleri, pSALv-RS-GFPa1 ile dönüştürülmüş hücreler için ampisilin (100 μg / mL) veya pET28c-F30-2x Brokoli ile dönüştürülmüş hücreler için kanamisin (50 μg / mL) ile desteklenmiş LB-agar plakaları üzerinde bir gecede 37 ° C'de büyütün.
- Plakadan 3-4 bakteri kolonisi seçin ve her koloniyi aseptik olarak uygun antibiyotik (100 μg / mL ampisilin veya 50 μg / mL kanamisin) ile desteklenmiş 5 mL LB ortamına aktarın. Kültürleri gece boyunca 37 ° C'de 225 rpm'de çalkalayan bir inkübatörde büyütün.
- Uygun antibiyotik (100 μg / mL ampisilin veya 50 μg / mL kanamisin) ile desteklenmiş 150 mL LB'ye aşılamak için gecelik kültürün 3 mL'sini kullanın ve kültürleri 225 rpm'de çalkalayan bir inkübatörde 37 ° C'de bir gecede büyütün.
- Hücreleri ≥3400 x g'de santrifüjleme ile 4 ° C'de 10 dakika boyunca pelet yapın.
- Plazmidleri üreticinin protokolü16'ya göre saflaştırmak için bir saflaştırma kiti kullanın.
- DNA'yı 0,5 mL saf DNaz/RNaz içermeyen su ile temizleyin. DNA konsantrasyonunu ölçün ve 1 mL DNA stok çözeltisi (100 ng / μL) hazırlayın. Tüpleri DNA'lı olarak 4 °C'de bir sonraki kullanıma kadar saklayın.
3. İpek fibroininin ekstraksiyonu ve başlangıç malzemelerinin hazırlanması.
- Silk-LiBr çözeltisi18'in% 10'unu oluşturmak için başka bir yerde ayrıntılı olarak açıklanan prosedüre göre Bombyx mori ipekböceği kozalarından yeniden yapılandırılmış ipek fibroin (SF) proteininin sulu bir çözeltisini hazırlayın.
- Sulu SF çözeltisinin son konsantrasyonunu belirleyin. 60 mm'lik bir Petri kabına 0,5 mL ipek çözeltisi pipetleyin, 60 ° C'de kurumasını bekleyin ve kuru ipek filmin ağırlığını ölçün. Hacim yüzdesi başına ağırlığı hesaplamak için kuru ağırlığı 0,5 mL'ye bölün.
- 1 mg/mL nihai konsantrasyon elde etmek için serolojik pipet yoluyla yavaşça su ekleyerek konsantre ipek çözeltisini DNaz/RNase içermeyen damıtılmış su ile seyreltin. Çözeltiyi ileride kullanmak üzere 4 °C'de saklayın.
- Bir antikor etiketleme kiti kullanarak floresan olarak etiketlenmiş ipek fibroini hazırlayın. Üreticinin protokolü19'a göre, proteinin N-terminal α-amino gruplarını NHS ester ile aktive edilmiş bir türev boya ile eşleştirmek için 1 mL 2 mg / mL ipek fibroin çözeltisi kullanın.
- 6 mg/mL konsantrasyonda 50 mL polietilenimin (PEI) sulu çözelti hazırlayın, HCl (1 M) ile pH'ı 4'e ayarlayın. Çözeltiyi steril bir 0,2 μm membrandan süzün. Ortam koşullarında aylarca depolama mümkündür.
- SiO2 çekirdeklerini hazırlayın. 300 μL SiO 2 partikülünü2 mL'lik bir mikrosantrifüj tüpüne pipetin. Mikropartikülleri iki kez 1 mL DNaz/RNaz içermeyen su ile 0,2 x g'de santrifüjleme ile 1 dakika boyunca yıkayın.
4. Bir asal katmanın, DNA plazmidlerinin ve ipek katmanlarının Katman Katman biriktirilmesini gerçekleştirin.
- PEI asal tabakasını SiO2 mikropartikülleri üzerine biriktirmek için, adım 3.6'dan itibaren bükülmüş peletlere 1 mL PEI çözeltisi ekleyin ve karışımı ortam koşullarında 800 rpm'de bir termomikser üzerinde 15 dakika boyunca çalkalayın. Partikülleri dört kez 1 mL DNaz / RNaz içermeyen deiyonize su ile 1 dakika boyunca 0,2 x g'de santrifüjleme ile yıkayın.
- DNA tabakasının birikmesini gerçekleştirmek için, adım 2.7'den PEI astarlı mikropartiküllere 1 mL sulu DNA plazmid çözeltisi ekleyin ve karışımı 15 dakika boyunca 800 rpm'de bir termomikser üzerinde 4 ° C'de hafifçe çalkalayın. Farklı DNA yüklerine sahip mikrokapsüller hazırlamak için, DNaz / RNaz içermeyen damıtılmış su kullanarak DNA plazmidlerinin konsantrasyonunu 50-200 ng / μL'den ayarlayın ve DNA'yı biriktirmek için bu çözeltilerin 1 mL'sini kullanın. Mikropartikülleri 1 dakika boyunca 0.2 x g'de santrifüjleme ile toplayın.
- GFPa1 ile birleştirilmiş teofilin riboswitch'i kodlayan DNA plazmidleri için tüpleri ThyRS-GFPa1 olarak ve Brokoli aptamerini BrocApter olarak kodlayan DNA plazmidleri için tüpleri işaretleyin.
NOT: DNA'lı mikrosantrifüj tüplerini buz üzerinde tutun. - Süpernatantı dikkatlice çıkarın ve mikropartikülleri 1 mL DNaz / RNaz içermeyen damıtılmış su ile dört kez yıkayın, her seferinde süpernatantı 1 dakika boyunca 0.2 x g'de santrifüjlemeden sonra atın. Aksi belirtilmedikçe tüm deneyleri oda sıcaklığında (RT) gerçekleştirin.
- İpek fibroin tabakasının birikmesini gerçekleştirmek için, adım 3.3'ten DNA adsorbe edilmiş mikropartiküllere 1 mL yeniden yapılandırılmış sulu SF çözeltisi ekleyin, yavaşça vorteks edin ve karışımı termomikser üzerinde 10 ° C'de 750 rpm'de 15 dakika boyunca çalkalayın. Mikropartikülleri 4 °C'de 1 dakika boyunca 0.2 x g'de santrifüjleme yoluyla toplayın, süpernatanı çıkarın ve ardından 1 mL DNaz / RNaz içermeyen damıtılmış su ile bir kez yıkayın. Santrifüjlemeyi tekrarlayın ve süpernatanı atın.
NOT: Deney sırasında, sıcaklığa bağlı jelleşmeyi önlemek için ipek çözeltisini buz üzerinde tutun. - İpek protein yapısında β tabaka oluşumunu indüklemek için parçacıkları yavaş yavaş metanol ile muamele edin. İlk olarak, 0,5 mL DNaz / RNaz damıtılmış su ekleyin, mikrosantrifüj tüpünü vorteksleyin, ardından 0,5 mL% 100 metanol ekleyin. Termomikser üzerindeki partikülleri 10 °C'de 5 dakika boyunca yavaşça çalkalayın. Partikülleri 1 dakika boyunca 0,2 x g'de santrifüjleme ile toplayın. Supernatan'ı çıkarın.
- β tabakaların oluşumunu teşvik etmek ve ipek tabakasının güçlü fiziksel adsorpsiyonunu sağlamak için parçacıkları metanol ile muamele edin. 1 mL% 100 metanol ekleyin. Termomikser üzerindeki partikülleri 750 rpm'de 10 dakika boyunca 10 °C'de yavaşça çalkalayın.
- Partikülleri 4 °C'de 1 dakika boyunca 0,2 x g'de santrifüjleme yoluyla toplayın ve her seferinde 1 mL DNaz / RNaz içermeyen damıtılmış su ile iki kez yıkayın, süpernatantı atın ve bir sonraki santrifüjlemeden önce hafifçe vorteks yapın.
- İpek çok katmanlı çekirdek-kabuk yapıları elde etmek için 4.5-4.8 arasındaki adımları 20 kez tekrarlayın. Son biriktirme adımı için, adım 3.4'ten (Silk-DyLight550, 1 mL) floresan olarak etiketlenmiş ipek kullanın.
- Son yıkama adımını gerçekleştirin ve mikropartikülleri ortam koşullarında 1 mL DNaz/RNaz içermeyen damıtılmış suda tutun.
NOT: İpek tabakaların birikmesi sırasında partiküllerin birikmesini önlemek için, partikül süspansiyonunun görsel bir incelemesini yapın ve homojen partikül dağılımını teşvik etmek için 1 mL'lik bir pipet ucu kullanarak yukarı ve aşağı pipetleyin. - Denklem 1'i kullanarak her bir mikrokapsül, N DNA'da kapsüllenmiş DNA plazmid kopyalarının sayısını hesaplayın:
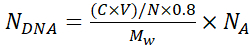 (1)
(1)
Burada N = 6.769 × 1011 - kapsülleme için kullanılan SiO2 çekirdeğinin sayısı. Seri seyreltmeler ve λ = 320 nm'de absorpsiyon A320 kullanarak bilinen silika parçacıkları konsantrasyonları için standart bir eğriden hesaplayın;
C- Adsorpsiyon için kullanılan DNA'nın ilk konsantrasyonu
V- Adsorpsiyon için kullanılan DNA hacmi
0.8- Çekirdeklerde DNA adsorpsiyon etkinliği
Mw- DNA plazmidinin moleküler ağırlığı
NA- Avogadro'nun numarası (6.022 × 1023)
5. İpek mikrokapsülleri elde etmek için çekirdeklerin çözülmesi.
- Stok çözeltisini (%48) damıtılmış su ile seyrelterek %8 hidroflorik asit (HF) çözeltisi, pH 5.5 hazırlayın. 50 mL'lik bir santrifüj tüpü edinin. 5 mL HF'yi dikkatlice pipetleyin ve% 8 HF çözeltisi elde etmek için 25 mL damıtılmış su ekleyin.
DİKKAT: HF oldukça aşındırıcı bir asittir ve dokularda ciddi yanıklara neden olabilir. Deneyler için HF'nin kullanımı ve kullanımı sırasında çok dikkatli olunmalıdır. İstenmeyen dökülme kazalarını önlemek için kuruluş tarafından geliştirilen HF'nin doğru kullanımı ve elleçlenmesi için Standart Çalışma Prosedürüne (SOP) uyun. HF asidini seyreltmek için cam kaplar kullanmayın. Protokolün bu adımını gerçekleştirmek için kimyasal başlığı kullanın. - Adım 4.10'dan itibaren peletlenmiş çekirdek-kabuk mikropartiküllerine 1,5 mL% 8 HF çözeltisi ekleyerek SiO2 çekirdeklerini çözün. Yavaşça vorteks yapın ve çekirdeklerin ortam koşullarında gece boyunca çözünmesine izin verin, 450 rpm'de hafifçe sallayın.
NOT: HF'nin dökülmesini önlemek için, mikrosantrifüj tüpünü kapatmak için aşılama bandı kullanın. Protokolün bu adımını gerçekleştirmek için kimyasal bir başlık kullanın. - 2 L deiyonize su ile doldurulmuş 2 L'lik bir cam beher hazırlayın. Mikrokapsül çözeltisini diyaliz cihazlarına (50 kDa MWCO) aktarın ve önümüzdeki 3 gün boyunca her 3 saatte bir suyun tekrar tekrar değiştirilmesiyle deiyonize suya karşı diyaliz edin.
NOT: İlk üç su değişimi sırasında süpernatantı toplayın ve çözeltiyi tehlikeli atık maddeler için belirlenen protokole göre atın. - Mikrokapsülleri toplamak üzere diyaliz cihazlarındaki süspansiyonu yeni 2 mL mikrosantrifüj tüplerine aktarmak için 1 mL'lik bir pipet kullanın.
NOT: Mikrokapsüllerin sulu çözeltilerini birkaç yıl boyunca ortam koşullarında saklayın.
6. Konfokal lazer tarama mikroskobu (CLSM) kullanılarak ipek fibroin mikrokapsüllerinin görüntülenmesi.
- DNA boyası kullanarak DNA boyama işlemi gerçekleştirin.
- 300 μL içi boş ipek fibroin mikrokapsüllerini taze bir 1 mL mikrosantrifüj tüpüne aktarın. 500 μL RNaz/DNaz içermeyen damıtılmış su ekleyin.
- DNA boyama boyasının 5 μL'sini, kısaca vorteksi ekleyin ve ışıktan korunan 2 saat boyunca RT'de inkübe edin.
- Her seferinde 4 °C'de 20 dakika boyunca 0,1 x g'de santrifüjleme yaparak dört yıkama adımı gerçekleştirin, süpernatantın 400 μL'sini dikkatlice çıkarın ve 400 μL RNaz / DNaz içermeyen damıtılmış su ile doldurun.
- 100x yağ daldırma hedefi (NA 1.49) kullanarak üç büyük lazerle (405 nm, 488 nm, 561 nm) donatılmış ters konfokal sistemlerde ipek kapsüllerin görüntülenmesini gerçekleştirin. Kapsül numunesinin 100 μL'sini 8 kuyucuklu cam slaytlardan oluşan tek bir kuyucuğa aktarın, kapsüllerin görüntülemeden önce 20-30 dakika boyunca çökelmesine izin verin.
NOT: Boyalar fotobeyazlatmaya karşı çok hassastır. Slaytları alüminyum folyo ile kaplayarak numuneleri koruyun.
7. Moleküler ağırlık kesme (MWCO) yöntemi kullanılarak içi boş mikrokapsüllerin geçirgenliğinin tahmini.
- Her biri 2 mL farklı M w (4 kDa, 20 kDa, 40 kDa, 70 kDa, 150 kDa, 250 kDa, 500 kDa ve 2 MDa) farklı Mw (20 μM, diH 2 O) dekstran florofor çözeltilerinin (20 μM, diH2O) her birini hazırlayın.
- Pipet 100 μL kapsüllerin süspansiyonunu, odacıklı bir cam slaytın tek bir kuyucuğuna yerleştirin. Her mikrokapsül tasarımını (PEI konsantrasyonu, DNA plazmidlerinin yükleme sayısı, ipek fibroin konsantrasyonu ve katman sayısı) ayrı ayrı analiz edin.
- Her bir kuyucuğa, en düşük Mw'den en yükseğe kadar 300 μL spesifik florofor çözeltisi ekleyin, böylece her bir kuyucuk spesifik florofor çözeltisine karşılık gelecektir. Yukarı ve aşağı pipetleyerek karıştırın ve florofor çözeltilerinin difüzyonu dengeye ulaşana kadar karışımın RT'de 1 saat inkübe etmesine izin verin.
- Slaytı bir konfokal lazer tarama mikroskobuna (CLSM) aktarın ve uyarma λ = 488 nm'de 100x yağ daldırma hedefi kullanarak her bir kuyucuğu görüntüleyin.
- Kapsüllerin en büyük çaplı daireler şeklinde göründüğünden emin olmak için odak düzlemini ayarlayarak ilgi alanını tanımlayın. Bu tipik olarak, kapsüller yerçekimi nedeniyle tortu oluşturduğunda numuneleri kuyunun dibine daha yakın görüntülerken olur.
- Slaytı XY yönünde hareket ettirerek mikrokapsül örneklerinin birkaç görüntüsünü toplayın. Her örnek için 100-150 kapsüle kadar hesap verecek şekilde görüntü yakalayın.
- Kapsüllerin içindeki ve dışındaki floresan yoğunluklarını karşılaştırarak her bir Mw florofor çözeltisindeki kapsül zarının geçirgenliğini analiz etmek için ImageJ yazılımını kullanın. Bunun için, kapsülün çevresini ana hatlarıyla belirtmek için bir daire şeklinde bir ilgi alanı (ROI) çizin ve içindeki floresan yoğunluğunu ölçmek için Analiz / Ölçüm'ü tıklayın. Verileri bir e-tabloya dönüştürün. Bu işlemi her mikrokapsül için toplam 200-300 kapsül için gerçekleştirin.
- ROI'yi ana hatlarıyla belirleyerek ve kapsüllerden uzaktaki yoğunluğu ölçerek dış floresan yoğunluğunu aynı şekilde değerlendirin. İstatistiksel analiz için 3-5 ölçüm yapın.
- İstatistiksel analiz yapmak için, kapsüllerin içindeki ve dışındaki floresan yoğunluklarını eşleştirilmiş t-testi kullanarak karşılaştırın (p < 0.05).
- Mw değişkenli FITC-Dextran için hidrodinamik yarıçapa dayanan mikrokapsüllerin geçirgenliğini tahmin etmek için Tablo 2 dönüşümünü kullanın.
8. İpek mikrokapsüllerinde sentetik teofilin riboswitch'in in vitro aktivasyonu
- 1 mL teofilin stok çözeltisi (100 mM, DMSO) hazırlayın. E. coli S30 ekstrakt sistemini, bileşenleri buz üzerinde 40 dakika boyunca çözerek dairesel DNA için hazırlayın.
- 0,5 mL DNaz/RNaz içermeyen mikrosantrifüj tüpü elde edin. İn vitro transkripsiyon/translasyon reaksiyonu gerçekleştirin, hücresiz bileşenleri aşağıdaki sırayla (50 μL toplam hacim) bir mikrokapsül örneği ile birleştirin: Amino asitler olmadan S30 ön karışımı (20 μL); S30 özü, dairesel (15 μL); tam amino asit karışımı (5 μL); adım 4.10'dan (9 μL) itibaren ThyRS-GFPa1 plazmidleri içeren içi boş mikrokapsüller; ve teofilin, 100 mM DMSO (1 μL).
NOT: Tüm bileşenleri ekledikten sonra, tüpü kısaca vorteksleyin ve numuneyi birkaç saniye boyunca 0,2 × g'da kısa santrifüjleme sırasında toplayın. - Tüpü 4 saat boyunca 30 ° C'de inkübe edin ve λ = 488 nm'de uyarma ve GFP / FITC filtresi için emisyon (510 nm ± 20 nm) kullanarak bir plaka okuyucu üzerindeki floresanı kontrol edin.
- Kapsülleri 488 nm ve 561 nm lazerler kullanarak herhangi bir LCSM sisteminde görüntüleyin. 100x yağ daldırma hedefi ve 8 kuyu odacıklı slaytları kullanarak en iyi kalitede görüntüler elde edin.
9. İpek mikrokapsüllerinde brokoli aptamerinin in vitro aktivasyonu
- DFHBI-1T boyasının 1 mL stok çözeltisini (30 μM, diH2O) hazırlayın. PURE (rekombinant elementler kullanılarak protein sentezi) hücresiz sistem reaksiyon kitini, bileşenleri buz üzerinde 40 dakika boyunca çözerek hazırlayın.
- 0,5 mL DNaz/RNaz içermeyen mikrosantrifüj tüpü elde edin. Hücresiz reaksiyon bileşenlerini aşağıdaki sırayla (50 μL toplam hacim) bir mikrokapsül örneği ile birleştirerek in vitro transkripsiyon reaksiyonu gerçekleştirin: çözelti A (20 μL); B çözeltisi (15 μL); adım 4.10'dan (14 μL) itibaren BrocApt plazmidleri içeren içi boş mikrokapsüller; ve DFHBI-1T boya (1 μL).
NOT: Tüm bileşenleri ekledikten sonra, tüpü kısaca vorteksleyin ve numuneyi birkaç saniye boyunca 0,2 × g'da kısa santrifüjleme sırasında toplayın. - Tüpü 37 ° C'de 6 saat boyunca inkübe edin ve λex = 470 nm'de uyarma ve λem = 510 nm ± 20 nm'de emisyon kullanarak bir plaka okuyucu üzerindeki floresanı kontrol edin.
- Kapsülleri 488 nm ve 561 nm lazerler kullanarak herhangi bir LCSM sisteminde görüntüleyin. 100x yağ daldırma hedefini ve 8 kuyucuklu kapak camı odacıklı slaytları kullanarak en iyi kalitede görüntüler elde edin.
Sonuçlar
Burada, çalışma, ipek protein kapsüllerinde kapsüllemeden sonra farklı sensör tasarımlarını (iki tip RNA tarafından düzenlenmiş transkripsiyon / translasyon elemanı) kodlayan DNA şablonlarının işlevselliğini ele almaktadır. Mikrokapsüller, anahtar bileşenlerin şablonlu Katman Katman (LbL) montajı ile hazırlandı: Bir asal katman, sensör tasarımlarını kodlayan DNA plazmidleri ve ipek fibroin biyopolimeri (Şekil 2). Makromoleküllerin katmanlı bir şekilde birikm...
Tartışmalar
Bu protokolü takiben çeşitli DNA kodlu sensör tasarımları ile yüklenen seçici geçirgen hidrojel mikrokapsüller hazırlanabilir. LbL yaklaşımının ayırt edici özelliklerinden biri, genellikle moleküler türlerin kurban şablonları üzerinde adsorpsiyonuyla başlayan aşağıdan yukarıya montaj sırasında mikrokapsüllerin karmaşıklığını uyarlama yeteneğidir. İlk bileşenlerin konsantrasyonlarını, pH koşullarını ve katman sayısını dikkatlice ayarlayarak, farklı DNA yükleme parametreleri...
Açıklamalar
Burada sunulan görüş ve düşünceler yazarların görüşleridir ve mutlaka DoD'nin veya Bileşenlerinin görüşlerini temsil etmez
Teşekkürler
Bu çalışma, Hava Kuvvetleri Bilimsel Araştırma Ofisi'nden LRIR 16RH3003J hibesi ve ABD Savunma Bakanlığı Araştırma ve Mühendislik Müsteşarlığı Ofisi'nin S&T Önceliklerinin Geliştirilmesi için Askeri Ortamlar için Sentetik Biyoloji Uygulamalı Araştırma (ARAP) programı ile desteklenmiştir.
ThyRS için plazmid vektör dizisi (pSALv-RS-GFPa1, 3.4 kb) Dr. J. Gallivan tarafından cömertçe sağlanmıştır. Bombyx mori'den ipekböceği kozaları, Tufts Üniversitesi, MA'dan Dr. D.L. Kaplan tarafından cömertçe bağışlandı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| (Z)-4-(3,5-difluoro-4-hydroxybenzylidene)-2-methyl-1-(2,2,2-trifluoroethyl)-1H-imidazol-5(4 H)-one (DFHBI-1T) | Lucerna | DFHBI-1T | |
| 5x T4 DNA Ligase Buffer | ThermoFisher Scientific | 46300-018 | |
| 6x Blue Gel Loading Dye | New England BioLabs | B7021S | |
| 96-well plates, black circular | Corning | 3601 | |
| Agarose | Sigma-Aldrich | A9539 | BioReagent, for molecular biology, low EEO |
| Ampicillin sodium salt | Sigma-Aldrich | A0166 | powder or crystals, BioReagent, suitable for cell culture |
| BlpI restriction enzymes | New England BioLabs | R0585S | |
| Corning Disposable Vacuum Filter/Storage Systems | FisherScientific | 09-761-1 | |
| Dimethyl sulfoxide, DMSO | Sigma-Aldrich | 472301 | ACS reagent, ≥99.9% |
| DNA Plasmid, pET28c-F30-2x Broccoli (5.4 kb), BrocApt. | Addgene | Plasmid #66788 | |
| DyLightTM550 Antibody Labeling kit (Invitrogen) | ThermoFisher Scientific | 84530 | |
| E. coli S30 extract system for circular DNA | Promega | L1020 | |
| Falcon Conical centrifuge tubes, 15 mL | FisherScientific | 14-959-53A | |
| Falcon Conical centrifuge tubes, 50 mL | 14-432-22 | ||
| Fisherbrand Microcentrifuge tubes, 1.5 mL | FisherScientific | 05-408-129 | |
| Hydrofluoric acid, HF | Sigma-Aldrich | 695068 | ACS reagent, 48% |
| Kanamycin sulfate | Sigma-Aldrich | 60615 | mixture of Kanamycin A (main component) and Kanamycin B and C |
| KpnI restriction enzymes | New England BioLabs | R0142S | |
| LB agar plate supplemented with 100 µg/mL ampicillin | Sigma-Aldrich | L5667 | pre-poured agar plates with 100 µg/mL ampicillin |
| LB agar plate supplemented with 50 µg/mL kanamycin | Sigma-Aldrich | L0543 | pre-poured agar plates with 50 µg/mL kanamycin |
| LB broth (Lennox grade) | Sigma-Aldrich | L3022 | |
| Lithium bromide, LiBr | Sigma-Aldrich | 213225 | ReagentPlus, ≥99% |
| Max Efficiency DH5-α competent E. coli strain | ThermoFisher Scientific | 18258012 | |
| Methanol | MilliporeSigma | 322415 | anhydrous, 99.8% |
| MilliQ-water | EMD MilliPore | Milli-Q Reference Water Purification System | |
| MinElute PCR Purification Kit | Qiagen | 28004 | |
| N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide hydrochloride, EDC | Sigma-Aldrich | E1769 | |
| PBS (phosphate buffered saline) | ThermoFisher Scientific | 10010023 | 1x PBS, pH 7.4 |
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | M0530S | |
| Polyethylenimine, branched | Sigma-Aldrich | 408727 | average Mw ~25,000 |
| PURExpress In Vitro Protein Synthesis Kit | New England BioLabs | E6800S | |
| QIAEX II Gel Extraction Kit | Qiagen | 20021 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| Quick-Load 2-Log DNA Ladder (0.1-10.0 kb) | New England BioLabs | N0469S | |
| SiO? silica microspheres, 4.0 µm | Polysciences, Inc. | 24331-15 | 10% aqueous solution |
| Slide-A-Lyzer G2 Dialysis Cassettes, 3.5K MWCO, 15 mL | ThermoFisher Scientific | 87724 | |
| Sodium carbonate, Na?CO? | Sigma-Aldrich | 222321 | ACS reagent, anhydrous, ≥99.5%, powder |
| Spectrum Spectra/Por Float-A-Lyzer G2 Dialysis Devices | FisherScientific | 08-607-008 | Spectrum G235058 |
| SYBR Safe DNA gel stain | ThermoFisher Scientific | S33102 | |
| T4 DNA Ligase (5 U/µL) | ThermoFisher Scientific | EL0011 | |
| Theophylline | Sigma-Aldrich | T1633 | anhydrous, ≥99%, powder |
| Tris Acetate-EDTA buffer (TAE buffer) | Sigma-Aldrich | T6025 | Contains 40 mM Tris-acetate and 1 mM EDTA, pH 8.3. |
| UltraPure DNase/RNase-Free Distilled Water | FisherScientific | 10-977-023 | |
| ZymoPURE II Plasmid MaxiPrep kit | ZymoResearch | D4202 |
Referanslar
- Slomovic, S., Pardee, K., Collins, J. J. Synthetic biology devices for in vitro and in vivo diagnostics. Proceedings of the National Academy of Sciences of the United States of America. 112 (47), 14429-14435 (2015).
- Harbaugh, S. V., Goodson, M. S., Dillon, K., Zabarnick, S., Kelley-Loughnane, N. Riboswitch-based reversible dual-color sensor. ACS Synthetic Biology. 6 (5), 766-781 (2017).
- König, H., Frank, D., Heil, R., Coenen, C. Synthetic genomics and synthetic biology applications between hopes and concerns. Current Genomics. 14 (1), 11-24 (2013).
- Silverman, A. D., Karim, A. S., Jewett, M. C. Cell-free gene expression: An expanded repertoire of applications. Nature Reviews Genetics. 21, 151-170 (2020).
- Chushak, Y., et al. Characterization of synthetic riboswitch in cell-free protein expression systems. RNA Biology. , 1-12 (2021).
- Cole, S. D., et al. Quantification of interlaboratory cell-free protein synthesis variability. ACS Synthetic Biology. 8 (9), 2080-2091 (2019).
- Thavarajah, W., et al. Point-of-use detection of environmental fluoride via a cell-free riboswitch-based biosensor. ACS Synthetic Biology. 9 (1), 10-18 (2020).
- Grӓwe, A., et al. A paper-based, cell-free biosensor system for the detection of heavy metals and date rape drugs. PLoS One. 14 (3), 0210940 (2019).
- Lin, X., et al. Portable environment-signal detection biosensors with cell-free synthetic biosystems. RSC Advances. 10 (64), 39261-39265 (2020).
- Caschera, F., Lee, J. W., Ho, K. K. Y., Liu, A. P., Jewett, M. C. Cell-free compartmentalized protein synthesis inside double emulsion templated liposomes with in vitro synthesized and assembled ribosomes. Chemical Communications. 52 (31), 5467-5469 (2016).
- Niederholtmeyer, H., Chaggan, C., Devaraj, N. K. Communication and quorum sensing in non-living mimics of eukaryotic cells. Nature Communications. 9, 5027 (2018).
- Timin, A. S., Gould, D. J., Sukkhorukov, G. B. Multi-layer microcapsules: Fresh insights and new applications. Expert Opinion on Drug Delivery. 14 (5), 583-587 (2017).
- Bomati, E. K., Haley, J. E., Noel, J. P., Deheyn, D. D. Spectral and structural comparison between bright and dim green fluorescent proteins in Amphioxus. Scientific Reports. 4, 5469 (2014).
- Frey, B., Reischl, U. Amplification of Genomic DNA by PCR. Molecular Diagnosis of Infectious Diseases. Methods in Molecular Medicine. 13, 143-156 (1998).
- Lee, P. Y., Costumbrado, J., Hsu, C. -. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. Journal of Visualized Experiments. (62), e3923 (2012).
- Zhou, Y., et al. Rapid regeneration and reuse of silica columns from PCR purification and gel extraction kits. Scientific Reports. 8, 12870 (2018).
- Kostylev, M., Otwell, A. E., Richardson, R. E., Suzuki, Y. Cloning should be simple: Escherichia coli DH5α-mediated assembly of multiple DNA fragments with short end homologies. PLoS One. 10 (9), 0137466 (2015).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6 (10), 1612-1631 (2011).
- Drachuk, I., et al. Silk macromolecules with amino acid-Poly(Ethylene Glycol) grafts for controlling layer-by-layer encapsulation and aggregation of recombinant bacterial cells. ACS Nano. 9 (2), 1219-1235 (2015).
- Antipov, A. A., Sukhorukov, G. B. Polyelectrolyte multilayer capsules as vehicles with tunable permeability. Advances in Colloid and Interface Science. 111 (1-2), 49-61 (2004).
- Drachuk, I., Harbaugh, S., Chávez, J. L., Kelley-Loughnane, N. Improving the activity of DNA-encoded sensing elements through confinement in silk microcapsules. ACS Applied Materials & Interfaces. 12 (43), 48329-48339 (2020).
- Melnikov, S., Ben-Shem, A., Garreau de Loubresse, N., Jenner, L., Yusupova, G., Yusupov, M. Structural basis for the inhibition of the eukaryotic ribosome. Nature Structural & Molecular Biology. 19 (6), 560-567 (2012).
- Zhao, S., et al. The future of layer-by-layer assembly: A tribute to ACS Nano associate editor Helmuth Möhwald. ACS Nano. 13 (6), 6151-6169 (2019).
- Main, K. H. S., Provan, J. I., Haynes, P. J., Wells, G., Hartley, J. A., Pyne, A. L. B. Atomic force microscopy-A tool for structural and translational DNA research. APL Bioengineering. 5, 031504 (2021).
- Riera, R., Feiner-Gracia, N., Fornaguera, C., Cascante, A., Borrós, S., Albertazzi, L. Tracking the DNA complexation state of pBAE polyplexes in cells with super resolution microscopy. Nanoscale. 11 (38), 17869-17877 (2019).
- Bilokapic, S., Strauss, M., Halic, M. Cryo-EM of nucleosome core particle interactions in trans. Scientific Reports. 8, 7046 (2018).
- Pritchard, E. M., Dennis, P. B., Omenetto, F., Naik, R. R., Kaplan, D. L. Physical and chemical aspects of stabilization of compounds in silk. Biopolymers. 97 (6), 479-498 (2012).
- Fritz, B. R., Jamil, O. K., Jewett, M. C. Implications of macromolecular crowding and reducing conditions for in vitro ribosome construction. Nucleic Acids Research. 43 (9), 4774-4784 (2015).
- Ge, X., Luo, D., Xu, J. Cell-free protein expression under macromolecular crowding conditions. PLoS One. 6 (12), 28707 (2011).
- Cawte, A. D., Unrau, P. J., Rueda, D. S. Live cell imaging of single RNA molecules with fluorogenic mango II arrays. Nature Communications. 11, 1283 (2020).
- Chen, X., et al. Visualizing RNA dynamics in live cells with bright and stable fluorescent RNAs. Nature Biotechnology. 37 (11), 1287-1293 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır