Method Article
Murin Beyaz Adipositlerinin Transkriptom ve Epigenom Analizleri için İzolasyonu ve İşlenmesi
Bu Makalede
Özet
Mevcut protokol, aşağı akış toplam RNA dizilimi, SONication ile Çekirdek Ekstraksiyonu (NEXSON) ve ChIP-seq için optimize edilmiş murin beyaz adipositlerinin izole edilmesi, saflaştırılması ve yukarı akış işlenmesi için evrensel bir yöntemi özetlemektedir.
Özet
Obezite genetik, epigenetik, çevre ve bunların etkileşimlerinden etkilenen karmaşık bir hastalıktır. Olgun adipositler, beyaz yağ dokusundaki ana hücre tipini temsil eder. Adipositlerin nasıl işlev gördüğünü ve (epi) genetik ve çevresel sinyallere nasıl yanıt verdiğini anlamak, obezitenin neden(ler)ini belirlemek için çok önemlidir. RNA ve kromatin daha önce enzimatik sindirim kullanılarak adipositlerden izole edilmiştir. Ek olarak, adiposit spesifik transgenik raportörlerin floresanla aktive edilen hücre sınıflandırması (FACS) ile saflaştırmanın sağlandığı nükleer izolasyon için protokoller geliştirilmiştir. Bu tür protokoller sırasında yüksek verim ve kalite elde etmenin önündeki en büyük zorluklardan biri, yağ dokusunda bulunan önemli miktarda lipittir. Mevcut protokol, lipitleri ilgilenilen hedeflerden (RNA/kromatin) ayırmak için heptan yararlanan olgun adipositleri izole etmek için optimize edilmiş bir prosedürü tanımlar. Elde edilen RNA, yüksek bütünlüğe sahiptir ve yüksek kaliteli RNA-seq sonuçları üretir. Benzer şekilde, prosedür çekirdek verim oranını iyileştirir ve numuneler arasında tekrarlanabilir ChIP-seq sonuçları üretir. Bu nedenle, mevcut çalışma, tüm genom transkriptom ve epigenom çalışmaları için uygun, güvenilir ve evrensel bir murin adiposit izolasyon protokolü sunmaktadır.
Giriş
Obezite tipik olarak, tip 2 diyabet, kardiyometabolik hastalık ve çeşitli kanser türleri riskinin artmasına katkıda bulunan aşırı yağ birikimi hastalığı olarak anlaşılır 1,2,3. Mevcut obezite anlayışı büyük ölçüde genetiğe dayansa da (hem insan hem de kemirgen çalışmalarından), metabolik hastalık yatkınlığının yaklaşık %30-70'i köken olarak genetik değildir 4,5,6,7,8 ve yanlış tanımlanmıştır.
Yağ dokusu obezite ve diğer metabolik hastalıklarda kritik bir rol oynar 9,10. Yağ dokusu, olgun adipositleri ve preadipositler, endotel hücreleri ve bağışıklık hücreleri dahil olmak üzere stromal vasküler fraksiyonu içerir. Her hücre tipinin obeziteye nasıl katkıda bulunduğu ve adiposit düzensizliğinin obeziteye nasıl katkıda bulunduğu hala belirsizdir. Olgun adiposit epigenom çalışmaları için tekrarlanabilir ve etkili izolasyon ve saflaştırma protokolleri alanın ilgi alanına girmektedir.
Olgun adipositler, gen ekspresyon analizleri11 ve epigenom çalışmaları12,13 için uzun süredir izole edilmiştir. Adipositleri izole etmek için iki ana strateji vardır. Birincisi, olgun adipositleri stromal vasküler fraksiyondaki(11,14) diğer hücre tiplerinden ayırmak için enzimatik sindirim kullanmaktır. İkincisi, sağlam çekirdekleri serbest bırakmak için yağ dokusunu ikiye katlamak ve daha sonra floresanla aktive edilen hücre sıralama (FACS)12,13 ile bir floresan raportöre dayalı olarak çekirdekleri geri kazanmaktır, bu da özel transgenik raportör modelleri gerektirir. Her iki durumdaki teknik zorluk, olgun adipositlerin yüksek konsantrasyonlarda lipit içermesidir (Şekil 1), bu da toplam RNA15,16 ve çekirdek17'nin kalitesini ve/veya verimini azaltır. Burada, olgun adipositleri izole etmek için optimize edilmiş bir enzimatik sindirim prosedürü tarif edilmiştir, burada heptanın avantajı, RNA ekstraksiyonundan önce lipitleri18 veya SONication ile Çekirdek Ekstraksiyonu (NEXSON)19 ile çekirdek izolasyon adımlarını hızlı ve verimli bir şekilde çözmek ve uzaklaştırmaktır. Protokol, genom çapında çalışmalar için toplam RNA'nın mükemmel bir şekilde geri kazanılmasını ve kalitesini sağlar ve tekrarlanabilir ChIP-seq için bozulmamış çekirdeklerin verimini önemli ölçüde artırır.
Protokol
Tüm hayvan deneyleri Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC), protokol numarası: 18-10-028 tarafından onaylanmıştır. 12 haftalık erkek C57BL / 6J farelerine CO2 ile ötenazi yapıldı ve epididimal beyaz yağ dokusundan (eWAT) yağ yastıkçıklarını toplamak için diseke edildi.
1. Adiposit izolasyonu
- Sindirim tamponunu hazırlayın (Tablo 1) ve bir su banyosunda 37 °C'ye ısıtın.
- Epididimal beyaz yağ dokusundan (eWAT) yağ pedini bir petri kabına koyun. 5 mL DMEM'de forseps ve neşter kullanarak dokuyu küçük parçalar halinde (5 mm x 5 mm) kesin.
NOT: Hücre yapışma kaplaması içermeyen bir Petri kabı tercih edilir. Hücrelere zarar vermemek için yağ pedini nazikçe tutmak da önemlidir. Yağ dokusu ne kadar çok işlenirse, verim o kadar fazla tehlikeye girer. Adipositlere zarar verebileceği için yağ yastıkçıklarını tek başına makas veya forseps ile kesmek yerine neşter/forseps yöntemi tercih edilir. - Doku kalıntılarını rahatsız etmeden fazla DMEM'i boşaltın.
NOT: Petri kabının yüzeyindeki doku kalıntılarını toplamayın. - Petri kabına 5 mL sindirim tamponu ekleyin, tabaktan doku parçalarını serbest bırakmak için döndürün ve tüm içeriği 50 mL'lik bir santrifüj tüpüne dökün. Tüm doku parçaları santrifüj tüpüne aktarılana kadar işlemi tekrarlayın.
- Kalan sindirim tamponunu, nihai hacim ~ 20 mL olacak şekilde santrifüj tüpüne ekleyin.
- Doku parçalarını 37 ° C'lik bir çalkalama su banyosunda 100 rpm'de 20-30 dakika boyunca veya doku parçaları 1 mm x 1 mm'den küçük olana kadar inkübe edin.
- Santrifüj tüpüne 0,4 mL 0,5 M EDTA ve 0,2 mL 0,5 M EGTA ekleyin ve 37 °C'de 10 dakika çalkalamaya devam edin.
- Sindirilmemiş dokuyu çıkarmak için hücre süspansiyonunu 10 mL'lik bir pipetle ince matrisli bir filtreden (420 μm, Malzeme Tablosuna bakınız) başka bir 50 mL santrifüj tüpünün üzerine aktarın.
- Saf adipositleri (üstte yüzen) stromal vasküler fraksiyondan (altta pelet) ayırmak için 50 mL'lik santrifüj tüpünü oda sıcaklığında 5 dakika boyunca 200 x g'da santrifüjleyin (Şekil 2A).
- Yüzen adiposit tabakasını 50 mL'lik yeni bir tüpe dökün ve peleti bozmamaya dikkat edin.
NOT: Yüzen adipositleri aktarmak için pipet uçlarını kullanmaktan kaçının çünkü bunlar pipet ucu duvarına yapışabilir (dolayısıyla verimi azaltır). Bir miktar sindirim tamponu yeni tüpe taşınacaktır; Adiposit tabakasının altından kalan sindirim tamponunu çıkarmak için bir şırınga ve iğne kullanın. - Saflaştırılmış adipositleri toplam RNA ekstraksiyonu (adım 2.) ve/veya ChIP-seq (adım 3. ve adım 4.) için hemen kullanın.
NOT: Kullanıcı, 2. adım için tüm adiposit ekstraktını kullanmaya karar verebilir. veya araştırma amacına bağlı olarak adım 3.. Kullanıcı ayrıca tüm adiposit ekstraktını iki parçaya bölebilir ve 2. adıma devam edebilir. ve adım 3. biyolojik olarak özdeş numunelerden analiz sonuçları elde etmek için paralel olarak.
2. Toplam RNA ekstraksiyonu
NOT: Bu adımı bir kimyasal başlıkta gerçekleştirin.
- 50 mL santrifüj tüpündeki saflaştırılmış adipositlere RNA izolasyon reaktifi (1 mL) (Malzeme Tablosuna bakınız) ekleyin (adım 1.11.).
- RNA izolasyon reaktifindeki adipositleri iyice çözmek için 1 mL'lik bir pipet ucu kullanarak yukarı ve aşağı pipetleyin ve 2 mL'lik bir mikrosantrifüj tüpüne aktarın.
- Tüpü oda sıcaklığında 15 dakika inkübe edin.
- Santrifüj tüpüne 0,5 mL heptan ekleyin ve 30 saniye boyunca tam hızda girdaplayın.
NOT: Lipitler heptan içinde çözünecektir (Şekil 2B). - Tüpü 1,000 x g'da 4 ° C'de 10 dakika santrifüjleyin.
- Bir şırınga ve 30 G iğne ile RNA izolasyon reaktifinin alt tabakasını alın ve yeni bir 1.5 mL tüpe aktarın.
- RNA izolasyon reaktifi ekstraktına 0.1 mL 1bromo-3kloropropan ( Malzeme Tablosuna bakınız) ekleyin ve 30 saniye boyunca tam hızda girdaplayın. Tüpü oda sıcaklığında 15 dakika inkübe edin.
- Tüpü 12.000 x g'da 4 ° C'de 15 dakika santrifüjleyin. Üst sulu fazı toplamak ve yeni bir tüpe aktarmak için bir pipet kullanın.
- 0,5 mL izopropanol ekleyin ve 4 °C'de 10 dakika inkübe edin. Tüpü 12.000 x g'da 4 ° C'de 10 dakika santrifüjleyin.
NOT: RNA, tüpün dibinde bir pelet olarak çökeltilecektir. - Süpernatanı çıkarmak için bir pipet kullanın, pelete dokunmamaya dikkat edin.
- 1 mL %75 EtOH ekleyin ve kısa bir süre tam hızda girdaplayın.
- Tüpü 7.500 x g'da 4 ° C'de 5 dakika santrifüjleyin. Süpernatanı bir pipet ucuyla dikkatlice çıkarın. Peletleri rahatsız etmeyin.
- Peletleri oda sıcaklığında 10 dakika veya pelet berrak/şeffaf hale gelene kadar havayla kurutun.
- Peletleri 50 μL nükleaz içermeyen suda çözün.
3. ChIP-seq için adiposit fiksasyonu
NOT: 3. adımı gerçekleştirin. kimyasal bir başlıkta.
- İzole adipositler içeren 50 mL tüpe 0.3 mL 0.5 M EDTA, 0.2 mL 0.5 M EGTA, 14.8 mL DMEM ve 10 mL heptan ekleyin (adım 1.11.).
- 0,7 mL %16 formaldehit (son %0,7) ekleyin ve oda sıcaklığında 5 dakika boyunca 10 rpm'de bir tüp döndürücü ( Malzeme Tablosuna bakınız) üzerinde döndürün.
NOT: Bir zamanlayıcı ayarlayın ve 5 dakika sayın. Birden fazla numune işleniyorsa, tüm numunelerde kesin ve karşılaştırılabilir fiksasyon zamanlaması sağlamak için formaldehiti 30 sn aralıklarla sırayla ekleyin. - 1.78 mL 1.25 M glisin (son 0.125 M) ekleyin ve oda sıcaklığında 5 dakikadan fazla olmamak üzere 10 rpm'de döndürücü üzerinde karıştırın.
NOT: Formaldehit, glisin eklendikten sonra bile aktif kalır. Bu nedenle, 5 dakikalık inkübasyon adımından hemen sonra katmanları santrifüjleme (adım 3.4.) ile ayırmak önemlidir. Birden fazla numune varsa, reaksiyonu 30 saniyelik zaman aralıklarında sırayla durdurmak için her numuneye glisin ekleyin. - Daha sonra, oda sıcaklığında 5 dakika boyunca 200 x g'da santrifüjleyin.
NOT: Üç belirgin ve ayrık sıvı tabakası olmalıdır (Şekil 2C). Ortadaki beyaz tabaka sabit adipositleri içerir. - Adiposit (beyaz) tabakayı 15 mL'lik yeni bir santrifüj tüpüne aktarmak için 1 mL'lik bir pipet ucu kullanın, böylece yeni tüpe taşınan fiksatif ve heptan miktarını en aza indirin.
- Tüpü, proteaz inhibitörü kokteyli (PIC, Malzeme Tablosuna bakınız) tableti ile desteklenmiş 10 mL (oda sıcaklığında) DMEM ile doldurun. Ters çevirerek iyice karıştırın.
- Tüpü oda sıcaklığında 5 dakika boyunca ≤200 x g'da santrifüjleyin. Hücre patlamasını en aza indirmek için santrifüjleme kuvvetini 100 x g'da tutun.
- 3.5.-3.7 adımlarını tekrarlayın. Adım 3.9'a geçmeden önce 1x.
- Adiposit (beyaz) tabakayı 1,5 mL veya 2 mL'lik bir mikrosantrifüj tüpüne aktarmak için 1 mL'lik bir pipet ucu kullanın.
- Tüpü oda sıcaklığında 5 dakika boyunca 100-200 x g'da santrifüjleyin ve heptanı (üst katman) ve DMEM'i (alt katman) çıkarmak için 1 ml'lik bir pipet ucu kullanın.
- Sabit adipositleri kullanana kadar −80 ° C'de 6 aya kadar saklayın.
4. Çekirdek ekstraksiyonu ve kromatin kesme
NOT: Bu prosedür Arrigoni ve ark.19'dan uyarlanmıştır.
- Sonikatörü açın ( Malzeme Tablosuna bakın) ve su banyosu soğutucusu 20 °C'ye ayarlandığında tepe gücünü 75 W'a, görev faktörünü %2'ye ve 200 döngü/patlamaya ayarlayın.
- Farnham laboratuvar tamponuna ve kesme tamponuna proteaz inhibitör kokteyli (PIC) ekleyin (Tablo 1).
NOT: Lütfen Arrigoni ve ark.19'da önerilen birkaç sonikatör ve parametreye göz atın. - 1 mL sonikasyon tüpünde 750-800 μL buz gibi Farnham laboratuvar tamponu ile sabit adipositleri (adım 3'ten itibaren) yeniden süspanse edin (Malzeme Tablosuna bakınız).
NOT: Tüpün tam kapasitesine kadar doldurulmaması tavsiye edilir. Aksi takdirde, adipositler tüpün en üst kısmına yüzer ve bu da sonikasyon verimliliğini azaltır. - Numuneyi 2,5 dakika boyunca sonikleştirin.
NOT: Daha fazla sonikasyon gerekip gerekmediğini belirlemek için bir faz kontrast mikroskobunda çekirdek ekstraksiyonunu kontrol edin. Çekirdekler, Şekil 2D'de gösterildiği gibi yuvarlak ve sağlam olmalıdır. - Daha fazla ilerlemeden önce, su banyosu soğutucusu 4 °C'ye ayarlanmış durumdayken, sonikatör tepe gücünü 140 W'a, görev faktörünü %5'e ve 200 döngü/patlamaya ayarlayın.
- Süpernatanı 1.5 mL'lik bir mikrosantrifüj tüpüne aktarmak için bir pipet kullanın. Tüpü 1.000 x g'da 4 ° C'de 5 dakika santrifüjleyin.
- Süpernatanı peletten (çekirdeklerden) dikkatlice çıkarın ve peleti saklayın.
- Peletleri 1 mL Farnham laboratuvar tamponu ile buz üzerinde yıkayın.
- Tüpü 4 ° C'de 5 dakika boyunca 1.000 x g'da santrifüjleyin, süpernatantı çıkarmak için bir pipet kullanın ve peleti tutun.
- 4.8.-4.9 adımlarını tekrarlayın. Adım 4.11'e geçmeden önce 1x.
NOT: İzole edilmiş ve yıkanmış çekirdekler, daha fazla kullanıma kadar 3 ay boyunca -80 °C'de saklanabilir. - İzole edilmiş çekirdekleri 1 mL kesme tamponunda yeniden süspanse edin ve bunları yeni bir 1 mL sonikasyon tüpüne aktarın. Tüpte kabarcık olmadığından emin olun.
- Kromatini 4 ° C'de kesmek için 140 W'lık bir tepe gücü,% 5'lik bir görev faktörü ve 12 dakika boyunca 200 döngü / patlama ile sonikatör içindeki çekirdekleri sonikleştirin.
- Lizatı 1.5 mL'lik bir mikrofüj tüpüne aktarın.
NOT: Kesilen kromatin çekirdekten salınır ve tamponda (lizat) bulunur. - Çözünmeyen kalıntıları peletlemek için tüpü 10.000 x g'da 4 ° C'de 5 dakika santrifüjleyin. Süpernatanı (kromatin) yeni bir 1.5 mL mikrosantrifüj tüpüne aktarın.
- Kesilmiş kromatin, 4 ° C'de 10 gün boyunca veya -80 ° C'de 3 ay boyunca daha fazla kullanıma kadar saklanabilir.
NOT: Ek kalite kontrolü: Daha önce yayınlanan raporu19 takiben RNA'yı DNaz içermeyen bir RNaz ile çapraz bağlamak ve çıkarmak için kesilmiş kromatinin 25 μL'sini alikotlayın. Bu çalışma için, elde edilen DNA, üreticinin talimatlarına göre bir DNA saflaştırma kiti ile saflaştırıldı, DNA, DNA miktar belirleme cihazı üzerinde bir DNA miktar belirleme kiti ile ölçüldü ve parça boyutu otomatik elektroforez cihazı ile değerlendirildi (bkz. Kesilen kromatin boyutu 100-800 bp aralığında olmalıdır. Kesme kromatininin geri kalanı, aşağı akış ChIP-Seq uygulaması için devam edebilir.
Sonuçlar
Adipositler altı yağ pedinden izole edildi, heptan bazlı RNA ekstraksiyonu yapıldı (aşama 2.) ve elde edilen RNA otomatik elektroforez cihazında analiz edildi. Tüm numuneler için hesaplanan RNA bütünlük numarası (RIN) >8 idi (Şekil 3A), bu da yüksek kaliteli ve tekrarlanabilir bir RNA preparatını gösteriyordu. Toplam RNA hazırlık kiti daha sonra RNA kütüphanelerini hazırlamak için kullanıldı ve her örnek, ≥40 milyon okuma derinliğine ulaşmak için yeni nesil dizileyicide dizilendi. Tüm örnekler (Şekil 3B) ve dizi başına (Şekil 3C) Phred skoru ≥30 idi, bu da yüksek kaliteli DNA dizilerinin20 göstergesiydi. Böylece heptan uzaklaştırma, RNA dizilimine uygun yüksek verimli, yüksek kaliteli RNA'nın izolasyonunu destekler.
Formaldehit fiksasyon adımında, üç heptan içeren nükleer izolasyon preparatı ve heptan içermeyen bir kontrol preparatı da gerçekleştirildi. Kesilen kromatin daha sonra otomatik elektroforez cihazında analiz edildi. Her iki durumda da, kromatin, aşağı akış ChIP-seq prosedürleri19 için ideal olan 100-800 bp boyut aralığına (Şekil 4A) kesildi. Daha da önemlisi, heptan ile muamele edilmiş numunelerden (11.5 ng/μL, 9.42 ng/μL ve 9.6 ng/μL) işlenmemiş numunelere (2.2 ng/μL) göre ~ 5 kat daha fazla kromatin elde edildi. H3K4me3 ve H3K27me3 ChIP-seq Arrigoni ve ark.19 tarafından gerçekleştirildi. Şekil 4B'de gösterildiği gibi, üç bağımsız heptan ile muamele edilmiş numuneden alınan sinyal izleri, her iki histon işareti için heptan ile muamele edilmemiş numunenin izi ile karşılaştırılabilirdi. Heptan muamelesi, ChIP-seq'in kalitesine müdahale etmez, ancak çekirdek (ve kesilmiş kromatin) verimini önemli ölçüde artırır.
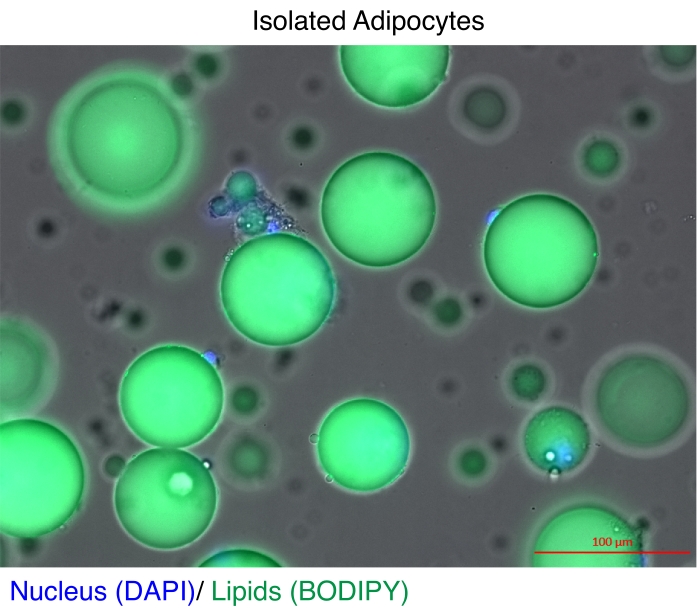
Şekil 1: İzole edilmiş adipositler. İzole edilen adipositler, çekirdeği boyamak için DAPI (mavi) ve lipitler için BODIPY (yeşil) ile boyandı. Sitozolik lipid damlacıkları, adipositlerin hacminin %95'ini oluşturur ve RNA ve kromatin ekstraksiyonları sırasında yüksek verim elde etmek için teknik bir zorluk teşkil eder. Ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
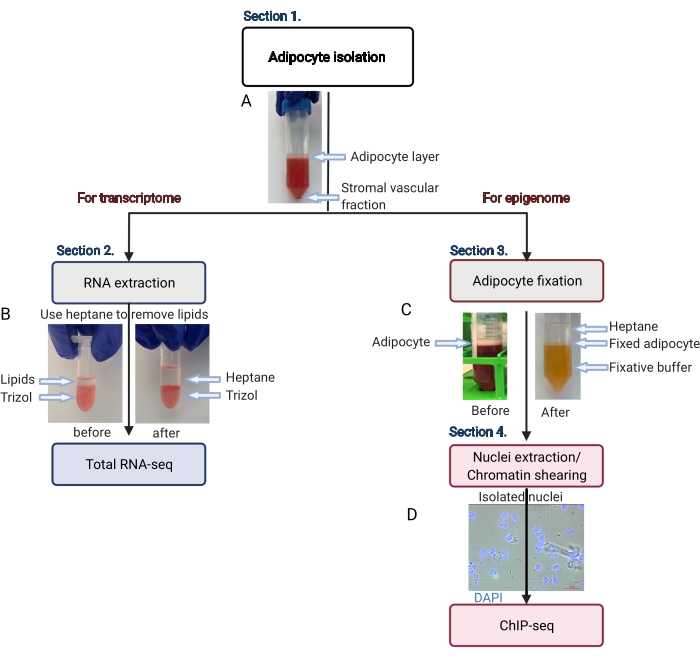
Şekil 2: Transkriptom ve epigenom analizi için adiposit izolasyonunun şematik akışı. Adiposit izolasyonundan transkriptom veya epigenom uygulamasına kadar tüm iş akışı tasvir edilmiştir. Anahtar adımlar ve temsili sonuçlar gösterilir. (A) İzole edilmiş adipositler, tüpün dibinde bir pelet olarak stromal vasküler fraksiyondan ayrılarak üst tabaka üzerinde yüzer. (B) RNA izolasyon reaktifi ile RNA ekstraksiyonundan önce lipitleri uzaklaştırmak için heptan kullanımı. (C) Adiposit fiksasyonu sırasında lipitleri uzaklaştırmak için heptan kullanımı. (D) İzole edilmiş adiposit çekirdeklerinin temsili görüntüsü sağlam ve yuvarlak olmalıdır. Ölçek çubuğu = 20 μm. Şema BioRender.com ile oluşturuldu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
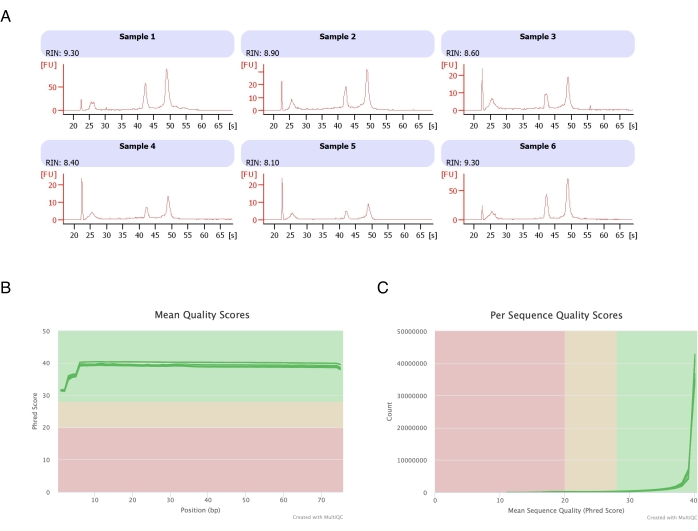
Şekil 3: RNA diziliminden sonra RNA bütünlüğü ve kalite skorlarının temsili elektroferogramı. (A) Örnekler 1-6, heptan ile muamele edilmiş adipositlerin altı kopyasını temsil eder ve RNA bütünlük analizleri, otomatik elektroforez cihazında çalıştırılmıştır. RNA bütünlük numarası (RIN), 18S ve 28S ribozomal RNA oranlarına dayanmaktadır ve RNA kalitesini temsil eder. 1'den (çok bozulmuş) 10'a (en az bozulmuş) kadar ölçeklendirin. (B,C) Sıralama okuma kalitesi puanı, bazlardaki ortalama kalite puanı (C) ve dizi başına kalite puanı için çoklu kalite analizi (B) ile belirlendi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
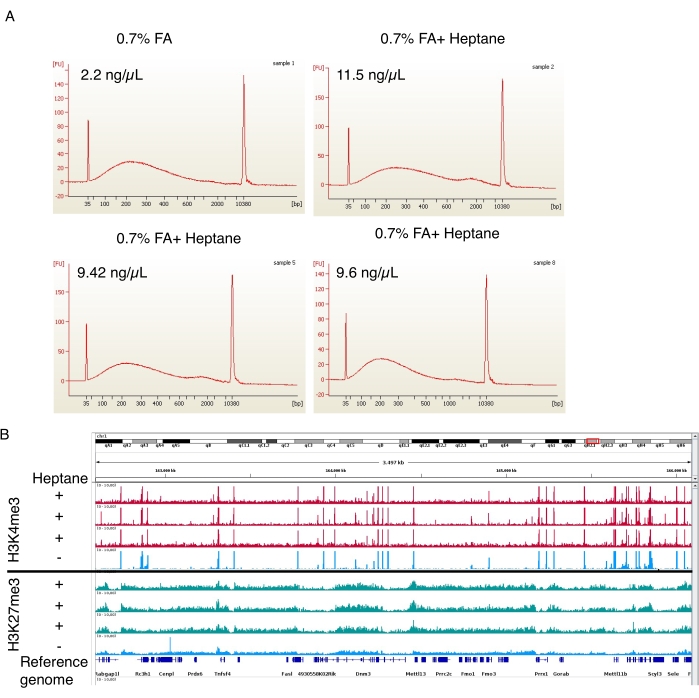
Şekil 4: ChIP-seq.'den kesilmiş kromatin ve zenginleştirme piklerinin temsili elektroferogramı. (A) Kontrolün kromatin boyutu dağılımlarını (numune 1, sol üst) ve heptan ile muamele edilmiş adiposit kromatin preparatlarını (numune 2, 5 ve 8, sağ üst ve alt iki) gösteren otomatik elektroforez cihazından alınan temsili profiller. Son preparatlardaki kromatin konsantrasyonları her görüntünün sol üst köşesinde belirtilmiştir. (B) Integrative Genomics Viewer (IGV) kullanılarak yapılan genom tarayıcısı ekran görüntüsü. Grafiğin üst kısmı, üç (kırmızı) heptan ile muamele edilmiş numune ve bir (mavi) kontrol için H3K4me3 ChIP-seq profillerini göstermektedir. Alt panel, H3K27me3'ün ChIP-seq'i için aynı şeyi gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Arabellek | Kompozisyon |
| Sindirim tamponu (3000 mg veya daha az yağ yastığı / 20 mL için) | 20 mL Dulbecco'nun Modifiye Kartal Ortamı (DMEM) |
| 0,3 g yağ asidi içermeyen BSA | |
| 0.1 g kollajenaz tip 2 | |
| Farnham laboratuvar tamponu | 5 mM BORULAR (pH 8) |
| 85 mM KCl | |
| % 0.5 IGEPAL | |
| Kesme tamponu | 10 mM Tris-HCl pH 8 |
| % 0.1 SDS | |
| 1 mM EDTA |
Tablo 1: Bu çalışmada kullanılan farklı tamponların bileşimi.
Tartışmalar
Burada sunulan adiposit izolasyon protokolü, olgun adipositleri (yüzer) beyaz yağ dokusunun kalan stromal vasküler fraksiyonundan ayırmak için iyi kabul görmüş enzimatik sindirim yöntemlerine11,14 dayanmaktadır. Herhangi bir fare modelinde olgun adipositleri saflaştırmak için basit ve evrensel bir yaklaşım sağlar. Yukarıda gösterildiği gibi, protokol tüm transkriptom ve ChIP-seq analizleri için aşağı akış kullanımı için uygundur. Aynı bireysel yağ pedinden birden fazla epigenomik profil (örneğin, birkaç histon modifikasyonu artı RNA-dizilimi) oluşturmak için yeterli verim sağlar.
Bu tür eşleşen epigenom verilerinin hazırlanmasını sağlayan yüksek verimleri sağlamak için, kritik bir adım, lipitleri sağlam adipositlerden ve işlem sırasında parçalanan adipositlerden çözmek için heptan kullanmaktır. Deneyimlerimize göre, bu adım, RNA ve çekirdeklerin lipit tabakasına kaybolmasını önleyerek tekrarlanabilirliği ve verimi önemli ölçüde artırır. Fiksasyon geçiren adiposit içeren tüplerin sürekli rotasyonu, lipitlerin adipositlerden uzaklaştırıldığı homojenliği arttırdığı için eşit derecede önemlidir. ChIP-seq literatürününçoğunda bildirilen %1 formaldehit fiksatif tamponu 21,22 yerine, aşırı fiksasyonu önlemek için konsantrasyonun %0.7 formaldehite düşürülmesinin gerekli olduğu bulunmuştur. Kromatin kesme süresi de ChIP-seq için optimum bir kromatin boyutu aralığı (100-800 bp) elde etmek için 12 dakikaya optimize edildi.
Protokol, toplu transkriptom ve epigenom çalışmaları için optimize edilmiştir. Mevcut protokolün tek hücreli transkriptom ve epigenom uygulamaları için hala kendi sınırlamaları vardır. Adipozite alanı 23,24'te bildirilen hücre heterojenliği göz önüne alındığında, bu izolasyon yöntemi, tek hücreli deneyler için uyarlanmak üzere daha da geliştirilebilir. Bu tür bağlamlarda, bor-dipirrometen (BODIPY)25 ve perilipin-1 (PLIN1)26, ASC-127 veya adiposit spesifik çekirdek belirteçleri gibi adiposit kısıtlı belirteçler, ek, işlevsel, ilgili hücresel parametrelerin28 kantitasyonunu sağlamada değerli olabilir. Genomik çalışmalara uygulamanın yanı sıra, bu protokol, adipositlerdeki yüksek lipid içeriği nedeniyle ekstra bir engele sahip olan adiposit proteomik çalışmalarını da iyileştirebilir29.
Bu protokol aynı zamanda insan adiposit çekirdeklerini (veriler gösterilmemiştir) başarılı bir şekilde çıkarmak için de kullanılabilir ve uygulamasını insan obezitesi araştırmalarına genişletir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
MPI-IE optik görüntüleme, dizileme, biyoinformatik çekirdek ve personele borçluyuz. Bu çalışma, MPG, Van Andel Araştırma Enstitüsü, Avrupa Birliği'nin Horizon 2020 araştırması, NIH (R01HG012444 ve R21HG011964), 675610 sayılı Marie Skłodowska-Curie hibe sözleşmesi ve Federal Eğitim ve Araştırma Bakanlığı'ndan 01KU1216 (Deutsches Epigenom Programm, DEEP) Proje Numarası kapsamında finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 16% Formaldehyde Solution (w/v). Methanol-free | ThermoFisher SCIENTIFIC | 28908 | |
| 1-bromo-3-chloropropane | SIGMA | B9673 | |
| 5 M NaCl | invitrogen | AM9759 | |
| Automated electrophoresis instrument (2100 Bioanalyzer Instrument) | Agilent Technologies | G2939BA | |
| BODIPY | ThermoFisher SCIENTIFIC | D3922 | |
| Collagenase Type 2 | Worthington Biochemical Corp. | 43D14184B | |
| Complete, EDTA-free, Protease inhibitor cocktail (PIC) | Roche | 4693159001 | EDTA free |
| DAPI | ThermoFisher SCIENTIFIC | D1306 | |
| DMEM (+ GlutaMAX) | life technologies | 61965-026 | |
| DNA purification kit (PCR purification kit) | Qiagen | 28104 | |
| DNA quantification instrument (Qubit 4 Fluorometer) | Fisher SCIENTIFIC | Q33238 | |
| DNA quantification kit (DNA high sensitivity assay) | Agilent Technologies | 5067-4626 | |
| EDTA | Fisher chimical | E478-500 | |
| EGTA | Fisher chimical | O2783-100 | |
| EtOH | PHARMCO | 111000200 | |
| Fatty acid-free BSA | SERVA | 11932.01 | bovine albumin fraction V, fatty acid-free lyophilized |
| Glycine | SIGMA | G7126-100G | |
| Heptane | SIGMA | H2198-1L | |
| High Sensitivity RNA Analysis | Agilent Technologies | 5067-1513 | |
| Igepal | SIGMA | 18896-50ML | |
| KCl | SIGMA | P3911-25G | |
| Matrix filter (420um) | Tisch Scientific | ME17238 | |
| Next-Generation Sequencer (HiSeq 3000 Sequencer) | Illumina | ||
| Nuclease-free water | Invitrogen | 4387936 | |
| PIPES | ACROS organics | 5625-37-6 | |
| Proteinase K | ThermoFisher SCIENTIFIC | EO0491 | |
| RNA isolation reagent (Trizol) | ThermoFisher SCIENTIFIC | 15596026 | |
| RNase A, DNase-free | ThermoFisher SCIENTIFIC | EN0531 | |
| Rotator (Thermo Scientific Tube Revolver Rotator) | ThermoFisher SCIENTIFIC | 88881001 | |
| SDS, Sodium dodecyl sulfate | SIGMA | 8170341000 | |
| Sonication tube (1 mL milliTUBE with AFA Fiber) | Covaris | 520135 | |
| Sonicator (Evolution Focused-ultra-sonicator (S220 or E220)) | Covaris | 500217 or 500239 | |
| Total RNA Prep kit ( Illumina Stranded Total RNA Prep kit) | Illumina | 20040525 | |
| Tris-HCl | Fisher bioreagents | BP153-500 |
Referanslar
- Albuquerque, D., Stice, E., Rodríguez-López, R., Manco, L., Nóbrega, C. Current review of genetics of human obesity: From molecular mechanisms to an evolutionary perspective. Molecular Genetics and Genomics. 290 (4), 1191-1221 (2015).
- Weihrauch-Blüher, S., Schwarz, P., Klusmann, J. H. Childhood obesity: Increased risk for cardiometabolic disease and cancer in adulthood. Metabolism. 92, 147-152 (2019).
- Weihrauch-Blüher, S., Wiegand, S. Risk factors and implications of childhood obesity. Current Obesity Reports. 7 (4), 254-259 (2018).
- Gluckman, P. D. Epigenetics, the life-course and metabolic disease. Nature Reviews Endocrinology. 8 (2), 74-76 (2012).
- Loh, M., Zhou, L., Ng, H. K., Chambers, J. C. Epigenetic disturbances in obesity and diabetes: Epidemiological and functional insights. Molecular Metabolism. 27, 33-41 (2019).
- Sayols-Baixeras, S., et al. DNA methylation and obesity traits: An epigenome-wide association study. The REGICOR study. Epigenetics. 12 (10), 909-916 (2017).
- Xia, Q., Grant, S. F. A. The genetics of human obesity. Annals of the New York Academy of Sciences. 1281 (1), 178-190 (2013).
- Yokoi, N. Epigenetic dysregulation in pancreatic islets and pathogenesis of type 2 diabetes. Journal of Diabetes Investigation. 9 (3), 475-477 (2018).
- Frayn, K. N. Obesity and metabolic disease: Is adipose tissue the culprit. Proceedings of the Nutrition Society. 64 (1), 7-13 (2005).
- Kawai, T., Autieri, M. V., Scalia, R. Adipose tissue inflammation and metabolic dysfunction in obesity. American Journal of Physiology-Cell Physiology. 320 (3), 375-391 (2021).
- Cat, A. N. D., Briones, A. M., Touyz, R. M., Schiffrin, E. L. . Hypertension: Methods and Protocols. , 283-295 (2017).
- Ambati, S., et al. Adipocyte nuclei captured from VAT and SAT. BMC Obesity. 3, 35 (2016).
- Roh, H. C., et al. Simultaneous transcriptional and epigenomic profiling from specific cell types within heterogeneous tissues in vivo. Cell Reports. 18 (4), 1048-1061 (2017).
- Jacobsen, M. J., et al. Epigenetic and transcriptomic characterization of pure adipocyte fractions from obese pigs identifies candidate pathways controlling metabolism. Frontiers in Genetics. 10, 1268 (2019).
- Janke, J., Engeli, S., Gorzelniak, K., Sharma, A. M. Extraction of total RNA from adipocytes. Hormone and Metabolic Research. 33 (4), 213-215 (2001).
- Cirera, S. Highly efficient method for isolation of total RNA from adipose tissue. BMC Research Notes. 6 (1), 472 (2013).
- Rajbhandari, P., et al. Single cell analysis reveals immune cell-adipocyte crosstalk regulating the transcription of thermogenic adipocytes. eLife. 8, 49501 (2019).
- Buddrick, O., Jones, O. A. H., Morrison, P. D., Small, D. M. Heptane as a less toxic option than hexane for the separation of vitamin E from food products using normal phase HPLC. RSC Advances. 3 (46), 24063-24068 (2013).
- Arrigoni, L., et al. Standardizing chromatin research: A simple and universal method for ChIP-seq. Nucleic Acids Research. 44 (7), 67 (2016).
- Ewels, P., Magnusson, M., Lundin, S., Käller, M. MultiQC: Summarize analysis results for multiple tools and samples in a single report. Bioinformatics. 32 (19), 3047-3048 (2016).
- Schmidt, D., et al. ChIP-seq: Using high-throughput sequencing to discover protein-DNA interactions. Methods. 48 (3), 240-248 (2009).
- Hoffman, E. A., Frey, B. L., Smith, L. M., Auble, D. T. Formaldehyde crosslinking: A tool for the study of chromatin complexes. Journal of Biological Chemistry. 290 (44), 26404-26411 (2015).
- Rondini, E. A., Granneman, J. G. Single cell approaches to address adipose tissue stromal cell heterogeneity. Biochemical Journal. 477 (3), 583-600 (2020).
- Corvera, S. Cellular heterogeneity in adipose tissues. Annu Review of Physiology. 83, 257-278 (2021).
- Katz, L. S., Geras-Raaka, E., Gershengorn, M. C. Heritability of fat accumulation in white adipocytes. American Journal of Physiology-Endocrinology and Metabolism. 307 (3), 335-344 (2014).
- Hansen, J. S., de Maré, S., Jones, H. A., Göransson, O., Lindkvist-Petersson, K. Visualization of lipid directed dynamics of perilipin 1 in human primary adipocytes. Scientific Reports. 7 (1), 15011 (2017).
- Ussar, S., et al. ASC-1, PAT2, and P2RX5 are cell surface markers for white, beige, and brown adipocytes. Science Translational Medicine. 6 (247), (2014).
- Onogi, Y., Khalil, A. E. M. M., Ussar, S. Identification and characterization of adipose surface epitopes. Biochemical Journal. 477 (13), 2509-2541 (2020).
- Kim, E. Y., et al. Recent advances in proteomic studies of adipose tissues and adipocytes. International Journal of Molecular Sciences. 16 (3), 4581-4599 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır