Method Article
Выделение и обработка белых адипоцитов мышей для транскриптомного и эпигеномного анализа
В этой статье
Резюме
В настоящем протоколе кратко изложен универсальный метод выделения, очистки и предварительной обработки белых адипоцитов мышей, оптимизированный для последующего секвенирования общей РНК, экстракции ядер методом SONication (NEXSON) и ChIP-seq.
Аннотация
Ожирение — это сложное заболевание, на которое влияют генетика, эпигенетика, окружающая среда и их взаимодействие. Зрелые адипоциты представляют собой основной тип клеток в белой жировой ткани. Понимание того, как адипоциты функционируют и реагируют на (эпи)генетические сигналы и сигналы окружающей среды, имеет важное значение для определения причины (причин) ожирения. РНК и хроматин ранее были выделены из адипоцитов с помощью ферментативного расщепления. Кроме того, разработаны протоколы для ядерной изоляции, где очистка достигается путем флуоресцентно-активируемой сортировки клеток (FACS) адипоцит-специфичных трансгенных репортеров. Одной из самых больших проблем для достижения высокой урожайности и качества во время таких протоколов является значительное количество липидов, содержащихся в жировой ткани. Настоящий протокол описывает оптимизированную процедуру выделения зрелых адипоцитов, которая использует гептан для отделения липидов от исследуемых мишеней (РНК/хроматин). Полученная РНК обладает высокой целостностью и генерирует высококачественные результаты РНК-секвенирования. Кроме того, процедура улучшает выход ядер и генерирует воспроизводимые результаты ChIP-seq для образцов. Таким образом, настоящее исследование обеспечивает надежный и универсальный протокол выделения мышиных адипоцитов, подходящий для полногеномных транскриптомных и эпигеномных исследований.
Введение
Под ожирением обычно понимают заболевание, связанное с избыточным накоплением жира, которое способствует повышенному риску развития диабета 2 типа, кардиометаболических заболеваний и некоторых формрака. В то время как современное понимание ожирения в значительной степени уходит корнями в генетику (исследования как на людях, так и на грызунах), около 30-70% предрасположенности к метаболическим заболеваниям имеют негенетическое происхождение 4,5,6,7,8 и остаются неопределенными.
Жировая ткань играет решающую роль в развитии ожирения и других метаболических заболеваний 9,10. Жировая ткань состоит из зрелых адипоцитов и стромальной васкулярной фракции, включая преадипоциты, эндотелиальные клетки и иммунные клетки. До сих пор неясно, как каждый тип клеток способствует ожирению и как дисрегуляция адипоцитов способствует ожирению. Воспроизводимые и эффективные протоколы выделения и очистки для исследований эпигенома зрелых адипоцитов представляют интерес для данной области.
Зрелые адипоциты уже давно выделены для анализа экспрессии генов11 и исследований эпигенома12,13. Существует две основные стратегии выделения адипоцитов. Первый заключается в использовании ферментативного расщепления для отделения зрелых адипоцитов от остальных типов клеток в стромально-васкулярной фракции11,14. Второй метод заключается в том, чтобы откачать жировую ткань для высвобождения интактных ядер, а затем восстановить ядра на основе флуоресцентного репортера методом флуоресцентно-активируемой сортировки клеток (FACS)12,13, для чего требуются специализированные трансгенные репортерные модели. Техническая сложность в каждом случае заключается в том, что зрелые адипоциты содержат высокие концентрации липидов (рис. 1), что снижает качество и/или выход общей РНК15,16 и ядер17. В данной работе описана оптимизированная процедура ферментативного расщепления для выделения зрелых адипоцитов, в которой преимущество гептана заключается в быстром и эффективном растворении и удалении липидов18 до экстракции РНК или этапов выделения ядер с помощью экстракции ядер методом SONication (NEXSON)19. Протокол обеспечивает превосходное восстановление и качество общей РНК для полногеномных исследований и значительно улучшает выход интактных ядер для воспроизводимого ChIP-секвенирования.
протокол
Все эксперименты на животных были одобрены Институциональным комитетом по уходу за животными и их использованию (IACUC), номер протокола: 18-10-028. 12-недельные самцы мышей C57BL/6J были усыплены с помощью CO2 и препарированы для сбора жировых пакетов из придатка яичка белой жировой ткани (eWAT).
1. Выделение адипоцитов
- Приготовьте буфер для пищеварения (табл. 1) и нагрейте до 37 °C на водяной бане.
- Положите жировую подушку из придатка яичка белой жировой ткани (eWAT) в чашку Петри. Разрежьте ткань на небольшие кусочки (5 мм х 5 мм) с помощью щипцов и скальпеля в 5 мл DMEM.
ПРИМЕЧАНИЕ: Предпочтительна чашка Петри, которая не содержит адгезионного покрытия клеток. Также важно аккуратно держать жировую подушку, чтобы не повредить клетки. Чем больше обрабатывается жировая ткань, тем больше снижается урожайность. Метод скальпеля/щипцов предпочтительнее, чем разрезание жировых подушечек ножницами или щипцами, так как они могут повредить адипоциты. - Слейте излишки DMEM, не нарушая остатки ткани.
ПРИМЕЧАНИЕ: Не собирайте остатки ткани с поверхности чашки Петри. - Добавьте 5 мл буфера для разложения в чашку Петри, взболтайте, чтобы освободить фрагменты тканей из чашки, и вылейте все содержимое в центрифужную пробирку объемом 50 мл. Повторяйте процесс до тех пор, пока все фрагменты ткани не будут перенесены в центрифужную пробирку.
- Добавьте оставшийся буфер для разложения в пробирку центрифуги так, чтобы конечный объем составил ~20 мл.
- Инкубируйте фрагменты ткани на водяной бане при температуре 37 °C при 100 об/мин в течение 20-30 минут или до тех пор, пока фрагменты ткани не станут меньше 1 мм x 1 мм.
- Добавьте 0,4 мл 0,5 М ЭДТА и 0,2 мл 0,5 М EGTA в центрифужную пробирку и продолжайте встряхивать при 37 °C в течение 10 минут.
- Перенесите клеточную суспензию с помощью пипетки объемом 10 мл через фильтр тонкой очистки (420 мкм, см. Таблицу материалов) поверх другой центрифужной пробирки объемом 50 мл, чтобы удалить непереваренную ткань.
- Центрифугируйте центрифужную пробирку объемом 50 мл при концентрации 200 x g в течение 5 минут при комнатной температуре, чтобы отделить чистые адипоциты (плавающие вверху) от стромальной васкулярной фракции (гранулы внизу) (рисунок 2A).
- Налейте плавающий слой адипоцитов в новую пробирку объемом 50 мл, стараясь не нарушить гранулу.
ПРИМЕЧАНИЕ: Избегайте использования наконечников для дозатора для переноса плавающих адипоцитов, поскольку они могут прилипать к стенке наконечника пипетки (следовательно, снижать выход). Некоторое количество буфера для сбраживания перейдет в новую пробирку; С помощью шприца и иглы удалите остаточный буфер пищеварения из-под слоя адипоцитов. - Используйте очищенные адипоциты для экстракции общей РНК (шаг 2) и/или ChIP-seq (шаг 3 и шаг 4.) немедленно.
ПРИМЕЧАНИЕ: Пользователь может принять решение об использовании экстракта адипоцитов целиком для шага 2. или шаг 3., в зависимости от цели исследования. Пользователь также может разделить весь экстракт адипоцитов на две части и продолжить шаг 2. и шаг 3. параллельно получать результаты анализа из биологически идентичных образцов.
2. Выделение общей РНК
ПРИМЕЧАНИЕ: Выполните этот шаг в химической вытяжке.
- Добавьте реагент для выделения РНК (1 мл) (см. Таблицу материалов) к очищенным адипоцитам в центрифужной пробирке объемом 50 мл (шаг 1.11).
- Пипеткой вверх и вниз с помощью наконечника пипетки объемом 1 мл тщательно растворите адипоциты в реагенте для выделения РНК и перенесите в микроцентрифужную пробирку объемом 2 мл.
- Инкубируйте пробирку в течение 15 минут при комнатной температуре.
- Добавьте 0,5 мл гептана в центрифужную пробирку и делайте вихрь на полной скорости в течение 30 с.
ПРИМЕЧАНИЕ: Липиды растворятся в гептане (Рисунок 2B). - Центрифугируйте пробирку при давлении 1 000 x g в течение 10 минут при 4 °C.
- Возьмите нижний слой реагента для выделения РНК с помощью шприца и иглы 30 G и переложите в новую пробирку объемом 1,5 мл.
- Добавить 0,1 мл 1бром-3хлорпропана (см. Таблицу материалов) в экстракт реагента для выделения РНК и сделать вихрь на полной скорости в течение 30 с. Инкубируйте пробирку при комнатной температуре в течение 15 минут.
- Центрифугируйте пробирку при давлении 12 000 x g в течение 15 минут при 4 °C. С помощью пипетки соберите верхнюю водную фазу и перенесите ее в новую пробирку.
- Добавьте 0,5 мл изопропанола и инкубируйте в течение 10 мин при 4 °C. Центрифугируйте пробирку при давлении 12 000 x g в течение 10 минут при 4 °C.
ПРИМЕЧАНИЕ: РНК будет осаждаться в виде гранул на дне пробирки. - С помощью пипетки удалите надосадочную жидкость, стараясь не прикасаться к грануле.
- Добавьте 1 мл 75% EtOH и быстро перемешайте на полной скорости.
- Центрифугируйте пробирку при давлении 7 500 x g в течение 5 минут при 4 °C. Осторожно удалите надосадочную жидкость с помощью наконечника пипетки. Не тревожьте гранулы.
- Высушите гранулы на воздухе при комнатной температуре в течение 10 минут или до тех пор, пока гранулы не станут прозрачными.
- Растворите гранулу в 50 μл воды, не содержащей нуклеаз.
3. Фиксация адипоцитов для ChIP-seq
ПРИМЕЧАНИЕ: Выполните шаг 3. в химическом капюшоне.
- Добавьте 0,3 мл 0,5 М ЭДТА, 0,2 мл 0,5 М ЭГТА, 14,8 мл ДМЭМ и 10 мл гептана в 50 мл пробирки, содержащей выделенные адипоциты (шаг 1.11).
- Добавьте 0,7 мл 16% формальдегида (итоговые 0,7%) и вращайте на вращателе трубки (см. Таблицу материалов) со скоростью 10 об/мин в течение 5 минут при комнатной температуре.
ПРИМЕЧАНИЕ: Установите таймер и отсчитайте 5 минут. При обработке нескольких образцов добавляйте формальдегид последовательно с интервалом в 30 с, чтобы обеспечить точное и сопоставимое время фиксации для всех образцов. - Добавьте 1,78 мл 1,25 М глицина (итоговые 0,125 М) и перемешайте на ротаторе при 10 об/мин не более 5 минут при комнатной температуре.
ПРИМЕЧАНИЕ: Формальдегид остается активным даже после добавления глицина. Поэтому важно отделить слои центрифугированием (шаг 3.4.) сразу после 5-минутной стадии инкубации. Если образцов более одного, добавьте глицин в каждый образец, чтобы остановить реакцию последовательно через 30 секунд. - Затем центрифугируйте при 200 х г в течение 5 минут при комнатной температуре.
ПРИМЕЧАНИЕ: Должны быть три очевидных и дискретных слоя жидкости (Рисунок 2C). Средний белый слой содержит неподвижные адипоциты. - Используйте наконечник пипетки объемом 1 мл для переноса слоя адипоцитов (белого) в свежую центрифужную пробирку объемом 15 мл, минимизируя количество фиксатора и гептана, переносимых в новую пробирку.
- Заполните пробирку 10 мл (комнатной температуры) DMEM с добавлением коктейля ингибитора протеазы (PIC, см. Таблицу материалов). Тщательно перемешайте методом инверсии.
- Центрифугируйте пробирку при ≤200 x g в течение 5 минут при комнатной температуре. Поддерживайте силу центрифугирования на уровне 100 x g , чтобы свести к минимуму разрыв ячейки.
- Повторите шаги 3.5.-3.7. 1x перед переходом к шагу 3.9.
- Используйте наконечник для дозатора объемом 1 мл для переноса слоя адипоцитов (белого) в микроцентрифужную пробирку объемом 1,5 мл или 2 мл.
- Центрифугируйте пробирку при давлении 100-200 x g в течение 5 минут при комнатной температуре и с помощью наконечника пипетки объемом 1 мл удалите гептан (верхний слой) и DMEM (нижний слой).
- Храните фиксированные адипоциты при температуре −80 °C до 6 месяцев до использования.
4. Экстракция ядер и сдвиг хроматина
ПРИМЕЧАНИЕ: Эта процедура адаптирована из Arrigoni et al.19.
- Включите ультразвуковой аппарат (см. Таблицу материалов) и установите пиковую мощность на 75 Вт, коэффициент заполнения на 2% и 200 циклов/всплеск, при этом чиллер на водяной бане установлен на 20 °C.
- Добавьте коктейль ингибиторов протеазы (PIC) в лабораторный буфер Farnham и буфер для сдвига (Таблица 1).
ПРИМЕЧАНИЕ: Пожалуйста, ознакомьтесь с еще несколькими предлагаемыми ультразвуковыми аппаратами и параметрами в Arrigoni et al.19. - Ресуспендируйте фиксированные адипоциты (начиная с шага 3) с помощью 750-800 мкл ледяного лабораторного буфера Фарнхэма в ультразвуковой пробирке объемом 1 мл (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Рекомендуется не заполнять пробирку на полную мощность. В противном случае адипоциты будут плавать в самой верхней части трубки, что снижает эффективность ультразвуковой обработки. - Обрабатывайте образец ультразвуком в течение 2,5 мин.
ПРИМЕЧАНИЕ: Проверьте экстракцию ядер на фазово-контрастном микроскопе, чтобы определить, требуется ли дальнейшая ультразвук. Ядра должны быть круглыми и неповрежденными, как показано на рисунке 2D. - Прежде чем продолжить, установите пиковую мощность ультразвукового аппарата на 140 Вт, коэффициент заполнения на 5% и 200 циклов на разрыв, при этом чиллер на водяной бане установлен на 4 °C.
- С помощью пипетки перенесите надосадочную жидкость в микроцентрифужную пробирку объемом 1,5 мл. Центрифугируйте пробирку при давлении 1 000 x g в течение 5 минут при 4 °C.
- Осторожно удалите надосадочную жидкость из гранулы (ядер) и оставьте гранулу у себя.
- Промойте гранулу 1 мл лабораторного буфера Farnham на льду.
- Центрифугируйте пробирку при давлении 1 000 x g в течение 5 минут при 4 °C, удалите надосадочную жидкость с помощью пипетки и оставьте гранулу на месте.
- Повторите шаги 4.8.-4.9. 1x перед переходом к шагу 4.11.
ПРИМЕЧАНИЕ: Выделенные и промытые ядра можно хранить при температуре −80 °C в течение 3 месяцев до дальнейшего использования. - Ресуспендируйте выделенные ядра в 1 мл буфера для сдвига и перенесите их в новую пробирку для ультразвука объемом 1 мл. Следите за тем, чтобы в трубке не было пузырьков.
- Ультразвуком обрабатывайте ядра в ультразвуковом аппарате с пиковой мощностью 140 Вт, коэффициентом заполнения 5% и 200 циклов/всплеск в течение 12 мин для сдвига хроматина при 4 °C.
- Перенесите лизат в микрофужную пробирку объемом 1,5 мл.
ПРИМЕЧАНИЕ: Сдвигованный хроматин высвобождается из ядер и содержится в буфере (лизате). - Центрифугируйте пробирку при давлении 10 000 x g в течение 5 минут при 4 °C для гранулирования нерастворимого мусора. Перенесите надосадочную жидкость (хроматин) в новую микроцентрифужную пробирку объемом 1,5 мл.
- Срезанный хроматин можно хранить при температуре 4 °C в течение 10 дней или при -80 °C в течение 3 месяцев до дальнейшего использования.
ПРИМЕЧАНИЕ: Дополнительная проверка качества: Аликвота 25 мкл сшитого хроматина для декросслинга и удаления РНК с РНКазой, свободной от ДНКазы, в соответствии с ранее опубликованным отчетом19. Для настоящего исследования полученную ДНК очищали с помощью набора для очистки ДНК в соответствии с инструкциями производителя, ДНК количественно определяли с помощью набора для количественного определения ДНК на приборе для количественного определения ДНК, а размер фрагмента оценивали с помощью автоматизированного прибора для электрофореза (см. Таблицу материалов). Размер сдвигаемого хроматина должен быть в пределах 100-800.о. Оставшаяся часть сдвигового хроматина может быть использована для последующего нанесения ChIP-Seq.
Результаты
Адипоциты были выделены из шести жировых пакетов, проведена экстракция РНК на основе гептана (этап 2), а полученная РНК проанализирована на автоматизированном электрофорезе. Расчетное число целостности РНК (RIN) для всех образцов составило >8 (рис. 3A), что свидетельствует о высоком качестве и воспроизводимости РНК-препарата. Затем для подготовки библиотек РНК был использован полный набор для подготовки РНК, и каждый образец был секвенирован на секвенсоре следующего поколения для достижения глубины чтения в ≥40 миллионов прочтений. Оценка по шкале Phred для всех образцов (рис. 3B) и для каждой последовательности (рис. 3C) составила ≥30, что указывает на высокое качество последовательностей ДНК20. Таким образом, удаление гептана способствует выделению высокопродуктивных высококачественных РНК, пригодных для секвенирования РНК.
На стадии фиксации формальдегида также проводили три гептансодержащих ядерных изолирующих препарата и один контрольный препарат без гептана. Затем сдвиг хроматина был проанализирован на автоматизированном приборе для электрофореза. В обоих случаях хроматин срезали до диапазона размеров 100-800.о. (рис. 4А), что идеально подходит для последующих процедур ChIP-seq19. Важно отметить, что из образцов, обработанных гептаном, было получено в ~5 раз больше хроматина (11,5 нг/л, 9,42 нг/мкл и 9,6 нг/мкл) по сравнению с необработанными образцами (2,2 нг/мкл). H3K4me3 и H3K27me3 ChIP-seq выполняли по Arrigoni et al.19. Как показано на рисунке 4B, сигнальные треки от трех независимых образцов, обработанных гептаном, были сопоставимы с треком необработанного гептаном образца для обеих гистоновых меток. Лечение гептаном не влияет на качество ChIP-seq, но значительно улучшает выход ядер (и сдвигового хроматина).
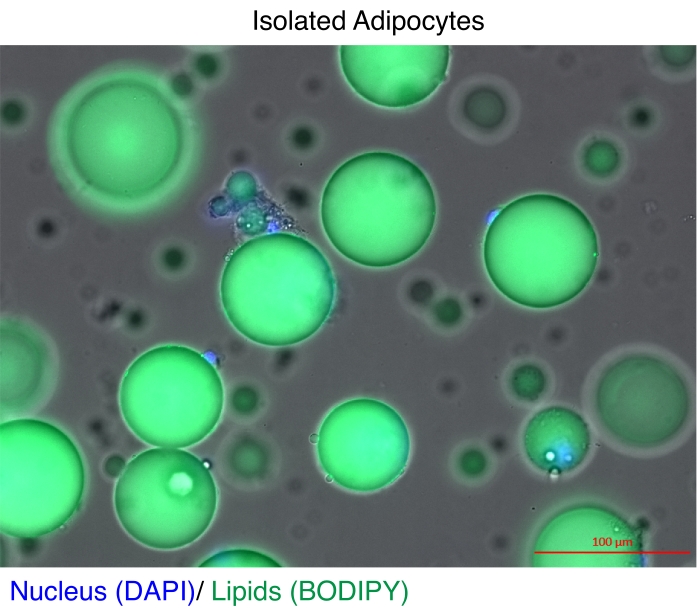
Рисунок 1: Выделенные адипоциты. Выделенные адипоциты окрашивали DAPI (синий) для окрашивания ядра и BODIPY (зеленый) для липидов. Цитозольные липидные капли составляют до 95% объема адипоцитов и представляют собой техническую проблему для достижения высоких выходов при экстракции РНК и хроматина. Масштабная линейка = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
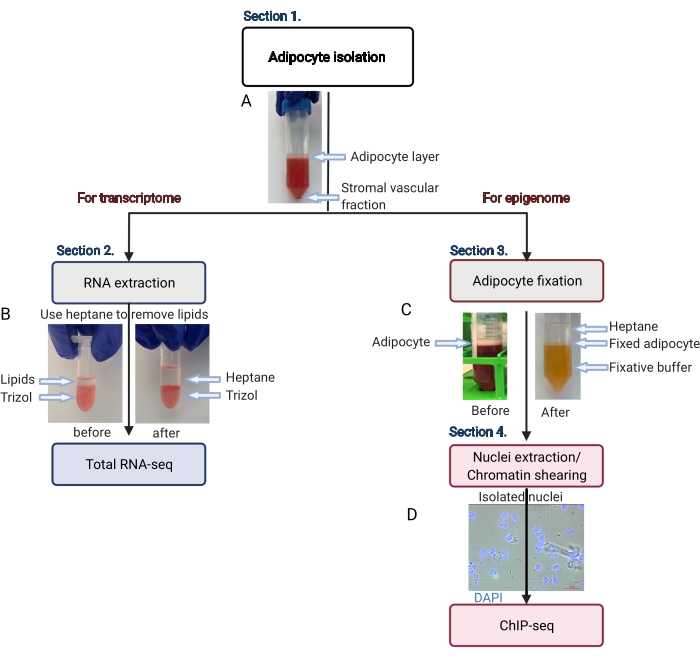
Рисунок 2: Схематический поток выделения адипоцитов для анализа транскриптома и эпигенома. Изображен весь рабочий процесс, от выделения адипоцитов до нанесения транскриптома или эпигенома. Показаны ключевые шаги и репрезентативные результаты. (А) Выделенные адипоциты плавают на верхнем слое, отделяясь от стромальной васкулярной фракции в виде гранулы на дне трубки. (В) Использование гептана для удаления липидов перед экстракцией РНК с помощью реагента для выделения РНК. (В) Использование гептана для удаления липидов во время фиксации адипоцитов. (D) Репрезентативное изображение выделенных ядер адипоцитов должно быть интактным и круглым. Масштабная линейка = 20 мкм. Схема была создана с BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
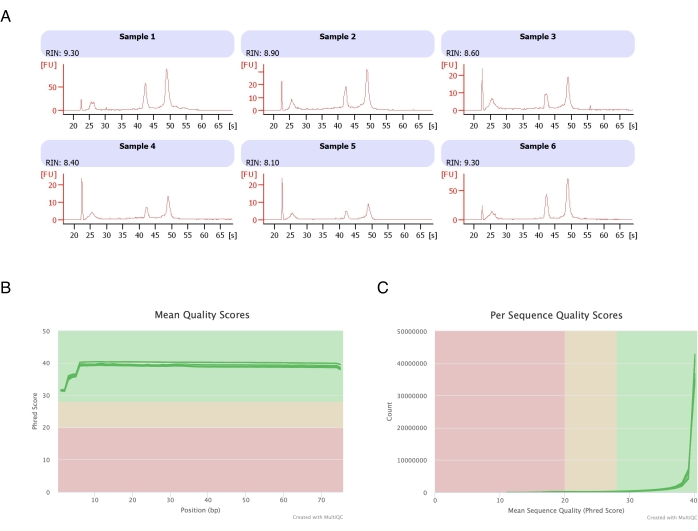
Рисунок 3: Репрезентативная электроферограмма целостности РНК и показателей качества после РНК-секвенирования. (A) Образцы 1-6 представляют собой шесть репликат обработанных гептаном адипоцитов, и их анализ целостности РНК был проведен с помощью автоматизированного электрофореза. Число целостности РНК (RIN) основано на соотношении 18S и 28S рибосомальных РНК и отражает качество РНК. Шкала от 1 (сильно деградировала) до 10 (наименее деградировала). (В,В) Оценка качества чтения секвенирования определялась с помощью мультиQC-анализа (B) для среднего балла качества по базису (C) и для оценки качества для каждой последовательности. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
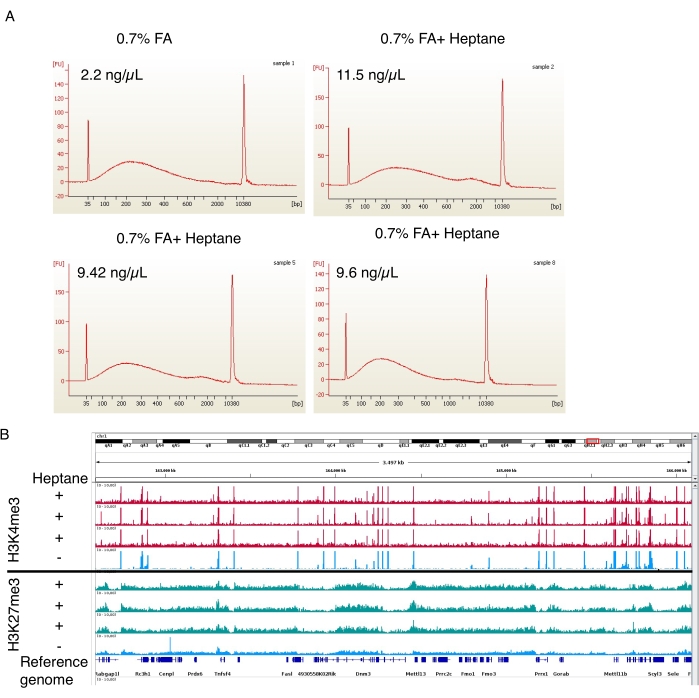
Рисунок 4: Репрезентативная электроферограмма сдвигового хроматина и пиков обогащения из ChIP-seq. (A) Репрезентативные профили с автоматизированного электрофореза, показывающие распределение хроматина по размерам в контроле (образец 1, вверху слева) и обработанных гептаном препаратах адипоцитарного хроматина (образцы 2, 5 и 8, вверху справа и внизу два). Концентрации хроматина в окончательных препаратах указаны в верхнем левом углу каждого изображения. (B) Скриншот браузера генома, сделанный с помощью Integrative Genomics Viewer (IGV). В верхней части графика показаны профили H3K4me3 ChIP-seq для трех (красных) образцов, обработанных гептаном, и одного (синего) контроля. На нижней панели показано то же самое для ChIP-seq H3K27me3. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Буфер | Состав |
| Буфер для пищеварения (для 3000 мг или менее жирового пакета/20 мл) | 20 мл модифицированной среды Dulbecco Eagle Medium (DMEM) |
| 0,3 г БСА без жирных кислот | |
| 0,1 г коллагеназы 2-го типа | |
| Лабораторный буфер Фарнхэма | ТРУБКИ 5 мМ (pH 8) |
| 85 мМ KCl | |
| 0,5% ИГЕПАЛ | |
| Буфер для сдвига | 10 мМ Tris-HCl pH 8 |
| 0,1% паспорта безопасности | |
| 1 мМ ЭДТА |
Таблица 1: Состав различных буферов, использованных в настоящем исследовании.
Обсуждение
Представленный здесь протокол выделения адипоцитов основан на общепринятых методах ферментативного расщепления11,14 для отделения зрелых адипоцитов (плавающих) от оставшейся стромально-сосудистой фракции белой жировой ткани. Он обеспечивает простой и универсальный подход к очищению зрелых адипоцитов у любой модели мыши. Как показано выше, протокол подходит для последующего использования для анализа всего транскриптома и ChIP-seq. Он обеспечивает достаточный выход для создания нескольких эпигеномных профилей (например, нескольких модификаций гистонов плюс РНК-секвенирование) из одного и того же отдельного жирового пакета.
Чтобы обеспечить высокий урожай, который позволяет получать такие согласованные данные эпигенома, критически важным шагом является использование гептана для растворения липидов из интактных адипоцитов и из адипоцитов, которые лизируются во время процесса. По нашему опыту, этот шаг существенно повышает воспроизводимость и выход, предотвращая потерю РНК и ядер в липидном слое. Непрерывное вращение трубок, содержащих адипоциты, подвергающиеся фиксации, не менее важно, так как это повышает однородность, с которой липиды удаляются из адипоцитов. Вместо 1% фиксирующего буфера формальдегида, о котором сообщалось в большей части литературы по ChIP-seq 21,22, было обнаружено, что снижение концентрации до 0,7% формальдегида необходимо для предотвращения чрезмерной фиксации. Время сдвига хроматина также было оптимизировано до 12 минут для достижения оптимального диапазона размеров хроматина (100-800.н.) для ChIP-seq.
Протокол был оптимизирован для объемных исследований транскриптома и эпигенома. Текущий протокол по-прежнему имеет свои ограничения для применения транскриптома и эпигенома одиночных клеток. Учитывая гетерогенность клеток, о которой сообщается в поле ожирения23,24, этот метод выделения может быть дополнительно усовершенствован для адаптации для анализов одиночных клеток. В таких условиях маркеры, ограниченные адипоцитами, такие как бор-дипиррометен (BODIPY)25 и перилипин-1 (PLIN1)26, ASC-127 или маркеры ядер, специфичные для адипоцитов, могут быть полезны для количественного определения дополнительных, функциональных, релевантных клеточных параметров. Помимо применения в геномных исследованиях, этот протокол может также улучшить протеомные исследования адипоцитов, которые имеют дополнительное препятствие из-за высокого содержания липидов в адипоцитах29.
Этот протокол также может быть использован для успешного извлечения ядер адипоцитов человека (данные не показаны), расширяя его применение для исследований ожирения человека.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы в долгу перед MPI-IE в области оптической визуализации, секвенирования, биоинформатического ядра и персонала. Эта работа была поддержана финансированием MPG, Исследовательского института Ван Анделя, исследования Европейского Союза Horizon 2020, NIH (R01HG012444 и R21HG011964), грантового соглашения Марии Склодовской-Кюри No 675610 и Федерального министерства образования и научных исследований в рамках проекта No 01KU1216 (Deutsches Epigenom Programm, DEEP).
Материалы
| Name | Company | Catalog Number | Comments |
| 16% Formaldehyde Solution (w/v). Methanol-free | ThermoFisher SCIENTIFIC | 28908 | |
| 1-bromo-3-chloropropane | SIGMA | B9673 | |
| 5 M NaCl | invitrogen | AM9759 | |
| Automated electrophoresis instrument (2100 Bioanalyzer Instrument) | Agilent Technologies | G2939BA | |
| BODIPY | ThermoFisher SCIENTIFIC | D3922 | |
| Collagenase Type 2 | Worthington Biochemical Corp. | 43D14184B | |
| Complete, EDTA-free, Protease inhibitor cocktail (PIC) | Roche | 4693159001 | EDTA free |
| DAPI | ThermoFisher SCIENTIFIC | D1306 | |
| DMEM (+ GlutaMAX) | life technologies | 61965-026 | |
| DNA purification kit (PCR purification kit) | Qiagen | 28104 | |
| DNA quantification instrument (Qubit 4 Fluorometer) | Fisher SCIENTIFIC | Q33238 | |
| DNA quantification kit (DNA high sensitivity assay) | Agilent Technologies | 5067-4626 | |
| EDTA | Fisher chimical | E478-500 | |
| EGTA | Fisher chimical | O2783-100 | |
| EtOH | PHARMCO | 111000200 | |
| Fatty acid-free BSA | SERVA | 11932.01 | bovine albumin fraction V, fatty acid-free lyophilized |
| Glycine | SIGMA | G7126-100G | |
| Heptane | SIGMA | H2198-1L | |
| High Sensitivity RNA Analysis | Agilent Technologies | 5067-1513 | |
| Igepal | SIGMA | 18896-50ML | |
| KCl | SIGMA | P3911-25G | |
| Matrix filter (420um) | Tisch Scientific | ME17238 | |
| Next-Generation Sequencer (HiSeq 3000 Sequencer) | Illumina | ||
| Nuclease-free water | Invitrogen | 4387936 | |
| PIPES | ACROS organics | 5625-37-6 | |
| Proteinase K | ThermoFisher SCIENTIFIC | EO0491 | |
| RNA isolation reagent (Trizol) | ThermoFisher SCIENTIFIC | 15596026 | |
| RNase A, DNase-free | ThermoFisher SCIENTIFIC | EN0531 | |
| Rotator (Thermo Scientific Tube Revolver Rotator) | ThermoFisher SCIENTIFIC | 88881001 | |
| SDS, Sodium dodecyl sulfate | SIGMA | 8170341000 | |
| Sonication tube (1 mL milliTUBE with AFA Fiber) | Covaris | 520135 | |
| Sonicator (Evolution Focused-ultra-sonicator (S220 or E220)) | Covaris | 500217 or 500239 | |
| Total RNA Prep kit ( Illumina Stranded Total RNA Prep kit) | Illumina | 20040525 | |
| Tris-HCl | Fisher bioreagents | BP153-500 |
Ссылки
- Albuquerque, D., Stice, E., Rodríguez-López, R., Manco, L., Nóbrega, C. Current review of genetics of human obesity: From molecular mechanisms to an evolutionary perspective. Molecular Genetics and Genomics. 290 (4), 1191-1221 (2015).
- Weihrauch-Blüher, S., Schwarz, P., Klusmann, J. H. Childhood obesity: Increased risk for cardiometabolic disease and cancer in adulthood. Metabolism. 92, 147-152 (2019).
- Weihrauch-Blüher, S., Wiegand, S. Risk factors and implications of childhood obesity. Current Obesity Reports. 7 (4), 254-259 (2018).
- Gluckman, P. D. Epigenetics, the life-course and metabolic disease. Nature Reviews Endocrinology. 8 (2), 74-76 (2012).
- Loh, M., Zhou, L., Ng, H. K., Chambers, J. C. Epigenetic disturbances in obesity and diabetes: Epidemiological and functional insights. Molecular Metabolism. 27, 33-41 (2019).
- Sayols-Baixeras, S., et al. DNA methylation and obesity traits: An epigenome-wide association study. The REGICOR study. Epigenetics. 12 (10), 909-916 (2017).
- Xia, Q., Grant, S. F. A. The genetics of human obesity. Annals of the New York Academy of Sciences. 1281 (1), 178-190 (2013).
- Yokoi, N. Epigenetic dysregulation in pancreatic islets and pathogenesis of type 2 diabetes. Journal of Diabetes Investigation. 9 (3), 475-477 (2018).
- Frayn, K. N. Obesity and metabolic disease: Is adipose tissue the culprit. Proceedings of the Nutrition Society. 64 (1), 7-13 (2005).
- Kawai, T., Autieri, M. V., Scalia, R. Adipose tissue inflammation and metabolic dysfunction in obesity. American Journal of Physiology-Cell Physiology. 320 (3), 375-391 (2021).
- Cat, A. N. D., Briones, A. M., Touyz, R. M., Schiffrin, E. L. . Hypertension: Methods and Protocols. , 283-295 (2017).
- Ambati, S., et al. Adipocyte nuclei captured from VAT and SAT. BMC Obesity. 3, 35 (2016).
- Roh, H. C., et al. Simultaneous transcriptional and epigenomic profiling from specific cell types within heterogeneous tissues in vivo. Cell Reports. 18 (4), 1048-1061 (2017).
- Jacobsen, M. J., et al. Epigenetic and transcriptomic characterization of pure adipocyte fractions from obese pigs identifies candidate pathways controlling metabolism. Frontiers in Genetics. 10, 1268 (2019).
- Janke, J., Engeli, S., Gorzelniak, K., Sharma, A. M. Extraction of total RNA from adipocytes. Hormone and Metabolic Research. 33 (4), 213-215 (2001).
- Cirera, S. Highly efficient method for isolation of total RNA from adipose tissue. BMC Research Notes. 6 (1), 472 (2013).
- Rajbhandari, P., et al. Single cell analysis reveals immune cell-adipocyte crosstalk regulating the transcription of thermogenic adipocytes. eLife. 8, 49501 (2019).
- Buddrick, O., Jones, O. A. H., Morrison, P. D., Small, D. M. Heptane as a less toxic option than hexane for the separation of vitamin E from food products using normal phase HPLC. RSC Advances. 3 (46), 24063-24068 (2013).
- Arrigoni, L., et al. Standardizing chromatin research: A simple and universal method for ChIP-seq. Nucleic Acids Research. 44 (7), 67 (2016).
- Ewels, P., Magnusson, M., Lundin, S., Käller, M. MultiQC: Summarize analysis results for multiple tools and samples in a single report. Bioinformatics. 32 (19), 3047-3048 (2016).
- Schmidt, D., et al. ChIP-seq: Using high-throughput sequencing to discover protein-DNA interactions. Methods. 48 (3), 240-248 (2009).
- Hoffman, E. A., Frey, B. L., Smith, L. M., Auble, D. T. Formaldehyde crosslinking: A tool for the study of chromatin complexes. Journal of Biological Chemistry. 290 (44), 26404-26411 (2015).
- Rondini, E. A., Granneman, J. G. Single cell approaches to address adipose tissue stromal cell heterogeneity. Biochemical Journal. 477 (3), 583-600 (2020).
- Corvera, S. Cellular heterogeneity in adipose tissues. Annu Review of Physiology. 83, 257-278 (2021).
- Katz, L. S., Geras-Raaka, E., Gershengorn, M. C. Heritability of fat accumulation in white adipocytes. American Journal of Physiology-Endocrinology and Metabolism. 307 (3), 335-344 (2014).
- Hansen, J. S., de Maré, S., Jones, H. A., Göransson, O., Lindkvist-Petersson, K. Visualization of lipid directed dynamics of perilipin 1 in human primary adipocytes. Scientific Reports. 7 (1), 15011 (2017).
- Ussar, S., et al. ASC-1, PAT2, and P2RX5 are cell surface markers for white, beige, and brown adipocytes. Science Translational Medicine. 6 (247), (2014).
- Onogi, Y., Khalil, A. E. M. M., Ussar, S. Identification and characterization of adipose surface epitopes. Biochemical Journal. 477 (13), 2509-2541 (2020).
- Kim, E. Y., et al. Recent advances in proteomic studies of adipose tissues and adipocytes. International Journal of Molecular Sciences. 16 (3), 4581-4599 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены