Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Uzun Menzilli Fiber Hizalamalı Mikromühendislik 3D Kollajen Hidrojelleri
Bu Makalede
Özet
Bu protokol, lifleri bir 3D kollajen hidrojel (kalınlığı <250 μm) hizalamak için uzatma gerinim (germe) oluşturmak için sıvı akış yönü boyunca değişen geometriye sahip bir mikroakışkan kanalın kullanımını göstermektedir. Ortaya çıkan hizalama birkaç milimetre boyunca uzanır ve uzatma gerinim hızından etkilenir.
Özet
Hizalanmış kollajen I (COL1) lifleri tümör hücresi motilitesine rehberlik eder, endotel hücre morfolojisini etkiler, kök hücre farklılaşmasını kontrol eder ve kalp ve kas-iskelet sistemi dokularının ayırt edici özelliğidir. İn vitro hizalanmış mikro ortamlara hücre tepkisini incelemek için, manyetik, mekanik, hücre tabanlı ve mikroakışkan yöntemler de dahil olmak üzere tanımlanmış fiber hizalamasına sahip COL1 matrisleri üretmek için çeşitli protokoller geliştirilmiştir. Bunlardan mikroakışkan yaklaşımlar, sıvı akışları ve hücresel mikro çevre üzerinde doğru kontrol gibi gelişmiş yetenekler sunar. Bununla birlikte, gelişmiş in vitro kültür platformları için hizalanmış COL1 matrisleri oluşturmaya yönelik mikroakışkan yaklaşımlar, 500 μm'den daha az mesafelere yayılan ve 3D hücre kültürü uygulamalarına elverişli olmayan COL1 liflerinin ince "paspasları" (<40 μm kalınlığında) ile sınırlandırılmıştır. Burada, mikroakışkan bir cihazda tanımlanmış fiber hizalamasının milimetre ölçekli bölgelerine sahip 3D COL1 matrislerini (130-250 μm kalınlığında) üretmek için bir protokol sunuyoruz. Bu platform, hücre kültürü için mikro mühendislik matrisine doğrudan erişim sağlayarak yapılandırılmış doku mikro ortamlarını modellemek için gelişmiş hücre kültürü yetenekleri sağlar.
Giriş
Hücreler, hücre dışı matris (ECM) adı verilen karmaşık bir 3D fibröz ağda bulunur ve bunların büyük kısmı yapısal protein kollajen tip I (COL1)1,2'den oluşur. ECM'nin biyofiziksel özellikleri, hücrelere rehberlik ipuçları sağlar ve buna cevaben, hücreler ECM mikromimarisiniyeniden şekillendirir 3,4,5. Bu karşılıklı hücre-matriks etkileşimleri,tümör ortamında anjiyogenezi ve hücre invazyonunu teşvik eden hizalanmış COL1 lif alanları6'ya yol açabilir 7,8,9 ve hücre morfolojisini10,11,12, polarizasyon 13 ve farklılaşma 14'ü etkiler. Hizalanmış kollajen lifleri ayrıca yara iyileşmesini destekler 15, doku gelişiminde önemli bir rol oynar16 ve uzun menzilli hücre iletişimine katkıda bulunur17,18. Bu nedenle, yerel COL1 fiber mikromimarisini in vitro olarak çoğaltmak, hizalanmış mikro ortamlara hücre tepkilerini incelemek için yapılandırılmış modeller geliştirmeye yönelik önemli bir adımdır.
Mikroakışkan hücre kültürü sistemleri, mikrofizyolojik sistemler (MPS) geliştirmek için tercih edilen bir teknoloji olarak kurulmuştur19,20,21,22,23. Uygun mikro ölçekli ölçeklendirme etkilerinden yararlanan bu sistemler, sıvı akışları üzerinde hassas kontrol sağlar, mekanik kuvvetlerin kontrollü bir şekilde kullanılmasını destekler ve bir mikrokanal 21,24,25,26,27 içindeki biyokimyasal mikro ortamı tanımlar. MPS platformları, dokuya özgü mikro ortamları modellemek ve çoklu organ etkileşimlerini incelemek için kullanılmıştır28. Aynı zamanda, hidrojeller, in vivo29,30 gözlemlenen ECM'nin 3D mekaniğini ve biyolojik etkisini özetlemek için yaygın olarak araştırılmıştır. 3D kültürün mikroakışkan platformlarla entegrasyonuna giderek artan bir vurgu ile, çok sayıda yaklaşım COL1 hidrojellerini mikroakışkan cihazlarda birleştirebilir31,32,33. Bununla birlikte, COL1 hidrojellerini mikroakışkan kanallarda hizalama yöntemleri, <1 mm genişliğindeki kanallarda ince 2D "paspaslar" (<40 μm kalınlığında) ile sınırlandırılmıştır ve hizalanmış 3D mikro ortamlarda hücre tepkilerini modellemek için sınırlı potansiyel sunar31,34,35,36.
Mikroakışkan bir sistemde hizalanmış 3D COL1 hidrojelleri elde etmek için, kendiliğinden monte edilen bir COL1 çözeltisi yerel uzatma akışlarına maruz kaldığında (akış yönünde hız değişimi), ortaya çıkan COL1 hidrojellerinin, yaşadıkları uzatma gerinim oranının büyüklüğü ile doğru orantılı bir derece lif hizalaması gösterdiği gösterilmiştir37, 38. Bu protokoldeki mikrokanal tasarımı iki şekilde benzersizdir; Birincisi, segmentli tasarım COL1 çözümüne yerel uzatma gerinimi getirir ve ikincisi, "iki parçalı" yapısı, kullanıcının COL1 liflerini hizalamasına ve daha sonra hizalanmış liflere açık bir biçimde doğrudan erişmek için kanalı sökmesine izin verir. Bu yaklaşım, sıralı COL1 matrislerine sahip mikrofizyolojik sistemler geliştiren modüler mikroakışkan platformlar geliştirmek için de benimsenebilir. Aşağıdaki protokol, parçalı mikro kanalların üretilmesi sürecini açıklamakta ve sığır atelo COL1'i hizalamak için kanalların kullanımını detaylandırmaktadır. Bu protokol aynı zamanda COL1 üzerindeki hücrelerin açık bir kuyu biçiminde kültürlenmesi için talimatlar sağlar ve modüler, manyetik bir taban katmanı kullanarak platforma işlevsellik eklemeyi tartışır.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. İki parçalı kanal ve modüler platform tabanının imalatı
NOT: Mikroakışkan kanal iki parça kullanılarak inşa edilmiştir - tanımlanmış kalınlıkta bir poli dimetil siloksan (PDMS) levhadan jiletle kesilen mikroakışkan kanal "kesme" ve kesime geri dönüşümlü olarak bağlanan ve kanalı oluşturan kanal kapağı. Kanal, bir ortam rezervuarı görevi görecek bir poli (metil metakrilat) (PMMA) çerçevesi ile çevrilidir (Şekil 1). PMMA çerçevesi, ek işlevsellik için özel modülleri manyetik olarak kilitlemek için de kullanılabilir.
- PDMS levhalardan tıraş bıçağı kesme kanalları:
NOT: Bu adım için mikroakışkan kanal tasarımı Ek Şekil 1'de verilmiştir. Kanal, her biri 5 mm uzunluğunda ve 10 mm, 5 mm, 2,5 mm, 1,25 mm ve 0,75 mm genişlikte beş segmentten oluşur. Sabit bir akış hızında (50-400 μL · dak-1) enjekte edilen kollajen çözeltisinin hızı, uzatılmış akış oluşturmak için kanal genişliği azaldıkça kanal boyunca lokal olarak artar.- 250 μm kalınlığında bir PDMS levhayı plastik bir taşıyıcı levhaya monte edin ve 0,5 mm, 1 cm·s−1 hız ve yüksek kuvvette bıçak derinliğinde bir zanaat kesici kullanarak mikroakışkan tasarımı jiletle kesin.
- Ultrasonik bir banyo kullanarak, mikroakışkan kanal kesiklerini 5 dakika boyunca temizleyin. Sonikasyonlu kanalları deiyonize (DI) suda durulayın ve 5 dakika boyunca 100 ° C'de temiz bir ocakta kurutun.
- Kanalları kullanana kadar temiz, kapalı bir Petri kabında saklayın.
- PDMS kapağının ve yüzey pasivasyonunun imalatı:
NOT: Bölüm 1.1'deki kanal kesimi, bir COL1 çözeltisinin enjekte edilebileceği kapalı bir kanal oluşturmak için üzerine yerleştirilebilecek bir kapak gerektirir (Ek Şekil 1). Kapak, COL1 kendiliğinden monte edildikten sonra çıkarılabilir. Kanaldaki COL1'in kapağa bağlanma olasılığını en aza indirmek için, kapak sığır serum albümini (BSA) kullanılarak pasifleştirilir. PDMS kapağı için kalıp tasarımı sağlanmıştır. Kalıp en az 2 mm kalınlığında olmalı ve mikroakışkan kanal kesiminin ayak izine eşit bir ayak izine sahip olmalıdır. Bu protokolde kalıp ayak izi 35 mm x 15 mm idi.- Kalıbı hazırlamak için, 2,5 mm kalınlığında bir PMMA tabakasına basınca duyarlı bir yapıştırıcı (PSA) tabakası yapıştırın ve istenen kalıp şeklini lazerle kesin.
- Lazerle kesilmiş PMMA kalıbını nemli, tüy bırakmayan bir mendille temizleyin ve PSA filmindeki desteği çıkarın. Kalıbı sıkıca bastırarak 100 mm çapında silikon gofret bt'ye takın.
- PDMS'yi 10:1 oranında hazırlayın (base:crosslinker). Doğru karıştırmayı sağlamak için 1 dakika boyunca kuvvetlice karıştırın ve hava kabarcıklarını gidermek için karışımı bir vakum odasında gazdan arındırın.
- Gazdan arındırılmış PDMS çözeltisini PMMA/silikon kalıba dökün ve 100 ° C'de bir ocak plakasında 20 dakika boyunca kürleyin. Kalıbın soğumasını bekleyin, kürlenmiş PDMS'yi çıkarın ve fazlalıkları bir tıraş bıçağı ile kesin.
NOT: PDMS kapaklarının silikon gofrete bakan taraflarının (düz kenarların) aşağıdaki tüm adımlar boyunca yukarı baktığından emin olun. - Mikroakışkan kanalın uçlarına karşılık gelen giriş ve çıkış delikleri oluşturmak için 1 mm çapında bir biyopsi zımbası kullanın. Adım 1.1'deki kanal kesimi, deliklerin konumunu yönlendirmek için şablon olarak kullanılabilir.
- Kapağı 5 dakika boyunca izopropanol (IPA) içinde sonikleştirin, DI suyuyla durulayın, basınçlı hava kaynağıyla kurutun ve ardından temiz, kapalı bir Petri kabında saklayın. Petri kabını sterilize etmek için 1 dakika boyunca bir UV sterilizasyon odasına (açık) yerleştirin.
- Örtün ve bir biyogüvenlik kabinine (BSC) aktarın.
- PDMS kapaklarına 1x fosfat tamponlu salin (PBS) içinde 40 mg•mL-1 sığır serum albümininden (BSA) oluşan 300 μL pipet yapın ve bir pipet ucu kullanarak çözeltiyi eşit şekilde yayın. Kullanmadan önce buzdolabında 4 ° C'de en az 4 saat bekletin.
- Kapakları buzdolabından BSC'ye taşıyın, 1x PBS ile 5 kez yıkayın ve 10 dakika boyunca havada kurumasını bekleyin.
NOT: PDMS kapakları, BSA ile kaplandıktan sonra buzdolabında 1 haftaya kadar saklanabilir.
- Kapakların glutaraldehit tedavisi
NOT: Kapak kaymalarının glutaraldehit ile işlevselleştirilmesi, COL1'i kovalent olarak kapak kaymasına bağlar ve hidrojelin ayrılmasını önler.- 49 mL asetona 1 mL APTES ekleyerek bir cam beherde %2 (v/v) aminopropil trietoksisilan (APTES) çözeltisi hazırlayın.
- %25'lik bir glutaraldehit çözeltisini DI suyunda %5'e seyreltin. Her 24 mm x 50 mm kapak kayması için 2 mL çözelti yapın. 24 mm x 24 mm veya 22 mm x 22 mm kapak kaymaları için, her biri için 1 mL çözelti yapın.
- IPA kullanarak kapak fişlerini banyo sonikatöründe 5 dakika boyunca temizleyin. IPA'yı DI suyu kullanarak kapaklardan durulayın. IPA, kapak kapağında pürüzsüz bir su filmi görülebildiğinde tamamen durulanır.
- Kapakları sıcak bir plaka üzerinde 100 ° C'de 5 dakika kurutun. Kurutulmuş kapakları temiz Petri kaplarına yerleştirin ve üst üste binmemelerini sağlayın.
- Bir korona deşarj değneği kullanarak, kapakları her biri 1 dakika boyunca bir korona deşarjına maruz bırakın.
NOT: Bu adım iyi havalandırılan bir alanda veya kimyasal bir başlıkta gerçekleştirilmelidir. - Kapak fişlerini Petri kabından çıkarın ve ardından korona maruz kaldıktan sonraki 5 dakika içinde 10 saniye boyunca APTES çözeltisine daldırın ve kapak kaymasının suya batırıldığından emin olun.
NOT: Hangi tarafın plazma ile tedavi edildiğini takip ettiğinizden ve yukarı bakacak şekilde tuttuğunuzdan emin olun. - Ardından, kapak kapağını 10 s boyunca asetona daldırın ve basınçlı hava ile kurulayın. Kuru kapak kaymasını Petri kabına geri yerleştirin, işlem görmüş tarafı yukarı bakacak şekilde.
NOT: Tüm kapak fişleri için 1.3.5-1.3.7 adımlarını yineleyin. - Her bir kapak kaymasının yüzeyine 1 mL glutaraldehit çözeltisi pipet uygulayın. Çözeltinin kapak kaymasının kenarına dökülmesine izin vermeden mümkün olduğunca fazla yüzeyi örtün. Gerekirse daha fazla glutaraldehit çözeltisi eklenebilir. Pipet ucuyla yüzeyi çizmediğinizden emin olun.
- Kapakların çözelti ile 30 dakika temas halinde kalmasına izin verin ve ardından 20 saat boyunca DI su ile durulayın. Kapakları basınçlı hava kullanarak kurutun ve plazma işlemden geçirilmiş Petri kaplarına geri yerleştirin.
NOT: Kapak fişleri oda sıcaklığında (RT) 1 haftaya kadar saklanabilir.
- Modüler manyetik tabanın lazerle kesilmesi
NOT: Modüler manyetik tabanın tasarımı Ek Şekil 1'de verilmiştir. Modüler taban, medyayı tutmak için bir kuyu görevi görür ve daha önce yayınlanmış çalışmalardaaçıklandığı gibi özel modülleri manyetik olarak bağlamak için de kullanılabilir 22,37,38,39.- Geçiş sayısı ve güç gibi uygun lazer ayarlarını kullanarak tasarımları PMMA katmanından kesin.
NOT: Lazer ayarları, mıknatıslar PMMA katmanına takılı olarak bastırılabilecek şekilde ayarlanmalıdır. Her lazer farklıdır ve kesim parametreleri deneysel olarak optimize edilmelidir. 45 W'lık bir lazer için, 2 mm ila 2 mm kalınlığında PMMA'yı kesmek için% 100 hız,% 100 güç ve 3 geçiş önerilir. - Lazer kesim işlemindeki kalıntıları gidermek için lazerle kesilmiş parçayı sabun ve su kullanarak yıkayın.
NOT: Lazerle kesilmiş parçaları temizlemek için çözücü kullanmayın. Solventler, lazerle kesilmiş kenarlarda mikro çatlakların yayılmasına neden olabilir.
- Geçiş sayısı ve güç gibi uygun lazer ayarlarını kullanarak tasarımları PMMA katmanından kesin.
- Platformun montajı
- Mıknatısları (3/16 çapında, 1/16 kalınlığında) elle lazer kesimli tabana itin. Mıknatısı itmeye yardımcı olmak için yumuşak bir çekiç veya tornavida ucu kullanılabilir. Mıknatısların kalınlığı, mıknatısların tabanın yüzeyi ile aynı hizada olmasını sağlamak için PMMA tabanının kalınlığından daha az olmalıdır.
NOT: Mıknatıslar, kullanıcının ek modüller takarak platforma işlevsellik eklemesine izin verir. - PSA tabakasının arkasını soyun ve tabanı, işlevselleştirilmiş tarafı yukarı bakacak şekilde glutaraldehit ile muamele edilmiş bir kapak kaymasına takın.
- PDMS kanal kesimini çerçeve tarafından tanımlanan boşluğa yavaşça yerleştirin. Hava kabarcıklarını çıkarmak ve konformal temas sağlamak için geniş uçlu cımbızla bastırın.
- BSA ile muamele edilmiş kanal kapağını, BSA tarafı aşağı bakacak şekilde kanal kesicisinin üstüne yerleştirin. Sıvı giriş ve çıkış portlarının kanalla aynı hizada olduğundan emin olun.
- Cihaz COL1 enjeksiyonu için hazırdır.
- Mıknatısları (3/16 çapında, 1/16 kalınlığında) elle lazer kesimli tabana itin. Mıknatısı itmeye yardımcı olmak için yumuşak bir çekiç veya tornavida ucu kullanılabilir. Mıknatısların kalınlığı, mıknatısların tabanın yüzeyi ile aynı hizada olmasını sağlamak için PMMA tabanının kalınlığından daha az olmalıdır.
2. COL1 çözeltisinin mikrokanala enjekte edilmesi ve hücre kültürü uygulamaları için kapağın çıkarılması
- COL1 çözümünün hazırlanması
- Gerekli tüm reaktifleri (COL1 stok çözeltisi [6 mg·mL−1], ultra saf su, 10x PBS, 0,1 M NaOH) biyogüvenlik kabinindeki buz üzerine yerleştirin.
- Reaktiflerin hacmini aşağıdaki gibi hesaplayın

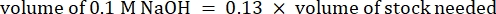
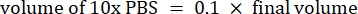
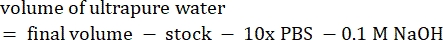
NOT: Bu nedenle, 6 mg·mL−1 stoktan 1 mL 2.5 mg·mL−1 nötralize kollajen yapmak için, 7 nihai pH için 416.67 μL kollajen, 429.16 μL DI su, 100 μL 10x PBS ve 54.16 μL 0.1 M NaOH ekleyin. 9.0 pH elde etmek için 20 μL 0.1 M NaOH ekleyin. - Reaktifleri aşağıdaki sırayla boş bir 5 mL şişeye ekleyin: i) COL1 stoğu, ii) DI suyu, iii) 10x PBS, iv) 0,1 M NaOH.
NOT: COL1 çözümünü işlemek için bir deplasmanlı pipet kullanın. Normal bir pipet kullanıldığında önemli numune kaybı meydana gelebilir ve bu da nihai çözelti konsantrasyonunda dalgalanmalara neden olabilir. - Çözeltinin pH'ını istenen pH'a yükseltin (tipik olarak 7-9 arasında).
- COL1 çözeltisinin enjekte edilmesi
- Bir biyogüvenlik kabinine bir şırınga pompası, soğutulmuş steril bir şırınga, soğutulmuş nötralize edilmiş COL1 çözeltisi ve steril bir 20 G 90 ° açılı uç Luer kilit iğnesi yerleştirin. COL1 çözeltisini şırıngaya yükleyin, kabarcıkların karışmasını önlemeye dikkat edin.
- 90° 20 G iğne ucunu şırıngaya takın, şırıngayı şırınga pompasına yükleyin, iğne aşağı bakacak şekilde ve iğneyi COL1 çözeltisi ile astarlayın.
- Şırınga pompasını 50-2.000 μL / dak arasında gerekli akış hızına ayarlayın.
- Hazırlanan PDMS kanallarını (bölüm 1) bir laboratuvar jakına yerleştirin ve iğne ile hizalayın.
- İğneyi PDMS kanalının giriş portuna (geniş taraf) yerleştirin. Çıkış tarafında ~ 30 μL'lik bir COL1 damlası toplanana kadar kanalı enjekte edin.
- Laboratuvar jakını indirin ve iğneyi yeni doldurulan kanaldan yavaşça ayırın.
- Tüm kanallar COL1 çözeltisiyle doldurulana kadar 2.2.5-2.2.9 arasındaki adımları yineleyin.
- Yeni oluşturulan COL1 jelinin dehidrasyonunu önlemek için doldurulmuş kanalları Petri kaplarına DI suyuyla doyurulmuş temiz, tüy bırakmayan bir mendille birlikte yükleyin.
- Petri kabını örtün ve yüklü kanalları soyma adımından önce 2 saat boyunca inkübatöre (37 ° C,% 95 nem) yerleştirin.
- Soyma ve ortam dengesi
- Cımbız kullanarak PDMS kapağını kaldırarak polimerize COL1 jelini açığa çıkarın. BSA işlemi, COL1'in kapağa yapışmasını önler.
- Kuyuya 650 μL EGM ekleyin.
- Jeli ve ortamı dengelemek için cihazları inkübatörde (37 ° C,% 95 nem) en az 4 saat bırakın. Hücrelerle tohumlamadan önce ortamı değiştirin
- Tohumlama hücreleri
- Biyogüvenlik kabinine gerekli sayıda 5 mL ve 10 mL pipetle birlikte %0,25 oranında sıcak tripsin ve kültür ortamı yerleştirin.
- Kültür insan göbek damarı endotel hücreleri (HUVEC'ler) endotel büyüme ortamında (EGM) 37 ° C'de% 80 akıcılık,% 95 nemde. HUVEC'leri içeren doku kültürü şişesini, mikroskop altında akıcılığı kontrol ettikten sonra BSC'ye yerleştirin.
- Ortamı T25 şişesine atın ve hücreleri 1x PBS ile 2 kat yıkayın. Şişeye 1 mL Tripsin ekleyin ve 3 dakika boyunca inkübatöre (37 ° C,% 95 nem) yerleştirin.
- Hücrelerin yüzeyden tamamen ayrıldığından emin olmak için şişeyi 3 dakika sonra mikroskop altında kontrol edin.
- Tripsini nötralize etmek için şişeye 3 mL EGM (serumlu) ekleyin. Ardından, 5 mL'lik bir pipet kullanarak hücre çözeltisini 15 mL'lik bir konik tüpe aktarın. Hücreleri içeren konik tüpü 150 x g'de 5 dakika boyunca santrifüjleyin.
- Konik tüpü biyogüvenlik kabinine yerleştirin ve hücre peletini rahatsız etmeden süpernatantı atın. Hücreleri 1 mL taze kültür ortamında yeniden askıya alın.
- 15 μL tripan mavisi ve 15 μL yeniden askıya alınmış hücre çözeltisini 1 mL konik tüp içinde ekleyin ve karıştırın.
- Bir hücre sayma slaydının her iki tarafına tripan mavisi ve hücre çözeltisi enjekte edin ve slaydı bir hücre sayma cihazına yerleştirin.
- Endotel büyüme ortamındaki hücre çözeltisini, hücre sayım cihazından elde edilen hücre konsantrasyonuna bağlı olarak gerekli konsantrasyona seyreltin.
NOT: %80 akıcılıkta bir T25 HUVEC şişesi, 1 mL ortamda seyreltilirse ~ 750.000 hücre·ml−1 üretecektir. Tohumlanacak hücre süspansiyonunun hacmi, kültür yüzeyinin alanı × hücre süspansiyonunun hücre yoğunluğu/konsantrasyonu olarak hesaplanır. Örnek: 35 mm x 15 mm'lik kuyuda 20.000 hücre·cm−2 tohumlamak için, hücre süspansiyonunun ~140 μL'sine ihtiyaç duyulur. - Tasarlanmış COL1 matrisindeki medyayı aspire edin.
- Hücre çözeltisinin gerekli hacmini COL1 substratına ekleyin ve hücrelerin görüntülemeden önce en az 4 saat bekletilmesine izin verin.
- Hücre çekirdeğinin ve hücre iskeletinin etiketlenmesi
- Ortamı hücrelerden aspire edin ve her yıkamada 1x PBS, 500 μL ile 3x yıkayın. RT'de 15 dakika boyunca hücre tabakasını% 4 paraformaldehit ile örtün.
- Paraformaldehiti aspire edin ve 5 dakika boyunca 1x PBS Tween-20 ile yıkayın.
- PBS'de 500 μL% 0.1 Triton-X çözeltisi kullanarak hücre zarını 15 dakika boyunca geçirgenleştirin. 1x PBS Tween-20 ile 5 dakika boyunca yıkayın.
- Spesifik olmayan bağlanma bölgelerini RT'de 30 dakika boyunca PBS'de 500 μL% 4 BSA ile bloke edin.
- Phalloidin-aktin floresan etiket çözeltisini %4 BSA'da (400 μL BSA'da 1 μL stok) seyreltin.
- BSA çözeltisini aspire edin, phalloidin çözeltisini hücrelere ekleyin ve RT'de 30 dakika bekleyin.
- Nükleer lekeyi% 4 BSA'da (500 μL'de 1 μL) seyreltin, falloidini aspire edin, çalışan nükleer leke çözeltisini ekleyin ve RT'de 15 dakika bekleyin.
- Nükleer leke çalışma solüsyonunu aspire edin, PBS Tween-20 ile her biri 5 dakika boyunca 3x yıkayın ve görüntülemeden önce 1x PBS ile değiştirin.
- 40x lensle FITC kanalını (ex 491 nm/em 516 nm) ve DAPI kanalını (ex 360 nm/em 460 nm) kullanarak epifloresan mikroskop kullanarak görüntü. 488 nm lazer çizgisi (%15 güç) ve 40x suya daldırma hedefi kullanarak yansıtma modunda lazer tarama konfokalı kullanarak kollajeni görüntüleyin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Kendiliğinden birleşen bir COL1 çözeltisi, kesit alanı azalan bir kanaldan aktığında, COL1 çözeltisinin akış hızı (v x), iki segment (∂x) arasındaki daralmanın uzunluğu boyunca yerel olarak bir büyüklük∂te, v x ile artar ve ε̇ = ∂v x/∂x olan bir uzatma gerinim oranı (ε̇) ile sonuçlanır. Ekstansiyonel gerinim oranı, Şekil 2'de görüldüğü gibi parçacık görüntü velosimetrisi (PIV) kullanılarak ölçülen sıvı hız...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Hizalanmış liflerle COL1 matrisleri oluşturmak için protokoller, manyetik yöntemler, mekanik gerinimin doğrudan uygulanması ve mikroakışkan teknikler kullanılarak tanımlanmıştır47. Mikroakışkan yaklaşımlar, biyokimyasal mikro çevre üzerinde hassas kontrol sağlayan iyi tanımlanmış akış ve taşıma özellikleri nedeniyle mikrofizyolojik sistemler oluşturmak için yaygın olarak kullanılmaktadır. Hizalanmış COL1 lifleri, yara iyileşmesi, tümör hücresi invazyonu ve d...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Tüm yazarlar birbiriyle çelişen çıkarlar olmadığını beyan eder.
Teşekkürler
Bu çalışma kısmen R21GM143658 ödül numarası altında Ulusal Sağlık Enstitüsü ve 2150798 hibe numarası altında Ulusal Bilim Vakfı tarafından desteklenmiştir. İçerik yalnızca yazarların sorumluluğundadır ve finansman kuruluşlarının resmi görüşlerini temsil etmek zorunda değildir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane, 99% (APTES) | Sigma Aldrich | 440140-100ML | |
| 20 Gauge IT Series Angled Dispensing Tip | Jensen Global | JG-20-1.0-90 | |
| 3/16" dia. x 1/16" thick Nickel Plated Magnet | KJ Magnetics | D31 | |
| 3M (TC) 12X12-6-467MP | DigiKey | 3M9726-ND | |
| ACETONE ACS REAGENT ≥99.5% | Signa Aldrich | 179124-4L | |
| BD-20AC LABORATORY CORONA TREATER | Electro-Technic Products | 12051A | |
| Bovine Serum Albumin (BSA), Fraction V, 98%, Reagent Grade, Alfa Aesar | VWR | AAJ64100-09 | |
| Clear cast acrylic sheet | McMaster-Carr | 8560K181 | |
| Corning 100 mL Trypsin 10x, 2.5% Trypsin in HBSS [-] calcium, magnesium, phenol red, Porcine Parvovirus Tested | VWR | 45000-666 | |
| Countess II Automated Cell Counter | Thermo Fisher Scientific | AMQAX1000 | |
| CT-FIRE software | LOCI - University of Wisconsin | ||
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit, (CC-3156 & CC-4176), Lonza CC-3162, 500 mL | Lonza | CC-3162 | |
| Glutaraldehyde 50% in aqueous solution, Reagent Grade, Packaging=HDPE Bottle, Size=100 mL | VWR | VWRV0875-100ML | |
| Graphtec CELITE-50 | Graphtec | CE LITE-50 | |
| HEPES (1 M) | Thermo Fisher Scientific | 15-630-080 | |
| High-Purity Silicone Rubber .010" Thick, 6" X 8" Sheet, 55A Durometer | McMaster-Carr | 87315K62 | |
| Human Umbilical Vein Endothelial cells | Thermo Fisher Scientific | C0035C | |
| Invitrogen Trypan Blue Stain (0.4%) | Thermo Fisher Scientific | T10282 | |
| Isopropanol | Fisher Scientific | A4154 | |
| Laser cutter | Full Spectrum | 20x12 H-series | |
| Microfluidics Syringe pump | New Era Syringe Pumps | NE-1002X | |
| Microman E Single Channel Pipettor, Gilson, Model M1000E | Gilson | FD10006 | |
| Molecular Probes Alexa Fluor 488 Phalloidin | Thermo Fisher Scientific | A12379 | |
| Molecular Probes Hoechst 33342, Trihydrochloride, Trihydrate | Thermo Fisher Scientific | H3570 | |
| Nutragen Bovine Atelo Collagen | Advanced BioMatrix | 5010-50ML | |
| Pbs (10x), pH 7.4 | VWR | 70011044.00 | |
| PBS pH 7.4 | Thermo Fisher Scientific | 10010049.00 | |
| Phosphate-buffered saline (PBS, 10x), with Triton X-100 | Alfa Aesar | J63521 | |
| Replacement carrier sheet for graphtec craft ROBO CC330L-20 | USCUTTER | GRPCARSHTN | |
| Restek Norm-Ject Plastic Syringe 1 mL Luer Slip | Restek | 22766.00 | |
| Silicon wafer | University wafer | 452 | |
| Sodium Hydroxide, ACS, Packaging=Poly Bottle, Size=500 g | VWR | BDH9292-500G | |
| Sylgard 184 | VWR | 102092-312 | |
| Thermo Scientific Pierce 20x PBS Tween 20 | Thermo Fisher Scientific | 28352.00 |
Referanslar
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Bosman, F. T., Stamenkovic, I. Functional structure and composition of the extracellular matrix. The Journal of Pathology. 200 (4), 423-428 (2003).
- Cox, T. R., Erler, J. T. Remodeling and homeostasis of the extracellular matrix: Implications for fibrotic diseases and cancer. Disease Models & Mechanisms. 4 (2), 165-178 (2011).
- Cross, V. L., et al. Dense type I collagen matrices that support cellular remodeling and microfabrication for studies of tumor angiogenesis and vasculogenesis in vitro. Biomaterials. 31 (33), 8596-8607 (2010).
- Lu, P., Takai, K., Weaver, V. M., Werb, Z. Extracellular matrix degradation and remodeling in development and disease. Cold Spring Harbor Perspectives in Biology. 3 (12), 005058(2011).
- Piotrowski-Daspit, A. S., Nerger, B. A., Wolf, A. E., Sundaresan, S., Nelson, C. M. Dynamics of tissue-induced alignment of fibrous extracellular matrix. Biophysical Journal. 113 (3), 702-713 (2017).
- Provenzano, P. P., et al. Collagen reorganization at the tumor-stromal interface facilitates local invasion. BMC Medicine. 4 (1), 38(2006).
- Provenzano, P. P., et al. Collagen density promotes mammary tumor initiation and progression. BMC Medicine. 6 (1), 11(2008).
- Szulczewski, J. M., et al. Directional cues in the tumor microenvironment due to cell contraction against aligned collagen fibers. Acta Biomaterialia. 129, 96-109 (2021).
- Aubin, H., et al. Directed 3D cell alignment and elongation in microengineered hydrogels. Biomaterials. 31 (27), 6941-6951 (2010).
- Gruschwitz, R., et al. Alignment and cell-matrix interactions of human corneal endothelial cells on nanostructured collagen type I matrices. Investigative Ophthalmology & Visual Science. 51 (12), 6303-6310 (2010).
- Wang, W. Y., et al. Extracellular matrix alignment dictates the organization of focal adhesions and directs uniaxial cell migration. APL Bioengineering. 2 (4), 046107(2018).
- Wang, W. Y., Lin, D., Jarman, E. H., Polacheck, W. J., Baker, B. M. Functional angiogenesis requires microenvironmental cues balancing endothelial cell migration and proliferation. Lab on a Chip. 20 (6), 1153-1166 (2020).
- Lanfer, B. The growth and differentiation of mesenchymal stem and progenitor cells cultured on aligned collagen matrices. Biomaterials. 30 (30), 5950-5958 (2009).
- Brauer, E., et al. Collagen fibrils mechanically contribute to tissue contraction in an in vitro wound healing scenario. Advanced Science. 6 (9), 1801780(2019).
- Ingber, D. E. From mechanobiology to developmentally inspired engineering. PhilosophicalTransactions of the Royal Society B: Biological Sciences. 373 (1759), 20170323(2018).
- Wang, H., Abhilash, A. S., Chen, C. S., Wells, R. G., Shenoy, V. B. Long-range force transmission in fibrous matrices enabled by tension-driven alignment of fibers. Biophysical Journal. 107 (11), 2592-2603 (2014).
- Reinhart-King, C. A., Dembo, M., Hammer, D. A. Cell-cell mechanical communication through compliant substrates. Biophysical Journal. 95 (12), 6044-6051 (2008).
- Ahadian, S., et al. Organ-on-a-chip platforms: A convergence of advanced materials, cells, and microscale technologies. Advanced Healthcare Materials. 7 (2), 1700506(2018).
- Hou, X., et al. Interplay between materials and microfluidics. Nature Reviews Materials. 2 (5), 17016(2017).
- Abhyankar, V. V., et al. A platform for assessing chemotactic migration within a spatiotemporally defined 3D microenvironment. Lab on a Chip. 8 (9), 1507-1515 (2008).
- Abhyankar, V. V., Wu, M., Koh, C. Y., Hatch, A. V. A reversibly sealed, easy access, modular (SEAM) microfluidic architecture to establish in vitro tissue interfaces. PLoS One. 11 (5), 0156341(2016).
- Williams, M. J., et al. A low-cost, rapidly integrated debubbler (RID) module for microfluidic cell culture applications. Micromachines. 10 (6), 360(2019).
- Hsu, M. C., et al. A miniaturized 3D printed pressure regulator (µPR) for microfluidic cell culture applications. Scientific Reports. 12, 10769(2022).
- Huh, D., Torisawa, Y. S., Hamilton, G. A., Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab on a Chip. 12 (12), 2156-2164 (2012).
- Abhyankar, V. V., Lokuta, M. A., Huttenlocher, A., Beebe, D. J. Characterization of a membrane-based gradient generator for use in cell-signaling studies. Lab on a Chip. 6 (3), 389-393 (2006).
- Hasan, M. R., et al. One-step fabrication of flexible nanotextured PDMS as a substrate for selective cell capture. Biomedical Physics & Engineering Express. 4 (2), 025015(2018).
- Meyvantsson, I., Beebe, D. J. Cell culture models in microfluidic systems. Annual Review of Physical Chemistry. 1, 423-449 (2008).
- Ma, Y., et al. Viscoelastic cell microenvironment: Hydrogel-based strategy for recapitulating dynamic ECM mechanics. Advanced Functional Materials. 31 (24), 2100848(2021).
- Ma, Y., et al. 3D spatiotemporal mechanical microenvironment: A hydrogel-based platform for guiding stem cell fate. Advanced Materials. 30 (49), 1705911(2018).
- Lee, P., Lin, R., Moon, J., Lee, L. P. Microfluidic alignment of collagen fibers for in vitro cell culture. Biomedical Microdevices. 8 (1), 35-41 (2006).
- Del Amo, C., Borau, C., Movilla, N., Asín, J., García-Aznar, J. M. Quantifying 3D chemotaxis in microfluidic-based chips with step gradients of collagen hydrogel concentrations. Integrative Biology. 9 (4), 339-349 (2017).
- Shi, N., et al. A 3D, magnetically actuated, aligned collagen fiber hydrogel platform recapitulates physical microenvironment of myoblasts for enhancing myogenesis. Small Methods. 5 (6), 2100276(2021).
- Lanfer, B., et al. Aligned fibrillar collagen matrices obtained by shear flow deposition. Biomaterials. 29 (28), 3888-3895 (2008).
- Saeidi, N., Sander, E. A., Ruberti, J. W. Dynamic shear-influenced collagen self-assembly. Biomaterials. 30 (34), 6581-6592 (2009).
- Saeidi, N., Sander, E. A., Zareian, R., Ruberti, J. W. Production of highly aligned collagen lamellae by combining shear force and thin film confinement. Acta Biomaterialia. 7 (6), 2437-2447 (2011).
- Ahmed, A., et al. Microengineered 3D collagen gels with independently tunable fiber anisotropy and directionality. Advanced Materials Technologies. 6 (4), 2001186(2021).
- Ahmed, A., et al. Local extensional flows promote long-range fiber alignment in 3D collagen hydrogels. Biofabrication. 14 (3), 035019(2022).
- Mansouri, M., et al. The modular µSiM reconfigured: Integration of microfluidic capabilities to study in vitro barrier tissue models under flow. Advanced Healthcare Materials. , (2022).
- Paten, J. A., et al. Flow-induced crystallization of collagen: a potentially critical mechanism in early tissue formation. ACS Nano. 10 (5), 5027-5040 (2016).
- Liu, Y., Eliceiri, K. W. Quantifying fibrillar collagen organization with curvelet transform-based tools. Journal of Visualized Experiments. (165), e61931(2020).
- Bredfeldt, J. S., et al. Automated quantification of aligned collagen for human breast carcinoma prognosis. Journal of Pathology Informatics. 5 (1), 28(2014).
- Bredfeldt, J. S., et al. Computational segmentation of collagen fibers from second-harmonic generation images of breast cancer. Journal of Biomedical Optics. 19 (1), 016007(2014).
- Carey, S. P., et al. Local extracellular matrix alignment directs cellular protrusion dynamics and migration through Rac1 and FAK. Integrative Biology. 8 (8), 821-835 (2016).
- Carey, S. P., Kraning-Rush, C. M., Williams, R. M., Reinhart-King, C. A. Biophysical control of invasive tumor cell behavior by extracellular matrix microarchitecture. Biomaterials. 33 (16), 4157-4165 (2012).
- Ahmed, A., et al. Engineering fiber anisotropy within natural collagen hydrogels. AmericanJournal of Physiology-Cell Physiology. 320 (6), 1112-1124 (2021).
- Mohammadi, H., Janmey, P. A., McCulloch, C. A. Lateral boundary mechanosensing by adherent cells in a collagen gel system. Biomaterials. 35 (4), 1138-1149 (2014).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır