A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الهندسة المجهرية 3D الكولاجين الهلاميات المائية مع محاذاة الألياف طويلة المدى
In This Article
Summary
يوضح هذا البروتوكول استخدام قناة الموائع الدقيقة مع تغيير الهندسة على طول اتجاه تدفق السوائل لتوليد إجهاد ممتد (تمتد) لمحاذاة الألياف في هيدروجيل الكولاجين ثلاثي الأبعاد (سمك <250 ميكرومتر). تمتد المحاذاة الناتجة عبر عدة ملليمترات وتتأثر بمعدل الإجهاد الممتد.
Abstract
توجه ألياف الكولاجين I (COL1) المحاذاة حركة الخلايا السرطانية ، وتؤثر على مورفولوجيا الخلايا البطانية ، وتتحكم في تمايز الخلايا الجذعية ، وهي سمة مميزة لأنسجة القلب والعضلات والعظام. لدراسة استجابة الخلايا للبيئات الدقيقة المحاذاة في المختبر ، تم تطوير العديد من البروتوكولات لتوليد مصفوفات COL1 مع محاذاة الألياف المحددة ، بما في ذلك الطرق المغناطيسية والميكانيكية والقائمة على الخلايا والموائع الدقيقة. من بين هذه الأساليب ، توفر مناهج الموائع الدقيقة قدرات متقدمة مثل التحكم الدقيق في تدفقات السوائل والبيئة المكروية الخلوية. ومع ذلك ، فإن مناهج الموائع الدقيقة لتوليد مصفوفات COL1 المحاذاة لمنصات الزراعة المتقدمة في المختبر قد اقتصرت على "الحصير" الرقيقة (<40 ميكرومتر في السماكة) من ألياف COL1 التي تمتد على مسافات أقل من 500 ميكرومتر ولا تفضي إلى تطبيقات زراعة الخلايا ثلاثية الأبعاد. هنا ، نقدم بروتوكولا لتصنيع مصفوفات 3D COL1 (بسمك 130-250 ميكرومتر) مع مناطق مقياس ملليمتر من محاذاة الألياف المحددة في جهاز الموائع الدقيقة. توفر هذه المنصة قدرات متقدمة لزراعة الخلايا لنمذجة البيئات الدقيقة للأنسجة المهيكلة من خلال توفير الوصول المباشر إلى المصفوفة المهندسة الدقيقة لزراعة الخلايا.
Introduction
توجد الخلايا في شبكة ليفية ثلاثية الأبعاد معقدة تسمى المصفوفة خارج الخلية (ECM) ، ويتكون الجزء الأكبر منها من الكولاجين البروتيني الهيكلي من النوع الأول (COL1) 1,2. توفر الخصائص الفيزيائية الحيوية ل ECM إشارات إرشادية للخلايا ، واستجابة لذلك ، تعيد الخلايا تشكيل العمارة الدقيقة ECM3،4،5. يمكن أن تؤدي هذه التفاعلات المتبادلة بين مصفوفة الخلايا إلى محاذاة مجالات ألياف COL16 التي تعزز تكوين الأوعية الدموية وغزو الخلايا في بيئة الورم7،8،9 وتؤثر على مورفولوجيا الخلية 10،11،12 ، الاستقطاب 13 ، والتمايز 14. تعمل ألياف الكولاجين المحاذاة أيضا على تعزيز التئام الجروح 15 ، وتلعب دورا رئيسيا في نمو الأنسجة16 ، وتساهم في اتصال الخلايا بعيد المدى17,18. لذلك ، يعد تكرار البنية الدقيقة لألياف COL1 الأصلية في المختبر خطوة مهمة نحو تطوير نماذج منظمة لدراسة استجابات الخلايا للبيئات الدقيقة المحاذاة.
تم إنشاء أنظمة زراعة خلايا الموائع الدقيقة كتقنية مفضلة لتطوير أنظمة الفيزيولوجيا الدقيقة (MPS) 19،20،21،22،23. من خلال الاستفادة من تأثيرات التحجيم المجهرية المواتية ، توفر هذه الأنظمة تحكما دقيقا في تدفقات السوائل ، وتدعم الإدخال المتحكم فيه للقوى الميكانيكية ، وتحدد البيئة المكروية الكيميائية الحيوية داخل قناة دقيقة21،24،25،26،27. تم استخدام منصات MPS لنمذجة البيئات الدقيقة الخاصة بالأنسجة ودراسة التفاعلات متعددة الأعضاء28. في الوقت نفسه ، تم استكشاف الهلاميات المائية على نطاق واسع لتلخيص ميكانيكا 3D والتأثير البيولوجي ل ECM التي لوحظت في الجسم الحي29,30. مع التركيز المتزايد على دمج ثقافة 3D مع منصات الموائع الدقيقة ، يمكن للعديد من الأساليب الجمع بين الهلاميات المائية COL1 في أجهزة الموائع الدقيقة31،32،33. ومع ذلك ، فقد اقتصرت طرق محاذاة الهلاميات المائية COL1 في قنوات الموائع الدقيقة على "حصائر" 2D رقيقة (سمك < 40 ميكرومتر) في قنوات بعرض <1 مم ، مما يوفر إمكانات محدودة لنمذجة استجابات الخلايا في البيئات الدقيقة ثلاثية الأبعادالمحاذاة 31،34،35،36.
لتحقيق الهلاميات المائية ثلاثية الأبعاد COL1 المحاذاة في نظام الموائع الدقيقة ، فقد ثبت أنه عندما يتعرض محلول COL1 ذاتي التجميع لتدفقات التمديد المحلية (تغير السرعة على طول الاتجاه الانسيابي) ، تعرض الهلاميات المائية COL1 الناتجة درجة من محاذاة الألياف تتناسب طرديا مع حجم معدل الإجهاد الممتد الذي يواجهونه37 ، 38. تصميم microchannel في هذا البروتوكول فريد من نوعه بطريقتين. أولا ، يقدم التصميم المجزأ إجهادا محليا ممتدا لحل COL1 ، وثانيا ، يسمح بنائه "المكون من قطعتين" للمستخدم بمحاذاة ألياف COL1 ثم تفكيك القناة للوصول مباشرة إلى الألياف المحاذاة بتنسيق مفتوح. يمكن اعتماد هذا النهج أيضا لتطوير منصات الموائع الدقيقة المعيارية التي تطور أنظمة فسيولوجية دقيقة مع مصفوفات COL1 مرتبة. يصف البروتوكول التالي عملية تصنيع القنوات الدقيقة المجزأة ويفصل استخدام القنوات لمحاذاة الأبقار atelo COL1. يوفر هذا البروتوكول أيضا تعليمات لزراعة الخلايا على COL1 بتنسيق بئر مفتوح ويناقش إضافة وظائف إلى النظام الأساسي باستخدام طبقة قاعدة مغناطيسية معيارية.
Protocol
1. تصنيع القناة المكونة من قطعتين وقاعدة المنصة المعيارية
ملاحظة: يتم إنشاء قناة الموائع الدقيقة باستخدام جزأين - قناة الموائع الدقيقة "انقطاع" ، وهي عبارة عن شفرة حلاقة مقطوعة من ورقة بولي ثنائي ميثيل سيلوكسان (PDMS) بسماكة محددة ، وغطاء القناة ، الذي يرتبط بشكل عكسي بالانقطاع ويشكل القناة. القناة محاطة بإطار بولي (ميثيل ميثاكريلات) (PMMA) يعمل كخزان وسائط (الشكل 1). يمكن أيضا استخدام إطار PMMA لتثبيت الوحدات المتخصصة مغناطيسيا للحصول على وظائف إضافية.
- قنوات القطع الحلاقة:
ملاحظة: يرد تصميم قناة الموائع الدقيقة لهذه الخطوة في الشكل التكميلي 1. تتكون القناة من خمسة أجزاء بطول 5 مم لكل منها وعرض 10 مم و 5 مم و 2.5 مم و 1.25 مم و 0.75 مم. تزداد سرعة محلول الكولاجين ، الذي يتم حقنه بمعدل تدفق ثابت (50-400 ميكرولتر · دقيقة −1) ، محليا على طول القناة حيث يتم تقليل عرض القناة لتوليد تدفق ممتد.- قم بتركيب لوح PDMS بسمك 250 ميكرومتر على لوح حامل بلاستيكي وقم بقص تصميم الموائع الدقيقة باستخدام قاطع حرفية على عمق شفرة يبلغ 0.5 مم وسرعة 1 سم · ثانية − 1 وقوة عالية.
- باستخدام حمام بالموجات فوق الصوتية ، قم بتنظيف قواطع قناة الموائع الدقيقة لمدة 5 دقائق. اشطف القنوات الصوتية في ماء منزوع الأيونات (DI) وجففها على لوح تسخين نظيف عند 100 درجة مئوية لمدة 5 دقائق.
- قم بتخزين القنوات في طبق بتري نظيف ومغطى حتى الاستخدام.
- تصنيع غطاء PDMS والتخميل السطحي:
ملاحظة: يتطلب انقطاع القناة من القسم 1.1 غطاءا يمكن وضعه فوقه لإنشاء قناة مغلقة يمكن حقن محلول COL1 فيها (الشكل التكميلي 1). يمكن إزالة الغطاء بعد تجميع COL1 ذاتيا. لتقليل فرص ارتباط COL1 في القناة بالغطاء ، يتم تخميل الغطاء باستخدام ألبومين مصل الأبقار (BSA). يتم توفير تصميم القالب لغطاء PDMS. يجب ألا يقل سمك القالب عن 2 مم ويجب أن يكون له بصمة مساوية لبصمة انقطاع قناة الموائع الدقيقة. في هذا البروتوكول ، كانت بصمة القالب 35 مم × 15 مم.- لتحضير القالب ، قم بتثبيت ورقة من المادة اللاصقة الحساسة للضغط (PSA) على ورقة بسمك 2.5 مم من PMMA وقطع شكل القالب المطلوب بالليزر.
- نظف قالب PMMA المقطوع بالليزر بمنديل رطب وخالي من النسالة وقم بإزالة الدعم من فيلم PSA. قم بتوصيل القالب برقاقة سيليكون قطرها 100 مم تضغط لأسفل بإحكام.
- قم بإعداد PDMS بنسبة 10: 1 (القاعدة: الرابط المتقاطع). تخلط بقوة لمدة 1 دقيقة لضمان الخلط السليم وإزالة الغازات من الخليط في غرفة مفرغة لإزالة فقاعات الهواء.
- صب محلول PDMS المنزوع التفريغ في قالب PMMA / السيليكون وعالجه على لوح تسخين عند 100 درجة مئوية لمدة 20 دقيقة. اترك القالب يبرد ، وقم بإزالة PDMS المعالج ، وقم بقص أي فائض بشفرة حلاقة.
ملاحظة: تأكد من أن الجوانب المواجهة لرقاقة السيليكون (الجوانب المسطحة) لأغطية PDMS متجهة لأعلى خلال جميع الخطوات التالية. - استخدم لكمة خزعة قطرها 1 مم لإنشاء فتحات مدخل ومخرج تتوافق مع نهايات قناة الموائع الدقيقة. يمكن استخدام انقطاع القناة من الخطوة 1.1 كقالب لتوجيه موضع الثقوب.
- قم بتنظيف الغطاء في الأيزوبروبانول (IPA) لمدة 5 دقائق ، ثم اشطفه بماء DI ، وجففه بمصدر هواء مضغوط ، ثم خزنه في طبق بتري نظيف ومغطى. ضع طبق بتري في غرفة التعقيم بالأشعة فوق البنفسجية (مكشوفة) لمدة 1 دقيقة للتعقيم.
- تغطية ونقل إلى خزانة السلامة البيولوجية (BSC).
- ماصة 300 ميكرولتر من 40 مجم • مل -1 ألبومين مصل البقر (BSA) في 1x محلول ملحي مخزن بالفوسفات (PBS) على أغطية PDMS وانشر المحلول بالتساوي باستخدام طرف ماصة. ضعه في الثلاجة على حرارة 4 درجات مئوية لمدة 4 ساعات على الأقل قبل الاستخدام.
- انقل الأغطية من الثلاجة إلى BSC ، واغسلها 5x باستخدام 1x PBS ، واتركها تجف في الهواء لمدة 10 دقائق.
ملاحظة: يمكن تخزين أغطية PDMS في الثلاجة لمدة تصل إلى 1 أسبوع بعد طلائها ب BSA.
- علاج الجلوتارالدهيد من أغطية الأغطية
ملاحظة: يؤدي تشغيل أغطية الغطاء باستخدام الجلوتارالدهيد إلى ربط COL1 تساهميا بغطاء الغطاء ويمنع الهيدروجيل من الانفصال.- تحضير محلول أمينوبروبيل ثلاثي إيثوكسيسيلان (APTES) بنسبة 2٪ (v / v) في دورق زجاجي بإضافة 1 مل من APTES إلى 49 مل من الأسيتون.
- تمييع 25٪ محلول غلوتارالدهيد إلى 5٪ في ماء DI. اصنع 2 مل من المحلول لكل غطاء 24 مم × 50 مم. بالنسبة لأغطية 24 مم × 24 مم أو 22 مم × 22 مم ، اصنع 1 مل من المحلول لكل منها.
- نظف أغطية الغطاء في صوتنة الحمام لمدة 5 دقائق باستخدام IPA. اشطف IPA من أغطية الغطاء باستخدام ماء DI. يتم شطف IPA تماما عندما يمكن رؤية فيلم ناعم من الماء على الغطاء.
- جفف أغطية الأغطية على طبق ساخن لمدة 5 دقائق عند 100 درجة مئوية. ضع أغطية الأغطية المجففة في أطباق بتري نظيفة ، مع التأكد من عدم تداخلها.
- باستخدام عصا تفريغ الهالة ، قم بتعريض أغطية الأغطية لتفريغ الهالة لمدة 1 دقيقة لكل منها.
ملاحظة: يجب تنفيذ هذه الخطوة في منطقة جيدة التهوية أو غطاء كيميائي. - قم بإزالة أغطية الغطاء من طبق بتري ثم انغمس في محلول APTES لمدة 10 ثوان في غضون 5 دقائق من التعرض للإكليل ، مع التأكد من غمر الغطاء.
ملاحظة: تأكد من تتبع الجانب الذي تم علاجه بالبلازما وإبقائه متجها لأعلى. - بعد ذلك ، اغمر الغطاء في الأسيتون لمدة 10 ثوان وجففه بالهواء المضغوط. ضع الغطاء الجاف مرة أخرى في طبق بتري ، بحيث يكون الجانب المعالج متجها لأعلى.
ملاحظة: كرر الخطوات من 1.3.5 إلى 1.3.7 لجميع قسائم الغطاء. - ماصة 1 مل من محلول الجلوتارالدهيد على سطح كل غطاء. قم بتغطية أكبر قدر ممكن من السطح دون السماح للمحلول بالانسكاب على حافة غطاء الغطاء. يمكن إضافة المزيد من محلول الجلوتارالدهيد إذا لزم الأمر. تأكد من عدم خدش السطح بطرف الماصة.
- اترك أغطية الغطاء على اتصال بالمحلول لمدة 30 دقيقة ثم اشطفها بماء DI لمدة 20 ثانية. جفف أغطية الغطاء باستخدام الهواء المضغوط وضعها مرة أخرى في أطباق بتري ، والجانب المعالج بالبلازما لأعلى.
ملاحظة: يمكن تخزين قسائم الغطاء لمدة تصل إلى 1 أسبوع في درجة حرارة الغرفة (RT).
- القطع بالليزر للقاعدة المغناطيسية المعيارية
ملاحظة: يرد تصميم القاعدة المغناطيسية المعيارية في الشكل التكميلي 1. تعمل القاعدة المعيارية كبئر لعقد الوسائط ويمكن استخدامها أيضا لإرفاق وحدات متخصصة مغناطيسيا ، كما هو موضح في الأعمال المنشورة سابقا22،37،38،39.- قم بقص التصميمات من طبقة PMMA باستخدام إعدادات الليزر المناسبة مثل عدد التمريرات والطاقة.
ملاحظة: يجب ضبط إعدادات الليزر بحيث يمكن الضغط على المغناطيس في طبقة PMMA. يختلف كل ليزر ، ويجب تحسين معلمات القطع تجريبيا. بالنسبة لليزر 45 واط ، يوصى باستخدام سرعة 100٪ وطاقة 100٪ و 3 تمريرات لقطع PMMA بسمك 2 مم إلى 2 مم. - اغسل الجزء المقطوع بالليزر باستخدام الماء والصابون لإزالة الحطام من عملية القطع بالليزر.
ملاحظة: لا تستخدم المذيبات لتنظيف الأجزاء المقطوعة بالليزر. قد تؤدي المذيبات إلى انتشار الشقوق الصغيرة في الحواف المقطوعة بالليزر.
- قم بقص التصميمات من طبقة PMMA باستخدام إعدادات الليزر المناسبة مثل عدد التمريرات والطاقة.
- تجميع المنصة
- ادفع المغناطيس (قطره 3/16 ، سمكه 1/16) يدويا إلى القاعدة المقطوعة بالليزر. يمكن استخدام مطرقة ناعمة أو طرف مفك براغي للمساعدة في دفع المغناطيس. يجب أن يكون سمك المغناطيس أقل من سمك قاعدة PMMA لضمان تدفق المغناطيس مع سطح القاعدة.
ملاحظة: تسمح المغناطيسات للمستخدم بإضافة وظائف إلى النظام الأساسي عن طريق إرفاق وحدات إضافية. - انزع الجزء الخلفي من لوح PSA وقم بتوصيل القاعدة بغطاء معالج بالجلوتارالدهيد مع توجيه الجانب الوظيفي لأعلى.
- ضع فتحة قناة PDMS برفق في التجويف المحدد بواسطة الإطار. اضغط لأسفل باستخدام ملاقط عريضة الطرف لإزالة فقاعات الهواء وضمان الاتصال المطابق.
- ضع غطاء القناة المعالج ب BSA أعلى فتحة القناة ، مع توجيه جانب BSA لأسفل. تأكد من محاذاة منافذ مدخل ومخرج السوائل مع القناة.
- الجهاز جاهز لحقن COL1.
- ادفع المغناطيس (قطره 3/16 ، سمكه 1/16) يدويا إلى القاعدة المقطوعة بالليزر. يمكن استخدام مطرقة ناعمة أو طرف مفك براغي للمساعدة في دفع المغناطيس. يجب أن يكون سمك المغناطيس أقل من سمك قاعدة PMMA لضمان تدفق المغناطيس مع سطح القاعدة.
2. حقن محلول COL1 في القناة الدقيقة وإزالة الغطاء لتطبيقات زراعة الخلايا
- تحضير محلول COL1
- ضع جميع الكواشف المطلوبة (محلول مخزون COL1 [6 mg·mL−1] ، ماء عالي النقاء ، 10x PBS ، 0.1 M NaOH) على الجليد في خزانة السلامة الحيوية.
- احسب حجم الكواشف على النحو التالي

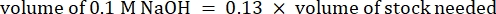
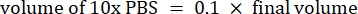
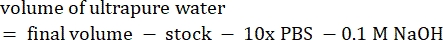
ملاحظة: لذلك ، لصنع 1 مل من 2.5 مجم · مل − 1 كولاجين محايد من مخزون 6 مجم · مل − 1 ، أضف 416.67 ميكرولتر من الكولاجين ، و 429.16 ميكرولتر من ماء DI ، و 100 ميكرولتر من 10x PBS ، و 54.16 ميكرولتر من 0.1 M NaOH للحصول على درجة حموضة نهائية تبلغ 7. أضف 20 ميكرولتر من 0.1 M NaOH لتحقيق الرقم الهيدروجيني 9.0. - أضف الكواشف إلى قنينة فارغة سعة 5 مل بالترتيب التالي: i) مخزون COL1 ، ii) ماء DI ، iii) 10x PBS ، iv) 0.1 M NaOH.
ملاحظة: استخدم ماصة الإزاحة للتعامل مع محلول COL1. قد يحدث فقدان كبير للعينة إذا تم استخدام ماصة عادية ، مما يؤدي إلى تقلبات في تركيز المحلول النهائي. - ارفع الرقم الهيدروجيني للمحلول إلى الرقم الهيدروجيني المطلوب (عادة بين 7-9).
- حقن محلول COL1
- ضع مضخة حقنة ، وحقنة معقمة مبردة ، ومحلول COL1 محايد مبرد ، وإبرة قفل Luer معقمة بزاوية 20 جم 90 درجة في خزانة السلامة البيولوجية. قم بتحميل محلول COL1 في المحقنة ، مع الحرص على تجنب إدخال الفقاعات.
- قم بتوصيل طرف الإبرة 90 درجة 20 جم بالمحقنة ، وقم بتحميل المحقنة في مضخة المحقنة ، والإبرة متجهة لأسفل ، وقم بتجهيز الإبرة بمحلول COL1.
- اضبط مضخة المحقنة على معدل التدفق المطلوب ، بين 50-2000 ميكرولتر / دقيقة.
- ضع قنوات PDMS المعدة (القسم 1) على مقبس المختبر وقم بتسويتها بالإبرة.
- أدخل الإبرة في منفذ مدخل قناة PDMS (الجانب العريض). قم بحقن القناة حتى تتجمع قطرة ~ 30 ميكرولتر من COL1 على جانب المخرج.
- اخفض مقبس المختبر وافصل الإبرة برفق عن القناة المملوءة حديثا.
- كرر الخطوات 2.2.5-2.2.9 حتى تمتلئ جميع القنوات بمحلول COL1.
- قم بتحميل القنوات المملوءة في أطباق بتري جنبا إلى جنب مع مناديل نظيفة وخالية من النسالة مشبعة بماء DI لمنع جفاف جل COL1 المشكل حديثا.
- غطي طبق بتري وضع القنوات المحملة في الحاضنة (37 درجة مئوية ، رطوبة 95٪) لمدة 2 ساعة قبل خطوة التقشير.
- تقشير وتوازن الوسائط
- كشف جل COL1 المبلمر عن طريق رفع غطاء PDMS باستخدام الملقط. يمنع علاج BSA COL1 من الالتصاق بالغطاء.
- أضف 650 ميكرولتر من EGM إلى البئر.
- اترك الأجهزة في الحاضنة (37 درجة مئوية ، رطوبة 95٪) لمدة لا تقل عن 4 ساعات لموازنة الجل والوسائط. استبدل الوسائط قبل البذر بالخلايا
- خلايا البذر
- ضع 0.25٪ من التربسين الدافئ ووسائط الاستزراع جنبا إلى جنب مع العدد المطلوب من الماصات 5 مل و 10 مل في خزانة السلامة الأحيائية.
- زراعة الخلايا البطانية للوريد السري البشري (HUVECs) إلى التقاء 80٪ في وسائط النمو البطاني (EGM) عند 37 درجة مئوية ، في رطوبة 95٪. ضع دورق زراعة الأنسجة الذي يحتوي على HUVECs في BSC بعد التحقق من الالتقاء تحت المجهر.
- تخلص من الوسائط في قارورة T25 واغسل الخلايا 2x باستخدام 1x PBS. أضف 1 مل من التربسين إلى القارورة وضعها في الحاضنة (37 درجة مئوية ، رطوبة 95٪) لمدة 3 دقائق.
- افحص القارورة تحت المجهر بعد 3 دقائق للتأكد من فصل الخلايا تماما عن السطح.
- أضف 3 مل من EGM (مع المصل) إلى القارورة لتحييد التربسين. بعد ذلك ، انقل المحلول الخلوي باستخدام ماصة 5 mL إلى أنبوب مخروطي 15mL. جهاز طرد مركزي الأنبوب المخروطي الذي يحتوي على خلايا عند 150 × جم لمدة 5 دقائق.
- ضع الأنبوب المخروطي في خزانة السلامة الحيوية وتخلص من المادة الطافية دون إزعاج حبيبات الخلية. أعد تعليق الخلايا في 1 مل من وسائط الثقافة الطازجة.
- أضف واخلط 15 ميكرولتر من التريبان الأزرق و 15 ميكرولتر من محلول الخلية المعاد تعليقه في أنبوب مخروطي سعة 1 مل.
- قم بحقن محلول التريبان الأزرق والخلية على جانبي شريحة عد الخلايا وأدخل الشريحة في جهاز عد الخلايا.
- قم بتخفيف محلول الخلية في وسائط النمو البطانية إلى التركيز المطلوب بناء على تركيز الخلية الذي تم الحصول عليه من جهاز عد الخلايا.
ملاحظة: قارورة T25 من HUVECs عند التقاء 80٪ ستنتج ~ 750000 خلية · مل − 1 إذا تم تخفيفها في 1 مل من الوسائط. يتم حساب حجم معلق الخلية المراد بذره كمساحة لسطح المزرعة × كثافة الخلية / تركيز تعليق الخلية. مثال: لزرع 20000 خلية · سم − 2 في بئر 35 مم × 15 مم ، سيحتاج المرء ~ 140 ميكرولتر من تعليق الخلية. - قم بشفط الوسائط على مصفوفة COL1 الهندسية.
- أضف الحجم المطلوب من محلول الخلية إلى ركيزة COL1 واترك الخلايا تستقر لمدة لا تقل عن 4 ساعات قبل التصوير.
- تسمية نواة الخلية والهيكل الخلوي
- نضح الوسائط من الخلايا واغسل 3x مع 1x PBS ، 500 ميكرولتر في كل غسلة. قم بتغطية طبقة الخلية بنسبة 4٪ بارافورمالدهيد لمدة 15 دقيقة في RT.
- نضح بارافورمالدهيد واغسله باستخدام 1x PBS Tween-20 لمدة 5 دقائق.
- تخلل غشاء الخلية باستخدام 500 ميكرولتر من محلول Triton-X 0.1٪ في PBS لمدة 15 دقيقة. يغسل مع 1x PBS Tween-20 لمدة 5 دقائق.
- قم بحظر مواقع الربط غير المحددة باستخدام 500 ميكرولتر من 4٪ BSA في PBS لمدة 30 دقيقة في RT.
- تمييع محلول ملصق الفلورسنت phalloidin-actin في 4٪ BSA (1 ميكرولتر من المخزون في 400 ميكرولتر من BSA).
- نضح محلول BSA ، وأضف محلول phalloidin إلى الخلايا ، وانتظر لمدة 30 دقيقة في RT.
- قم بتخفيف البقعة النووية في 4٪ BSA (1 ميكرولتر في 500 ميكرولتر) ، ونضح القضيب ، وأضف محلول البقع النووي العامل ، وانتظر لمدة 15 دقيقة في RT.
- نضح محلول عمل البقع النووية ، واغسله باستخدام PBS Tween-20 3x لمدة 5 دقائق لكل منهما ، واستبدله ب 1x PBS قبل التصوير.
- صورة باستخدام مجهر فوق فلوري باستخدام قناة FITC (على سبيل المثال 491 نانومتر / م 516 نانومتر) وقناة DAPI (على سبيل المثال 360 نانومتر / م 460 نانومتر) مع عدسة 40x. تخيل الكولاجين باستخدام مسح بالليزر متحد البؤر في وضع الانعكاس باستخدام خط ليزر 488 نانومتر (طاقة 15٪) وهدف غمر الماء 40x.
النتائج
عندما يتدفق محلول COL1 ذاتي التجميع عبر قناة ذات مساحة مقطعية متناقصة ، تزداد السرعة الانسيابية (v x) لمحلول COL1 محليا بمقدار ∂v x ، على طول الانقباض بين الجزأين (∂x) ، مما يؤدي إلى معدل إجهاد ممتد (ε̇) حيث ε̇ = ∂v x / ∂x. يمكن حساب معدل الإجهاد الممتد من سرعة السائل ، والتي يتم قياس?...
Discussion
تم وصف بروتوكولات توليد مصفوفات COL1 مع الألياف المحاذاة باستخدام الطرق المغناطيسية ، والتطبيق المباشر للإجهاد الميكانيكي ، وتقنيات الموائع الدقيقة47. تستخدم مناهج الموائع الدقيقة بشكل شائع لإنشاء أنظمة فسيولوجية دقيقة بسبب خصائص التدفق والنقل المحددة جيدا ، والتي تتيح التح?...
Disclosures
يعلن جميع المؤلفين عدم وجود مصالح متنافسة.
Acknowledgements
تم دعم هذا العمل جزئيا من قبل المعهد الوطني للصحة بموجب رقم الجائزة R21GM143658 ومن قبل المؤسسة الوطنية للعلوم بموجب المنحة رقم 2150798. المحتوى هو مسؤولية المؤلفين وحدهم ولا يمثل بالضرورة الآراء الرسمية لوكالات التمويل.
Materials
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane, 99% (APTES) | Sigma Aldrich | 440140-100ML | |
| 20 Gauge IT Series Angled Dispensing Tip | Jensen Global | JG-20-1.0-90 | |
| 3/16" dia. x 1/16" thick Nickel Plated Magnet | KJ Magnetics | D31 | |
| 3M (TC) 12X12-6-467MP | DigiKey | 3M9726-ND | |
| ACETONE ACS REAGENT ≥99.5% | Signa Aldrich | 179124-4L | |
| BD-20AC LABORATORY CORONA TREATER | Electro-Technic Products | 12051A | |
| Bovine Serum Albumin (BSA), Fraction V, 98%, Reagent Grade, Alfa Aesar | VWR | AAJ64100-09 | |
| Clear cast acrylic sheet | McMaster-Carr | 8560K181 | |
| Corning 100 mL Trypsin 10x, 2.5% Trypsin in HBSS [-] calcium, magnesium, phenol red, Porcine Parvovirus Tested | VWR | 45000-666 | |
| Countess II Automated Cell Counter | Thermo Fisher Scientific | AMQAX1000 | |
| CT-FIRE software | LOCI - University of Wisconsin | ||
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit, (CC-3156 & CC-4176), Lonza CC-3162, 500 mL | Lonza | CC-3162 | |
| Glutaraldehyde 50% in aqueous solution, Reagent Grade, Packaging=HDPE Bottle, Size=100 mL | VWR | VWRV0875-100ML | |
| Graphtec CELITE-50 | Graphtec | CE LITE-50 | |
| HEPES (1 M) | Thermo Fisher Scientific | 15-630-080 | |
| High-Purity Silicone Rubber .010" Thick, 6" X 8" Sheet, 55A Durometer | McMaster-Carr | 87315K62 | |
| Human Umbilical Vein Endothelial cells | Thermo Fisher Scientific | C0035C | |
| Invitrogen Trypan Blue Stain (0.4%) | Thermo Fisher Scientific | T10282 | |
| Isopropanol | Fisher Scientific | A4154 | |
| Laser cutter | Full Spectrum | 20x12 H-series | |
| Microfluidics Syringe pump | New Era Syringe Pumps | NE-1002X | |
| Microman E Single Channel Pipettor, Gilson, Model M1000E | Gilson | FD10006 | |
| Molecular Probes Alexa Fluor 488 Phalloidin | Thermo Fisher Scientific | A12379 | |
| Molecular Probes Hoechst 33342, Trihydrochloride, Trihydrate | Thermo Fisher Scientific | H3570 | |
| Nutragen Bovine Atelo Collagen | Advanced BioMatrix | 5010-50ML | |
| Pbs (10x), pH 7.4 | VWR | 70011044.00 | |
| PBS pH 7.4 | Thermo Fisher Scientific | 10010049.00 | |
| Phosphate-buffered saline (PBS, 10x), with Triton X-100 | Alfa Aesar | J63521 | |
| Replacement carrier sheet for graphtec craft ROBO CC330L-20 | USCUTTER | GRPCARSHTN | |
| Restek Norm-Ject Plastic Syringe 1 mL Luer Slip | Restek | 22766.00 | |
| Silicon wafer | University wafer | 452 | |
| Sodium Hydroxide, ACS, Packaging=Poly Bottle, Size=500 g | VWR | BDH9292-500G | |
| Sylgard 184 | VWR | 102092-312 | |
| Thermo Scientific Pierce 20x PBS Tween 20 | Thermo Fisher Scientific | 28352.00 |
References
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Bosman, F. T., Stamenkovic, I. Functional structure and composition of the extracellular matrix. The Journal of Pathology. 200 (4), 423-428 (2003).
- Cox, T. R., Erler, J. T. Remodeling and homeostasis of the extracellular matrix: Implications for fibrotic diseases and cancer. Disease Models & Mechanisms. 4 (2), 165-178 (2011).
- Cross, V. L., et al. Dense type I collagen matrices that support cellular remodeling and microfabrication for studies of tumor angiogenesis and vasculogenesis in vitro. Biomaterials. 31 (33), 8596-8607 (2010).
- Lu, P., Takai, K., Weaver, V. M., Werb, Z. Extracellular matrix degradation and remodeling in development and disease. Cold Spring Harbor Perspectives in Biology. 3 (12), 005058 (2011).
- Piotrowski-Daspit, A. S., Nerger, B. A., Wolf, A. E., Sundaresan, S., Nelson, C. M. Dynamics of tissue-induced alignment of fibrous extracellular matrix. Biophysical Journal. 113 (3), 702-713 (2017).
- Provenzano, P. P., et al. Collagen reorganization at the tumor-stromal interface facilitates local invasion. BMC Medicine. 4 (1), 38 (2006).
- Provenzano, P. P., et al. Collagen density promotes mammary tumor initiation and progression. BMC Medicine. 6 (1), 11 (2008).
- Szulczewski, J. M., et al. Directional cues in the tumor microenvironment due to cell contraction against aligned collagen fibers. Acta Biomaterialia. 129, 96-109 (2021).
- Aubin, H., et al. Directed 3D cell alignment and elongation in microengineered hydrogels. Biomaterials. 31 (27), 6941-6951 (2010).
- Gruschwitz, R., et al. Alignment and cell-matrix interactions of human corneal endothelial cells on nanostructured collagen type I matrices. Investigative Ophthalmology & Visual Science. 51 (12), 6303-6310 (2010).
- Wang, W. Y., et al. Extracellular matrix alignment dictates the organization of focal adhesions and directs uniaxial cell migration. APL Bioengineering. 2 (4), 046107 (2018).
- Wang, W. Y., Lin, D., Jarman, E. H., Polacheck, W. J., Baker, B. M. Functional angiogenesis requires microenvironmental cues balancing endothelial cell migration and proliferation. Lab on a Chip. 20 (6), 1153-1166 (2020).
- Lanfer, B. The growth and differentiation of mesenchymal stem and progenitor cells cultured on aligned collagen matrices. Biomaterials. 30 (30), 5950-5958 (2009).
- Brauer, E., et al. Collagen fibrils mechanically contribute to tissue contraction in an in vitro wound healing scenario. Advanced Science. 6 (9), 1801780 (2019).
- Ingber, D. E. From mechanobiology to developmentally inspired engineering. PhilosophicalTransactions of the Royal Society B: Biological Sciences. 373 (1759), 20170323 (2018).
- Wang, H., Abhilash, A. S., Chen, C. S., Wells, R. G., Shenoy, V. B. Long-range force transmission in fibrous matrices enabled by tension-driven alignment of fibers. Biophysical Journal. 107 (11), 2592-2603 (2014).
- Reinhart-King, C. A., Dembo, M., Hammer, D. A. Cell-cell mechanical communication through compliant substrates. Biophysical Journal. 95 (12), 6044-6051 (2008).
- Ahadian, S., et al. Organ-on-a-chip platforms: A convergence of advanced materials, cells, and microscale technologies. Advanced Healthcare Materials. 7 (2), 1700506 (2018).
- Hou, X., et al. Interplay between materials and microfluidics. Nature Reviews Materials. 2 (5), 17016 (2017).
- Abhyankar, V. V., et al. A platform for assessing chemotactic migration within a spatiotemporally defined 3D microenvironment. Lab on a Chip. 8 (9), 1507-1515 (2008).
- Abhyankar, V. V., Wu, M., Koh, C. Y., Hatch, A. V. A reversibly sealed, easy access, modular (SEAM) microfluidic architecture to establish in vitro tissue interfaces. PLoS One. 11 (5), 0156341 (2016).
- Williams, M. J., et al. A low-cost, rapidly integrated debubbler (RID) module for microfluidic cell culture applications. Micromachines. 10 (6), 360 (2019).
- Hsu, M. C., et al. A miniaturized 3D printed pressure regulator (µPR) for microfluidic cell culture applications. Scientific Reports. 12, 10769 (2022).
- Huh, D., Torisawa, Y. S., Hamilton, G. A., Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab on a Chip. 12 (12), 2156-2164 (2012).
- Abhyankar, V. V., Lokuta, M. A., Huttenlocher, A., Beebe, D. J. Characterization of a membrane-based gradient generator for use in cell-signaling studies. Lab on a Chip. 6 (3), 389-393 (2006).
- Hasan, M. R., et al. One-step fabrication of flexible nanotextured PDMS as a substrate for selective cell capture. Biomedical Physics & Engineering Express. 4 (2), 025015 (2018).
- Meyvantsson, I., Beebe, D. J. Cell culture models in microfluidic systems. Annual Review of Physical Chemistry. 1, 423-449 (2008).
- Ma, Y., et al. Viscoelastic cell microenvironment: Hydrogel-based strategy for recapitulating dynamic ECM mechanics. Advanced Functional Materials. 31 (24), 2100848 (2021).
- Ma, Y., et al. 3D spatiotemporal mechanical microenvironment: A hydrogel-based platform for guiding stem cell fate. Advanced Materials. 30 (49), 1705911 (2018).
- Lee, P., Lin, R., Moon, J., Lee, L. P. Microfluidic alignment of collagen fibers for in vitro cell culture. Biomedical Microdevices. 8 (1), 35-41 (2006).
- Del Amo, C., Borau, C., Movilla, N., Asín, J., García-Aznar, J. M. Quantifying 3D chemotaxis in microfluidic-based chips with step gradients of collagen hydrogel concentrations. Integrative Biology. 9 (4), 339-349 (2017).
- Shi, N., et al. A 3D, magnetically actuated, aligned collagen fiber hydrogel platform recapitulates physical microenvironment of myoblasts for enhancing myogenesis. Small Methods. 5 (6), 2100276 (2021).
- Lanfer, B., et al. Aligned fibrillar collagen matrices obtained by shear flow deposition. Biomaterials. 29 (28), 3888-3895 (2008).
- Saeidi, N., Sander, E. A., Ruberti, J. W. Dynamic shear-influenced collagen self-assembly. Biomaterials. 30 (34), 6581-6592 (2009).
- Saeidi, N., Sander, E. A., Zareian, R., Ruberti, J. W. Production of highly aligned collagen lamellae by combining shear force and thin film confinement. Acta Biomaterialia. 7 (6), 2437-2447 (2011).
- Ahmed, A., et al. Microengineered 3D collagen gels with independently tunable fiber anisotropy and directionality. Advanced Materials Technologies. 6 (4), 2001186 (2021).
- Ahmed, A., et al. Local extensional flows promote long-range fiber alignment in 3D collagen hydrogels. Biofabrication. 14 (3), 035019 (2022).
- Mansouri, M., et al. The modular µSiM reconfigured: Integration of microfluidic capabilities to study in vitro barrier tissue models under flow. Advanced Healthcare Materials. , (2022).
- Paten, J. A., et al. Flow-induced crystallization of collagen: a potentially critical mechanism in early tissue formation. ACS Nano. 10 (5), 5027-5040 (2016).
- Liu, Y., Eliceiri, K. W. Quantifying fibrillar collagen organization with curvelet transform-based tools. Journal of Visualized Experiments. (165), e61931 (2020).
- Bredfeldt, J. S., et al. Automated quantification of aligned collagen for human breast carcinoma prognosis. Journal of Pathology Informatics. 5 (1), 28 (2014).
- Bredfeldt, J. S., et al. Computational segmentation of collagen fibers from second-harmonic generation images of breast cancer. Journal of Biomedical Optics. 19 (1), 016007 (2014).
- Carey, S. P., et al. Local extracellular matrix alignment directs cellular protrusion dynamics and migration through Rac1 and FAK. Integrative Biology. 8 (8), 821-835 (2016).
- Carey, S. P., Kraning-Rush, C. M., Williams, R. M., Reinhart-King, C. A. Biophysical control of invasive tumor cell behavior by extracellular matrix microarchitecture. Biomaterials. 33 (16), 4157-4165 (2012).
- Ahmed, A., et al. Engineering fiber anisotropy within natural collagen hydrogels. AmericanJournal of Physiology-Cell Physiology. 320 (6), 1112-1124 (2021).
- Mohammadi, H., Janmey, P. A., McCulloch, C. A. Lateral boundary mechanosensing by adherent cells in a collagen gel system. Biomaterials. 35 (4), 1138-1149 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved